2. 陕西省生物农药工程技术研究中心,陕西 杨凌 712100;
3. 农业部 农药检定所,北京 100125
2. Biopesticide Technology & Engineering Center of Shaanxi Province, Yangling 712100, Shaanxi Province, China;
3. Institute for the Control of Agrochemicals, Ministry of Agriculture, Beijing 100125, China
农药施用后,可经地表径流、淋溶和飘移等途径进入水体,污染饮用水或进一步影响整个水生态环境。因此,在新农药登记中,农药在水体中的降解特性是评价其环境安全性的重要指标之一,也是必备资料之一。
植物源农药苦参碱 (matrine) 具有良好的杀虫、抑菌及调节作物生长发育的作用[1-5]。据查询中国农药信息网,截至 2016 年 3 月,已有 96 种含苦参碱的农药产品获准登记,居中国植物源农药之首[6]。然而,目前有关其环境安全性研究的报道仍较少,仅见其在黄瓜中易降解、不易残留,对斑马鱼、蜜蜂和家蚕低毒等报道[7-8],导致人们对苦参碱的环境安全性缺乏系统认识。
本课题组前期研究已表明,苦参碱在土壤中易消解,在小白菜田土壤中的消解半衰期为 1.4~1.6 d[9],在东北黑土等几种典型土壤中的半衰期为 4.1~9.8 d (未灭菌条件下) 和 11.6~13.7 d (灭菌条件下),均为易降解[10]。在上述研究的基础上,笔者参照“化学农药环境安全性评价试验准则”[11] (以下简称“准则”),开展了苦参碱在水体中的降解特性研究,以期为评价其对水环境的安全性提供科学依据,同时为该植物源农药的科学合理使用提供指导。
1 材料和方法 1.1 药剂及试剂苦参碱 (matrine) 标准品 (纯度 ≥ 95%),由内蒙古鄂尔多斯市金驼药业有限责任公司提供;甲醇、乙醇等溶剂均为色谱纯或分析纯。
1.2 供试水样pH 5.0 缓冲液:500 mL 苯二甲酸氢钾溶液 (0.10 mol/L) 加 239 mL 氢氧化钠溶液 (0.1 mol/L),再加蒸馏水定容至 1 000 mL。
pH 7.0 缓冲液:500 mL 磷酸二氢钾溶液 (0.10 mol/L) 加 296 mL 氢氧化钠溶液 (0.1 mol/L),用蒸馏水定容至 1 000 mL。
pH 9.0 缓冲液:500 mL 体积比为 1:1 的硼砂 (0.10 mol/L) 与氯化钾溶液 (0.10 mol/L),加 213 mL 氢氧化钠溶液 (0.1 mol/L),再加蒸馏水定容至 1 000 mL。
池塘水,采自陕西省杨凌区崔西沟村鱼塘;河水,采自渭河杨凌段;超纯水,西北农林科技大学试验用水;自来水,采自陕西省杨凌区;湖水,采自安徽省白云湖;海水,采自海南省海口市南海;雨水,采自陕西省杨凌区。采集时间均为 2015 年 6 月。
上述样品经抽滤、过 0.22 μm 滤膜后,于 4 ℃ 条件下贮存,备用。
1.3 主要仪器设备Chromaster UItra RS 日立超高效液相色谱仪,日立高新技术公司;DDSJ-308F 电导率仪及 E-201-C pH 计,上海精密科学仪器有限公司。
1.4 试验用水的基本数据试验用水基本数据根据《水和废水监测和分析方法》[12]测定;水体中菌落数量参照《生活饮用水标准检验方法微生物指标》[13]测定;水样矿化度测定采用重量法[14];通过电导率仪及 pH 计分别测定各水样的电导率和 pH 值。具体数据见表 1。
|
|
表 1 试验用水基本数据 Table 1 Basic parameters of the tested water |
1.5 超高效液相色谱检测条件
LaChromUltraⅡC18 色谱柱 (250 mm × 3.0 mm,1.9 μm);流速 0.4 mL/min;流动相:V (甲醇) : V (水) = 90 : 10;进样量 2 μL;检测波长 210 nm;柱温 40 ℃。上述条件下,苦参碱的保留时间约 5.64 min。
回收率与检测限:水样中苦参碱添加水平在 1~10 mg/L 范围内时,回收率测定结果为 94.2%~107.5%,相对标准偏差为 1.56%~5.58%,水样中苦参碱的最低检测浓度为 0.01 mg/L,符合残留检测要求。
1.6 苦参碱在不同 pH 缓冲体系及不同温度下的水解动态测定参照“准则”[11],分别用经过高压蒸汽灭菌的, pH 5、7 和 9 的缓冲溶液配制 10.0 μg/mL 的苦参碱水溶液,于 2 mL 安瓿瓶中密封,置于 (25 ± 1)、(35 ± 1) 和 (50 ± 1) ℃ 恒温培养箱中黑暗培养,定期取样分析。每处理重复 3 次。所用玻璃器皿均经高温、高压灭菌,整个试验过程避光、密闭。
1.7 苦参碱在不同自然水体中的降解动态测定研究不同水质对苦参碱降解的影响。250 mL 锥形瓶中加入 100 mL 各水样 (表 1),分别进行灭菌 (压力升至 102.9 kPa,121 ℃,维持 30 min) 和未灭菌处理,加入苦参碱,使其在水样中的质量浓度为 10.0 μg/mL。锥形瓶用滤纸封口后,放入 (25 ± 1) ℃ 培养箱内黑暗培养。分别于培养 2 h 及 1、3、5、7、9、14、21、30、45 和 60 d 后取样分析。每处理重复 3 次。
1.8 初始量对苦参碱降解的影响分别称取一定量苦参碱于锥形瓶中,加入 100 mL 自来水或池塘水,配制质量浓度分别为 1.0、5.0、10.0 和 20.0 μg/mL 的苦参碱水样,每浓度设 3 个平行。锥形瓶用滤纸封口后,放入 (25 ± 1) ℃ 培养箱内黑暗培养,间隔 3~5 d 依次取样分析。
1.9 结果计算和数据处理利用 OriginPro 8.0 软件对数据进行处理和分析。按式 1 计算农药降解率;以采样时间为横坐标,以苦参碱的残留浓度为纵坐标绘制降解动态曲线,并用一级反应方程 (式 2) 描述;按式 3 计算降解半衰期。
| $\begin{aligned}& {\text{农药降解率}}/{\text\%} = \\ & \left[{{{\text{(农药初始质量浓度}} - {\text{农药残留质量浓度)}}} /}\right. \\& \left.{{\text{农药初始质量浓度}}} \right] \times 100\end{aligned}$ | (1) |
| ${C_t} = {C_0}{e^{ - kt}}$ | (2) |
| ${t_{1/2}} = Ln2/k$ | (3) |
式中:C0 为苦参碱初始质量浓度 (mg/L);Ct 为 t 时刻苦参碱的残留质量浓度 (mg/L);k 为降解速率常数;t 为降解反应时间 (d);t1/2 为降解半衰期 (month 或 d)。
根据“准则”[11],将农药的降解特性划分成 5 个等级 (表 2)。
|
|
表 2 农药降解特性等级划分 Table 2 The standard for pesticide degradation |
2 结果与分析 2.1 苦参碱在缓冲体系中的水解
测定了苦参碱在不同温度 (25、35 和 50 ℃) 及不同 pH 值 (5、7 和 9) 缓冲体系中的水解情况 (表 3)。从中可知,整个检测期间,苦参碱的水解极其缓慢,120 d 后其水解率均不超过 25%,可见苦参碱在标准缓冲液中较难水解。
|
|
表 3 苦参碱 (10.0 μg/mL) 在不同温度及不同 pH 值缓冲液中的水解 Table 3 Hydrolysis of matrine (10.0 μg/mL) in different buffer solutions at different temperatures |
为直观分析比较水体 pH 值和温度对苦参碱水解的影响,依据表 1 中数据,绘制了苦参碱在不同 pH 值缓冲液 (25 ℃) 及不同温度 (pH 7) 下的水解动态曲线,结果见图 1。
由图 1A 可知,当水体温度为 25 ℃ 时,初始质量浓度为 10.0 μg/mL 的苦参碱在不同 pH 条件下的水解动态略有不同,其水解速率随 pH 值升高而略有加快;由图 1B 可知,在 pH 7 的缓冲液中,苦参碱的水解速率随温度升高而略有加快;但整体而言,温度和 pH 值对其水解的影响不大。

|
A. 25 ℃ 下苦参碱在不同 pH 缓冲液中的水解动态;B. pH 7 下苦参碱在不同温度缓冲液中的水解动态。 A. Hydrolytic dynamic of matrine in the buffered solutions with different pH values at 25 ℃;B. Hydrolytic dynamic of matrine in the buffered solutions with different temperatures at pH 7. 图 1 苦参碱在不同 pH 值缓冲液及不同温度下的水解动态 Fig. 1 Hydrolytic dynamic of matrine in the buffered solutions with different pH values and different temperatures |
2.2 苦参碱在自然水体中的降解
2.2.1 不同水质对苦参碱降解的影响 测定了初始质量浓度为 10.0 μg/mL 的苦参碱在 6 种不同水体中的降解动态,结果见表 4、表 5 及图 2。在灭菌处理后的不同水体中,苦参碱降解缓慢且趋势相似,60 d 内降解率均不超过 15% (表 4);在未灭菌处理的 6 种自然水体中,苦参碱降解均较快 (图 2)。以图 2 中的数据拟合出降解方程,其动力学参数见表 5。从中可知,苦参碱在 6 种自然水体中的降解半衰期在 6.26~12.81 d 之间,均属于易降解,其降解速率排序依次为:池塘水 > 河水 > 雨水 > 湖水 > 海水 > 自来水。对比苦参碱在同类水体灭菌和未灭菌条件下的降解,发现未灭菌水体中的降解速率远大于灭菌水体中,表明水体中的微生物是影响苦参碱降解的主要因素。
|
|
表 4 苦参碱在不同灭菌水体中的降解 Table 4 Degradation of matrine in different sterilized water samples |
|
|
表 5 苦参碱在不同自然水体中的降解动力学参数 Table 5 Degradation kinetics parameter of matrine in different non-sterilized water samples |
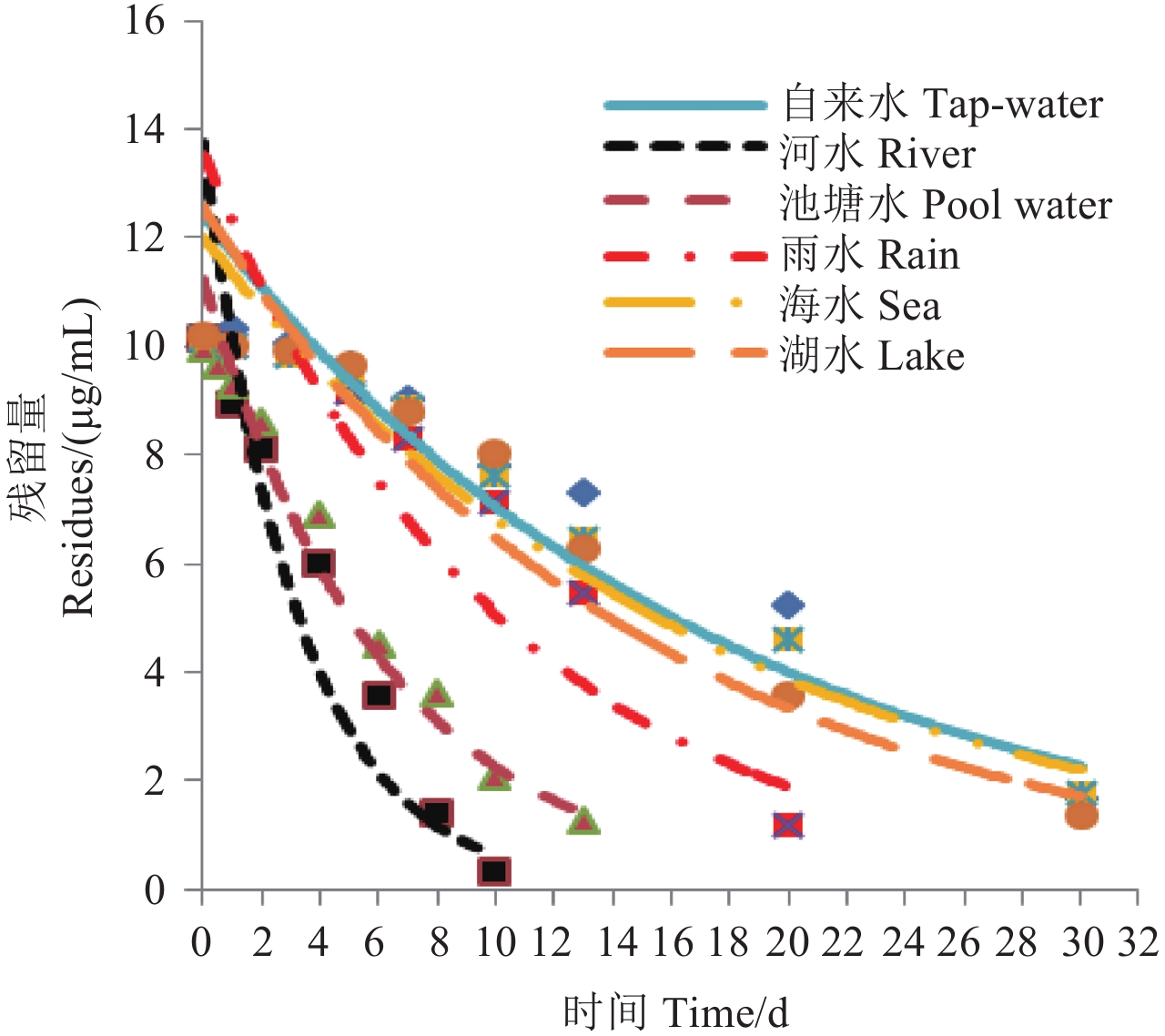
|
图 2 苦参碱在 6 种未灭菌自然水体中的降解曲线 Fig. 2 Degradation curve of matrine in 6 kinds of natural water systems |
2.2.2 初始量对苦参碱降解的影响 测定了苦参碱初始量与其降解速率的关系 (表 6)。从中可知,随着初始量的增大,苦参碱在不同自然水体中的降解速率均降低,半衰期变长。
|
|
表 6 不同初始量下苦参碱在 6 种自然水体中的降解方程及半衰期 Table 6 Degradation kinetics equation and half-life of matrine in 6 kinds of natural water under different initial concentrations |
2.2.3 水体理化性质对苦参碱降解的影响 以降解半衰期为因变量,分别以不同自然水体的 pH 值、含菌量、矿化度和电导率为自变量,进行单因子回归分析 (表 7)。结果表明,苦参碱在自然水体中的降解主要受水体含菌量的影响,其降解半衰期与含菌量呈显著负相关关系 (P = 0.006)。可见,微生物降解是苦参碱在水体环境中降解的主要方式。
|
|
表 7 苦参碱在自然水体中的降解半衰期与水体理化性质的相关性分析 Table 7 Correlation between Half-life value of matrine in natural water and water properties |
3 讨论 3.1 苦参碱在缓冲液中难水解,但在自然水体中易降解
农药在水体中的降解特性是各国新农药登记的必备资料,也是评价农药环境安全性的重要参考。“化学农药环境安全性评价试验准则”[11]中对农药水解试验的要求是在人工配制的无菌缓冲液中进行,且需考察温度和 pH 值的影响。一般而言,高温及碱性条件有利于农药的水解[15-18]。本研究发现,10.0 μg/mL 的苦参碱在 pH 5、7 和 9 的缓冲液中,120 d 内的水解率均不超过 25%,水解相对较慢,温度升高对其水解的影响也不明显,但碱性环境和高温能对其水解起到轻微的促进作用。该结果符合一般农药水解的规律,且苦参碱属于不易水解性农药。
田间施用后,苦参碱有可能通过不同途径最终进入雨水、池塘水、河水及海水等自然水体中。自然界中水环境是一个复杂的系统,农药在其中的降解可涵盖微生物降解、光化学降解和化学降解等多种方式,其残余是多种降解过程综合作用的结果[19-21]。本研究表明,苦参碱在供试 6 种自然水体中降解均较快,半衰期随初始质量浓度的增大有所延长,但均不超过一个月,属于易降解型。一般认为,农药在自然水体中的降解要快于在人工配制的水体中,其原因主要与自然水体中存在的微生物、悬浮颗粒、可溶性有机质、金属离子和溶液盐度等因素有关[21]。欧晓明等[22]发现,硫肟醚 (sulfoxime) 在自然水体中的降解快于在纯净水中。本研究在黑暗条件下进行,可排除光化学降解,且苦参碱在未灭菌自然水体中降解要明显快于在无菌缓冲液和 6 种灭菌水体中,同时水体中含菌量与其降解半衰期呈显著负相关性。综上可见,微生物降解是苦参碱在水体中主要的降解方式。
该特点也与前人关于植物源农药水解的研究报道较为一致。如,雷公藤生物碱在 pH 7.0 的水体中 5 d 的水解率小于 10%,在河水中的半衰期分别为 5.65 d (50 ℃) 和 20.03 d (25 ℃),在池塘水中半衰期分别为 5.19 d (50 ℃) 和 12.65 d (25 ℃),均属易水解[23];印楝素 A 在 pH 7 (35 ℃) 的缓冲液中的半衰期为 146~305 h,但在卡尔特斯湖 (Cultus lake) 和里斯河 (Sleese creek) 的水体中仅为 10.2 和 14.2 h[24];鱼藤酮在 pH 5、7 和 9 的缓冲液中的半衰期分别为 12.6、3.2 和 2.0 d,但在池塘水中仅为 13.9 h (24 ℃) 和 83.9 h (0 ℃)[25-26]。
总之,尽管依据“准则”[11],苦参碱为不易水解,但其在自然水体中却较易降解。
3.2 苦参碱对水环境具有一定的安全性农药进入水体后,除发生降解外,还可与水中悬浮物、底泥等发生吸附作用[19]。本研究结果表明,苦参碱在不同自然水体中均易降解,半衰期为 6.26~12.81 d。笔者等针对苦参碱吸附性进行的试验也表明,其在江西红土、关中娄土、河南二合土和东北黑土中的吸附常数 (Kd) 分别为 7.31、20.63 和 21.32、30.09,根据“准则”[11]划分标准,分别属于中等吸附 (东北黑土、河南二合土、关中娄土) 和较难吸附 (江西红土),且吸附能力与土壤有机质含量呈显著正相关 (待发表)。其在水体中的光解特性初步研究表明,苦参碱在缓冲液、池塘水、河水、海水等水体中均易降解,尤其是在自然水体中,光解半衰期均在 0.5 h 内[10]。可见,在生产实践中,苦参碱进入水体后可发生吸附、微生物降解及光解等多种行为,其在自然水体中的消解会更快,因此不易污染水体,对水环境具有一定的安全性。但尚需进一步评价其对水体生物的安全性,以最终明确其对水环境的安全性。
综上所述,苦参碱在标准缓冲液中难水解,但在自然水体中易降解,该特性对于指导苦参碱的实际应用具有重要意义。
| [1] |
张兴, 马志卿, 冯俊涛, 等. 植物源农药研究进展[J]. 中国生物防治学报, 2015, 31(5): 685–698.
ZHANG X, MA Z Q, FENG J T, et al. Review on research and development of botanical pesticides[J]. Chin J Biol Contr, 2015, 31(5): 685–698. |
| [2] |
夏丽娟, 王朝斌, 赵霞, 等. 苦参碱 1.5% 可溶液剂防治芹菜、苦瓜、西葫芦蚜虫效果研究[J]. 农药科学与管理, 2013, 34(10): 51–54.
XIA L J, WANG C B, ZHAO X, et al. The control effect of 1.5% matrine SL against aphids on celery, balsam pear and summer squash[J]. Pestic Sci Admin, 2013, 34(10): 51–54. doi:10.3969/j.issn.1002-5480.2013.10.015 |
| [3] |
杨雪云, 赵博光, 巨云为. 苦参碱和氧化苦参碱的抑菌活性及增效作用[J]. 南京林业大学学报(自然科学版), 2008, 32(2): 79–82.
YANG X Y, ZHAO B G, JU Y W. Antifungal activities and synergetic tests of matrine and oxymatrine to some tree pathogens[J]. J Nanjing For Univ (Nat Sci Ed), 2008, 32(2): 79–82. |
| [4] | ZHENG Y Y. Antibacterial activity of Sophora flavescens extracts against pepper blight (Fusarium oxysporum) [J]. Plant Dis Pests, 2011, 2(3): 59–61. |
| [5] | XIONG X, YAO M, FU L L, et al. The botanical pesticide derived from Sophora flavescens for controlling insect pests can also improve growth and development of tomato plants [J]. Ind Crops Prod, 2016, 92: 13–18. doi:10.1016/j.indcrop.2016.07.043 |
| [6] |
农业部农药检定所. 中国农药信息网农药综合查询系统[DB/OL]. [2016-09-12]. http://www.chinapesticide.gov.cn/hysj/index.jhtml.
Institute for the Control of Agrochemicals, Ministry of Agriculture. Integrated pesticide query system in China pesticide information network[DB/OL]. [2016-09-12]. http://www.chinapesticide.gov. cn/hysj/index.jhtml. |
| [7] |
孙扬, 徐应明, 秦冬梅, 等. 苦参碱在黄瓜和土壤中的检测方法及其残留动态研究[J]. 农业环境科学学报, 2010, 29(4): 686–691.
SUN Y, XU Y M, QIN D M, et al. Residue detection and degradation of matrine in cucumber and soil[J]. J Agro-Environ Sci, 2010, 29(4): 686–691. |
| [8] |
陈昂. 五种植物源农药的环境毒性评价[D]. 长沙: 中南大学, 2010: 20-23.
CHEN A. Environmental toxicity evaluation of five botanical pesticides[D]. Changsha: Central South University, 2010: 20-23. |
| [9] |
郝佳, 吴志凤, 邱晓鹏, 等. 高效液相色谱法检测苦参碱在小白菜及土壤中的残留与消解动态[J]. 农药学学报, 2016, 18(3): 367–372.
HAO J, WU Z F, QIU X P, et al. Determination and study on residue and dissipation of matrine in Brassica rapa L. chinensis Group and soil by high performance liquid chromatography [J]. Chin J Pestic Sci, 2016, 18(3): 367–372. |
| [10] |
姚满. 苦参碱在土壤和水体环境中的行为研究[D]. 杨凌: 西北农林科技大学, 2016: 23.
YAO M. Behavors of matrine in soil and water environments[D]. Yangling: Northwest A&F University, 2016: 23. |
| [11] |
化学农药环境安全评价试验准则: GB/T 31270—2014[S]. 北京: 中国标准出版社, 2014.
Test guidelines on environmental safety assessment for chemical pesticides: GB/T 31270—2014[S]. Beijing: China Standard Press, 2014. |
| [12] |
国家环境保护总局. 水和废水监测分析方法[M]. 4 版. 北京: 中国环境科学出版社, 2002: 102-112.
State Environmental Protection Administration. Determination methods for examination of water and wastewater[M]. 4th ed. Beijing: China Environmental Science Press, 2002: 102-112. |
| [13] |
生活饮用水标准检验方法 微生物指标: GB/T 5750.12—2006[S]. 北京: 中国标准出版社, 2007.
Standard examination methods for drinking water-microbiological parameters: GB/T 5750.12—2006[S]. Beijing: China Standard Press, 2007. |
| [14] |
矿化度的测定(重量法): SL 79—1994[S]. 北京: 中国标准出版社, 1995.
Determination of mineralized degree (gravimetric method): SL 79—1994[S]. Beijing: China Standard Press,1995. |
| [15] |
刘景坤, 武春媛, 邓晓, 等. 烯啶虫胺水解和土壤降解环境行为研究[J]. 热带作物学报, 2014, 35(5): 1029–1033.
LIU J K, WU C Y, DENG X, et al. Hydrolysis and degradation behavior of nitenpyram in soil[J]. Chin J Trop Crops, 2014, 35(5): 1029–1033. |
| [16] |
赵锋, 罗婧, 王鸣华. 哒嗪硫磷水解与土壤降解研究[J]. 生态环境学报, 2012, 21(4): 780–785.
ZHAO F, LUO J, WANG M H. Hydrolysis of pyridaphenthione and its degradation in soils[J]. Ecol Environ Sci, 2012, 21(4): 780–785. |
| [17] |
彭娟莹, 杨仁斌, 袁芳, 等. 敌草快的水解动力学研究[J]. 农药学学报, 2006, 8(4): 349–352.
PENG J Y, YANG R B, YUAN F, et al. Hydrolysis dynamics of diquat in aquatic environment[J]. Chin J Pestic Sci, 2006, 8(4): 349–352. |
| [18] |
田芹, 周志强, 江树人, 等. 毒死蜱在环境水体中降解的研究[J]. 农业环境科学学报, 2005, 24(2): 289–293.
TIAN Q, ZHOU Z Q, JIANG S R, et al. Degradation of chlorpyrifos in environmental water[J]. J Agro-Environ Sci, 2005, 24(2): 289–293. |
| [19] |
欧晓明. 农药在环境中的水解机理及其影响因子研究进展[J]. 生态环境, 2006, 15(6): 1352–1359.
OU X M. Hydrolysis and its influencing factors of pesticides in environment: a review[J]. Ecol Environ, 2006, 15(6): 1352–1359. |
| [20] |
于金莲, 石登荣, 任丽萍. 水体中农药降解研究的进展[J]. 农业环境科学学报, 2005, 24(Suppl. 1): 367–370.
YU J L, SHI D R, REN L P. The progress in the research of pesticides degradation in water[J]. J Agro-Environ Sci, 2005, 24(Suppl. 1): 367–370. |
| [21] | LIU B, MCCONNELL L L, TORRENTS A. Hydrolysis of chlorpyrifos in natural waters of the chesapeake bay[J]. Chemosphere, 2001, 44(6): 1315–1323. doi:10.1016/S0045-6535(00)00506-3 |
| [22] |
欧晓明, 雷满香, 裴晖, 等. 新农药硫肟醚的水解研究[J]. 农业环境科学学报, 2007, 26(6): 2309–2315.
OU X M, LEI M X, PEI H, et al. Hydrolysis of novel insecticide sulfoxime in buffered solutions[J]. J Agro-Environ Sci, 2007, 26(6): 2309–2315. |
| [23] |
曹忠军, 郑伟, 马志卿, 等. 雷公藤生物碱在水体中的降解[J]. 西北农业学报, 2015, 24(1): 166–169.
CAO Z J, ZHENG W, MA Z Q, et al. Degradation of alkaloids from Tripterygium wilfordii in water [J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2015, 24(1): 166–169. doi:10.7606/j.issn.1004-1389.2015.01.029 |
| [24] | SZETO S Y, WAN M T. Hydrolysis of azadirachtin in buffered and natural waters[J]. J Agric Food Chem, 1996, 44(4): 1160–1163. doi:10.1021/jf950575t |
| [25] | GILDERHUS P A, ALLEN J L, DAWSON V K. Persistence of rotenone in ponds at different temperatures[J]. North Am J Fish Manage, 1986, 6(1): 129–130. doi:10.1577/1548-8659(1986)6<129:PORIPA>2.0.CO;2 |
| [26] | DAWSON V K, HARMAN P D, SCHULTZ D P, et al. Rapid method for measuring rotenone in water at piscicidal concentrations[J]. Trans Am Fish Soc, 1983, 112(5): 725–727. doi:10.1577/1548-8659(1983)112<725:RMFMRI>2.0.CO;2 |
 2017, Vol. 19
2017, Vol. 19


