2. 西北农林科技大学 中国旱区节水农业研究院,陕西 杨凌 712100
2. Institute of Water-saving Agriculture in Arid Areas of China, Northwest A&F University, Yangling 712100, Shaanxi Province, China
玉米是生产中杂种优势利用最彻底的高秆 C4 作物,高产潜力巨大,是一种高光效作物,单产位于三大作物之首[1],在中国农业生产中占有十分重要的地位。玉米高产潜力能否得以发挥与群体光合作用强度有很重要的关系[2]。玉米生产中主要通过选用优良品种[3]、改善养分和水分供应条件[4]、优化群体结构[5]等措施来提高群体产量,化学调控技术的应用并不多见。
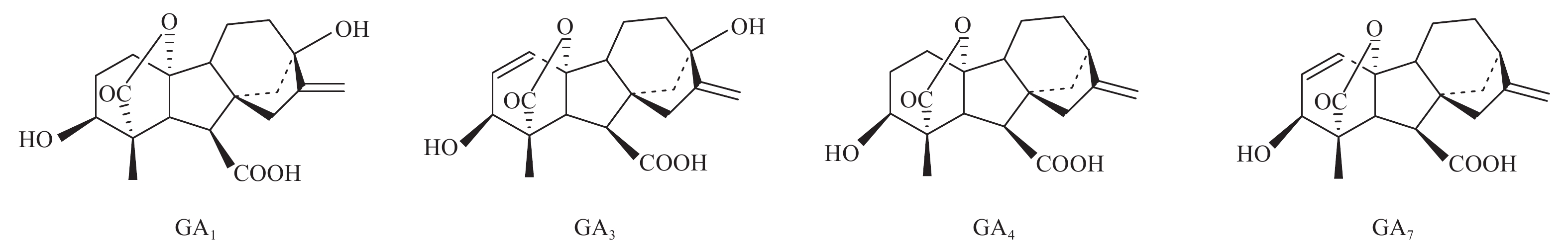
赤霉素是一种对从种子萌发到开花结果等生理过程都有调节作用的植物生长激素,目前已发现的赤霉素共有136种,总称为赤霉素类 (GAs),并依发现的先后顺序编号为 GA1~GA136,且发现时间越早,其活性越高 (部分具有高活性的赤霉素分子结构式见图式 1)[6]。在生产上经常通过喷施、枝条浸泡、浸种、拌种、涂抹外源赤霉素 (GA3) 等方法来促进生长、早熟及增产[7-8],有效地打破种子、块根、块茎和芽的休眠,促进萌发[9-10],诱导萝卜、白菜等二年生植物开花[11-12],促进坐果和果实生长[13-14],促进生根[15-16]等。赤霉素对植物的光合作用也有影响,如幼苗期用 GA3 处理茎生长点,可不同程度地提高甜菜叶片的光合速率和气孔导度,降低蒸腾速率[17]。但也有研究表明,赤霉素处理降低了羊草单位叶面积的净光合速率[18]。袁琳等[19]研究认为,外源 GA3 处理是否促进大豆的光合作用取决于其叶片内有活性的内源 GA1+3 的浓度。不同的研究中赤霉素对植物光合作用的影响结果并不一致。GA3 是目前应用最广的植物生长激素之一,随着研究的深入,该族的其他同系物,特别是 GA4 和 GA7 (见图 1) 由于对植物具有特殊作用而越来越受到重视。GA3 在打破种子休眠时会使胚轴伸长,而用 GA4、GA7 诱导只打破种子休眠并不影响胚轴;GA4 或 GA7 可提高某些植物的坐果率,但不会造成过多的营养生长[20];GA4 和 GA7 在延缓叶片衰老方面比 GA3 更有效[21]。
|
图式 1 具有高活性的赤霉素分子结构式 Scheme1 The chemical structure of GAs with high bioactivity |
玉米前期光合作用的增强有利于营养器官的形成与发育,从而保证营养生长顺利进行,而营养生长和后期的生殖生长密切相关,前期营养生长良好是正常、及时过渡到生殖生长的基础。作物个体的生产力高低首先取决于其开始时的投入,种子作为作物生产的最初投入,对植株的生长及其产量具有很大影响[22]。种子引发 (seed priming) 是一项控制种子缓慢吸水和逐步回干的种子处理技术,目前大多数研究表明,种子引发对作物前期的生长有着非常重要的作用,可以促进种子的萌发、提高出苗率,提高幼苗干重、鲜重及苗高,增强幼苗抗逆能力[23],而目前关于其对作物前期光合作用研究的报道较少。为了进一步探讨赤霉素对光合作用的影响,本研究采用 GA4+7 引发玉米种子处理,分析了 GA4+7 对玉米叶片叶绿素含量、荧光特性和光合指标的影响,以期为大田作物生产上植物生长调节剂的合理使用及玉米种子处理技术开发提供依据。
1 材料与方法 1.1 试验地概况试验设在西北农林科技大学农作试验一站 (108°04′E,34°20′N)。该站位于秦岭北麓、渭河平原西部的头道塬上,年平均日照时数 2 150 h,年平均气温 12~14 ℃,极端最低气温 –21~15 ℃,年平均降水量 580.5 mm,雨量主要集中在 7、8、9 月,属暖温带半湿润易旱气候。播种前土壤基本理化性状:土壤有机质 10.89 g/kg,全氮 1.43 g/kg,全磷 0.79 g/kg,全钾 5.86 g/kg,碱解氮 57.81 mg/kg,速效磷 26.09 mg/kg,速效钾 96.84 mg/kg。
1.2 试验材料及仪器供试玉米品种:‘郑单 958’购自中国种子公司。
供试药剂:赤霉素 GA4+7[m (GA4): m (GA7) = 40:60],(BR,纯度 ≥ 90.0%),购自上海瑞永生物科技有限公司。其余试剂为市售分析纯。
主要仪器:LI-6400 型光合测定仪 (美国,LI-COR 公司);PAM-2100 便携式叶绿素荧光仪 (德国,Walz 公司);UV-2500 紫外分光光度计 (日本,岛津有限公司)。
1.3 试验设计1.3.1 种子引发 参考文献[9, 24-26]进行。先用少量乙醇将 GA4+7 溶解,用蒸馏水定容并配制成质量浓度 (以 GA4 和 GA7 的总质量计) 分别为 10、60、120 mg/L 的溶液,依次记为 G1、G2 和 G3 处理,以未经处理的种子为对照 (CK)。将供试玉米种子先用 0.3% 的 NaClO 溶液消毒 5 min,再用无菌水振荡清洗 3 次,分别用不同质量浓度的 GA4+7 溶液在黑暗常温 (25 ℃) 下浸种 18 h,进行种子引发处理。将引发后的种子用蒸馏水快速冲洗干净,用无菌滤纸吸干表面水分后,于 25~30 ℃ 下脱水回干至原含水量 (10%),于 4 ℃ 冰箱中密封贮藏,待用。
1.3.2 大田试验 采用随机区组设计,小区面积 45 m2 (10 m × 4.5 m),3 次重复。玉米于 2015 年 6 月 13 日播种,行距 60 cm,株距 20 cm,播种密度为 82 500 株/hm2。播种前施尿素 150 kg/hm2、磷酸二胺 273 kg/hm2。于三叶期间苗,作物全生育期不灌溉,采用人工除草和喷洒化学药剂防虫等常规田间管理措施。玉米生育期降雨量 172.8 mm。于 2015 年 10 月 7 日收获,测定产量。
1.4 测定项目及方法1.4.1 光合参数 分别在三叶期、七叶期和拔节期,于晴天上午 9:00—11:00,用光合测定仪测定玉米植株最上一片完全展开叶的净光合速率 (Pn)、气孔导度 (Cd)、胞间 CO2 浓度 (Ci)。每个处理 3 次重复,取其平均值[27]。
1.4.2 叶绿素荧光参数 在三叶期、七叶期测定 Pn 的同时,利用叶绿素荧光仪测定玉米植株最上一片完全展开叶在自然光下的最大荧光 (Fm′) 和稳态荧光 (Fs) 等荧光参数,并在测定当晚 21:00 后叶片完全暗适应后,测定同一叶片的初始荧光 (F0) 和最大荧光 (Fm) [27]。每个处理 3 次重复。计算荧光参数 PSⅡ 最大光能转化效率 (Fv/Fm)、PSⅡ 实际量子转化效率 (⊿F/Fm′),其中 Fv = Fm–F0,⊿F = Fm′ – Fs。
1.4.3 叶片光合色素含量 分别于七叶期与拔节期取玉米植株最上一片完全展开叶的中间部位,去掉叶脉,称取鲜样 0.08 g,用 V (丙酮):V (无水乙醇) : V (蒸馏水) = 4.5 : 4.5 : 1 混合溶剂提取[28],通过紫外分光光度计测定。用 Lichtenthaler 公式[29]计算叶绿素 a、叶绿素 b 和类胡萝卜素含量。
1.4.4 叶面积 在三叶期、七叶期与拔节期分别选取 3 株长势一致的玉米植株,用长宽系数法[30]测量并计算绿色叶单株光合叶面积 (S) : S = L·b·k,其中 L 为叶片的长,b 为叶片宽,k 为校正系数 (取 k = 0.75,完全展开叶;k = 0.50,未完全展开叶)。3 次重复。
1.4.5 干物质积累量 选取具有代表性的单株 3 株,分别在三叶期、七叶期和拔节期,将植株按茎和鞘、叶及其他分为 3 部分,在烘箱中 105 ℃ 杀青 0.5 h 后,80 ℃ 烘干至恒重,分别称其干重[31]。3 次重复。
1.4.6 收获并测定产量 在成熟期,每小区选取中间 3 行玉米,随机选取 20 个果穗进行拷种,包括穗行数、行粒数、秃顶长、百粒重等。收获穗全部脱粒后自然风干,用水分仪测定水分后,按 14% 含水量计算籽粒产量[31]。
1.5 数据处理与分析用 Microsoft Excel 进行数据处理;用 SPSS 18.0 进行方差分析,用 Duncan 新复极差测验法进行多重比较。
2 结果与分析 2.1 用赤霉素进行种子引发处理对玉米前期光合参数的影响光合作用是植物获得能量和赖以生存的基础,其强弱直接决定了产量的高低。从三叶期、七叶期到拔节期,玉米种子经 GA4+7 引发后,与对照相比均显著提高了玉米的光合速率 (Pn)(表 1)。三叶期 Pn 大小表现为 G2 > G1 > G3 > CK,GA4+7 处理分别较对照提高了 74.3%、44.7% 和 23.3% (差异显著,P < 0.05,下同);七叶期为 G2 > G1 > G3 > CK,引发处理分别较对照提高了 42.6%、31.4% 和 22.4% (P < 0.05);拔节期为 G2 > G1 > G3 > CK,G2 和 G1 处理显著高于对照,分别提高 39.6% 和 27.4% (P < 0.05)。表明用 60 mg/L 的 GA4+7 引发种子的处理 (G2) 对玉米光合速率的提高幅度最大。
|
|
表 1 GA4+7 引发种子处理对玉米前期光合指标的影响 Table 1 Effect of seed priming with GA4+7 on photosynthetic indexes of maize in early stage |
二氧化碳和水分可以通过叶片气孔进行交换,气孔开放程度影响着细胞内 CO2 的同化及水分的利用。由表 1 可以看出,气孔导度 (Cd) 与光合速率变化趋势基本一致,对赤霉素质量浓度的反应也一致。三叶期各处理的 Cd 大小表现为 G2 > G1 > G3 > CK,引发处理分别较对照增加了 56.0%、67.6% 和 18.9% (P < 0.05);七叶期为 G2 > G1 > G3 > CK,引发处理分别较对照增加了 139.1%、45.6% 和 40.0% (P < 0.05);拔节期为 G2 > G1 > G3 > CK,引发处理分别较对照提高了 95.2%、36.3% 和 30.8% (P < 0.05)。说明 GA4+7 引发种子处理通过增大气孔导度保证 CO2 能够顺利进入叶片叶肉细胞,是 Pn 提高的重要原因。
如表 1 所示,随 GA4+7 质量浓度的增大,胞间 CO2 浓度 (Ci) 呈现先上升后降的趋势,且较对照均有不同程度的提高。在三叶期、七叶期和拔节期均以 G2 组的增幅最大,分别较对照提高了 67.5%、38.8% 和 76.7% (P < 0.05);G1 和 G3 在三叶期分别较对照提高了 36.8% 和 18.2%,其中 G1 较对照的差异达显著水平;在七叶期 G1 和 G3 分别较对照提高了 23.6% 和 20.8% (P < 0.05);在拔节期赤霉素各处理较对照提高均不显著。胞间 CO2 浓度的变化反映了叶肉细胞光合作用能力的大小,可作为影响光合速率变化主要原因的判断依据[32],胞间 CO2 浓度的提高,为玉米 Pn 的提高提供了原料保障。
2.2 赤霉素引发种子处理对玉米苗期荧光参数的影响初始荧光 (F0) 是植物叶片暗适应后光合系统 Ⅱ (PSⅡ) 中心完全处于开放状态下的荧光强度,代表不参与 PSⅡ 光化学反应的光能辐射部分[33]。PSⅡ 天线的热耗散增加可导致 F0 降低,PSⅡ 反应中心的破坏或可逆失活则可引起 F0 的增高[34]。从表 2 可以看出,随着 GA4+7 浓度的增大,F0 呈现先降低后升高的变化趋势,但是 3 个供试浓度下的 F0 均低于对照。三叶期表现为 G2 < G3 < G1 < CK,GA4+7 引发种子处理分别较对照显著降低了 28.0%、18.1% 和 15.1% (P < 0.05);七叶期表现为 G2 < G1 < G3 < CK,引发处理分别较对照降低了 8.6%、6.5% 和 3.4%,其中 G1 和 G2 与对照相比差异达显著水平 (P < 0.05)。说明用 GA4+7 引发种子能使 PSⅡ 天线的热耗散增加,从而导致 F0 降低,以热的形式将过多的激发能散发出去,避免了对 PSⅡ 反应中心的破坏。
|
|
表 2 用 GA4+7 引发种子处理对玉米苗期叶片荧光参数的影响 Table 2 Effect of seed priming with GA4+7 on the chlorophyll fluorescence parameters in leaves of maize seedlings |
最大荧光 (Fm) 是 PSⅡ 反应中心全部关闭时的荧光强度,是 PSⅡ 的最大量子产量,反映了电子传递情况[35]。从表 2 可以看出,种子经 GA4+7 引发后,Fm 值随着药剂质量浓度的增大呈现先升高后降低的趋势。三叶期表现为 G2 > G3 > G1 > CK,其中 G2 较对照提高 18.5% (P < 0.05),G3 和 G1 提高不显著;七叶期表现为 G2 > G1 > G3 > CK,引发处理组均显著高于对照,分别提高 10.2%、8.3% 和 6.9% (P < 0.05)。说明 GA4+7 引发种子对玉米叶片 Fm 有显著的促进作用,可提高光系统 II 的电子传递活性,保证光化学反应的顺利进行。
叶绿素荧光指标 Fv/Fm 反映的是 PSⅡ 反应中心内的光能转换效率或称最大 PSⅡ 的光能转换效率[36]。由表 2 可以看出,GA4+7 3 个浓度处理下的 Fv/Fm 值均显著高于对照,其中 G2 处理达到最大值,三叶期与七叶期均显著高于对照,分别提高了 25.6% 和 5.2% (P < 0.05)。说明在适宜的浓度范围内,种子经 GA4+7 引发处理可有效提高 PSⅡ 反应中心内光能转换效率。
PSⅡ 的实际量子效率 ⊿F/Fm′ = (Fm′ – Fs)/Fm′为 PSⅡ 反应中心电荷分离的实际量子效率,不仅与碳同化有关,也与光呼吸及依赖 O2 的电子流有关。它反映的是开放的 PSⅡ 反应中心在有部分关闭情况下的实际原初光能捕获效率[37]。由表 2 可见,GA4+7 各处理 PSⅡ 的实际量子效率均显著高于 CK,其中 G2 提高幅度最大,三叶期与七叶期较对照分别增加了 89.4% 和 65.4% (P < 0.05)。说明用适宜浓度的 GA4+7 引发种子,可以明显提高 ⊿F/Fm′值,从而有利于提高光能转化效率,为暗反应的光合碳同化积累更多所需的能量,以促进碳同化的高效运转和有机物的积累。
2.3 赤霉素引发种子处理对玉米前期叶片光合色素含量的影响在一定范围内,光合速率随叶绿素含量的增加而加快。叶绿素 a 在光合原初反应过程中起到反应中心色素分子和天线色素的作用,对于保证光合作用顺利进行起到关键的作用,其含量不仅决定总叶绿素含量水平,而且与叶片的净光合速率呈正相关[38]。由表 3 可以看出:随着 GA4+7 质量浓度的增大,玉米叶片中叶绿素 a 含量呈现先增大后减小的趋势,各处理较对照均有提高。其中以 G2 处理效果最好,三叶期、七叶期和拔节期分别较对照提高 20.7%、9.9% 和 9.0% (P < 0.05);其次是 G1 处理,各时期较对照分别提高 6.6%、6.6% 和 7.6% (P < 0.05);G3 处理仅三叶期较对照提高显著 (P < 0.05),七叶期和拔节期对叶绿素 a 含量无明显影响。
|
|
表 3 GA4+7引发种子对玉米前期叶片光合色素含量的影响 Table 3 Effect of seed priming with GA4+7 on photosynthetic pigment contents in leaves of maize in early stage |
叶绿素 b 是捕光色素蛋白复合体的重要组成部分,能够吸收和传递光能。叶绿素 b 含量高有利于捕获更多的光能,促进光合作用[39]。由表 3 可知,各处理在苗期均明显提高了玉米叶绿素 b 的含量,且 G1 与 G2 处理与对照均差异显著,三叶期分别提高 9.6% 与 25.3%,七叶期分别提高 20.8% 与 25.2%;拔节期各处理较对照虽有提高,但不显著。
虽然 Chl a/b 值的大小与叶片的净光合速率无直接正相关,但当具有较高的叶绿素含量时,低的 Chl a/b 值对光合作用的促进效果明显[38]。由表 3 可以看出,各浓度 GA4+7 引发种子处理均降低了 Chl a/b 值,其中七叶期 G1、G2 和 G3 较对照分别降低了 12.1%、12.7% 和 11.9% (P < 0.05);三叶期与拔节期较对照降低不明显。
类胡萝卜素一方面是光合色素,吸收光能并传递给反应中心,参与光合作用;另一方面又是细胞内源抗氧化剂,能够吸收剩余光能,淬灭活性氧,防止细胞的膜脂过氧化[34]。如表 3 所示,GA4+7 各处理在促进叶绿素合成的同时,类胡萝卜素含量也有相应的提高。在三叶期、七叶期和拔节期,G1 处理组叶片中类胡萝卜素含量较对照分别提高了 35.4%、9.0% 和 3.4%,G2 较对照分别提高了 52.8%、12.3% 和 5.7% (P < 0.05);而 G3 处理对类胡萝卜素含量没有影响。
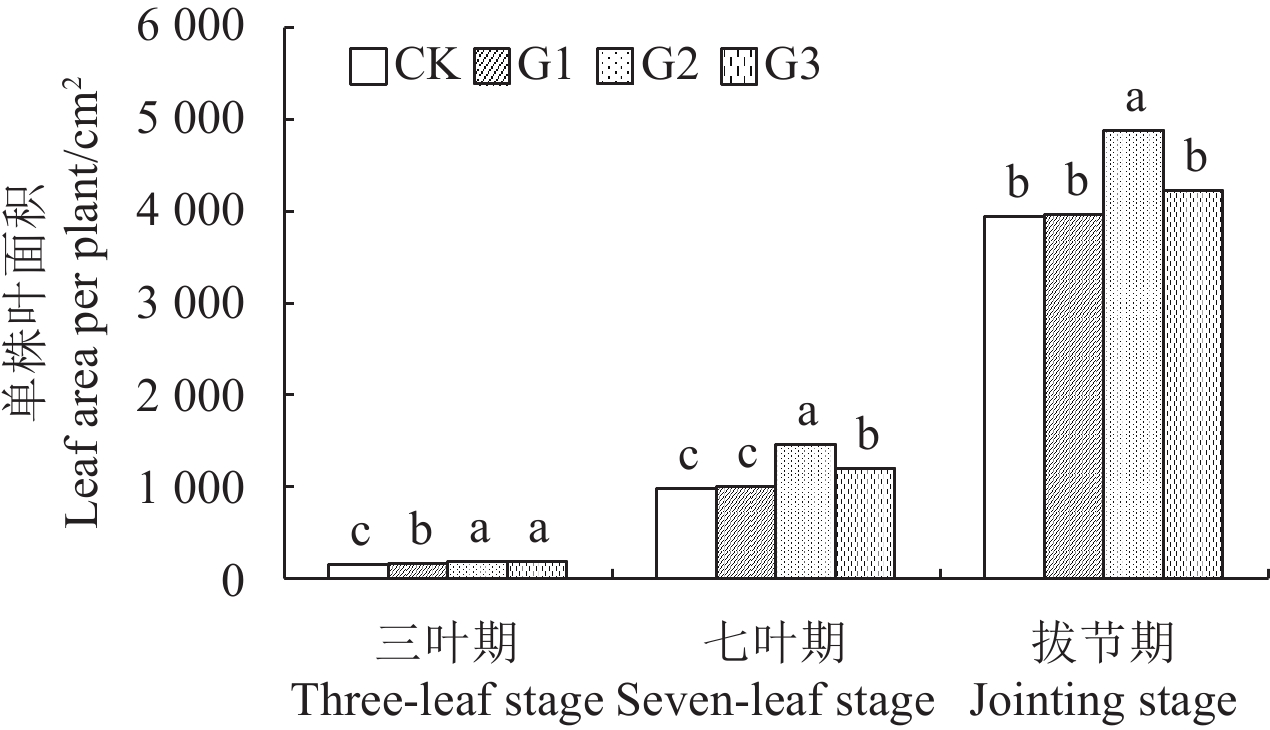
2.4 赤霉素引发种子处理对玉米前期单株叶面积的影响玉米种子经不同质量浓度的 GA4+7 引发后,其单株叶面积较对照都有了相应的提高 (图 1)。三叶期叶面积大小表现为 G2 > G3 > G1 > CK,引发处理较对照分别提高 30.9%、24.9% 和 11.8% (P < 0.05);七叶期表现为 G2 > G3 > G1 > CK,G2 和 G3 显著高于对照,分别提高了 48.5% 和 22.5% (P < 0.05);拔节期为 G2 > G3 > G1 > CK,G2 显著高于对照,提高了 24.1% (P < 0.05),G3 和 G1 较对照提高了 7.4% 和 0.8%。
|
注:图中同一时期不同小写字母表示处理间在 0.05 水平存在显著性差异。 Note: Values in the same stage followed by different letters are significantly different at 0.05 level. 图 1 GA4+7 引发种子对玉米前期单株叶面积的影响 Fig. 1 Effect of seed priming with GA4+7 on plant leaf area of maize early stage |
2.5 赤霉素引发种子处理对玉米前期单株干物质积累的影响
种子经 GA4+7 引发后促进了玉米三叶期、七叶期和拔节期的干物质积累 (图 2),且单株干物质量随赤霉素质量浓度增大呈现先升后降的变化趋势,与叶面积的变化趋势大体一致。单株干物质的积累量在三叶期、七叶期和拔节期均表现为 G2 > G3 > G1 > CK,且 G2 和 G3 均显著高于对照,三叶期分别提高 19.6% 和 8.8% (P < 0.05);七叶期分别提高 46.9% 和 26.5% (P < 0.05),拔节期分别提高 52.9% 和 34.4% (P < 0.05),G1 与对照差异不显著。从图中可以看出,GA4+7 引发种子与对照的差异随生育时期而加大。

|
图 2 GA4+7 引发种子对玉米前期单株干物质积累量的影响 Fig. 2 Effect of seed priming with GA4+7 on dry weight accumulation of maize early stage |
2.6 赤霉素引发种子处理对玉米产量及其构成因素的影响
玉米种子经不同浓度的 GA4+7 引发后,可不同程度地提高玉米产量 (表 4)。不同处理组玉米籽粒产量表现为 G2 > G3 > G1 > CK,较对照的增幅依次为 9.7%、6.0% 和 3.4%,其中 G2 和 G3 显著高于对照 (P < 0.05);引发处理组穗粒数较对照虽有所提高,但均未达到显著水平;不同处理的百粒重表现为 G2 > G3 > G1 > CK,较对照的增幅依次是 6.0%、5.1% 和 2.6% (P < 0.05)。
|
|
表 4 GA4+7 引发种子对玉米产量及其构成因素的影响 Table 4 Effect of seed priming with GA4+7 on yield and yield components of maize |
3 讨论
有关外源赤霉素处理对植物光合作用的影响已有许多报道。如不同浓度赤霉素处理能明显增加瓜尔豆叶片的净光合速率和蒸腾速率,促进其光合作用[40];能提高百合胞间 CO2 浓度[33]。本研究通过对玉米光合参数进行分析发现:采用不同浓度的赤霉素引发种子,均可促进叶片气孔的开放,同时增大胞间 CO2 浓度,为光合作用顺利进行提供充足的原料供应,明显提高了玉米前期的净光合速率,且以 60 mg/L 的 GA4+7 处理作用效果最为显著。
叶绿素在受到光的激发后,会产生荧光现象,叶绿素荧光与光合作用的过程紧密相关。褚孝莹等[8]通过研究开花期叶面喷施赤霉素对小黑麦光合作用的影响,发现一定浓度的外源赤霉素可增加小黑麦旗叶的 Fm 及 Fv/Fm 值,提高小黑麦旗叶的电子传递活性,减少光能的热耗散,利于光合机制的保护。张演义等[41]利用赤霉素处理葡萄果穗,发现其 PSⅡ 实际光化学量子效率和电子传递效率均显著增加。本研究结果表明:用赤霉素引发种子可以降低玉米叶片的初始荧光 (F0),提高其最大荧光 (Fm)、PSⅡ 光化学效率 (Fv/Fm) 以及 PSⅡ 实际量子效率 (⊿F/Fm′)。这与在百合[33]、小黑麦[8]以及葡萄[41]上施用赤霉素的研究结果一致。
光合色素是植物进行光合作用的物质基础。许多研究认为,在一定范围内增加叶绿素含量可以促进叶绿体对光能的吸收和转化[42-43]。本研究中,种子经 GA4+7 引发处理后可使玉米在七叶期和拔节期叶片中的叶绿素 a 和叶绿素 b 含量增加,提高了总体光合色素的含量,其原因是否为外源赤霉素促进了内源赤霉素的活性,进而促进了叶绿素的合成,尚需做进一步的机理研究。有研究表明,Chl a/b 值越低,越有利于类囊体的垛叠,形成更发达的基粒片层,有利于光能的吸收和传递[44]。本研究中,GA4+7 各处理较对照均显著降低了玉米前期 Chl a/b 值,是其光合速率提高的基础。当逆境胁迫时光化学反应就会受阻,叶绿素荧光只能消耗很少一部分捕获光能,热耗散便成为消耗过剩光能的主要方式。类胡萝卜素是叶绿体光合天线的辅助色素,同时以非辐射的方式耗散光系统 (PSⅡ) 的过剩能量,以保护叶绿素免受破坏。研究表明,在低温、弱光处理下,类胡萝卜素紫黄质与实际量子效率 (⊿F/Fm′)呈极显著正相关[45]。在本研究中,种子经不同浓度的 GA4+7 引发后均提高了玉米叶片中类胡萝卜素的含量,且与实际量子效率 (⊿F/Fm′)变化趋势一致,都以 60 mg/L GA4+7 的处理效果最好。
叶片是植物进行光合作用的最主要器官,叶面积的增加可以增加植株总的光合面积,提高光合能力。罗士苇等[46]研究报道,经过赤霉素处理的盆栽和大田种植的蚕豆、大豆和苋菜,其叶面积均有显著增加,并指出这是这几种作物鲜重和干重增加的重要因素之一。本研究结果表明,用 GA4+7 引发种子,也能增大玉米的叶面积,其中以 60 mg/L GA4+7 处理的叶面积最大,之后随 GA4+7 质量浓度增大玉米的叶面积呈现减小趋势。这是否由于高浓度赤霉素会引起叶片内脱落酸的大幅增加,削弱了其他促进类激素的效应,使其对细胞分裂的抑制效应增大,尚有待深入研究。
干物质生产与积累是玉米产量形成的基础。有研究表明,返青期外施赤霉素对羊草单株地上干物质的积累效果最好,最佳处理质量浓度为 50 mg/L[18];喷施 GA3 可以促进烤烟上部烟叶开片,促进烟株根、茎、上部叶的生长和干物质积累[47]。本研究表明,玉米种子用 GA4+7 引发可以提高玉米前期的干物质积累量,且以 60 mg/L 处理的效果最好,这可能是由于种子经 GA4+7 引发后,玉米叶片的净光合速率与叶面积同时增大,促进了光合产物累积的缘故。
作物产量是作物所有生理变化以及外界环境因子影响程度的最终体现。许多研究结果显示,赤霉素能够促进作物生长,从而提高产量[7-8, 48]。本研究结果表明,玉米种子经 GA4+7 处理,可以增大其前期叶面积,提高光合速率,有助于积累更多的干物质,从而促进前期营养生长,为后期生长提供物质基础,进而提高穗粒数和百粒重,影响产量,且与光合速率、叶面积、干物质积累的影响结果表现一致,增产幅度达 3.4%~9.7%,其中以 60 mg/L GA4+7 处理的增产效果最明显。
4 结论玉米种子经适宜浓度的 GA4+7 引发,能够显著提高其前期的净光合速率,这是因为 GA4+7 可提高气孔导度和胞间 CO2 浓度,为光合作用提供原料供应。用适宜浓度的 GA4+7 引发种子,还可提高玉米叶片中光合色素含量,改善叶绿素 a 与叶绿素 b 比值,从而能更协调地吸收光能,有效降低初始荧光 (F0),增大最大荧光 (Fm)、最大 PSⅡ 的光能转换效率 (Fv/Fm) 和 PSⅡ 的实际量子效率 (⊿F/Fm′),促进光化学反应的顺利进行,有利于玉米前期叶面积的增大和干物质的积累,提高穗粒数和百粒重,最终实现增产。GA4+7 3 个浓度处理中以 60 mg/L 的效果最明显。
| [1] |
梁书荣, 赵会杰, 李洪岐, 等. 密度、种植方式和品种对夏玉米群体发育特征的影响[J]. 生态学报, 2010, 30(7): 1927–1931.
LIANG S R, ZHAO H J, LI H Q, et al. Effects of planting densities and modes on developmental characteristics of summer maize populations in two varieties[J]. Acta Ecologica Sinica, 2010, 30(7): 1927–1931. |
| [2] |
王庆成, 刘开昌, 张秀清, 等. 玉米的群体光合作用[J]. 玉米科学, 2001, 9(4): 57–61.
WANG Q C, LIU K C, ZHANG X Q, et al. Canopy photosynthesis of maize (Zea mays L.) [J]. Maize Sci, 2001, 9(4): 57–61. |
| [3] |
马达灵, 任琴, 周峰. 玉米产量提高过程中品种特征研究进展[J]. 中国农学通报, 2016, 32(15): 38–43.
MA D L, REN Q, ZHOU F. Advances in cultivar characteristics for maize yield improving[J]. Chin Agric Sci Bull, 2016, 32(15): 38–43. doi:10.11924/j.issn.1000-6850.casb15100045 |
| [4] |
王晓娟, 贾志宽, 梁连友, 等. 不同有机肥量对旱地玉米光合特性和产量的影响[J]. 应用生态学报, 2012, 23(2): 419–425.
WANG X J, JIA Z K, LIANG L Y, et al. Effects of organic fertilizer application rate on leaf photosynthetic characteristics and grain yield of dryland maize[J]. Chin J Appl Ecol, 2012, 23(2): 419–425. |
| [5] |
张倩, 张洪生, 宋希云, 等. 种植方式和密度对夏玉米光合特征及产量的影响[J]. 生态学报, 2015, 35(4): 1235–1241.
ZHANG Q, ZHANG H S, SONG X Y, et al. The effects of planting patterns and densities on photosynthetic characteristics and yield in summer maize[J]. Acta Ecologica Sinica, 2015, 35(4): 1235–1241. |
| [6] |
黄桃鹏, 李媚娟, 王睿, 等. 赤霉素生物合成及信号转导途径研究进展[J]. 植物生理学报, 2015, 51(8): 1241–1247.
HUANG T P, LI M J, WANG R, et al. Progress in study of gibberellins biosynthesis and signaling transduction pathway[J]. Plant Physiol J, 2015, 51(8): 1241–1247. |
| [7] |
丁俊胄, 尹涛, 余翔, 等. 外源赤霉素、6-苄基腺嘌呤及矿物质对水培绿豆芽生长的影响[J]. 植物生理学报, 2011, 47(5): 501–504.
DING J Z, YIN T, YU X, et al. Effects of exogenous GA3, 6-BA and mineral on mung bean sprouts growth [J]. Plant Physiol J, 2011, 47(5): 501–504. |
| [8] |
褚孝莹, 李晶, 李馨园, 等. 开花期叶面喷施赤霉素对小黑麦旗叶光合及产量的影响[J]. 麦类作物学报, 2011, 31(6): 1136–1140.
CHU X Y, LI J, LI X Y, et al. Effect of spraying GA3 at anthesis stage on photosynthesis of flag leaf and yield of triticale [J]. Trit Crops, 2011, 31(6): 1136–1140. doi:10.7606/j.issn.1009-1041.2011.06.024 |
| [9] |
屈燕, 区智, 尤小婷, 等. 赤霉素对总状绿绒蒿三个居群种子萌发特性的影响[J]. 植物生理学报, 2014, 50(9): 1374–1378.
QU Y, OU Z, YOU X T, et al. Effects of gibberellin on seed germination characteristics in three populations of Meconopsis racemosa [J]. Plant Physiol J, 2014, 50(9): 1374–1378. |
| [10] |
张雪, 梁俊, 景淑娟, 等. 植物生长调节剂对‘秦冠’苹果花粉管生长和花粉萌发的影响[J]. 中国农学通报, 2014, 30(25): 213–217.
ZHANG X, LIANG J, JING S J, et al. Influences of plant growth regulators on pollen tube growth and germination in ‘Qinguan’ apple[J]. Chin Agric Sci Bull, 2014, 30(25): 213–217. doi:10.11924/j.issn.1000-6850.2014-0516 |
| [11] |
侯雷平, 王丽, 李梅兰. 赤霉素处理促进白菜开花的效应分析[J]. 中国农学通报, 2009, 25(6): 171–174.
HOU L P, WANG L, LI M L. Analysis about the effects of gibberellins promoting flowering of Chinese cabbage[J]. Chin Agric Sci Bull, 2009, 25(6): 171–174. |
| [12] |
王淑芬, 徐文玲, 郎丰庆, 等. 赤霉素对耐抽薹萝卜抽薹开花的影响[J]. 山东农业科学, 2002(6): 14–16.
WANG S F, XU W L, LANG F Q, et al. Effects of Gibberelin (GA3) treatment on bolting and flowering of difficult bolting type of Chinese radish [J]. Shandong Agric Sci, 2002(6): 14–16. |
| [13] |
杨玉艳, 王建楼, 鲁井云, 等. ‘峰后’葡萄果实发育与赤霉素(GA3)处理以及VvSEP3基因表达的关系
[J]. 中国农业大学学报, 2012, 17(1): 72–79.
YANG Y Y, WANG J L, LU J Y, et al. Berry development in relation to gibberellin (GA3) treatment and VvSEP3 expression of ‘Fenghou’ grapevine [J]. China Agric Univ, 2012, 17(1): 72–79. |
| [14] |
鲁井云, 卢龙, 邢佳毅, 等. 外施赤霉素对‘峰后’葡萄坐果及VvAG基因表达的影响
[J]. 中国农业大学学报, 2015, 20(1): 53–59.
LU J Y, LU L, XING J Y, et al. Improvement of fruit set and expression of VvAGs in ‘Fenghou’ grapevine with exogenous gibberellin [J]. China Agric Univ, 2015, 20(1): 53–59. |
| [15] |
于玲, 钟原, 王莹, 等. 低温和赤霉素对紫斑牡丹种子萌发和幼苗生长的影响[J]. 北京林业大学学报, 2015, 37(4): 120–126.
YU L, ZHONG Y, WANG Y, et al. Effects of gibberellic acid and chilling treatments on seed germination and seedling growth of Paeonia rockii hybrids [J]. Beijing Forestry Univ, 2015, 37(4): 120–126. |
| [16] |
王书胜, 单文, 张乐华, 等. 植物生长调节剂对鹿角杜鹃扦插繁殖的影响[J]. 植物科学学报, 2014, 32(2): 158–167.
WANG S S, SHAN W, ZHANG L H, et al. Effects of plant growth regulator on cutting propagation of Rhododendron latoucheae [J]. Plant Sci J, 2014, 32(2): 158–167. |
| [17] |
黄兆峰, 李彩凤, 孙世臣, 等. 赤霉素对甜菜当年抽苔及光合作用的调控[J]. 作物杂志, 2009(2): 41–43.
HUANG Z F, LI C F, SUN S C, et al. Regulation of gibberellin on bolting in the first year and photosynthesis in sugar beet[J]. Crops, 2009(2): 41–43. |
| [18] |
崔爽, 穆春生. 分蘖拔节期外施赤霉素对羊草光合和蒸腾作用的影响[J]. 草业学报, 2005, 14(2): 97–101.
CUI S, MU C S. Effects of exogenous gibberellin acid (GA3) on photosynthesis and transpiration of Leymus chinensis at the tillering and jointing stage [J]. Acta Pratacuurae Sinica, 2005, 14(2): 97–101. |
| [19] | YUAN L, XU D Q. Stimulatory effect of exogenous GA3 on photosynthesis and the level of endogenous GA1+3 in soybean leaf [J]. Plant Physiol Mol Biol, 2002, 28(4): 317–320. |
| [20] |
颜方贵, 秦杰, 何增国, 等. 赤霉素A4、A7的研究进展
[J]. 微生物学通报, 1994, 21(3): 163–167.
YAN F G, QIN J, HE Z G, et al. Research advances of GA4, GA7[J]. Microbiol China, 1994, 21(3): 163–167. |
| [21] | JORDI W, STOOPEN G M, KELEPOURIS K, et al. Gibberellin-induced delay of leaf senescence of Alstroemeria cut flowering stems is not caused by an increase in the endogenous cytokinin content [J]. Plant Growth Regul, 1995, 14(3): 121–127. doi:10.1007/BF00210913 |
| [22] |
王庆祥. 玉米种子差异对前期生长及产量的影响[J]. 玉米科学, 1994, 2(3): 41–44.
WANG Q X. The influence of seed difference on early growth and grain yield of maize[J]. Maize Sci, 1994, 2(3): 41–44. |
| [23] |
马多结吉, 王永超. 种子引发技术的研究进展[J]. 种子, 2013, 32(12): 43–46.
MADUO J J, WANG Y C. Study progress of seed priming techniques[J]. Seed, 2013, 32(12): 43–46. doi:10.3969/j.issn.1001-4705.2013.12.012 |
| [24] |
刘冰, 薛枫, 马建芳, 等. 不同浓度GA3对萝卜和玉米种子发芽率及幼苗生长的影响
[J]. 天津师范大学学报(自然科学版), 2011, 31(4): 70–73.
LIU B, XUE F, MA J F, et al. Effects of different concentrations of GA3 on germination rate and seedling growth of radish and corn [J]. J Tianjin Normal Univ (Nat Sci Ed), 2011, 31(4): 70–73. |
| [25] |
金兰, 丁莉, 罗桂花, 等. 不同浓度GA3对川贝母发芽率及酯酶同工酶的影响
[J]. 种子, 2009, 28(8): 51–52.
JIN L, DING L, LUO G H, et al. Effects of different concentration GA3 on germination rate and esterase of Fritillaria cirrhosa seeds [J]. Seed, 2009, 28(8): 51–52. |
| [26] |
张永芳, 卫秋慧, 王润梅, 等. 外源赤霉素对盐胁迫下谷子种子萌发的影响[J]. 作物杂志, 2012(6): 139–141.
ZHANG Y F, WEI Q H, WANG R M, et al. Effect of exogenous GA3 on seed germination of millet under salt stress [J]. Crops, 2012(6): 139–141. |
| [27] |
孟祥萍. 褪黑素引发种子对冬小麦水分胁迫下生长及生理的影响[D]. 杨凌: 西北农林科技大学, 2016.
MENG X P. Effects of melatonin priming seedlings treatment on growth and physiology of wheat under water stress[D]. Yangling: Northwest A&F University, 2016. |
| [28] |
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 74-76.
GAO J F. Experimental guidance for plant physiology[M]. Beijing: Higher Education Press, 2006: 74-76. |
| [29] | LICHTENTHALER H K, WELLBURN A R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents[J]. Biochem Soc Trans, 1983, 11(5): 591–592. doi:10.1042/bst0110591 |
| [30] | 王得贤. 四种测定单株玉米总叶面积方法的比较[J]. 青海农林科技, 1999(04): 20–21. |
| [31] |
刘铁宁. 减源对密植夏玉米光合性能和产量的影响及其生理机制研究[D]. 泰安: 山东农业大学, 2015.
LIU T N. Effects of leaf removal on photosynthetic capacity and yield of summer maize under high density and its physiological mechanisms[D]. Tai’an: Shandong Agricultural University, 2015. |
| [32] |
孟凡超, 张佳华, 郝翠, 等. CO2浓度升高和不同灌溉量对东北玉米光合特性及产量的影响
[J]. 生态学报, 2015, 35(7): 2126–2135.
MENG F C, ZHANG J H, HAO C, et al. Effects of elevated CO2 and different irrigation on photosynthetic parameters and yield of maize in Northeast China [J]. Acta Ecologica Sinica, 2015, 35(7): 2126–2135. |
| [33] |
黄樟华. 赤霉素对百合组培苗光合特性和生长状况的影响研究[D]. 南宁: 广西大学, 2006: 30.
HYANG Z H. Study on the effects of GA3 on the photosynthetic characteristics and growth of tisseu-cultured derived plant lily[D]. Nanning: Guangxi University, 2006: 30. |
| [34] |
杨志晓, 丁燕芳, 张小全, 等. 赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响[J]. 生态学报, 2015, 35(12): 4146–4154.
YANG Z X, DING Y F, ZHANG X Q, et al. Impacts of Alternaria alternata stress on characteristics of photosynthesis and chlorophyll fluorescence in two tobacco cultivars with different resistances [J]. Acta Ecologica Sinica, 2015, 35(12): 4146–4154. |
| [35] |
郝兴宇, 韩雪, 李萍, 等. 大气CO2浓度升高对绿豆叶片光合作用及叶绿素荧光参数的影响
[J]. 应用生态学报, 2011, 22(10): 2776–2780.
HAO X Y, HAN X, LI P, et al. Effects of elevated atmospheric CO2 concentration on mung bean leaf photosynthesis and chlorophyll fluorescence parameters [J]. Chin J App Ecol, 2011, 22(10): 2776–2780. |
| [36] |
唐晓川. 植物生长调节剂对冬小麦苗期抗旱生长的影响[D]. 北京: 中国农业科学院, 2014: 28-29.
TANG X C. Effect of plant growth regulators on winter wheat growth under drought stress[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014: 28-29. |
| [37] |
卢广超, 许建新, 薛立, 等. 干旱胁迫下4种常用植物幼苗的光合和荧光特性综合评价[J]. 生态学报, 2013, 33(24): 7872–7881.
LU G C, XU J X, XUE L, et al. Comprehensive evaluation on photosynthetic and fluorescence characteristics in seedlings of 4 drought resistance species[J]. Acta Ecologica Sinica, 2013, 33(24): 7872–7881. |
| [38] |
孟军, 陈温福, 徐正进, 等. 水稻剑叶净光合速率与叶绿素含量的研究初报[J]. 沈阳农业大学学报, 2001, 32(4): 247–249.
MENG J, CHEN W F, XU Z J, et al. Study on photosynthetic rate and chlorophyll content[J]. J Shenyang Agric Univ, 2001, 32(4): 247–249. |
| [39] |
王琼, 唐娅, 谢涛, 等. 入侵植物喜旱莲子草和本地种接骨草光合生理特征对增温响应的差异[J]. 生态学报, 2017, 37(3): 770–777.
WANG Q, TANG Y, XIE T, et al. Distinctive responses of photosynthetic characteristics to warming of invasive Alternanthera philoxeroides and native Sambucus chinensis [J]. Acta Ecologica Sinica, 2017, 37(3): 770–777. |
| [40] |
周玲, 魏小春, 郑群, 等. 脱落酸与赤霉素对瓜尔豆叶片光合作用及内源激素的影响[J]. 作物杂志, 2010(1): 15–20.
ZHOU L, WEI X C, ZHENG Q, et al. Effects of ABA and GA3 on guar photosynthetic characteristics and endogenous hormones [J]. Crops, 2010(1): 15–20. |
| [41] |
张演义, 贾海锋, 赵方贵, 等. 赤霉素处理夏黑葡萄果穗对叶片光合及荧光特性的影响[J]. 江苏农业学报, 2014, 30(6): 1472–1479.
ZHANG Y Y, JIA H F, ZHAO F G, et al. Effect of gibberellin treatment on photosynthesis and chlorophyll fluorescence characteristics of summer black grape leaf[J]. Jiangsu J Agric Sci, 2014, 30(6): 1472–1479. |
| [42] |
王一, 张霞, 杨文钰, 等. 不同生育时期遮阴对大豆叶片光合和叶绿素荧光特性的影响[J]. 中国农业科学, 2016, 49(11): 2072–2081.
WANG Y, ZHANG X, YANG W Y, et al. Effect of shading on soybean leaf photosynthesis and chlorophyll fluorescence characteristics at different growth stages[J]. Scientia Agricultura Sinica, 2016, 49(11): 2072–2081. doi:10.3864/j.issn.0578-1752.2016.11.004 |
| [43] |
王景燕, 龚伟, 包秀兰, 等. 水肥耦合对汉源花椒幼苗叶片光合作用的影响[J]. 生态学报, 2016, 36(5): 1321–1330.
WANG J Y, GONG W, BAO X L, et al. Coupling effects of water and fertilizer on diurnal variation of photosynthesis of Zanthoxylum bungeanum Maxim ‘Hanyuan’seedling leaf [J]. Acta Ecologica Sinica, 2016, 36(5): 1321–1330. |
| [44] | ANDERSON J M, ARO E M. Grana stacking and protection of photosystem II in thylakoid membranes of higher plant leaves under sustained high irradiance: an hypothesis[J]. Photosynth Res, 1994, 41(2): 315–326. doi:10.1007/BF00019409 |
| [45] | 吴天珍. 低温弱光下辣椒叶片类胡萝卜素含量变化及其与叶绿素荧光参数的关系[D]. 兰州: 甘肃农业大学, 2015: 29. |
| [46] |
罗士苇, 林坤律, 张正福. 赤霉素的生理作用Ⅱ. 赤霉素对植物叶面积与光合作用的影响[J]. 实验生物学报, 1960, 7(1-2): 105–108.
LUO S W, LIN K L, ZHANG Z F. Studies on the physiological actions of the gibberellins Ⅱ. The effect of gibberellin on the leaf area and photosynthesis of plants[J]. Acta Biologiae Experimentalis Sinica, 1960, 7(1-2): 105–108. |
| [47] |
李健忠, 薛立新, 朱金峰, 等. 赤霉素和萘乙酸互作对烤烟生长、碳氮代谢及烟叶品质的影响[J]. 植物生理学报, 2015, 51(9): 1473–1481.
LI J Z, XUE L X, ZHU J F, et al. Interaction effect of gibberelin and NAA on growth, carbon and nitrogen metabolism and leaf quality in flue-cured tobacco[J]. Plant Physiol J, 2015, 51(9): 1473–1481. |
| [48] |
李海平, 任彩文. 赤霉素浸种对苦荞种子萌发生理特性的影响[J]. 山西农业科学, 2009, 37(2): 19–21.
LI H P, REN C W. Effect of GA seed soaking on germination physiological characteristics in buckwheat seeds[J]. Shanxi Agric Sci, 2009, 37(2): 19–21. |
 2017, Vol. 19
2017, Vol. 19


