独脚金属 (Striga spp.) 及列当属 (Orobanche spp. 和 Phelipanchce spp.) 根寄生杂草是危害农业生产的重要有害生物,每年因其侵染茄科、豆科和谷类等农作物,可造成 20%~80%的产量损失[1]。独脚金属和列当属等根寄生杂草种子萌发具有时空调控性:首先需要在合适的温度和湿度下经过预培养,才能够响应萌发诱导物的刺激,然后在合适的萌发诱导物刺激下,根寄生杂草种子萌发,并与寄主建立寄生关系[2]。根据根寄生杂草种子萌发的特异性,可借助化学调控方式造成其种子萌发的时空错配 (自杀性萌发),提前终止根寄生杂草在寄主作物上的生长,进而达到对根寄生杂草的有效控制。本文拟围绕根寄生杂草的危害及其生长特点、种子萌发剂独脚金内酯的生物合成与分离鉴定,以及调控根寄生杂草种子萌发的机制等方面进行综述,旨在为根寄生杂草的防治提供参考。
1 根寄生杂草类型寄生植物是一类全球分布、依靠寄主植物获得营养的特殊植物类群[3],依据寄生寄主植物部位的不同,可划分为茎叶寄生植物和根寄生植物[4]。其中,对农业生产造成较大危害的是根寄生杂草,主要包括独脚金属 (Striga spp.) 及列当属 (Orobanche spp. 和 Phelipanchce spp.)[5]。列当属杂草自身不能进行光合作用,需要完全依赖寄主植物获得水分和营养,属于全寄生性杂草,寄生的植物主要是茄科和豆科,如番茄、烟草、茄子、豌豆和蚕豆等双子叶植物[6]。独脚金属杂草是半寄生性植物,尽管其自身具有一定的光合作用能力,但仍需要依赖寄主完成整个生活史[5]。独脚金属杂草主要寄生在谷类作物上,如玉米、高粱、稻、粟、甘薯等[6]。
2 根寄生杂草寄主范围、危害及生长特点 2.1 根寄生杂草危害是世界性问题独脚金属和列当属杂草是世界范围内危害最为严重的根寄生杂草,每年由其侵染寄主农作物可造成数十亿美元的经济损失[7]。对农作物生产造成严重危害的列当属杂草主要包括锯齿列当 Orobanche crenata Forsk.、向日葵列当 Orobanche cumana Wallr.、分枝列当 Phelipanche ramose L.、瓜列当 Phelipanche aegyptiaca Pers.、弯管列当 Orobanche cernua Loefl. 和小列当 Orobanche minor Sm.[6]。其中,中国常见的列当属杂草有向日葵列当、分枝列当和瓜列当[8]。
锯齿列当主要危害的农作物有蚕豆、豌豆、小扁豆和胡萝卜等,在地中海沿岸国家和亚洲西部均有分布[9]。向日葵列当主要侵染向日葵,在中国、欧洲东部、地中海东部和北非等国家均有分布[6]。弯管列当主要侵染番茄、烟草、辣椒、茄子等茄科植物,在中国、东欧、南欧、北非、南亚和澳大利亚均有分布[6, 10]。分枝列当主要在地中海地区分布,主要侵染番茄、马铃薯和烟草[10-12]。瓜列当和分枝列当有相似的寄主范围,在中国新疆、地中海东部和西南亚国家有分布[6, 8, 13]。小列当主要侵染苜蓿,广泛分布在欧洲、中东和北非的西海岸[6]。
目前报道的独脚金属杂草有 28 种,其中,对农业生产造成危害的主要包括珍珠粟独脚金 Striga hermonthica、玉米独脚金 S. asiatica 和烟草独脚金 S. gesnerioides[14]。珍珠粟独脚金是独脚金属中对农业生产危害最为严重的根寄生杂草,广泛分布在非洲的热带和亚热带地区[15-16]。玉米独脚金主要寄生于红花,在非洲东部、非洲南部以及亚洲热带和亚热带地区均有分布[17-18]。烟草独脚金在非洲分布广泛,可侵染豇豆、烟草和红薯[17, 19]。目前看来,根寄生性杂草危害已逐渐成为世界性问题。
2.2 根寄生杂草的生活史了解根寄生杂草的生活史,对该杂草的防治具有重要的指导意义。独脚金属和列当属杂草的生活史间存在相似性,主要包括:1) 根寄生杂草种子识别适当的寄主,继而萌发,萌发的幼苗朝向寄主生长;2) 产生吸器,借助吸器吸取寄主的养分和水分;3) 在寄主上建立寄生关系,完成根寄生杂草自身的生活史,直至产生种子。
独脚金属和列当属杂草可产生大量细小的种子,并可在土壤中存活数年,最长可达 14 a[20]。独脚金属和列当属等根寄生杂草种子的萌发具有时空调控性,即首先需要经过一定温度和湿度条件下的预培养,以完成种子的胚后熟过程[2],然后在一定浓度的特定萌发诱导物刺激下才能够萌发;否则,将再次进入休眠[5]。种子萌发后,根尖朝向寄主植物的根生长,一旦与寄主植物的根接触,根寄生杂草将形成吸器,穿透寄主植物根的表皮。独脚金属杂草借助形成的吸器建立与寄主木质部的连接,从而获得寄主的水分和营养物质。列当属杂草,除与寄主建立木质部连接外,还可形成韧皮部间的连接,且与寄主韧皮部间的连接是列当属杂草从寄主获取营养的主要方式[21]。寄生关系建立后,根寄生杂草即可依赖寄主作物完成自身生活史,包括开花、授粉和结种。
根寄生杂草种子颗粒小,储存营养少,一旦萌发,如果不能及时与寄主建立寄生关系,将导致杂草种子萌发的时空错配 (自杀性萌发),从而失去正常生长条件而消亡。因此,可针对根寄生杂草种子萌发的特点,通过切实可行的防治措施进行防治。
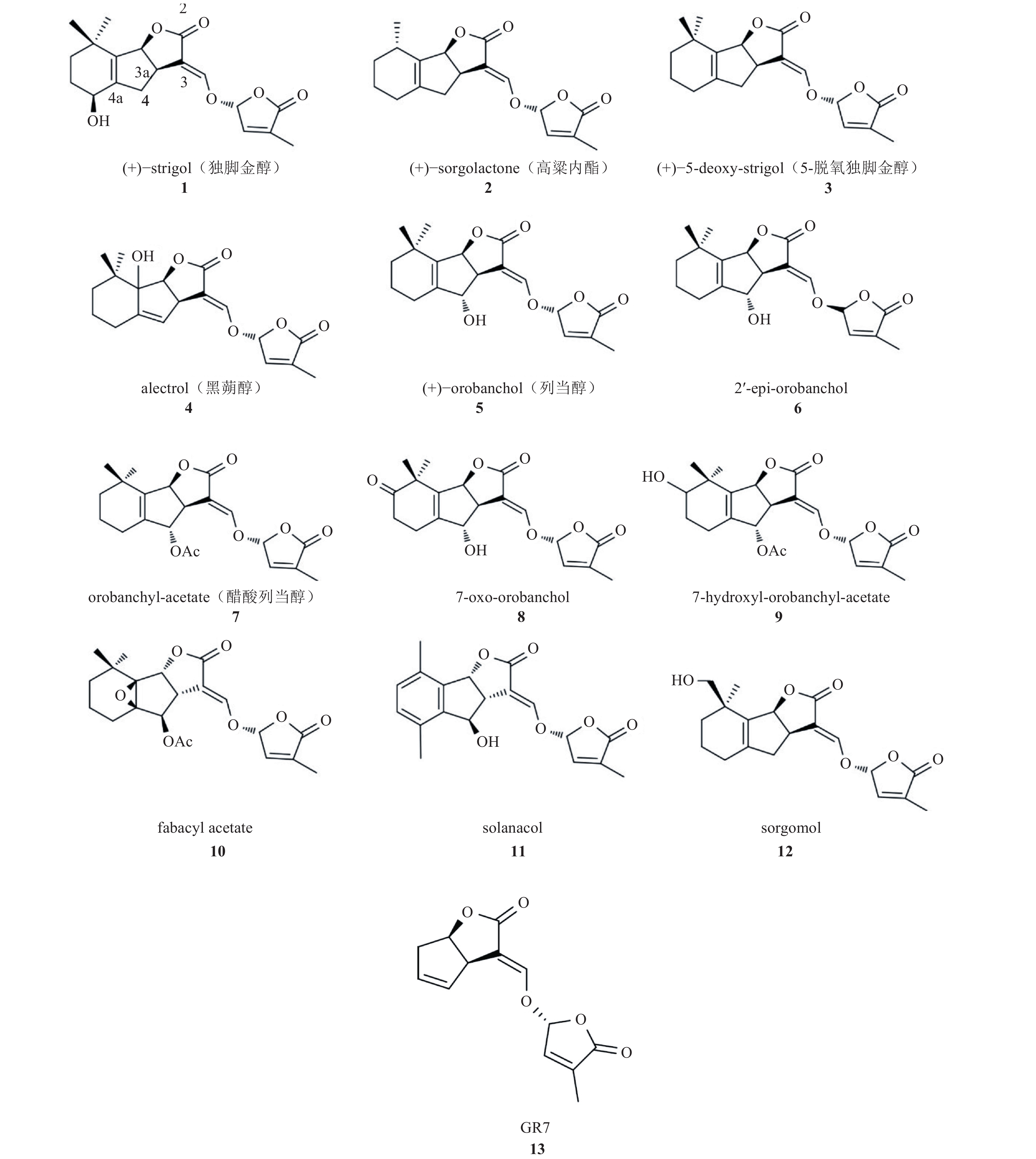
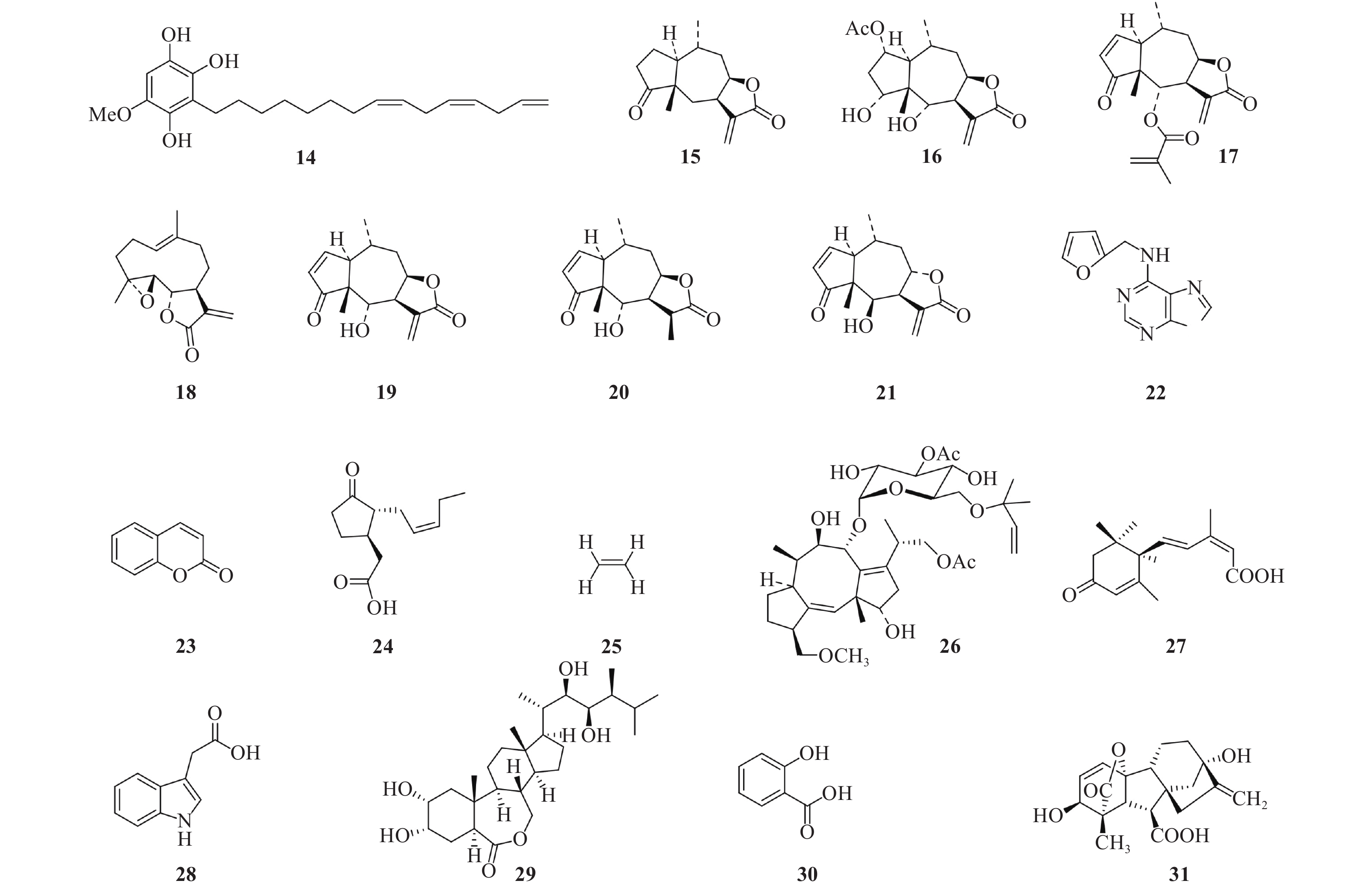
3 种子萌发剂类型及适用范围第一个被分离得到的根寄生杂草种子萌发刺激物是独脚金醇 (strigol,图 1 化合物 1)[22]。随后,一系列结构相似、具有促进根寄生杂草萌发活性的化合物 (图 1) 从不同的寄主植物根系分泌物中被分离出来,这类化合物被称为独脚金内酯 (strigolactones,SLs)[23-24]。此后化学家模拟天然独脚金内酯的结构,合成了一系列独脚金内酯衍生物或类似物[24]。痕量的独脚金内酯 (10–15 至 10–7 mol/L) 即可促进独脚金属和列当属杂草种子的萌发[25]。然而,不同化学结构的独脚金内酯对不同根寄生杂草种子萌发的刺激能力有所不同。例如,与化合物 1 [(+)-strigol] 和 11 (solanacol) 相比,化合物 6 (2′-epi-orobanchol) 具有更强的促进小列当 O. minor 和分枝列当 P. ramosa 种子萌发的能力,而化合物 5 [(+)-orobanchol] 的萌发刺激能力居中[26]。目前,已分离到的种子萌发刺激物还包括二氢高粱醌 (dihydrosorogoleone,化合物 14)、倍半萜烯内酯 (sesquiterpene lactones,化合物 15~21)、细胞分裂素 (cytokinin,CTK, 化合物 22)、香豆素 (coumarin,化合物 23)、茉莉酸酮酯 (jasmonate,JA, 化合物 24)、乙烯 (ethylene,ETH, 化合物 25) 和真菌代谢物壳梭孢菌素 (fusicoccin,化合物 26) (图 2)[23],但这些化合物并不能对所有的 Striga 属、Orobanche 属和 Phelipanchce 属杂草种子的萌发表现出刺激作用[25]。例如,一些倍半萜烯内酯化合物能够诱导根寄生杂草向日葵列当 O. cumana 种子的萌发,但对锯齿列当 O. crenata 和分枝列当 O. ramosa 种子的萌发无刺激作用[27-28]。而独脚金内酯不仅刺激根寄生杂草种子萌发的能力最强,并且较其他种子萌发刺激物更具有广谱性。因此,我们认为独脚金内酯是最具有市场开发潜力的种子萌发剂,可借助独脚金内酯化学调控根寄生杂草种子的萌发,造成根寄生杂草种子萌发的时空错配,提前终止其寄生寄主作物,实现对根寄生植物的有效防治。
|
图 1 天然产物独脚金内酯及人工合成物 GR7 的化学结构[24] Fig. 1 Structures of naturally occurring strigolactones and synthetic analogue GR7[24] |
|
图 2 部分种子萌发刺激物的化学结构 Fig. 2 Structures of some seed germination stimulants |
天然独脚金内酯或其衍生物和类似物在土壤中的稳定性受土壤 pH 影响。例如,独脚金内酯的人工合成物 GR7 (化合物 13) 在 pH ≤ 7.5 的土壤中的半衰期为 100 h 左右,而在 pH > 7.5 的碱性环境中其半衰期迅速缩短[29]。因此,受不同田块土壤不同 pH 值的限制,现阶段独脚金内酯作为潜在的种子萌发剂尚不能在实际生产中推广使用。
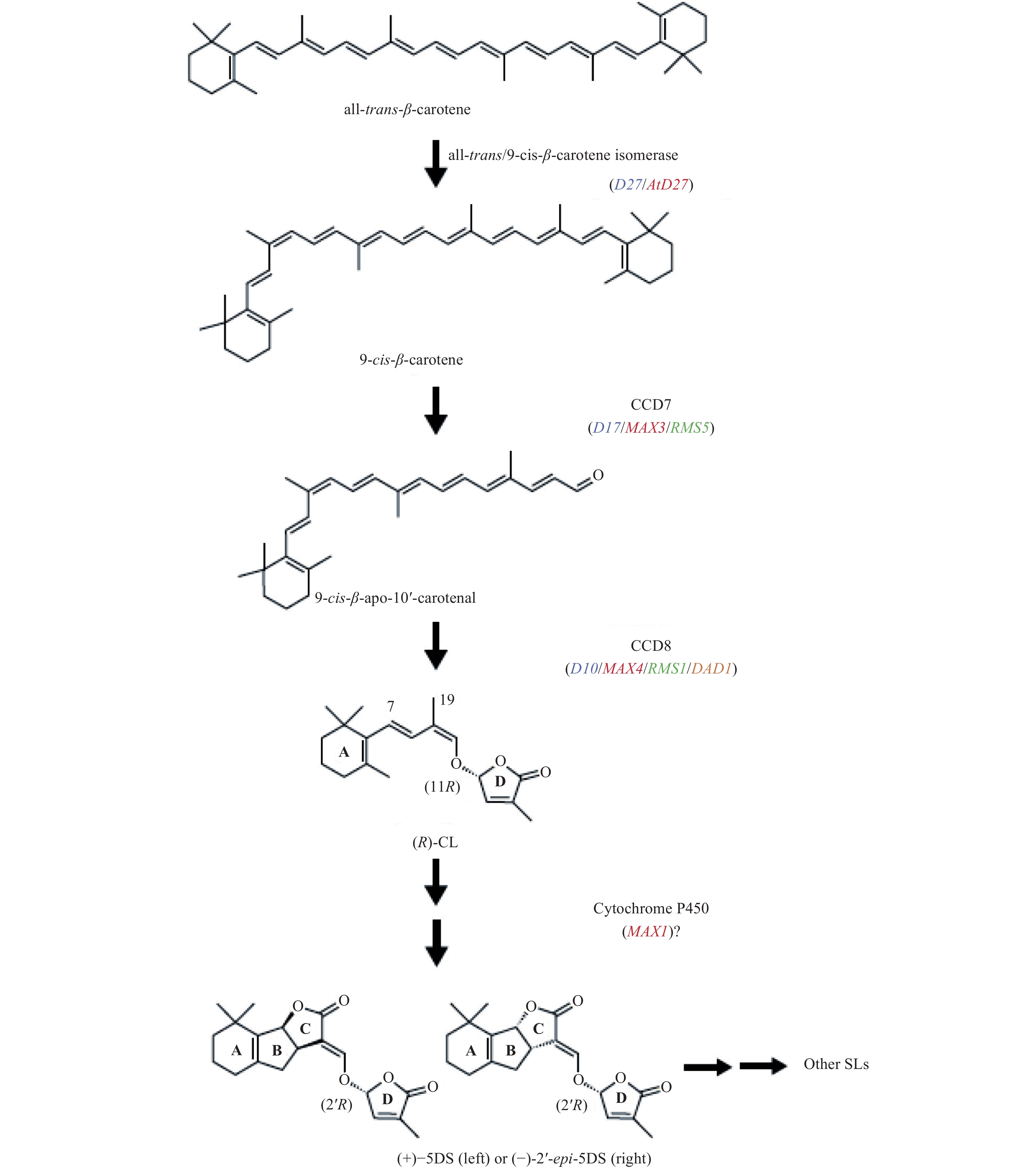
4 独脚金内酯的生物合成途径及分离鉴定 4.1 独脚金内酯的生物合成途径典型的独脚金内酯化学结构是 A、B、C 3 环通过烯醇醚键与丁烯酸内酯的 D 环连接。目前,有关独脚金内酯的生物合成取得了一定的研究进展[30-31],主要成果如图 3 所示:1) 异构酶 DWARF27 (D27) 催化 C40 all-trans-β-carotene 转换成 9-cis-β-carotene;2) 9-cis-β-carotene 被类胡萝卜素裂解双加氧酶CCD7 (D17、MAX3) 裂解成 C13 β-ionone 和 C27 9-cis-β-apo 10′carotenal;3) CCD8 (D10、MAX4) 裂解 C27 9-cis-β-apo 10′carotenal,形成已知的独脚金内酯的前体 carlactone (CL);4) 水稻中独脚金内酯可通过细胞色素 P450 蛋白 MAX1 蛋白家族的 carlactone oxidase (CO) 和 orobancholsynthase (OS) 直接催化 carlactone 形成;而对拟南芥中参与独脚金内酯生物合成的最后步骤尚不完全清楚,仅已知 MAX1 基因编码的蛋白催化 CL 形成 CLA (carlactonoic acid),之后,一种未知的甲基化转移酶催化 CLA 形成 MeCLA。近来的研究表明,Lateral branching oxidoreductase (LBO) 蛋白在转换 MeCLA 形成独脚金内酯类似物的过程中发挥着重要作用[32]。综上所述,独脚金内酯的生物合成极为复杂,目前已成功鉴定的生物合成基因数量有限。参与不同独脚金内酯间转换的基因,以及不同植物体内参与独脚金内酯生物合成的相关基因,都仍有待于研究鉴定。
4.2 独脚金内酯的分离鉴定
1966 年,从独脚金的非寄主植物棉花 Gossypium hirsutum L. 的根渗出物中分离获得第一个独脚金内酯化合物独脚金醇 (strigol, 化合物 1)[22]。随后,从独脚金的寄主植物高粱 Sorghum bicolor Moench、玉米 Zea mays L. 和小米 Panicum miliaceum L. 根分泌物中也鉴定出了独脚金醇[33]。之后,于 1992 年从独脚金寄主植物高粱 S. bicolor 的根渗出物中分离获得了与独脚金醇结构相似的化合物高粱内酯 (sorgolatone, 化合物 2)[34],同时从烟草独脚金 S. gesnerioides 的寄主豇豆根渗出物中分离获得了黑蒴醇 (alectrol, 化合物 4)[35]。
第一个成功鉴定的列当萌发刺激物列当醇 (orobanchol,化合物 5) 是从小列当寄主红三叶草 Trifolium pratense L. 根分泌物中分离获得的[36-37]。液相色谱-串联质谱 (LC-MS/MS) 分析方法的应用,大大加速了从植物根分泌物中鉴定新的独脚金内酯化合物的研究进度[38-39]。截至目前,已经从番茄、百脉根、烟草、高粱、玉米、紫云英、白羽扇豆、亚麻和黄瓜等多种植物根渗出物中鉴定出了 20 多种独脚金内酯 (图 1)[23, 40]。然而,从植物根分泌物中分离获得独脚金内酯费时费力,而高效低成本规模化的独脚金内酯天然产物全合成依然是个挑战。
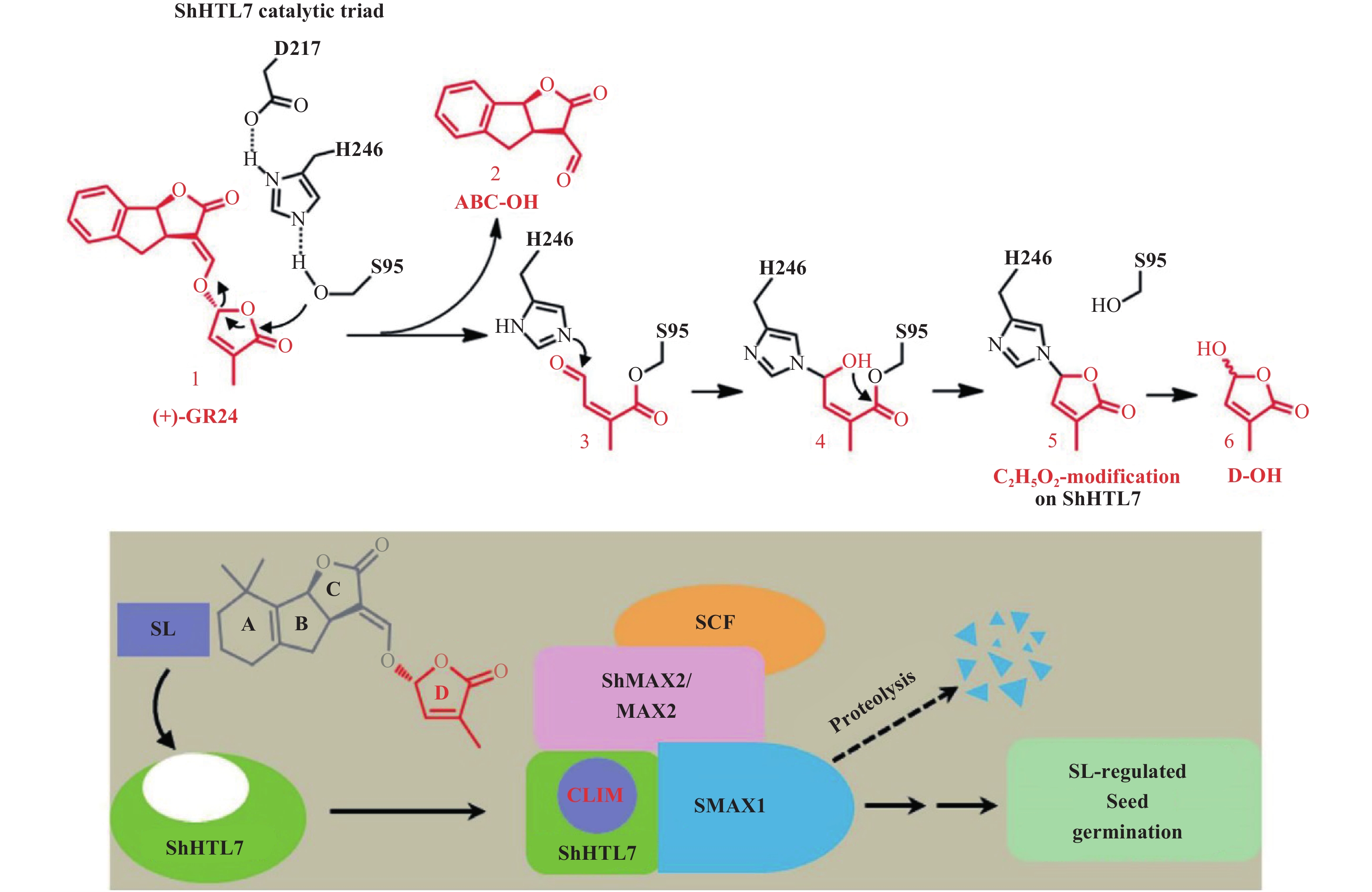
5 独脚金内酯调控根寄生杂草种子萌发的机制近来,独脚金内酯调控根寄生杂草种子萌发机制的研究取得了重大突破。Conn 等[41]通过系统进化树分析和计算化学分析,发现根寄生杂草中的 HTL/KAI2 (Hyposensitive To Light/ KArrikinInsensitive2) 蛋白能够更好地与独脚金内酯结合;Toh 等[42]采用异源表达方法,将独脚金中的 HTL 基因 ShHTL1-11 分别转入拟南芥 HTL 缺陷型突变体中进行表达,结果表明,用 ShHTL4、ShHTL5、ShHTL6 和 ShHTL7 成功表达的拟南芥突变体对独脚金内酯高度敏感,能够响应独脚金内酯而引起拟南芥种子的萌发;Tsuchiya 等[43]利用荧光探针,揭示了珍珠粟独脚金 (S. hermonthica) 的 HTL 蛋白能够识别独脚金内酯。2017 年 Yao 等[44]探讨了独脚金中受体蛋白 ShHTL7 响应独脚金内酯 GR24 信号,调控根寄生杂草独脚金种子萌发的作用方式。结果 (图 4) 表明:在独脚金内酯 GR24 刺激下,ShHTL7 蛋白与 GR24 对接,并催化 GR24 水解产生 CLIM 中间体;随后,CLIM 与 ShHTL7 受体蛋白通过共价结合,引起 ShHTL7 蛋白构象的变化,进而引起 ShHTL7 与 ShMAX2 及 SMAX1 的相互作用,从而激发独脚金内酯的信号传导途径,调控种子萌发。然而,目前除 ShHTL7 外,关于其他受体蛋白响应独脚金内酯的作用方式依旧未知。
6 种子萌发过程中激素间的协同调控作用
种子萌发一般以胚根突破种皮作为标志,其过程受多种内源激素调控。目前已经报道有 10 类结构不同的植物激素,包括脱落酸 (abscisic acid,ABA,化合物 27)、生长素 (auxin, IAA,化合物 28)、油菜素甾醇 (brassinosteroids, BR, 化合物 29)、细胞分裂素 (CTK,化合物 22)、乙烯 (ETH,化合物 25)、茉莉酸酮酯 (JA,化合物 24)、一氧化氮 (NO)、水杨酸 (salicylic acid, SA,化合物 30)、赤霉素 (gibberellin, GA,化合物 31) 和独脚金内酯 (SLs,化合物 1~12)[45]。萌发初期,种子内束缚态生长素 (IAA) 转变为游离态生长素 (IAA),同时赤霉素 (GA)、细胞分裂素 (CTK) 和乙烯 (ETH) 含量也有所增加,而 ABA 含量则明显减少[46]。SLs 通过调控 ABA、GA 和 ETH 的生物合成,进而刺激根寄生杂草种子的萌发[47-48]。其他植物激素如 BR、JA 和 SA 等也能调控种子萌发。一般认为,这些植物激素形成信号转导网络,共同调控种子萌发[49]。
7 展望 7.1 根寄生杂草的化学防控独脚金属、列当属等根寄生杂草是农业生产的重要有害生物,每年可对茄科、豆科和谷类等作物造成严重的经济损失。目前,尚无切实可行的方式来有效控制根寄生杂草。我们认为,利用独脚金内酯类化合物对根寄生杂草种子的萌发进行化学调控,应该可以有效防治根寄生杂草,但目前高效、低成本和规模化合成稳定的独脚金内酯依然是个挑战。如何高效地从植物中分离获得独脚金内酯化合物,或高效合成出在土壤中稳定、可用于根寄生杂草田间防治的农药,值得研究。
7.2 独脚金内酯合成相关基因的分离鉴定及应用目前已鉴定出的独脚金内酯生物合成相关基因的数量仍有限,由其参与的不同独脚金内酯的生物合成途径也有待于完善。中国具有丰富的植物资源,未来可借助分子生物学与生物化学手段,尝试从更多的植物中分离鉴定独脚金内酯合成相关基因,并验证其参与独脚金内酯生物合成的生化功能,丰富独脚金内酯的生物合成研究体系,明确独脚金内酯的生物合成途径。此外,借助基因工程技术,对已阐明的独脚金内酯的生物合成途径进行工程改造,调控独脚金内酯的生物合成,进而应用于根寄生杂草的防治。
7.3 基于受体蛋白的种子萌发剂的设计筛选不同独脚金内酯刺激根寄生杂草种子萌发能力的差异,可能是由与受体蛋白结合的口袋差异造成的。在珍珠粟独脚金 S. hermonthica 中,响应独脚金内酯的受体 HTL 蛋白可能是高效、广谱种子萌发剂设计的分子靶标。因此,可借助分子生物学与计算化学模拟手段,建立独脚金受体蛋白 HTL 空间结构与独脚金内酯生物活性的构效关系,将为理性设计和筛选低成本、高活性、广谱的种子萌发剂提供理论基础与技术支撑。
7.4 独脚金内酯的应用前景独脚金内酯作为新的植物激素,除能够促进根寄生杂草的种子萌发外,还可以调控植物结构 (包括抑制芽的生长和侧枝产生),以及促进植物益生菌枞枝真菌的分枝,因此在农业生产和园艺中具有一定应用前景。
| [1] | ALY R. Conventional and biotechnological approaches for control of parasitic weeds[J]. In Vitro Cell Dev Biol Plant, 2007, 43(4): 304–317. doi:10.1007/s11627-007-9054-5 |
| [2] | MATUSOVA R, VAN MOURIK T, BOUWMEESTER H J. Changes in the sensitivity of parasitic weed seeds to germination stimulants[J]. Seed Sci Res, 2004, 14(4): 335–344. doi:10.1079/SSR2004187 |
| [3] | ATSATT P R. Host-parasite interactions in higher plants[M]//LANGE O L, NOBEL P S, OSMOND C B, et al. Physiological plant ecology III: responses to the chemical and biological environment. Berlin Heidelberg: Springer, 1983: 519-535. |
| [4] | MUSSELMAN L J, PRESS M C. Introduction to parasitic plants[M]//PRESS M C, GRAVES J D. Parasitic plants. London: Chapman & Hall Press, 1995: 1-293. |
| [5] | CARDOSO C, RUYTER-SPIRA C, BOUWMEESTER H J. Strigolactones and root infestation by plant-parasitic Striga, Orobanche and Phelipanche spp. [J]. Plant Sci, 2011, 180(3): 414–420. doi:10.1016/j.plantsci.2010.11.007 |
| [6] | PARKER C. Observations on the current status of Orobanche and Striga problems worldwide [J]. Pest Manag Sci, 2009, 65(5): 453–459. doi:10.1002/ps.v65:5 |
| [7] | WESTWOOD J H, YODER J I, TIMKO M P, et al. The evolution of parasitism in plants[J]. Trends Plant Sci, 2010, 15(4): 227–235. doi:10.1016/j.tplants.2010.01.004 |
| [8] |
桑晓清, 孙永艳, 杨文杰, 等. 寄生杂草研究进展[J]. 江西农业大学学报, 2013, 35(1): 0084–0091.
SANG X Q, SUN Y Y, YANG W J, et al. Advances in the research on parasitic weeds[J]. Acta Agric Univ Jiangxiensis, 2013, 35(1): 0084–0091. |
| [9] | SAUERBORN J, RANSOM J K, MUSSELMAN L J, et al. The economic importance of the phytoparasites Orobanche and Striga[C]//Proceedings of the 5th international symposium of parasitic weeds. Nairobi, Kenya: International Maize and Wheat Improvement Center, 1991. |
| [10] | PARKER C, RICHES C R. Parasitic weeds of the world: biology and control[M]. Wallingford: CAB International. 1993. |
| [11] | PARKER C. The present state of the Orobanche problem[M]//PIETERSE A H, VERKLEIJ J A C, TER BORG S J. Biology and management of Orobanche. Proceedings of the 3rd international workshop on Orobanche and related Striga research. Amsterdam, Netherlands: Royal Tropical Institute, 1994. |
| [12] | QASEM J R. Chemical control of branched broomrape (Orobanche ramosa) in glasshouse grown tomato [J]. Crop Prot, 1998, 17(8): 625–630. doi:10.1016/S0261-2194(98)00062-3 |
| [13] | MUSSELMAN L J. The biology of Striga, Orobanche, and other root-parasitic weeds [J]. Annu Rev of Phytopathol, 1980, 18(1): 463–489. doi:10.1146/annurev.py.18.090180.002335 |
| [14] | SPALLEK T, MUTUKU M, SHIRASU K. The genus Striga: a witch profile [J]. Mol Plant Pathol, 2013, 14(9): 861–869. doi:10.1111/mpp.2013.14.issue-9 |
| [15] | DE GROOTE H, WANGARE L, KANAMPIU F, et al. The potential of a herbicide resistant maize technology for Striga control in Africa [J]. Agric Syst, 2008, 97(1-2): 83–94. doi:10.1016/j.agsy.2007.12.003 |
| [16] | VASUDEVA RAO M J, MUSSELMAN L J. Host specificity in Striga spp. and physiological " strains”[M]//MUSSELMAN L J. Parasitic weeds in agriculture, volume I Striga. Boca Raton, FL: CRC Press, 1987. |
| [17] | DUGJE I Y, KAMARA A Y, OMOIGUI L O. Infestation of crop fields by Striga species in the savanna zones of northeast Nigeria [J]. Agric Ecosyst Environ, 2006, 116(3-4): 251–254. doi:10.1016/j.agee.2006.02.013 |
| [18] | MOHAMED K I, MUSSELMAN L J. Taxonomy of agronomically important Striga and Orobanche species[C]//LABRADA R. Progress on farmer training in parasitic weed management. Rome: Plant Production & Protection Division, Food and Agricultural Organization of the United Nations, 2008. |
| [19] | AGGARWAL V D, OUEDRAOGO J T. Estimation of cowpea yield loss from Striga infestation [J]. Trop Agric, 1989, 66(1): 91–92. |
| [20] | BEBAWI F F, EPLEE R E, HARRIS C E, et al. Longevity of witchweed (Striga asiatica) seed [J]. Weed Sci, 1984, 32(4): 494–497. |
| [21] | SHEN H, YE W, HONG L, et al. Progress in parasitic plant biology: host selection and nutrient transfer[J]. Plant Biol, 2006, 8(2): 175–185. doi:10.1055/s-2006-923796 |
| [22] | COOK C E, WHICHARD L P, TURNER B, et al. Germination of witchweed (Striga lutea Lour.): isolation and properties of a potent stimulant [J]. Science, 1966, 154(3753): 1189–1190. doi:10.1126/science.154.3753.1189 |
| [23] | XIE X N, YONEYAMA K, YONEYAMA K. The strigolactone story[J]. Annu Rev Phytopathol, 2010, 48: 93–117. doi:10.1146/annurev-phyto-073009-114453 |
| [24] | ZWANENBURG B, POSPÍŠIL T, ZELJKOVIĆ S Ć. Strigolactones: new plant hormones in action[J]. Planta, 2016, 243(6): 1311–1326. doi:10.1007/s00425-015-2455-5 |
| [25] | BOUWMEESTER H J, MATUSOVA R, SUN Z K, et al. Secondary metabolite signalling in host-parasitic plant interactions[J]. Curr Opin Plant Biol, 2003, 6(4): 358–364. doi:10.1016/S1369-5266(03)00065-7 |
| [26] | XIE X N, KUSUMOTO D, TAKEUCHI Y, et al. 2′-Epi-orobanchol and solanacol, two unique strigolactones, germination stimulants for root parasitic weeds, produced by tobacco[J]. J Agric Food Chem, 2007, 55(20): 8067–8072. doi:10.1021/jf0715121 |
| [27] | GALINDO J C, DE LUQUE A P, JORRÍN J, et al. SAR studies of sesquiterpene lactones as Orobanche cumana seed germination stimulants [J]. J Agric Food Chem, 2002, 50(7): 1911–1917. doi:10.1021/jf0110809 |
| [28] | DE LUQUE A P, GALINDO J C G, MACÍAS F A, et al. Sunflower sesquiterpene lactone models induce Orobanche cumana seed germination [J]. Phytochemistry, 2000, 53(1): 45–50. doi:10.1016/S0031-9422(99)00485-9 |
| [29] | SCREPANTI C, YONEYAMA K, BOUWMEESTER H J. Strigolactones and parasitic weed management 50 years after the discovery of the first natural strigolactone strigol: status and outlook [J]. Pest Manag Sci, 2016, 72(11): 2013–2015. doi:10.1002/ps.2016.72.issue-11 |
| [30] | FLEMATTI G R, SCAFFIDI A, WATERS M T, et al. Stereospecificity in strigolactone biosynthesis and perception[J]. Planta, 2016, 243(6): 1361–1373. doi:10.1007/s00425-016-2523-5 |
| [31] | SETO Y, YAMAGUCHI S. Strigolactone biosynthesis and perception[J]. Curr Opin Plant Biol, 2014, 21: 1–6. |
| [32] | BREWER P B, YONEYAMA K, FILARDO F, et al. Lateral Branching oxidoreductase acts in the final stages of strigolactone biosynthesis in Arabidopsis [J]. Proc Natl Acad Sci USA, 2016, 113(22): 6301–6306. doi:10.1073/pnas.1601729113 |
| [33] | SIAME B A, WEERASURIYA Y, WOOD K, et al. Isolation of strigol, a germination stimulant for Striga asiatica, from host plants [J]. J Agric Food Chem, 1993, 41(9): 1486–1491. doi:10.1021/jf00033a025 |
| [34] | HAUCK C, MÜLLER S, SCHILDKNECHT H. A germination stimulant for parasitic flowering plants from Sorghum bicolor, a genuine host plant [J]. J Plant Physiol, 1992, 139(4): 474–478. doi:10.1016/S0176-1617(11)80497-9 |
| [35] | MÜLLER S, HAUCK C, SCHILDKNECHT H. Germination stimulants produced by Vigna unguiculata Walp cv Saunders Upright [J]. J Plant Growth Regul, 1992, 11(2): 77–84. doi:10.1007/BF00198018 |
| [36] | MORI K, MATSUI J, YOKOTA T, et al. Structure and synthesis of orobanchol, the germination stimulant for Orobanche minor [J]. Tetrahedron Lett, 1999, 40(5): 943–946. doi:10.1016/S0040-4039(98)02495-2 |
| [37] | YOKOTA T, SAKAI H, OKUNO K, et al. Alectrol and orobanchol, germination stimulants for Orobanche minor, from its host red clover [J]. Phytochemistry, 1998, 49(7): 1967–1973. doi:10.1016/S0031-9422(98)00419-1 |
| [38] | SATO D, AWAD A A, CHAE S H, et al. Analysis of strigolactones, germination stimulants for Striga and Orobanche, by high-performance liquid chromatography/tandem mass spectrometry [J]. J Agric Food Chem, 2003, 51(5): 1162–1168. doi:10.1021/jf025997z |
| [39] | SATO D, AWAD A A, TAKEUCHI Y, et al. Confirmation and quantification of strigolactones, germination stimulants for root parasitic plants Striga and Orobanche, produced by cotton [J]. Biosci Biotechnol Biochem, 2005, 69(1): 98–102. doi:10.1271/bbb.69.98 |
| [40] | AL-BABILI S, BOUWMEESTER H J. Strigolactones, a novel carotenoid-derived plant hormone[J]. Annu Rev Plant Biol, 2015, 66(1): 161–186. doi:10.1146/annurev-arplant-043014-114759 |
| [41] | CONN C E, BYTHELL-DOUGLAS R, NEUMANN D, et al. Convergent evolution of strigolactone perception enabled host detection in parasitic plants[J]. Science, 2015, 349(6247): 540–543. doi:10.1126/science.aab1140 |
| [42] | TOH S, HOLBROOK-SMITH D, STOGIOS P, et al. Structure-function analysis identifies highly sensitive strigolactone receptors in Striga [J]. Science, 2015, 350(6257): 203–207. doi:10.1126/science.aac9476 |
| [43] | TSUCHIYA Y, YOSHIMURA M, SATO Y, et al. Probing strigolactone receptors in Striga hermonthica with fluorescence [J]. Science, 2015, 349(6250): 864–868. doi:10.1126/science.aab3831 |
| [44] | YAO R F, WANG F, MING Z H, et al. ShHTL7 is a non-canonical receptor for strigolactones in root parasitic weeds[J]. Cell Res, 2017. doi:10.1038/cr.2017.3 |
| [45] | SANTNER A, ESTELLE M. Recent advances and emerging trends in plant hormone signalling[J]. Nature, 2009, 459(7250): 1071–1078. doi:10.1038/nature08122 |
| [46] | TAIZ L, ZEIGER E, MØLLER I M, et al. Plant physiology and development[M]. 6th edition. Sunderland: Sinauer Associates, 2014. |
| [47] | TOH S, KAMIYA Y, KAWAKAMI N, et al. Thermoinhibition uncovers a role for strigolactones in Arabidopsis seed germination [J]. Plant Cell Physiol, 2012, 53(1): 107–117. doi:10.1093/pcp/pcr176 |
| [48] | SUGIMOTO Y, ALI A M, YABUTA S, et al. Germination strategy of Striga hermonthica involves regulation of ethylene biosynthesis [J]. Physiol Plant, 2003, 119(1): 137–145. doi:10.1034/j.1399-3054.2003.00162.x |
| [49] |
周峰. 植物种子萌发及活力的调控机制[J]. 湖北农业科学, 2014, 53(3): 497–499.
ZHOU F. Regulation mechanism of plants seed germination and vigor[J]. Hubei Agric Sci, 2014, 53(3): 497–499. |
 2017, Vol. 19
2017, Vol. 19