2. 河北农业大学 河北省梨工程技术研究中心,河北 保定 071001
2. Pear Engineering and Technology Research Center of Hebei Province, Agricultural University of Hebei, Baoding 071001, Hebei Province, China
毒死蜱 (chlorpyrifos) 属中等毒性有机磷杀虫杀螨剂,具有触杀、胃毒和熏蒸三重作用,具有一定的渗透性,杀虫谱广,可有效防治梨木虱、介壳虫、金龟子、梨黄粉虫和梨小食心虫等多种梨树害虫[1],近几年在园艺产品生产中得到了广泛应用。前人对于毒死蜱在园艺作物上的研究多注重于毒死蜱降解动态[2-4]、安全性分析[5-6]及毒死蜱在果实不同部位的分布特征[7-9],认为毒死蜱是一种易降解农药,按照推荐剂量及次数施药不会造成农药残留超标,在番茄、黄瓜、苹果和柑橘等果实中的残留量均表现为果皮部位远远高于果肉[6-7]。毒死蜱在梨上的研究较少,且仅局限于毒死蜱在巴梨果实中的降解动态及安全使用方法[5]。
中国规定梨中毒死蜱的最大残留限量值 (MRL) 为 1.0 mg/kg,欧盟规定为 0.5 mg/kg [5, 10]。近年由于毒死蜱使用的广泛性及使用量的逐年增加等原因已导致部分果品生产及出口企业面临出口鸭梨毒死蜱残留超标问题,严重影响果品安全生产及对外贸易[11]。因此,如何降低毒死蜱的残留量,提高果品安全性,成为鸭梨生产中亟待解决的问题。作者前期研究已表明,于施药前施用 0.5 mg/L 的油菜素内酯或 100 mg/L 的水杨酸,可使鸭梨中毒死蜱含量比对照缩短 2~4 d 达到检测标准[12]。鸭梨生产园中存在套袋果实毒死蜱残留依然超标的现象,对于毒死蜱是否具有内吸性,不同学者观点各异。梁俊等[13]认为,毒死蜱具有内吸性;而陈振德等[14]和吴玉杰等[3]则持相反观点;贺虹等[15]认为,农药是否具有内吸传导性,受植物解剖学、生理学特点以及农药吸收部位等因素的综合影响,即同一种化合物在不同植物体内的传导方式和传导速率存在很大差异。鉴于药剂内吸传导的特异性,毒死蜱在鸭梨枝叶、果实中的运输特性需引起重视。已有研究表明:不同植物叶片角质层厚度、气孔数量和外质连丝分布影响药剂在叶片表面的附着和随后的扩散过程[16];果实中毒死蜱降解途径包括水解、光解和生物代谢,生长稀释作用亦会降低其相对含量[8]。因此其在果实中分布及降解规律受毒死蜱特性、环境条件及果实自身特征的影响。鸭梨果皮及蜡质较番茄等厚且密布果点,果肉脆而多汁,加之其生长曲线有异,导致其果实中毒死蜱分布及降解特征异于巴梨[5]、苹果[7]和番茄[8]等园艺产品。为此,本研究开展有关鸭梨中毒死蜱的吸收传导特性及分布规律研究,以期为鸭梨安全生产及食用提供理论依据。
1 材料与方法 1.1 材料试验于 2014 年在河北省定州市东亭镇黄家营黄家葡萄酒庄鸭梨果园进行。供试鸭梨树龄 20 a 生,栽植密度 4 m × 6 m,选取枝量、果量和生长势基本一致的梨树作为供试树。果园地势平坦,管理水平中等。
毒死蜱标准品 (纯度 ≥ 99.8%,Sigma-Aldrich 公司);48% 毒死蜱乳油 (美国陶氏益农公司)。
1.2 试验设计与处理供试药剂为 48% 毒死蜱乳油,将其分别稀释 500 和 1 000 倍得到有效成分含量为 960 和 480 mg/L 的毒死蜱药液。试验地果农防治梨树害虫常用毒死蜱剂量为 480 mg/L;研究毒死蜱在套袋果实中的运输及分布时,为增强试验效果,设置 2 倍常用剂量即 960 mg/L 毒死蜱药液进行施药处理。
1.2.1 整株喷施毒死蜱对套袋梨果实中毒死蜱运输及分布的影响 于鸭梨果实膨大期 (7 月 14 日即花后 89 d),在每株试验树上选取大小一致、无损伤的鸭梨果实,用保鲜膜将果柄处缠严,然后将果实套袋,用胶带封口,以防药液沿果柄流入或从袋口处进入 (图 1)。用 48% 毒死蜱乳油 500 倍液 (有效成分 960 mg/L) 进行整株均匀喷施至有液滴滑落为止,每株梨树用药液量为 6 L。分别于施药后 12、24 和 72 h 采样,按东、西、南和北 4 个方位随机采果共 10 个。取全部果实果柄,按四分法分别取果梗洼、果皮、果肉 (胴部) 和果心,于 –40 ℃ 保存,待测。以处理前采果作为空白对照。随机区组设计,每小区 2 株,重复 3 次。

|
图 1 果实各部位全方位保护过程 Fig. 1 The process of comprehensive protection on every part of the treated fruits |
1.2.2 果面喷施毒死蜱对贮藏期梨果实不同部位毒死蜱残留量的影响 于果实成熟期采前 (9 月 21 日即花后 158 d) 以 48% 毒死蜱乳油 1 000 倍液 (有效成分 480 mg/L) 进行果面均匀喷施至有液滴滑落为止,每株梨树用药液量为 3 L。重复 3 次。待药液干后每处理按东、西、南和北 4 个方位随机采果共 30 个,于常温 (25 ± 2 ℃) 下贮藏,分别于施药后 7、14 和 25 d 随机取样,每处理取果 10 个。按四分法分别取全果、果皮和果肉 (胴部),于 –40 ℃ 保存,待测。
1.3 样品中毒死蜱残留提取及其含量测定方法采用乙腈萃取,GC-NPD 法检测。全果、果肉 (包括果梗洼)、果心和果皮中毒死蜱提取方法参照张莹等[12];由于单个果柄质量相对较小,且采果量有限,果柄中毒死蜱残留提取方法稍有改动:准确称取待测果柄,剪碎并研磨至渣状后,转移至 250 mL 具塞三角瓶中;加入 30 mL 乙腈,于 210 r/min 下旋转振荡提取 30 min,过滤;收集滤液于装有 3 g NaCl 的具塞量筒中,剧烈振荡 1 min,静置 30 min;取上层乙腈相 15 mL 于 50 mL 旋蒸瓶中,于 40 ℃ 水浴下旋蒸浓缩至近干;用丙酮溶解并定容到 4 mL,于 4 ℃ 保存,待测。气相色谱检测方法同张莹等[12]。
1.4 标准溶液的配制及标准曲线的绘制以保留时间定性,外标法定量,标准曲线法校准。准确称取 0.01 g (精确至 0.000 1 g) 毒死蜱标准品,用丙酮溶解并定容至 100 mL,配制成 100 μg/mL 的毒死蜱丙酮标准储备液,再逐级稀释为 0.05、0.5、1、3 和 5 μg/mL 的系列标准工作溶液,按照 1.3 节的检测方法由低至高浓度依次进样,每个浓度重复 5 次。以毒死蜱质量浓度为横坐标 (x),峰面积为纵坐标 (y) 绘制标准曲线。
1.5 添加回收试验在空白梨全果、果肉、果心、果皮和果柄中分别添加 0.05、0.5 和 1 mg/kg 3 个水平的毒死蜱标准溶液,按照 1.3 节的方法进行提取、净化及测定。每个添加水平重复 5 次。
1.6 数据分析用 Excel 和 DPS 软件对试验数据进行处理、制图及差异显著性分析。
2 结果与分析 2.1 毒死蜱提取及检测方法可行性分析2.1.1 标准曲线的制作 结果表明:在 0.05~5 μg/mL 范围内,毒死蜱峰面积与对应的质量浓度间呈良好的线性关系,回归方程 y = 21.544x – 0.537 8 (R2 = 0.999 9)。在本试验条件下,毒死蜱的保留时间为 13.384 min。
2.1.2 毒死蜱在梨果实不同部位的添加回收率及相对标准偏差 毒死蜱在梨全果中的添加回收率和相对标准偏差 (RSD) 分别为 86%~101% 和 2.5%~5.6%,在果肉中的为 89%~101% 和 4.4%~6.6%,在果心中的为 83%~99% 和 3.0%~7.3%,在果皮中的为 95%~102% 和 2.4%~6.2%,在果柄中的为 95%~99% 和 2.1%~4.7%。该结果均满足《农药残留试验准则》[17]对农药残留分析的要求。
2.1.3 方法的灵敏度 本试验方法的最低检测浓度 (LOQ) 为 0.05 mg/kg,低于中国及欧盟规定的梨中毒死蜱的最大残留限量 (MRL) 值。因此,该方法的灵敏度完全可以满足农药残留检测的要求。
2.2 整株喷施毒死蜱对套袋梨果实中毒死蜱运输及分布的影响施药后果实各部位毒死蜱残留量随时间推移多呈现先逐渐上升而后下降趋势,果柄、果皮、果梗洼和果肉中毒死蜱最高值分别为 6.66、2.42、0.09 和 0.06 mg/kg,分别出现在 12、24、12 和 12 h (表 1)。
|
|
表 1 整株施药后套袋梨果实中各部位毒死蜱残留量 Table 1 Residual quantity of chlorpyrifos in different tissues of bagged Ya pear fruits |
施药后 12 和 24 h,梨果实不同部位中毒死蜱残留量以果柄最高,其次为果皮,均显著高于其他部位;72 h 果柄与果皮中毒死蜱残留量差异不显著,但仍显著高于其他部位。从上述结果中可看出,毒死蜱从鸭梨枝叶至果实中表现出内吸传导性,套袋果实各部位中毒死蜱来源于枝叶运输,且经果柄进入果实后易向果皮累积。
2.3 套袋对梨果皮中毒死蜱残留量的影响未套袋梨果皮中毒死蜱含量显著高于套袋处理,施药后 12 和 72 h 未套袋果实果皮中毒死蜱含量分别为套袋处理的 12.56 和 7.29 倍 (图 2),表明套袋避免了毒死蜱与果实的直接接触,能显著降低毒死蜱残留;套袋果实果皮中毒死蜱含量显著高于空白对照,其中施药后 12 和 72 h 毒死蜱含量分别为空白对照的 2.21 和 3.03 倍。与 12 h 相比,72 h 未套袋果实果皮中毒死蜱含量降低,而套袋果实果皮中毒死蜱含量升高了 36.20%。
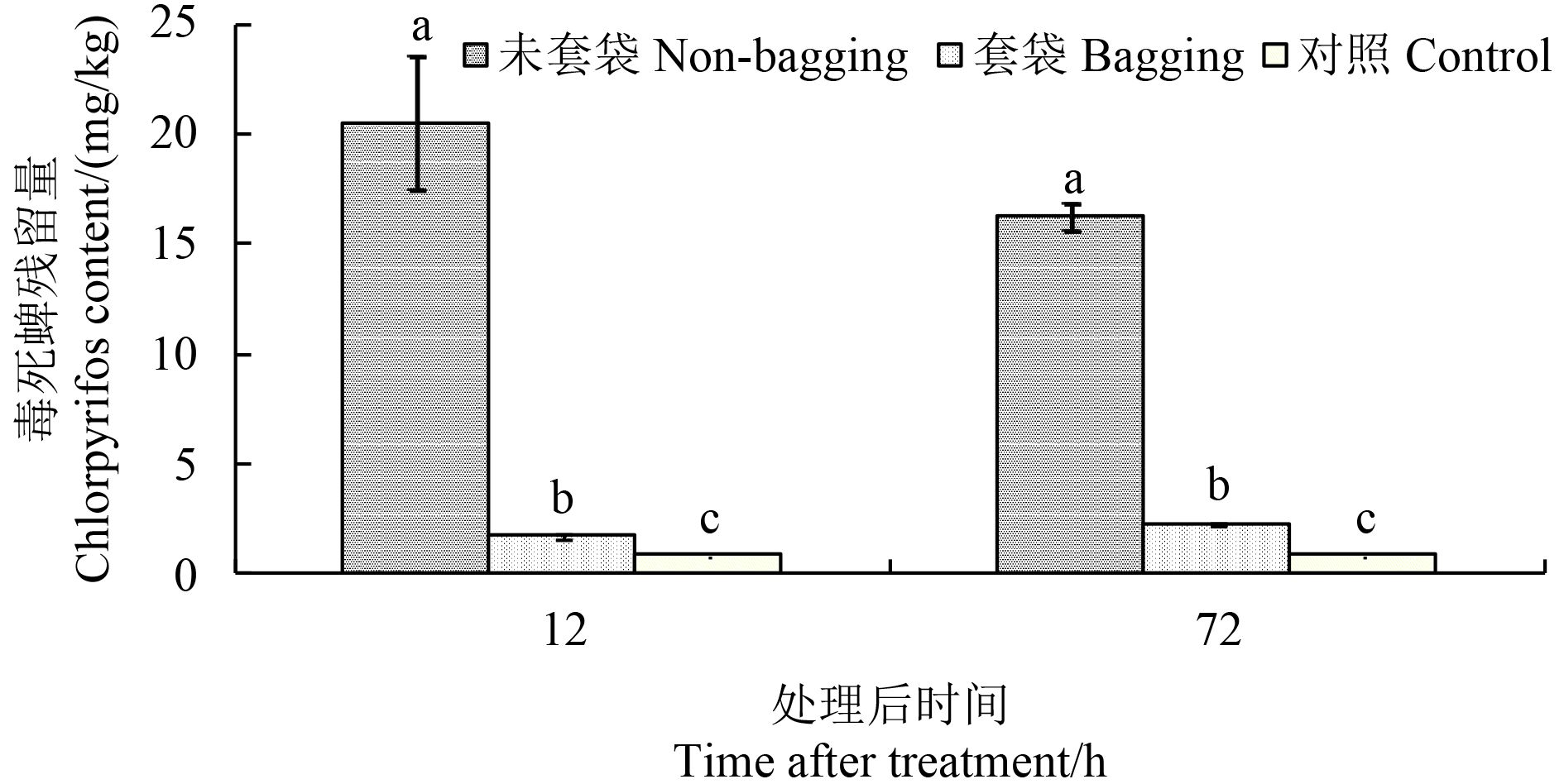
|
注:同一时间点处理柱状图上不同字母表示在 0.05 水平上差异显著。 Note: Different letters above the bars at the same time treatment indicate significant difference at the 0.05 level. 图 2 套袋对鸭梨果皮中毒死蜱残留量的影响 Fig. 2 The effect of bagging on chlorpyrifos content in the peel of Ya pear fruits |
2.4 果面喷施毒死蜱对贮藏期梨果实不同部位毒死蜱残留量的影响
随着贮藏期的延长,果皮、全果中毒死蜱含量均呈现逐渐降低趋势 (表 2)。对于同一取样时间点而言,果皮中毒死蜱含量显著高于全果,而果肉中毒死蜱含量始终低于 LOQ (0.05 mg/kg)。施药后 7、14 和 25 d,果皮中毒死蜱残留含量均占全果总残留量的 100%。因此,将毒死蜱喷施于果实表面后,果皮为果实毒死蜱主要残留部位,贮藏期果皮中毒死蜱不易向果肉扩散或进入果肉后迅速降解。
|
|
表 2 果面施药后鸭梨果实各部位中毒死蜱分布及含量变化 Table 2 Distribution and content variation of chlorpyrifos in different tissues of Ya pear fruits after spraying |
3 讨论
黄玉南等[18]认为,农药残留的存在有两种方式:其一是附着于果实表面;其二是内吸性农药通过在植物体内循环到达植株各部位。果实表面通常附有一层蜡质,具有较强的疏水性,从而能阻挡亲水性污染物进入果实内部。但是,由于毒死蜱具亲脂性,它会首先吸附并溶解到果实表面蜡质层[19],然后通过高浓度向低浓度扩散的方式进入果肉。Briggs 等[20]研究发现,亲脂性强的植物部位更易富集非离子有机物。因此,番茄[8]和苹果[13]中毒死蜱更倾向分布于富含蜡质的果皮,这与本研究中非套袋鸭梨果皮是果实毒死蜱主要残留部位结果相一致。Baur 等[21-22]研究表明,有机活性物质的渗透速率取决于路径长度,农药在果皮较厚的果实中迁移速率较慢,而在薄皮果实中较快[23]。汤宇恋[9]将毒死蜱喷施于番茄果实表面,其果皮中毒死蜱含量约占全果的 70%,本研究采用相同剂量的毒死蜱喷施于鸭梨果实表面,其果皮中毒死蜱含量占全果的 99% 以上,造成此差异的原因可能与不同植物果实果皮结构组成与厚度不同有关;陈振德等[24-25]研究发现,菠菜、不结球白菜和苹果果实中毒死蜱残留均存在明显的品种间差异,本研究结果与赵丽娟等[5]的结果也表现出相同规律。
姚安庆等[16]的研究表明,药剂的传导性是一个具有范围性或者特异性的概念,无论何种结构的农药均可以在多种植物上或同种植物的不同部位表现出不同程度的传导性。汪志威[8]发现,毒死蜱可以从番茄果柄进入番茄内部,本研究中套袋果实果柄在施药后初期积累了在各部位中最高的农药浓度,并且出现套袋果实多部位在施药后 72 h 内毒死蜱浓度随时间推移呈现先逐渐升高而后下降过程,推测毒死蜱可能也是通过果柄运输进入果实。有研究表明[16],农药从植物的叶片进入后由于蒸腾作用的影响,共质体成为化合物进入的主要途径;如果将农药施于根部,一旦化合物进入导管,将随蒸腾流向上移动,可见,蒸腾流对于农药在植物体内的运输传导起着关键作用。毒死蜱由鸭梨枝叶运输进入套袋果实表现出毒死蜱的内吸传导性,蒸腾流为其提供了动力。生长期果实由内向外的蒸腾流方向与贮藏期果实由内向外的水分耗散方向均不利于喷施于果实表面的毒死蜱由外向内运输,因此表现喷施于枝叶的毒死蜱经运输后易于在果皮积累,直接喷施于果面的毒死蜱主要分布于果皮而不易向果肉逆向扩散,此可能成为鸭梨果皮易富集毒死蜱的原因之一。
未套袋果实果皮中毒死蜱含量在 12~72 h 时降低,而套袋果实却在此时期升高了 36.20%,其原因可能是非套袋果实毒死蜱来源于果面接触及枝叶运输,光照等因素促进果皮中毒死蜱降解使其含量下降;而套袋果实中毒死蜱仅来源于枝叶运输,其到达峰值的时间相对滞后,同时套袋可能在一定程度上抑制毒死蜱降解。王建武等[26]研究表明,荔枝套袋影响了农药残留的淋失、挥发和光降解过程,且不利于已进入袋内果实的农药残留的消解。
按照当地果农防治梨树害虫常用毒死蜱剂量,采前于果面喷施 48% 毒死蜱乳油 1 000 倍液 (有效成分 480 mg/L),施药后 7 d 果肉中毒死蜱含量甚微,而全果中毒死蜱含量在施药后 25 d 仍超出中国及欧盟规定的梨中毒死蜱的 MRL 值 (1.0 和 0.5 mg/kg),可见果皮中毒死蜱残留对全果毒死蜱残留起着决定性作用。本课题组前期的研究结果表明,果实采后清洗或在清洗液中加入油菜素内酯或水杨酸可促进毒死蜱降解[12],因此果实食用前适当清洗可有效降低毒死蜱的残留量。毒死蜱的内吸传导性导致套袋鸭梨果柄中其残留量较其他部位高,果实采后立即剪掉果柄,是否可降低毒死蜱残留量值得进一步研究。
| [1] |
刘占山, 黄安辉, 肖明山. 毒死蜱的研究应用现状及产业发展前景[J]. 世界农药, 2009, 31(S1): 59–61.
LIU Z S, HUANG A H, XIAO M S. Current situation of study application on chlorpyrifos and it’s industrial development prospects[J]. World Pestic, 2009, 31(S1): 59–61. |
| [2] |
周颖, 王亮, 李刚, 等. 毒死蜱在冬季芹菜中的残留降解动态研究[J]. 中国农学通报, 2015, 31(22): 180–183.
ZHOU Y, WANG L, LI G, et al. Study on residue and degradation dynamics of chlorpyrifos in celery in winter[J]. Chin Agric Sci Bull, 2015, 31(22): 180–183. doi:10.11924/j.issn.1000-6850.casb15020110 |
| [3] |
吴玉杰, 吕春秋, 李湧, 等. 毒死蜱在青刀豆中的残留降解研究[J]. 检验检疫学刊, 2012, 22(6): 44–47.
WU Y J, LV C Q, LI Y, et al. Study on resides and degradation dynamics of chlorpyrifos in green bean[J]. J Insp Quar, 2012, 22(6): 44–47. |
| [4] |
吴华, 李冰清, 林琼芳, 等. 毒死蜱在豆角、辣椒和土壤中的残留动态[J]. 农药, 2007, 46(11): 767–769.
WU H, LI B Q, LIN Q F, et al. The residue dynamic of chlorpyrifos in carob, chili and soil[J]. Agrochemicals, 2007, 46(11): 767–769. doi:10.3969/j.issn.1006-0413.2007.11.016 |
| [5] |
赵丽娟, 张洪, 秦曙, 等. 毒死蜱在梨和土壤中的残留研究[J]. 农药科学与管理, 2010, 31(2): 42–46.
ZHAO L J, ZHANG H, QIN S, et al. Study on the chlorpyrifos residues in pear and soil[J]. Pestic Sci Admin, 2010, 31(2): 42–46. |
| [6] |
丁建, 周洪波, 崔永亮, 等. 毒死蜱在猕猴桃上的残留动态研究[J]. 西南农业学报, 2011, 24(1): 373–375.
DING J, ZHOU H B, CUI Y L, et al. Residue dynamics of chlorpyrifos in kiwi fruit[J]. Southwest China J Agric Sci, 2011, 24(1): 373–375. |
| [7] |
张金虎, 赵政阳, 梁俊, 等. 毒死蜱在苹果果实、叶片及果园土壤中的残留分析研究[J]. 中国农学通报, 2009, 25(1): 185–189.
ZHANG J H, ZHAO Z Y, LIANG J, et al. Residue determination of chlorpyifos in apple fruit, leaf and orchard soil[J]. Chin Agric Sci Bull, 2009, 25(1): 185–189. |
| [8] |
汪志威. 百菌清和毒死蜱在设施作物上的动态分布、迁移特征和果实中农药去除方法的研究[D]. 杭州: 浙江工业大学, 2013: 16, 64-66.
WANG Z W. Dynamic distribution, movement and domestic removal method of chlorothalonil and chlorpyrifos in greenhouse plant[D]. Hangzhou: Zhejiang University of Technology, 2013: 16, 64-66. |
| [9] |
汤宇恋. 百菌清和毒死蜱在设施作物中的分布与消解研究[D]. 杭州: 浙江工业大学, 2011: 46.
TANG Y L. Distribution and dissipation of chlorothalonil and chlorpyrifos in greenhouse crops[D]. Hangzhou: Zhejiang University of Technology, 2011: 46. |
| [10] |
食品中农药最大残留限量: GB 2763—2014[S]. 北京: 中国标准出版社, 2014.
National food safety standard-Maximum residue limits for pesticides in food: GB 2763—2014[S]. Beijing: Standards Press of China, 2014. |
| [11] |
张婧, 练薇薇, 王楠, 等. 绿色壁垒对中国农产品出口贸易的影响探析[J]. 浙江林学院学报, 2010, 27(3): 456–463.
ZHANG J, LIAN W W, WANG N, et al. Influence of the green barrier on the Chinese agricultural product export trade[J]. J Zhejiang For Coll, 2010, 27(3): 456–463. |
| [12] |
张莹, 杜国强, 张玉星. 喷施油菜素内酯和水杨酸促进鸭梨果实毒死蜱残留降解效应[J]. 河北农业大学学报, 2015, 38(4): 66–70, 75.
ZHANG Y, DU G Q, ZHANG Y X. Efficacy of spraying of brassinolide and salicylic acid to accelerate degradation of chlorpyrifos in Ya Pear fruits[J]. J Agric Univ Hebei, 2015, 38(4): 66–70, 75. |
| [13] |
梁俊, 赵政阳, 李海飞, 等. 苹果中毒死蜱残留降解动态研究[J]. 农业环境科学学报, 2008, 27(6): 2461–2466.
LIANG J, ZHAO Z Y, LI H F, et al. Residual degradation behaviors of chlorpyrifos in apple[J]. J Agro-Environ Sci, 2008, 27(6): 2461–2466. |
| [14] |
陈振德, 袁玉伟, 陈雪辉, 等. 毒死蜱在韭菜中的残留动态研究[J]. 安全与环境学报, 2006, 6(6): 41–43.
CHEN Z D, YUAN Y W, CHEN X H, et al. Residual dynamics of chlorpyrifos in Allium Tuberosum [J]. J Saf Environ, 2006, 6(6): 41–43. |
| [15] |
贺虹, 张翔, 王宏建, 等. 氧化乐果在不同树种体内的输导研究[J]. 西北林学院学报, 2002, 17(4): 15–18.
HE H, ZHANG X, WANG H J, et al. The primitive research on omethoate transporting mechanism in different trees[J]. J Northwest For Univ, 2002, 17(4): 15–18. |
| [16] |
姚安庆, 杨健. 农药在植物体内的传导方式和农药传导生物学[J]. 中国植保导刊, 2012, 32(10): 14–18.
YAO A Q, YANG J. Conduction mode of pesticides in plant and pesticide-conduction biology[J]. China Plant Prot, 2012, 32(10): 14–18. doi:10.3969/j.issn.1672-6820.2012.10.003 |
| [17] |
农药残留试验准则: NY/T 788—2004[S].北京: 中国农业出版社, 2004.
Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
| [18] |
黄玉南, 张绍铃, 方金豹, 等. 吡虫啉在梨果实中的残留动态分析[J]. 果树学报, 2010, 27(3): 453–456.
HUANG Y N, ZHANG S L, FANG J B, et al. Study on residue trends of imidacloprid in pear fruit[J]. J Fruit Sci, 2010, 27(3): 453–456. |
| [19] | ABOU-ARAB A A K. Behavior of pesticides in tomatoes during commercial and home preparation[J]. Food Chem, 1999, 65(4): 509–514. doi:10.1016/S0308-8146(98)00231-3 |
| [20] | BRIGGS G G, BROMILOW R H, EVANS A A, et al. Relationships between lipophilicity and the distribution of non-ionised chemicals in barley shoots following uptake by the roots[J]. Pestic Sci, 1983, 14(5): 492–500. doi:10.1002/ps.v14:5 |
| [21] | BAUR P, MARZOUK H, SCHÖNHERR J, et al. Partition coefficients of active ingredients between plant cuticle and adjuvants as related to rates of foliar uptake[J]. J Agric Food Chem, 1997, 45(9): 3659–3665. doi:10.1021/jf970233i |
| [22] | BAUR P, MARZOUK H, SCHÖNHERR J. Estimation of path lengths for diffusion of organic compounds through leaf cuticles[J]. Plant Cell Environ, 1999, 22(3): 291–299. doi:10.1046/j.1365-3040.1999.00429.x |
| [23] | CLAEYS W L, SCHMIT J F, BRAGARD C, et al. Exposure of several Belgian consumer groups to pesticide residues through fresh fruit and vegetable consumption[J]. Food Control, 2011, 22(3-4): 508–516. doi:10.1016/j.foodcont.2010.09.037 |
| [24] |
陈振德, 张清智, 王文娇, 等. 叶类蔬菜低农药残留基因型筛选研究[J]. 农业环境科学学报, 2010, 29(2): 239–245.
CHEN Z D, ZHANG Q Z, WANG W J, et al. Screening of genotypes with low pesticide residue in leafy vegetables[J]. J Agro-Environ Sci, 2010, 29(2): 239–245. |
| [25] |
陈振德, 陈建美, 韩明三, 等. 苹果果实中毒死蜱残留的品种间差异及套袋对毒死蜱残留的影响[J]. 农业环境科学学报, 2011, 30(11): 2197–2201.
CHEN Z D, CHEN J M, HAN M S, et al. Difference of chlorpyrifos residue in fruits of various apple cultivars and bagging effect on the residue[J]. J Agro-Environ Sci, 2011, 30(11): 2197–2201. |
| [26] |
王建武, 陈厚彬, 周强, 等. 套袋对荔枝果实质量和农药残留的影响[J]. 应用生态学报, 2003, 14(5): 710–712.
WANG J W, CHEN H B, ZHOU Q, et al. Effects of bagging on the fruit quality in Litchi chinensis fruit and pesticide residues in it [J]. Chin J Appl Ecol, 2003, 14(5): 710–712. |
 2017, Vol. 19
2017, Vol. 19


