噻唑锌 (zinc-thiazole,图式 1A) 是中国自主研发创制的噻二唑类有机锌农药,是防治农作物细菌性病害的新一代高效、低毒、安全的农用杀菌剂,已在水稻、柑橘、黄瓜和烟草等作物上登记使用,对水稻、柑橘、蔬菜等作物的细菌性病害防效突出,兼有保护和内吸杀菌治疗作用[1-4]。

|
图式 1 噻唑锌 (A) 和噻二唑 (B) 的结构式 Scheme1 The structure of zinc-thiazole (A) and AMT (B) |
噻唑锌由于毒性低 (大鼠急性经口 LD 50 > 5 000 mg/kg,急性经皮 LD 50 > 2 000 mg/kg) 及对细菌性病害的防效好,目前已在农业生产上广泛推荐使用。中国已制定了噻唑锌在水稻糙米和柑橘上的最大允许残留限量 (MRL) 值分别为 0.2 和 0.5 mg/kg [5],但有关噻唑锌在农产品和环境样品中残留的检测方法尚未见报道。由于该化合物熔点 > 300 ℃,不溶于水和大多数有机溶剂,只微溶于 N,N-二甲基甲酰胺 (DMF),因此难以用气相色谱或液相色谱直接对其进行痕量分析。为此,本研究采用将噻唑锌转化为 2-氨基-5-巯基-1, 3, 4-噻二唑 (AMT,噻二唑,图式 1B) 的方法,通过测定 AMT 的量来进行噻唑锌的定量分析,建立了采用高效液相色谱-二极管阵列检测器 (HPLC-DAD) 测定水、土壤和黄瓜中噻唑锌残留量的方法。
1 材料与方法 1.1 仪器、药剂与试剂Agilent 1100series 高效液相色谱仪,配二极管阵列检测器 (美国 Agilent 公司);FA1004 电子天平 (上海天平仪器厂);SPS402F 型电子天平 [梅特勒-托利多 (常州) 称重设备有限公司];PB-10 pH 酸度计 (德国赛多利斯股份公司);R201 旋转蒸发仪 (上海申胜生物技术有限公司);SHB-AⅢ循环水式真空泵 (杭州大卫科教仪器有限公司);HH-4 恒温水浴锅 (江苏金坛市江南仪器厂);SHZ-82 气浴恒温振荡器 (江苏金坛亿通电子有限公司);Purelab ultra Analytic 超纯水仪 (英国 ELGA 公司);0.22 μm 聚四氟乙烯过滤膜 (上海安谱科学仪器有限公司)。
噻唑锌 (zinc-thiazole) 标准品 (99.5%,浙江新农化工股份有限公司);噻二唑 (2-amino-5-mercapto-1,3,4-thiadiazole,AMT) 标准品 (98.0%,ABCR GmbH & Co.KG);乙腈、甲醇和乙酸均为色谱纯,其他试剂均为分析纯。
1.2 标准溶液配制及标准曲线绘制准确称取 AMT 标准品 0.010 1 g 于 100 mL 容量瓶中,用甲醇溶解并定容至 100 mL,配成质量浓度为 100 mg/L 的 AMT 标准储备液,于 4 ℃ 冰箱保存,备用。
用甲醇梯度稀释 AMT 标准储备液,配成 0.1、0.2、0.5、1、2、5 和 10 mg/L 的系列 AMT 标准工作溶液,分别进样 10 μL 测定,以浓度-峰面积绘制 AMT 标准溶液曲线。
准确称取噻唑锌标准品 0.01 g (精确至 0.000 1 g),用N,N-二甲基甲酰胺 (DMF) 溶解并定容至 100 mL,配成 100 mg/L 的噻唑锌标准储备液,于 4 ℃ 冰箱保存,备用。
用超纯水梯度稀释噻唑锌标准储备液,配成 0.2、0.5、1、2 和 5 mg/L 的系列噻唑锌标准工作溶液,按 1.3 节中水样分析方法测定对应的 AMT。分别进样 10 μL,测定对应的 AMT 峰面积,再通过 AMT 标准曲线换算为 AMT 浓度,得到噻唑锌-AMT 对应浓度关系曲线。
1.3 样品前处理1.3.1 样品采集及制备
黄瓜:随机在试验小区内不同方向及上、下不同部位采集黄瓜,切成 1 cm 大小方块,混匀,于 –18 ℃ 下保存,备用。
土壤:随机在试验小区内取点 6~12 个,采集 0~15 cm 的表层土壤,除去杂质后混匀,于 –18 ℃ 下保存,备用。
水:在试验地周边池塘随机取 10 个点的水样,混匀后于 –18 ℃ 下保存,备用。
1.3.2 样品提取及净化
水:准确量取 20 mL 水样于 100 mL 具塞三角瓶中,加入 1.0 mol/L 的 Na 2S 溶液 2 mL,于 40 ℃ 下振荡 30 min 后,加入 20 mL 乙腈继续振荡 1 h,振毕立即用 0.5 mol/L H 2SO 4 调 pH 值至 3.00 ± 0.05;转入 250 mL 分液漏斗中,加入 100 mL 乙酸乙酯萃取 1 min (剧烈振摇),静置;有机相经无水 Na 2SO 4 脱水;滤液转入 200 mL 平底烧瓶中,加入 0.1 mL 1,2-丙二醇,于 45 ℃ 水浴下浓缩至干,用甲醇定容至 2 mL,待测。
黄瓜及土壤:准确称取 20 g 样品 (精确至 0.01 g) 于 100 mL 三角瓶中,加入 0.1 mol/L 的 Na 2S 溶液 20 mL,于 40 ℃ 恒温下振荡 30 min 后,加入 20 mL 乙腈继续振荡 1 h 后,立刻加入 0.5 mol/L 的 H 2SO 4 0.6 mL,摇匀 30 s 后抽滤,用少量乙腈洗涤;合并滤液,用 0.5 mol/L 的 H 2SO 4 调节 pH 值至 3.00 ± 0.05;转入 250 mL 分液漏斗中,加入 100 mL 乙酸乙酯萃取 1 min,静置;有机相经无水 Na 2SO 4 脱水;滤液转入 200 mL 烧瓶中,加入 0.1mL 1,2-丙二醇,于 45 ℃ 水浴下浓缩至干,用甲醇定容至 2 mL,过 0.22 μm 滤膜,待测。
1.4 色谱分析条件色谱柱为 BDS HYPERSIL C 18 (250 mm × 4.6 mm,5 μm);流动相为 V (乙腈) : V (0.1% 乙酸溶液) = 10 : 90;流速 0.7 mL/min;柱温 30 ℃;二极管阵列检测器 (DAD) 检测波长 313 nm;进样量 10 μL;保留时间约 6.1 min。
1.5 定性与定量方法以样品与标准品的色谱保留时间定性,外标法定量。根据 (1) 式计算噻唑锌的进样浓度,根据 (2) 式计算样品中噻唑锌的残留量。为定量准确,每批样品测定时,均要同时按水样的前处理方法制备噻唑锌不同浓度的标准溶液。
| ${\rho _{_2}} = ({\rho _{_1}} + {\rm{ }}0.023{)}/{\rm{ }}0.5118$ | (1) |
| $R = {\rho _{_2}} \times V/W$ | (2) |
式中:ρ 2 为噻唑锌进样质量浓度 (mg/L);ρ 1 为 AMT 进样质量浓度 (mg/L);0.023 和 0.511 8 分别为噻唑锌-AMT 对应浓度曲线的截距和斜率;R 为样品中噻唑锌残留量 (mg/kg 或 mg/L);V 为样品溶液最终定容体积 (mL);W 为样品质量 (g)。
2 结果与讨论 2.1 标准曲线、线性范围和检出限结果 (表 1) 表明:在 0.10~10 mg/L 范围内,AMT 的质量浓度与对应的峰面积间呈良好的线性关系,其线性回归方程为 y = 51.537x – 1.913 2 (R2 = 0.999 9),AMT 的检出限 LOD (S/N = 3) 为 0.05 mg/L。
|
|
表 1 噻二唑和噻唑锌的线性范围、回归方程、决定系数和检出限 (LOD) Table 1 Linear ranges, regression equations, coefficients of determination and limits of detection (LOD) of AMT and zinc-thiazole |
在 0.2~5 mg/L 范围内,噻唑锌的质量浓度与对应的 AMT 峰面积及 AMT 浓度间呈良好的线性关系,得到的噻唑锌-AMT 对应浓度曲线方程为 y = 0.511 8x – 0.023 (R2 = 0.999 6),噻唑锌的 LOD (S/N = 3) 为 0.1 mg/L。
2.2 方法的准确度、精密度与定量限在水、土壤和黄瓜空白样品中分别添加 3 个水平的噻唑锌标准溶液,重复 5 次。结果 (表 2、图 1) 表明:在 0.2、1 和 5 mg/L 添加水平下,噻唑锌在水中的平均回收率为 100%~110%,相对标准偏差 (RSD) 为 0.90%~6.4%;在 0.05、0.5 和 5 mg/kg 添加水平下,噻唑锌在土壤中的平均回收率为 81%~98%,RSD 为 0.7%~2.8%;在 0.05、0.5 和 2 mg/kg 添加水平下,噻唑锌在黄瓜中的平均回收率为 95%~102%,RSD 为 1.3%~4.2%。
|
|
表 2 噻唑锌在黄瓜、土壤和水中的平均添加回收率、相对标准偏差 (RSD) 和定量限 (LOQ) Table 2 Average recoveries,relative standard deviations (RSD) and limit of quantification (LOQ) of zinc-thiazole in cucumber, soil and water samples (n = 5) |
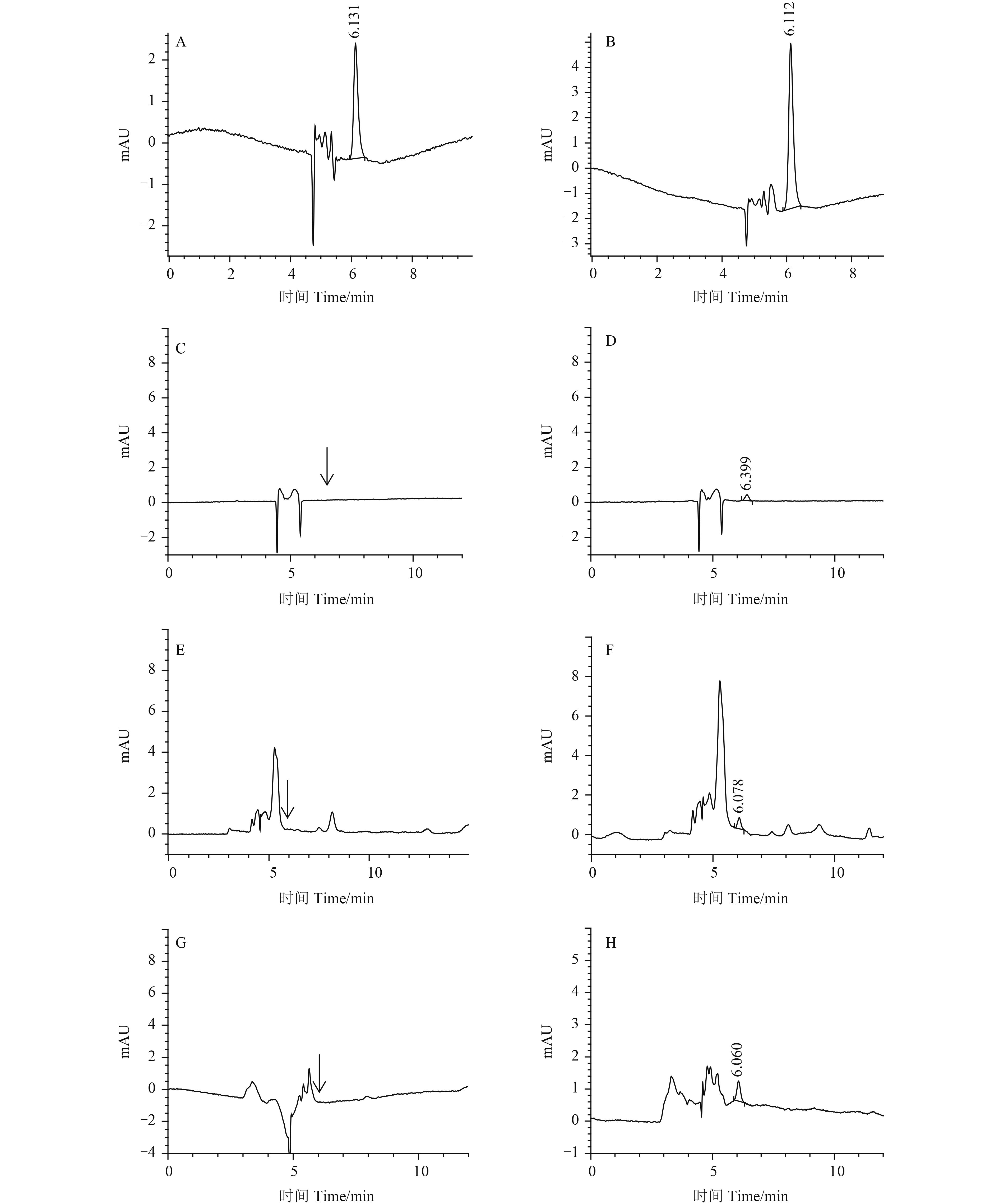
|
A:AMT 标准溶液 (0.5 mg/L);B:噻唑锌标准溶液 (0.5 mg/L);C:水空白;D:水添加 (0.2 mg/L);E:黄瓜空白;F:黄瓜添加 (0.05 mg/kg);G:土壤空白;H:土壤添加 (0.05 mg/kg)。 A: Standard chromatogram of AMT (0.5 mg/L); B: Standard chromatogram of zinc-thiazole (0.5 mg/L); C: Blank sample of water; D: Water sample fortified with zinc-thiazole (0.2 mg/L); E: Blank sample of C. sativus L; F: C. sativus L sample fortified with zinc-thiazole (0.05 mg/kg); G: Blank sample of soil; H: Soil sample fortified with zinc-thiazole (0.05 mg/kg). 图 1 不同样品中添加噻唑锌的典型高效液相色谱图 Fig. 1 HPLC chromatograms of zinc-thiazole spiked in different samples |
本方法以空白样品的 10 倍信噪比 (S/N = 10) 确定水、土壤和黄瓜样品中噻唑锌的定量限 (LOQ) 分别为 0.03 mg/L、0.05 mg/kg 和 0.05 mg/kg。
2.3 噻唑锌转化条件的选择与优化噻唑锌不易气化,难以用气相色谱测定,可用液相色谱-紫外检测器进行常量分析[6],但无法用于残留分析。因噻唑锌化学结构中含有 2-氨基-5-巯基-1,3,4-噻二唑 (AMT),可考虑通过将噻唑锌转化为 AMT 的方式间接测定。本研究首先考察了在 5 mg/L 的噻唑锌水溶液 (20 mL) 中添加 5 mL 1 mol/L 的不同试剂 (NaOH、Na 2S、H 2SO 4、HCl和 Na 2S 2O 3) 及采用不同反应条件 (放置过夜、室温下振荡 30 min 和超声反应 30 min) 后,对噻唑锌转化率的影响,结果表明:在添加 1 mol/L Na 2S 及室温下振荡 30 min 的转化条件下,噻唑锌的转化率最高 (接近 40%);其次考察了在 Na 2S 不同添加浓度 (0.1、1 mol/L)、不同振荡温度 (室温、40 ℃) 及不同振荡时间 (30、60 min) 条件下,5.0 mg/L 噻唑锌水溶液 (20 mL) 中噻唑锌的转化率。结果表明:在添加 1.0 mol/L 的 Na 2S、40 ℃ 恒温振荡 30 min 条件下,噻唑锌转化为 AMT 的得率最高,为 50% 左右。在此条件下,考察了不同质量浓度 (0.2、0.5、1、2 和 5 mg/L) 的噻唑锌转化率的稳定性。结果表明,噻唑锌的转化率在 45%~51% (n = 4) 之间,平均为 48%,基本保持稳定,且转化为 AMT 后的质量浓度与噻唑锌质量浓度间呈良好线性关系,HPLC-DAD 对 AMT 的 LOD 达 0.05 mg/L (表 1),方法的准确度和精密度可满足农药残留分析的要求[7]。因此笔者认为,噻唑锌转化率的高低并不影响方法的建立。
2.4 色谱分析条件的优化2.4.1 流动相的选择 比较了以不同比例乙腈-乙酸、甲醇-KH 2PO 4、甲醇-乙酸作为流动相时仪器对 AMT 的响应。结果发现:乙腈和甲醇在流动相中所占比例越高,AMT 的仪器响应越强,且添加 0.1% 乙酸能更好地改善色谱峰型。因此最终选择 V (乙腈) : V (0.1% 乙酸溶液) = 10 : 90 作为流动相,柱温为 30 ℃,流速为 0.7 mL/min。
2.4.2 检测波长的选择 在 190~400 nm 波长范围内,用二极管阵列检测器 (DAD) 对 AMT 进行光谱扫描。结果表明:AMT 在 313 nm 处有最大吸收峰,故选择 313 nm 作为检测波长。
2.5 样品提取及净化条件的优化考察了 40 ℃ 恒温振荡条件下在转化液中分别添加乙腈和甲醇对 AMT 提取效率的影响,以及调节提取液中不同酸碱度 (pH 3、pH 7 和 pH 9) 及添加乙酸乙酯和二氯甲烷对 AMT 提取及净化效果的影响。综合试验结果最终确定:样品加入 2 mmol 的 Na 2S 在 40 ℃ 恒温下振荡反应 30 min;加入 20 mL 乙腈于 40 ℃ 恒温下振荡提取 1 h,过滤;滤液调节 pH = 3,加入 100 mL 乙酸乙酯进行液-液萃取净化。在此条件下,可保证 AMT 的回收率 > 80%,并减少样品杂质和乳化。此外,样品过滤前添加酸可起到中和转化反应的作用,浓缩时添加 1,2-丙二醇则可防止溶剂浓缩后 AMT 的损失。
2.6 方法的应用应用本方法对噻唑锌田间残留试验黄瓜和土壤样品,以及周边池塘水样进行了测定。结果表明:黄瓜样品中未检出噻唑锌 (< 0.05 mg/kg),土壤样品中噻唑锌残留量为 < 0.050~0.23 mg/kg,池塘水中未检出噻唑锌 (< 0.03 mg/L)。
3 结论与讨论本研究通过向样品中添加 Na 2S 溶液,在 40 ℃ 恒温条件下振荡,可将噻唑锌转化为 AMT,再经乙腈恒温振荡提取,乙酸乙酯液-液分配 (pH 3) 净化,建立了利用 HPLC-DAD 及 BDS Hypersil-C 18 色谱柱测定水、土壤和黄瓜样品中噻唑锌残留的方法。对噻唑锌转化为 AMT 的条件、样品提取净化方法及仪器测定参数进行了优化。方法的添加回收率为 81%~110%,AMT 的线性范围为 0.1~10 mg/L,定量限为 0.03~0.05 mg/kg。该方法简单、准确和可靠,能满足农药残留分析的要求,对于噻二唑类金属络合物型农药 (噻唑锌、噻菌铜、噻森铜等) 的残留分析具有一定的参考价值。为进一步提高检测方法的灵敏度和检出限,减少复杂基质可能带来的干扰和影响,今后可考虑使用 HPLC-MS/MS 代替 HPLC 进行样品的检测分析。
| [1] |
王益锋, 陈如祥, 许丹倩. 创制农药噻唑锌的球磨合成工艺[J]. 农药, 2015, 54(4): 251–253.
WANG Y F, CHEN R X, XU D Q. Synthesis of the New Creating Pesticide Zinc Thiazole in a Ball Mill[J]. Agrochemicals, 2015, 54(4): 251–253. |
| [2] |
魏方林, 戴金贵, 许丹倩, 等. 创制农药噻唑锌对水稻细菌性病害的田间药效[J]. 农药, 2007, 46(12): 810–811.
WEI F L, DAI J G, XU D Q, et al. Efficacy of the New Creating Pesticide Zn Thiazole against Bacteria Disease[J]. Agrochemicals, 2007, 46(12): 810–811. doi:10.3969/j.issn.1006-0413.2007.12.004 |
| [3] |
魏方林, 许丹倩, 戴金贵, 等. 创制农药噻唑锌对柑桔溃疡病的田间药效[J]. 农药, 2008, 47(2): 90–91, 96.
WEI F L, XU D Q, DAI J G, et al. Efficacy of the New Creating Pesticide Zn Thiazole against Citrus Canker Disease[J]. Agrochemicals, 2008, 47(2): 90–91, 96. |
| [4] |
农业部农药检定所. 中国农药信息网农药登记数据查询系统[DB/OL]. [2016-09-12]. http://www.chinapesticide.gov.cn/hysj/ index.jhtml.
Institute for the Control of Agrochemicals, Ministry of Agriculture. pesticide registration data query system in China pesticide information network[DB/OL]. [2016-09-12]. http://www.chinapesticide.gov.cn/ hysj/index.jhtml. |
| [5] |
食品中农药最大残留限量: GB 2763—2014[S]. 北京: 中国标准出版社, 2014.
Maximum residue limits for pesticides in food: GB 2763—2014[S]. Beijing: Standard Press of China, 2014. |
| [6] |
姜宜飞, 赵永辉, 李国平. 噻唑锌原药高效液相色谱分析方法研究[J]. 农药科学与管理, 2009, 30(8): 44–46.
JIANG Y F, ZHAO Y H, LI G P. Analytical method for Zn-thiazole TC By HPLC[J]. Pest Sci Admin, 2009, 30(8): 44–46. |
| [7] |
农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004.
Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
 2017, Vol. 19
2017, Vol. 19


