2. 现代农业产业技术体系北京市创新团队, 北京 100029
2. Team-Innovation of Beijing Modern Agriculture and Industrial Technology Innovation System, Beijing 100029, China
中国是生姜的主要出口国之一,广泛出口至巴基斯坦、孟加拉国、韩国、美国、荷兰、马来西亚、日本及英国等[1]。生姜幼苗期长且生长缓慢,长时间处于高温多雨季节,杂草萌发生长力强,若管理不及时极易形成草荒,所以在幼苗期及时除草是一项重要的管理措施。目前姜田主产区常用的除草剂主要是二甲戊灵和乙氧氟草醚,均已有产品获准在生姜上登记使用。二甲戊灵属二硝基苯胺类选择性芽前除草剂,其作用机理是通过抑制幼芽、幼根的分生细胞分裂,使幼芽次生根不能正常生长而导致杂草死亡[2],应用很广,已成为仅次于草甘膦和百草枯的第三大除草剂[3]。乙氧氟草醚是一种触杀型的二苯醚类除草剂,通过破坏杂草细胞的透性,致使细胞萎蔫脱落,可防除多种阔叶和禾本科杂草[4]。目前,关于二甲戊灵或乙氧氟草醚在大蒜[5]、葱[6]、甘蓝[7]、烟草[8-9]、花生[10]、棉花[11-12]、水稻[13]上及环境中残留的分析方法或消解动态研究已有报道,但尚未见有关这两种除草剂在生姜上的残留分析方法及环境中消解动态的研究报道。因此,笔者建立了气相色谱-质谱联用(GC-MS) 同时检测二甲戊灵和乙氧氟草醚在姜块、茎秆和土壤中残留量的分析方法。并采用所建立的方法研究了两种除草剂在田间生姜及土壤环境中的消解规律和最终残留,以期为两种药剂在生姜上的科学合理使用提供参考。
1 材料与方法 1.1 仪器及试剂气相色谱-质谱联用仪(Shimadzu GC-MS-QP2010 plus,日本岛津公司),配备EI源;RTX-5色谱柱(30 m × 0.25 mm,0.25 μm);Filter Unit滤膜(0.45 μm,美瑞泰克公司)。
二甲戊灵(pendimethalin) 标准品(≥99.0%),江苏剑农用化学品有限公司;乙氧氟草醚(oxyfluorfen) 标准品(≥98.9%),由国家农药产品质量监督检验中心(沈阳) 提供。33%二甲戊灵乳油(EC,山东华阳化工有限公司生产);24%乙氧氟草醚乳油(浙江一帆化工有限公司生产);N-丙基乙二胺(PSA)、石墨化碳黑(GCB) 及弗罗里硅土(Florisil)(天津博纳艾杰尔科技有限公司);乙腈、正己烷、丙酮、氯化钠及无水硫酸镁均为分析纯。
1.2 田间试验设计于2015年4月-10月和2016年4月-10月分别在中国山东潍坊安丘市和青州市两地同时进行二甲戊灵和乙氧氟草醚在姜田土壤中的消解动态以及在生姜、茎秆和土壤中的最终残留试验[17]。采用人工混合方法,按m (二甲戊灵) :m (乙氧氟草醚)=7 : 1的比例分别配制推荐剂量(有效成分:693 g/hm2和72 g/hm2) 及高剂量(推荐剂量的1.5倍,有效成分:1 039 g/hm2和108 g/hm2) 的二甲戊灵-乙氧氟草醚乳油混剂,每个浓度重复3次。完全随机区组排列,小区面积30 m2以上。
|
|
表 1 田间试验土壤基本理化性质 Table 1 The main physicochemical characteristics of soil used in the field |
1.2.1 消解动态试验
采用一次施药多次取样的方法。药剂按推荐剂量以600 kg/hm2的用水量对水稀释,地面均匀喷雾。在施药后2 h及7、14、28、56、112、192 d分别采集土壤样品。取土深度0~10 cm,每个小区采样不少于5个点,采样量约1 kg,去除杂草、碎石后混匀,四分法留样300 g,于-20 ℃保存,备用。
1.2.2 最终残留试验设推荐剂量和高剂量两组处理,分别于播种后进行1次喷雾施药。于生姜收获期分别采集姜块、茎秆和土壤样品,土样采集同1.2.1节,姜块和茎秆则在取土点附近各取一株生姜植株。采用所建立的方法进行前处理及检测。
1.3 分析方法 1.3.1 样品前处理 1.3.1.1 姜块和茎秆样品分别粉碎、匀浆后,准确称取各组织液8.0 g于50 mL离心管中,加入16 mL乙腈,涡旋30 s,超声振荡15 min;加入3.2 g无水MgSO4和0.8 g NaCl,振摇1 min后超声振荡15 min,于4 000 r/min下离心5 min;取上清液2 mL于10 mL离心管中(300 mg无水MgSO4 + 150 mg PSA + 50 mg GCB),涡旋30 s,于4 000 r/min离心5 min,上清液过0.45 μm滤膜;取1 mL滤液于1.5 mL进样瓶中,氮气吹干,加入1 mL正己烷,于-80 ℃保存,待测。
1.3.1.2 土壤样品称取8 g干土于50 mL离心管中,加入8 mL乙腈,摇匀,再加入4 mL超纯水,涡旋30 s,超声振荡15 min;加入3.2 g无水MgSO4和0.8 g NaCl,振摇1 min后超声振荡15 min,于4 000 r/min下离心5 min;取上清液2 mL于10 mL离心管中(300 mg无水MgSO4 + 50 mg Florisil)。其余同姜块和茎秆样品处理。
1.3.2 气相色谱-质谱检测条件 1.3.2.1 色谱条件RTX-5色谱柱(30 m × 0.25 mm,0.25 μm);载气为氦气(纯度 > 99.999%);柱箱温度160 ℃;进样口温度260 ℃;柱流量0.71 mL/min;进样量1 μL;升温程序:160 ℃保持3 min,以35 ℃/min升到220 ℃,保持1 min,再以20 ℃/min升到260 ℃,保持3 min,总时间:10.71 min;不分流进样。
1.3.2.2 质谱条件接口温度280 ℃;离子源温度250 ℃;离子化电压70 eV;溶剂延迟时间3.0 min。采集模式:选择离子模式(SIM),二甲戊灵和乙氧氟草醚定量离子均为m/z 252;二甲戊灵定性离子分别为m/z 252、m/z 191和m/z 162,扫描时间设定在8~9 min;乙氧氟草醚定性离子分别为m/z 361、m/z 300和m/z 252,扫描时间设定在9~10 min。
1.3.3 标准溶液配制及标准曲线绘制用丙酮分别溶解配制200 mg/L的二甲戊灵和乙氧氟草醚标准母液,试验时再用正己烷分别将标准母液梯度稀释配成5、2、1、0.5、0.1、0.05及0.01 mg/L的两种标准工作溶液,并按比例配制相同系列浓度的混合标准工作溶液,均于-20 ℃保存。于1.3.2节条件下检测,以进样质量浓度为横坐标,相应的峰面积为纵坐标,绘制标准工作曲线。
1.3.4 添加回收试验在空白姜块、茎秆和土壤样品中分别准确添加0.01、0.05和0.5 mg/kg 3个水平的二甲戊灵或乙氧氟草醚标准溶液,每种除草剂每个浓度设5次重复,加药0.5 h后,按上述所建立方法进行样品提取、净化及测定,计算平均回收率及相对标准偏差(RSD)。
2 结果与分析 2.1 色谱分离效果在所选定的色谱-质谱条件下,二甲戊灵和乙氧氟草醚的分离情况良好,未出现杂质干扰峰,表明本检测方法的色谱-质谱条件合理可行。其中,二甲戊灵的保留时间为8.37 min,乙氧氟草醚保留时间为9.42 min (图 1)。
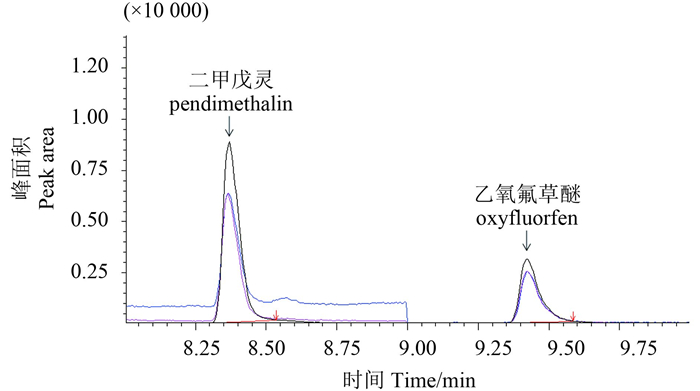
|
图 1 二甲戊灵和乙氧氟草醚标准溶液气相色谱图(0.5 mg/L) Fig. 1 Gas chromatogram of standard solution of pendimethalin and oxyfluorfen at 0.5 mg/L |
2.2 分析方法的线性相关性及定量限
结果表明,在0.01~5 mg/L范围内,二甲戊灵、乙氧氟草醚进样质量浓度与峰面积间均呈现良好的线性关系。二甲戊灵标准曲线回归方程为:y=57 793x -2 669.9,相关系数r=0.999 8;乙氧氟草醚标准曲线回归方程为:y=35 442x -1 691.6,r=0.999 3。根据《农药残留试验准则》中定义[18],得二甲戊灵和乙氧氟草醚的定量限(LOQ) 均为0.01 mg/kg。
2.3 方法的准确度与精密度试验表明,当添加水平在0.01~0.5 mg/kg时,二甲戊灵在姜块中的平均回收率为91%~100%,相对标准偏差(RSD) 为3.2%~3.7%;在茎秆中的平均回收率为90%~98%,RSD为2.7%~4.2%;在土壤中的平均回收率为86%~100%,RSD为3.2%~5.1%。乙氧氟草醚在姜块中的平均回收率为90%~95%,RSD为2.4%~4.4%;在茎秆中的平均回收率为86%~91%,RSD为3.9%~5.5%;在土壤中的平均回收率为85%~95%,RSD为2.3%~4.9%。结果符合国家农药残留分析与检测要求[18]。
2.4 消解动态二甲戊灵和乙氧氟草醚在土壤中的消解均符合一级反应动力学方程,消解方程及半衰期分别见表 2和表 3。随时间延长,土壤中二甲戊灵和乙氧氟草醚的残留量均逐渐降低,至56 d时,消解率均达到80%以上;二甲戊灵的消解半衰期在12.5~20.5 d之间,乙氧氟草醚在18.8~25.6 d之间。2015和2016年,山东青州试验点二甲戊灵及乙氧氟草醚的消解半衰期均长于安丘试验点,其原因可能与两地土壤含水量、有机质含量及土壤颗粒大小等因素有关[19];同一地块,2016年二甲戊灵及乙氧氟草醚的消解速率均略快于2015年,其原因可能与当年的温度、湿度、风力、降雨等气象因素有关[10, 20]。经查阅相关资料发现,山东潍坊2016年4-6月期间较2015年同期温度偏高。相同条件下,二甲戊灵的消解半衰期均长于乙氧氟草醚。
|
|
表 2 土壤中二甲戊灵的消解动态 Table 2 The dissipation dynamic of pendimethalin in soil |
|
|
表 3 土壤中乙氧氟草醚的消解动态 Table 3 The dissipation dynamic of oxyfluorfen in soil |
2.5 最终残留结果
试验表明,分别采用推荐剂量和高剂量的二甲戊灵-乙氧氟草醚乳油混剂处理土壤,至生姜收获期,在姜块和茎秆中均未检出两种除草剂残留,其在土壤中的残留量均低于LOQ值(0.01 mg/kg)。
3 小结与讨论采用快速、简单、经济、高效的QuEChERS前处理方法提取生姜、茎秆和土壤中的二甲戊灵和乙氧氟草醚残留[21],样品用乙腈提取,姜块和茎秆提取液经PSA和GCB净化去除杂质和色素,土壤样品用弗罗里硅土柱净化。通过GC-MS进行检测,采用SIM模式,相比单纯的GC或LC方法,具有定性简单、灵敏度高和分离度好的优点,添加回收率在85%~100%之间,相对标准偏差、准确度、精密度及定量限均符合农药残留检测标准要求[18]。
二甲戊灵和乙氧氟草醚的最终残留量对于其在生姜上的安全使用及风险评估具有重要意义。目前,中国尚未制定二甲戊灵和乙氧氟草醚在生姜上的最大允许残留限量(MRL) 标准,欧盟规定其MRL值分别为0.1和0.05 mg/kg[22]。研究表明,采用推荐剂量和高剂量的二甲戊灵-乙氧氟草醚乳油混剂处理姜田土壤,至生姜收获期时,两种农药在姜块中的残留量均低于欧盟的MRL标准,产品满足出口欧盟等国家的要求。因此,建议中国在制定二甲戊灵和乙氧氟草醚在生姜上的MRL值时可采用与欧盟相同的标准。
| [1] |
李飞雪. 莱芜市生姜出口现状分析[J]. 合作经济与科技, 2015(8): 132–134.
LI F X. The present situation analysis of ginger export in Laiwu[J]. Co-operat Econ Sci, 2015(8): 132–134. |
| [2] | APPLEBY A P, VALVERDE B E. Behavior of dinitroaniline herbicides in plants[J]. Weed Technol, 1989, 3(1): 198–206. |
| [3] |
刘志俊. 二甲戊乐灵-世界最大的选择性除草剂[J]. 农药市场信息, 2004(22): 14–15.
LIU Z J. Pendimethalin-the largest selective herbicides of the world[J]. Pestic Market News, 2004(22): 14–15. |
| [4] | EL HUSSEIN A A, MOHAMED A T, EL SIDDIG M A, et al. Effects of oxyfluorfen herbicide on microorganisms in loam and silt loam soils[J]. Res J Envrion Sci, 2012, 6(4): 134–145. doi:10.3923/rjes.2012.134.145 |
| [5] |
李闯, 候志广, 刘建国, 等. 气相色谱法测定大蒜中二甲戊乐灵·乙氧氟草醚·乙草胺3种除草剂的残留[J]. 安徽农业科学, 2011, 39(22): 13429–13430.
LI C, HOU Z G, LIU J G, et al. Determination of pendimethalin, oxyfluorfen and acetochlor residue in garlic by GC[J]. J Anhui Agri Sci, 2011, 39(22): 13429–13430. |
| [6] | WU X H, XU J, DONG F S, et al. Simultaneous determination of metolachlor, pendimethalin and oxyfluorfen in bulb vegetables using gas chromatography-tandem mass spectrometry[J]. Anal Methods, 2013, 5(22): 6389–6394. doi:10.1039/c3ay41332b |
| [7] |
黄雅丽, 毛黎娟, 吴慧明, 等. 二甲戊乐灵在甘蓝及土壤中的残留及消解动态研究[J]. 农业环境科学学报, 2004, 23(6): 1147–1150.
HUANG Y L, MAO L J, WU H M, et al. Residues and degradation of pendimethalin in cabbage and soil[J]. J Agro-Environ Sci, 2004, 23(6): 1147–1150. |
| [8] |
相振波, 孙惠青, 王秀国, 等. 二甲戊灵在烟草和土壤中的残留消解动态和残留量[J]. 农药, 2013, 52(1): 45–47.
XIANG Z B, SUN H Q, WANG X G, et al. Residues and decline dynamics of pendimethalin in tobacco and soil[J]. Agrochemicals, 2013, 52(1): 45–47. |
| [9] | TRIANTAFYLLIDIS V, HELA D, SALACHAS G, et al. Soil dissipation and runoff losses of the herbicide pendimethalin in tobacco field[J]. Water Air Soil Poll, 2009, 201(1-4): 253–264. doi:10.1007/s11270-008-9942-2 |
| [10] | SAHA A, BHADURI D, PIPARIYA A, et al. Behaviour of pendimethalin and oxyfluorfen in peanut field soil:effects on soil biological and biochemical activities[J]. Chem Ecol, 2015, 31(6): 550–566. doi:10.1080/02757540.2015.1039526 |
| [11] |
于乐祥, 梁林, 张爱娟, 等. 气相色谱-质谱法测定二甲戊灵在棉花中的残留量[J]. 农药科学与管理, 2015, 36(5): 35–38.
YU L X, LIANG L, ZHANG A J, et al. Determination of pendimethalin residue in cotton by GC-MS[J]. Pestic Sci Adm, 2015, 36(5): 35–38. |
| [12] | TSIROPOULOS N G, LOLAS P C. Persistence of pendimethalin in cotton fields under sprinkler or drip irrigation in central Greece[J]. Int J Environ Anal Chem, 2004, 84(1-3): 199–205. doi:10.1080/0306731031000149714 |
| [13] | SONDHIA S. Persistence of oxyfluorfen in soil and detection of its residues in rice crop[J]. Toxicol Environ Chem, 2009, 91(3): 425–433. doi:10.1080/02772240802269096 |
| [14] | SCHINNER F, ÖHLINGER R, KANDELER E, et al. Methods in soil biology[M]. Berlin Heidelberg, Germany: Springer-Verlag, 1995: 386-389. |
| [15] | NELSON D W, SOMMERS L E. Total carbon, organic carbon, and organic matter[M]//MILLER A L, KEENCY R H. Methods of soil analysis. Madison, WI, USA:Soil Science Society of America and American Society of Agronomy, 1985:539-576. |
| [16] | MARGESIN R, SCHINNER F. Manual for soil analysis-monitoring and assessing soil bioremediation[M]. Berlin Heidelberg, Germany: Springer-Verlag, 2005: 47-49. |
| [17] |
农业部农药检定所.
农药登记残留田间试验标准操作规程[M]. 北京: 中国标准出版社, 2007: 43-47.
Institute for the Control of Agrochemicals, Ministry of Agriculture. Standard operating procedures on pesticide registration residue field trials[M]. Beijing: Standards Press of China, 2007: 43-47. |
| [18] |
农药残留试验准则:NY/T 788-2004[S].北京:中国农业出版社, 2004.
Guideline on pesticide residue trials:NY/T 788-2004[S]. Beijing:China Agriculture Press, 2004. |
| [19] | KULSHRESTHA G, SINGH S B. Influence of soil moisture and microbial activity on pendimethalin degradation[J]. Bull Environ Contam Toxicol, 1992, 48(2): 269–274. |
| [20] | MANTZOS N, KARAKITSOU A, HELA D, et al. Persistence of oxyfluorfen in soil, runoff water, sediment and plants of a sunflower cultivation[J]. Sci Total Envrion, 2014, 472: 767–777. doi:10.1016/j.scitotenv.2013.11.016 |
| [21] | ANASTASSIADES M, LEHOTAY S J, ŠTAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412–431. |
| [22] |
中国农药信息网.农药最大残留限量数据库[DB/OL].[2016-09-05]. http://202.127.42.84/tbt-sps/mrlsdb/mrlsdb.do.China
Pesticide Information Network. Maximum pesticide residue limits database[DB/OL].[2016-09-05]. http://202.127.42.84/tbt-sps/mrlsdb/mrlsdb.do. |
 2017, Vol. 19
2017, Vol. 19


