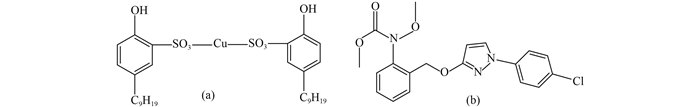
壬菌铜(cuppric nonyl phenolsulfonate),结构式见图示1a,是中国自主创制的一种高效、广谱、低毒、低残留的新型有机铜类杀菌剂,其可通过诱导细菌细胞壁变薄、抑制细菌分裂以及凝固病原菌细胞膜蛋白,导致病菌机能失调以致衰竭死亡,对蔬菜、瓜类、果树、花卉等农作物的霜霉病、炭疽病、白粉病、软腐病、细菌性角斑病及疫病等均具有出色的防治效果,具有广阔的应用前景[1-2]。吡唑醚菌酯(pyraclostrobin,图示1b) 是一种低毒、对非靶标生物安全、对环境友好的广谱性杀菌剂,其作用机理是抑制真菌孢子萌发和菌丝生长,目前已被广泛应用于防治苹果、大麦、大豆、花生等作物上由子囊菌、担子菌、半知菌和卵菌等真菌病原体引起的病害[3-4]。为保护公众健康,美国、欧盟等已制定了吡唑醚菌酯在蔬菜、水果、粮食等作物中的最大残留限量(MRL) 值,日本制定了壬菌铜在水果、蔬菜及粮食等作物中的MRL值(如苹果中为5 mg/kg)[5],中国规定了吡唑醚菌酯在苹果中的MRL值为0.5 mg/kg[6],但尚未制定作物中壬菌铜的MRL标准。
|
图式1 壬菌铜(a) 和吡唑醚菌酯(b) 的结构式 Scheme1 Chemical structures of cuppric nonyl phenolsulfonate (a) and pyraclostrobin (b) |
现有报道中关于有机铜残留量的检测方法主要包括原子吸收光谱法[7]、化学发光法[8]、气相色谱法[9-10]和高效液相色谱法[11-12]等。其中,原子吸收光谱法通过测定铜的原子吸收光谱得到有机铜的含量,由于铜在样品中普遍存在,因此易导致实际测定误差偏大[7];化学发光法是利用铜离子氧化鲁米诺,仪器较为复杂且受鲁米诺发光时间限制[8];色谱法需采用五氟苄基溴进行衍生化[9],或采用乙腈混合少量强酸/强碱超声提取后再用正己烷或石油醚重复萃取[10-12],前处理过程繁琐。目前尚缺乏简单、快速、准确且适用于大多数有机铜类农药残留的检测方法。吡唑醚菌酯的分析方法主要包括气相色谱法[13]、高效液相色谱法[14]和液相色谱-质谱联用法[15-16],前处理方法则多采用液-液萃取和固相萃取,较为繁琐。截至目前,尚未见关于壬菌铜在果蔬中残留分析及消解动态的研究报道,也未见农产品中壬菌铜和吡唑醚菌酯残留的同时检测以及二者复配使用后在果蔬和土壤中消解动态行为的相关报道。
由于壬菌铜的响应信号较低,难以满足检测需求,因此需采用破络剂将其转化为壬基酚磺酸后再进行定量[17]。本研究中以硫化钠为破络剂,样品采用分散固相萃取法净化,结合高效液相色谱-串联质谱(HPLC-MS/MS) 技术,建立了同时检测苹果和土壤中壬菌铜和吡唑醚菌酯残留的分析方法,并利用该方法研究了壬菌铜和吡唑醚菌酯在苹果和土壤中的消解动态规律和残留状况,以期全面准确评价壬菌铜和吡唑醚菌酯在苹果上使用的安全性,并为壬菌铜在苹果中MRL值的制定及其合理使用提供科学依据。
1 材料与方法 1.1 仪器及试剂Agilent 1200液相色谱仪(美国Agilent公司),API2000串联四极杆质谱仪(美国ABSciex公司),IKA-2高速匀浆机(德国IKA公司),高速离心机(美国Thermo公司),涡流混合器(海门市其林贝尔仪器有限公司),万分之一电子天平(瑞士Mettler Toledo公司)。
吡唑醚菌酯(pyraclostrobin) 标准品(纯度99%,德国Dr. E公司);壬基酚磺酸(nonyl phenol sulfonic acid) 标准品(纯度>90%) 以及24%吡唑醚菌酯·壬菌铜微乳剂(ME,陕西上格之路生物科学有限公司提供);PSA分散固相萃取净化剂(天津博纳艾杰尔科技有限公司);乙腈和甲醇(色谱纯),无水硫酸镁、氯化钠、柠檬酸钠及柠檬酸氢二钠(分析纯)。
1.2 分析方法 1.2.1 样品前处理 1.2.1.1 苹果称取5.0 g匀浆后的苹果样品,加入10 mL乙腈和0.5 g硫化钠,涡旋约2 min,静置1 h。加入4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸氢二钠,涡旋2 min,4 000 r/min离心5 min。取上层清液1.5 mL于离心管中,加入1.5 mL乙腈、150 mg无水硫酸镁和25 mg PSA,涡旋2 min,于13 000 r/min下离心10 min,吸取上层清液800 μL,经0.22 μm滤膜过滤后待测。
1.2.1.2土壤称取土壤样品5.0 g于50 mL离心管中,加入2 mL去离子水、10 mL乙腈及0.5 g硫化钠,涡旋2 min,静置1 h。加入4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸氢二钠,涡旋2 min,4 000 r/min离心5 min。取上层清液1.5 mL于离心管中,加入1.5 mL乙腈、150 mg无水硫酸镁和25 mg PSA,涡旋2 min,于13 000 r/min下离心10 min,吸取上层清液800 μL,经0.22 μm滤膜过滤后待测。
1.2.2 仪器检测条件 1.2.2.1 色谱条件Agilent Eclipse XBD-C18色谱柱(150 mm × 4.6 mm,5 μm);柱温30 ℃;流动相A为水,流动相B为甲醇;流速:0.3 mL/min;进样量5 μL。梯度洗脱条件:0~1 min内保持B相体积分数为10%;1~2 min线性增加至90%,保持6 min;8~10 min内线性恢复至10%。系统平衡4 min。
1.2.2.2 质谱条件采用正负离子同时扫描,具体参数见表 1。
|
|
表 1 壬基酚磺酸和吡唑醚菌酯检测质谱参数 Table 1 MS parameters for nonyl phenol sulfonic acid and pyraclostrobin |
1.2.3 标准溶液配制及标准曲线的绘制
分别准确称取壬基酚磺酸和吡唑醚菌酯标准品约0.05 g (精确至0.000 1 g) 于100 mL容量瓶中,用甲醇定容至刻度,得到5 × 105 μg/L的标准品母液。试验时再用空白基质提取液稀释配制系列浓度的壬基酚磺酸和吡唑醚菌酯混合基质匹配标准溶液。其中,壬基酚磺酸的浓度按换算(m壬菌铜=2.2m壬基酚磺酸) 后壬菌铜的质量浓度计,分别为10、25、50、100、250、500、1 250和2 500 μg/L;吡唑醚菌酯的质量浓度分别为1.0、2.5、5.0、10、25、50、125及250 μg/L。按1.2.2节条件进行测定。分别以壬菌铜和吡唑醚菌酯的质量浓度为横坐标、相应的峰面积为纵坐标绘制标准曲线。
1.2.4 添加回收试验分别向空白的苹果和土壤样品中添加3个水平的吡唑醚菌酯和壬菌铜混合标准溶液,使壬菌铜在苹果和土壤中的添加水平分别为0.1、0.5、5和10 mg/kg,吡唑嘧菌酯在苹果和土壤中的添加水平分别为0.01、0.05、0.5和1 mg/kg,按1.2节方法进行样品前处理及测定。每个水平重复5次。
1.3 田间试验设计田间试验分别于2014年和2015年在中国宁夏银川、山东淄博和北京3地进行。供试药剂为24%吡唑醚菌酯·壬菌铜微乳剂,按《农药残留试验准则》(NY/T788-2004)[18]要求设试验小区,每小区2棵树,重复3次,随机排列,分别设空白对照区、低剂量处理区、高剂量处理区和消解动态处理区,小区间设保护带。
1.3.1 消解动态试验苹果中消解动态试验按施药剂量(有效成分) 450 mg/kg于苹果生长到成熟个体一半大小时喷雾施药1次;土壤中消解动态试验地块面积为30 m2,单独施药,施药剂量为制剂有效成分1 000 g/hm2。另设清水空白对照。分别于施药后2 h和1、3、5、7、10、14、21、30、45 d采样:在试验小区内不同方向及果树上、中、下、里、外等不同部位采集12个以上(不少于2 kg) 苹果果实;土壤随机取6~12个点,钻取0~10 cm的地表土1~2 kg,去除杂草碎石。样品于-20 ℃保存,备用。
1.3.2 最终残留试验设2个施药剂量:低剂量为推荐剂量(有效成分300 mg/kg),高剂量为推荐剂量的1.5倍(有效成分450 mg/kg),各设3次和4次施药,施药间隔期为10 d,分别于距最后一次施药后14、21及30 d时采样。土壤取样深度为0~15 cm,其余采样方法同1.3.1节。
2 结果与分析 2.1 方法优化 2.1.1 前处理条件优化本研究分别考察了硫化钠和氢氧化钠的破络效果,发现硫化钠的破络效果更好,因此选择其作为破络剂。当壬菌铜的质量浓度在10~4 000 μg/L范围内时,加入0.5 g硫化钠,在室温下反应1 h,壬菌铜转化为壬基酚磺酸的转化率在90.2%~93.3%之间,相对标准偏差(RSD) 小于2.5% (n=3),可以满足分析检测需求。
进一步根据壬菌铜和吡唑醚菌酯的性质,考察了甲醇、乙腈、丙酮等常用提取剂对二者的提取效果。结果表明:采用丙酮提取时共萃物较多,干扰大;甲醇对硫化钠有一定的溶解性,会对仪器造成不利影响;而先用乙腈提取,再使用硫化钠破络时,壬菌铜的回收率低于45.5%,这可能是由于乙腈对壬菌铜的提取效果较差造成的;当同时加入乙腈和硫化钠时,则壬菌铜和吡唑醚菌酯的回收率均在98%~106%之间。因此在样品前处理过程中,最终选择以乙腈为提取溶剂,并同时加入硫化钠进行破络。
2.1.2 色谱-质谱条件优化流动相组成对化合物的色谱行为及其质谱响应具有显著影响。本研究考察了甲醇-水和乙腈-水两种流动相体系以及不同浓度甲酸对目标物色谱-质谱分离效果的影响。结果表明:与乙腈-水体系相比,采用甲醇-水洗脱时,吡唑醚菌酯和壬基酚磺酸的峰形更好,响应值更高;在水中添加体积分数为0.05%~0.2%的甲酸对离子化效率仅有微弱提高,但采用含有甲酸的水溶液作为流动相时,由于壬基酚磺酸与C18色谱柱间的疏水作用较强,导致其色谱峰拖尾十分严重;因此,最终选择甲醇-水作为流动相。此外,试验中尝试了不同梯度洗脱条件对二者分离效果的影响,结果表明,当按照1.2.2.1节条件进行梯度洗脱时,吡唑嘧菌酯和壬基酚磺酸的峰形较好,且均与杂质得到了良好的分离。
根据两种化合物的不同性质,采用了正、负离子同时扫描模式。结果表明:在正离子模式下,咪唑醚菌酯产生了m/z=388.3的[M+H]+和m/z=410.5的[M+Na]+离子峰,由于m/z=410.5峰的响应值远高于m/z=388.3峰,因此,选择[M+Na]+作为吡唑醚菌酯的母离子。其二级质谱的特征碎片离子m/z分别为380.0、216.0和186.3,其中m/z 216.0的响应值高且稳定,因此将m/z 410.5/216.0作为吡唑醚菌酯的定量离子对。在负离子模式下,壬基酚磺酸生成稳定的m/z=299.3的[M-H]-离子峰,其二级质谱的特征碎片离子m/z分别为213.2和133.2,其中m/z 133.2碎片离子丰度最高,结构信息显著,因此选择299.3/133.2作为壬基酚磺酸的定量离子对。
2.2 方法的线性范围、准确度及精密度结果表明,在10~2 500 μg/L质量浓度范围内,壬菌铜的峰面积(y) 与质量浓度(x) 间呈良好线性关系,回归方程分别为:y=5 010x + 61 800,r=0.996 8 (苹果) 和y=4 460x + 44 500,r=0.995 0 (土壤);同样,在1.0~250 μg/L范围内,吡唑醚菌酯峰面积(y) 与质量浓度(x) 间也呈良好的线性关系,回归方程分别为y=923x + 1 010,r=0.994 6 (苹果) 和y=1 130x + 423,r=0.997 0 (土壤)。
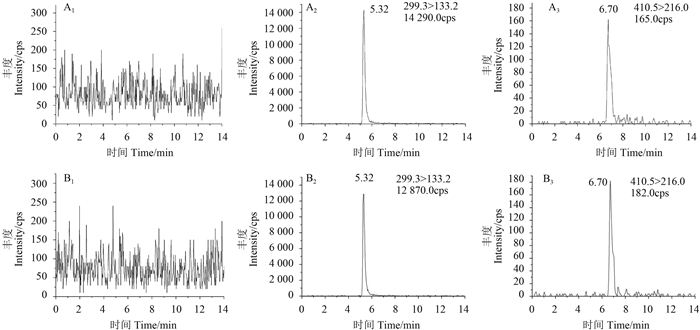
从表 2可知,在0.1、0.5、5和10 mg/kg添加水平下,壬菌铜在苹果及土壤中的回收率范围为92%~103%,RSD为1.3%~5.1%;在0.01、0.05、0.5和1 mg/kg添加水平下,吡唑醚菌酯在苹果和土壤中的回收率范围为96%~105%,RSD为2.4%~4.6%。根据《农药残留试验准则》[18]中最低检测浓度(LOQ) 定义,苹果和土壤中壬菌铜和吡唑醚菌酯的LOQ值分别为0.1和0.01 mg/kg。典型色谱图如图 1所示。
|
|
表 2 苹果和土壤中壬菌铜和吡唑醚菌酯的添加回收率及相对标准偏差(n=5) Table 2 Average recoveries and relative standard deviation (RSD) for cuppric nonylphenolsulfonate and pyraclostrobin in apple and soil samples (n=5) |
|
A1:空白苹果;A2:苹果中添加0.1 mg/kg壬菌铜;A3:苹果中添加0.01 mg/kg吡唑醚菌酯;B1:空白土壤;B2:土壤中添加0.1 mg/kg壬菌铜;B3:土壤中添加0.01 mg/kg吡唑醚菌酯。 A1: blank apple; A2: apple spiked with 0.1 mg/kg cuppric nonylphenolsulfonate; A3: apple spiked with 0. 01 mg/kg pyraclostrobin; B1: blank soil; B2: soil spiked with 0.1 mg/kg cuppric nonylphenolsulfonate; B3:soil spiked with 0.01 mg/kg pyraclostrobin. 图 1 空白样品及添加回收样品高效液相色谱-串联质谱图 Fig. 1 HPLC-MS/MS Chromatograms of blank and spiked samples |
2.3 壬菌铜和吡唑醚菌酯在苹果和土壤中的消解动态
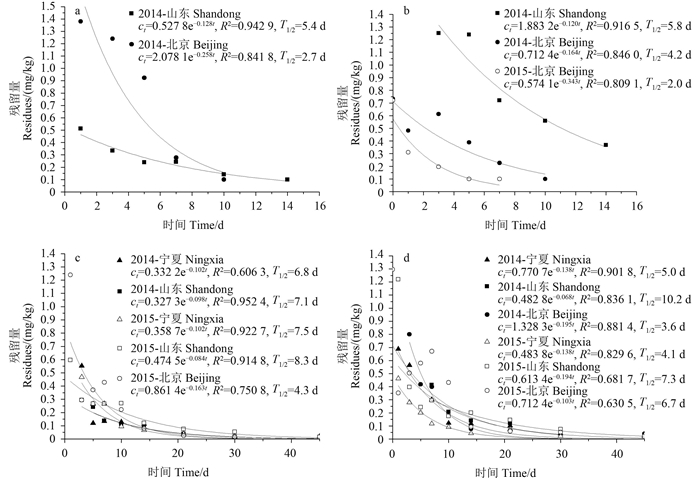
结果见图 2。在2014-2015年宁夏、山东和北京两年三地试验中,壬菌铜在苹果和土壤中的原始沉积量分别为0.10~0.37和0.10~0.73 mg/kg,施药14 d后,其在苹果和土壤中的残留量均低于LOQ (0.1 mg/kg)。仅2014年山东和北京试验点拟合出了壬菌铜在苹果中的消解动态曲线,半衰期分别为5.4和2.7 d;仅2014年山东和北京以及2015年北京试验点拟合出了壬菌铜在土壤中的消解动态曲线,半衰期分别为5.8、4.2和2.0 d。吡唑醚菌酯在苹果中的原始沉积量为0.07~0.53 mg/kg,施药10 d后消解率达54.9%以上,30 d达90.9%以上,除2014年北京试验点外其余均拟合出了消解动态曲线,半衰期为4.3~8.3 d;其在土壤中的原始沉积量为0.11~1.30 mg/kg,施药10 d后消解率达50.0%以上,30 d达82.7%以上,45 d达91.8%,各试验点均拟合得到了消解动态曲线,半衰期在3.6~10.2 d之间。总体而言,壬菌铜和吡唑醚菌酯的原始沉积量和消解速率存在差异,其在山东试验点消解最慢,分析可能与苹果种植密度、果实大小、苹果生长周期、土壤类型、土壤pH值、有机质含量及气候条件等因素有关。
|
图 2 壬菌铜在苹果(a) 和土壤(b) 以及吡唑醚菌酯在苹果(c) 和土壤(d) 中的消解动态曲线 Fig. 2 Dynamic curve of cuppric nonyl phenolsulfonate in appls (a) and soil (b) and pyraclostrobin in apples (c) and soil (d) |
2.4 壬菌铜和吡唑醚菌酯在苹果和土壤中的最终残留
结果见表 3。可以看出,在两年三地的试验中,分别按推荐剂量(有效成分300 mg/kg,800倍稀释) 和推荐剂量的1.5倍(有效成分450 mg/kg,533.3倍稀释) 施药3~4次时,随着采样间隔期的延长,各试验点苹果中壬菌铜和吡唑醚菌酯的残留量均随之降低,两种农药在苹果中的最终残留值分别在ND~0.31和ND~0.27 mg/kg之间;壬菌铜和吡唑醚菌酯在土壤中的最终残留值分别为ND~0.33和ND~0.32 mg/kg。
|
|
表 3 苹果和土壤中壬菌铜和吡唑醚菌酯的最终残留量 Table 3 Final residue of cuppric nonylphenolsulfonate and pyraclostrobin in apple and soil samples |
3 结论
目前,关于吡唑醚菌酯的检测方法已有报道,但对壬菌铜的残留分析方法及消解行为还鲜有报道,也未见关于二者同时分析的报道。本研究采用硫化钠为破络剂,优化了QuEChERS样品前处理方法,结合高效液相色谱-串联质谱(HPLC-MS/MS) 技术,建立了苹果及其土壤中壬菌铜和吡唑醚菌酯的同步分析方法,可为壬菌铜和有机铜类农药残留检测提供参考。所建立方法前处理步骤简单快捷,重复性好,准确度和灵敏度均能满足农药残留分析与检测技术要求,实现了壬菌铜和吡唑醚菌酯复配剂在苹果和土壤中残留的同时检测。
2014和2015年,宁夏、山东及北京3地的消解动态试验结果表明:在苹果和土壤中,壬菌铜的半衰期分别为2.7~5.4和2.0~5.8 d,吡唑醚菌酯的半衰期分别为4.3~8.3和3.6~10.2 d,二者消解均较快,残留量较低,因此在作物上使用相对安全。两种农药在两年三地苹果和土壤中的消解速率不尽相同,其原因可能是由于各地苹果品种、气候条件、土壤类型和施药时期等因素不同,以及农药在苹果和土壤中的降解机制差异所致。
最终残留试验结果表明,24%吡唑醚菌酯·壬菌铜微乳剂以推荐剂量和推荐剂量的1.5倍施药3~4次,距最后一次施药14、21、30 d后,苹果中壬菌铜的最高残留量为0.31 mg/kg,低于日本规定的苹果中壬菌铜的MRL值(5 mg/kg)[5],吡唑醚菌酯的最高残留量为0.27 mg/kg,低于中国规定的苹果上吡唑醚菌酯的MRL值(0.5 mg/kg)[6],因此建议其采收安全间隔期可定为14 d。
| [1] |
杨萌.新型杀菌剂30%壬菌铜微乳剂的开发与研究[D].杨陵:西北农林科技大学, 2006:7.
YANG M. The exploitation and research of 30% cuppric nonyl phenolsulfonate ME[D]. Yangling:Northwest Agricultural and Forestry University, 2006:7. |
| [2] |
周艳丽.壬菌铜与乙蒜素增效复配制剂研究[D].杨陵:西北农林科技大学, 2014:4.
ZHOU Y L. Synergistic complex preparation research of copper nonyl phensulfonate and ethylicin[D]. Yangling:Northwest Agricultural and Forestry University, 2006:4. |
| [3] | BARTLETT D W, CLOUGH J M, GODWIN J R, et al. The strobilurin fungicides[J]. Pest Manag Sci, 2002, 58(7): 649–662. doi:10.1002/(ISSN)1526-4998 |
| [4] |
杨丽娟, 柏亚罗. 甲氧基丙烯酸酯类杀菌剂-吡唑醚菌酯[J]. 现代农药, 2012, 11(4): 46–50.
YANG L J, BAI Y L. Strobilurin fungicide-pyraclostrobin[J]. Modern Agrochem, 2012, 11(4): 46–50. |
| [5] | The Japan Food Chemical Research Foundation. Table of MRLs for agricultural chemicals[DB/OL].[2015-06-29]. http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=49500 |
| [6] |
食品中农药最大残留限量:GB 2763-2014[S].北京:中国标准出版社, 2014.
National food safety safety standard-maximum residue limits for pesticides in food:GB 2763-2014[S]. Beijing:Standards Press of China, 2014. |
| [7] | STOCK D J. Flame atomic absorption spectrometric determination of copper-8-quinolinolate anti-stain on treated lumber surfaces[J]. J Anal At Spectrom, 1990, 5(7): 631–634. doi:10.1039/ja9900500631 |
| [8] | UECHI M, FUJIWARA T, OKAMOTO Y. A flow method for the determination of oxine-copper based on a reversed micellar mediated chemiluminescence detection system following on-line extraction[J]. Japan Soc Anal Chem, 2004, 53(4): 285–290. |
| [9] | KOBAYASHI H, MATANO O, GOTO S. Determination of oxine-copper in orange by gas chromatography[J]. J Chromatogr A, 1989, 474(2): 381–387. doi:10.1016/S0021-9673(01)93931-7 |
| [10] | OHNO H, AOYAMA T. Determination of oxine-copper in water by gas chromatography[J]. Jap J Toxicol Environ Health, 1991, 37(6): 522–528. doi:10.1248/jhs1956.37.522 |
| [11] |
肖浩, 龚道新, 吴亮, 等. 高效液相色谱法测定稻田样品中喹啉铜残留[J]. 农药学学报, 2015, 17(1): 106–110.
XIAO H, GONG D X, WU L, et al. Determination of oxine-copper residue in paddy field samples by high performance liquid chromatography[J]. Chin J Pestic Sci, 2015, 17(1): 106–110. |
| [12] | UEHARA N, NOMOTO K, SHIMIZU T. Determination of dissociation rate constant of oxine-copper complex using high-performance liquid chromatography[J]. Bunseki Kagaku, 2006, 55(3): 185–190. doi:10.2116/bunsekikagaku.55.185 |
| [13] | WANG Y H, YANG Y X, ZHOU Q F, et al. Dissipation and residue of picoxystrobin in banana and soil under field conditions[J]. Pol J Environ Stud, 2014, 23(4): 1361–1365. |
| [14] | NAGESWARA RAO T, RAMESH A, PARVATHAMMA T, et al. Development and validation of a HPLC-UV method for simultaneous determination of strobilurin fungicide residues in tomato fruits followed by matrix solid-phase dispersion (MSPD)[J]. Indian J Sci Res, 2012, 3(1): 113–118. |
| [15] | HETHERTON C L, SYKES M D, FUSSELL R J, et al. A multi-residue screening method for the determination of 73 pesticides and metabolites in fruit and vegetables using high-performance liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2004, 20(18): 2443–2450. |
| [16] | RAINA-FULTON R. Determination of neonicotinoid insecticides and strobilurin fungicides in particle phase atmospheric samples by liquid chromatography-tandem mass spectrometry[J]. J Agric Food Chem, 2015, 63(21): 5152–5162. doi:10.1021/acs.jafc.5b01347 |
| [17] |
王秀国, 闫晓阳, 宋超, 等. QuEChERS/高效液相色谱-串联质谱法测定烟叶与土壤中的壬菌铜残留[J]. 分析测试学报, 2015, 34(1): 91–95.
WANG X G, YAN X Y, SONG C, et al. Determination of cuppric nonyl phenolsulfonate residue in tobacco leaves and soil by QuEChERS/high performance liquid chromatography-tandem mass spectrometry[J]. J Instrumental Anal, 2015, 34(1): 91–95. |
| [18] |
中华人民共和国农业部.农药残留试验准则:NY/T 788-2004[S].北京:中国农业出版社, 2004.
Ministry of Agriculture of the People's Republic of China. Guideline on pesticide residue trials:NY/T 788-2004[S]. Beijing:Chinese Agricultural Press, 2004. |
 2017, Vol. 19
2017, Vol. 19


