稻田杂草不仅与水稻争水、争肥、争光,抑制水稻生长,同时也可传播病虫害,降低水稻品质[1]。化学防除是稻田除草的重要手段,目前适用于水稻田的除草剂主要有丙草胺(pretilachlor)、苄嘧磺隆(bensulfuron methyl) 和丁草胺(butachlor) 等[2-3]。但这些除草剂使用适期和杀草谱均较窄,并且残留期较长、毒性偏高,会影响生态环境和后茬作物生长[4-5]。
五氟磺草胺( Scheme 1 ) 是美国陶氏益农公司开发的一种三唑并嘧啶磺酰胺类除草剂,可有效防除千金子、稗草及其他一些一年生莎草科杂草,其作用机制是抑制乙酰乳酸合成酶(ALS)[6]。五氟磺草胺对鱼类、鸟类、陆生和水生无脊椎动物低毒,对水生植物低毒至中等毒性,但由于其在稻田环境使用频率较高,故可能存在一定的生态和膳食风险[7]。
|
Scheme 1 |
目前,关于五氟磺草胺残留的分析方法主要是采用传统的色谱法,存在检测灵敏度相对较低等不足[8-10]。本研究拟采用超高效液相色谱-质谱联用(UPLC-MS/MS) 建立一套快速、准确、灵敏的检测五氟磺草胺在稻田环境样品中的残留量,并进一步对其消解动态、残留规律和膳食风险进行初步研究,以期为其生态和膳食风险评估提供数据支撑。
1 材料与方法 1.1 主要仪器、药剂与试剂超高效液相色谱-质谱仪(UPLC-MS/MS) 和Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm × 100 mm, 1.7 μm),美国Waters公司;DHZ-DA大型冷冻恒温振荡器,苏州太仓公司;R-210旋转蒸发仪及V-700真空泵,瑞士BUCHI公司。
99.2%五氟磺草胺(penoxsulam) 标准品(国家标准物质中心);0.025%五氟磺草胺颗粒剂(含量经浙江省药检所检定,瑞农植保技术有限公司);N-丙基乙二胺(PSA),美国Welch Materials公司;乙腈为色谱纯;其余试剂均为分析纯。
1.2 田间试验试验于2014-2015年在浙江、福建、黑龙江3地进行,供试药剂为0.025%五氟磺草胺颗粒剂。供试水稻品种分别为秀水09 (浙江)、良引88 (福建)、东农425 (黑龙江)。按照文献[11-12]的要求设计试验小区,每小区面积30 m2,重复3次,各小区间设保护间隔区,并在不同小区间设围埂,以阻止不同小区间田水流动引起的相互影响。另设45 m2仅施用清水的空白对照区。试验均于秧苗移栽后7 d进行。
1.2.1 消解动态试验施药剂量为有效成分含量56.25 g/hm2,施药1次,施药方法为均匀撒施。分别于施药后2 h及1、3、5、7、14、21和28 d采样(2 h,1 d不采植株样品,28 d不采田水样品)。
1.2.2 最终残留试验设37.5 (低剂量) 和56.3 g/hm2 (高剂量) 两个施药剂量,施药1次,施药方法为均匀撒施。分别于水稻成熟时和成熟后7 d采集稻穗样品。
1.3 分析方法 1.3.1 样品的采集与处理田水:在试验小区内随机取10个点,采集水样2~3 L,混匀后留样1 L。
水稻:在试验小区内随机取10个以上点,采集1~2 kg生长正常、无病害的水稻植株,将植株(稻秆) 剪成约0.5 cm的小段,留样250 g;脱壳糙米用粉碎机粉碎后,过40目筛(孔径37 μm),留样250 g。于-18~-20 ℃下保存,备用。
所有田间样本均于采集8 h内处理。
1.3.2 样品提取与净化 1.3.2.1 水稻植株、糙米和土壤准确称取10 g (精确至0.05 g) 水稻植株样品于250 mL锥形瓶中,加入20 mL去离子水,静置10 min,再加入50 mLV (乙腈) :V (1 mol/L盐酸)=9:1提取液,振荡提取30 min,过滤至装有5 g氯化钠的具塞量筒中,剧烈振摇1 min,静置10 min;取上清液30 mL于40 ℃水浴下浓缩氮吹至近干,用乙腈定容至2 mL;加入100 mg PSA和300 mg无水硫酸镁,于10 000 r/min下冷冻离心3 min,过0.22 μm滤膜,待测。
准确称取10 g (精确至0.05 g) 糙米样品(或土壤样品) 于50 mL离心管中,加入20 mLV (乙腈) :V (1 mol/L盐酸)=9:1提取液,静置10 min,加入3 g氯化钠和5 g硫酸镁,漩涡1 min,于4 000 r/min下离心3 min;取上清液10 mL于40 ℃水浴下浓缩氮吹至近干,用乙腈定容至2 mL;加入100 mg PSA和300 mg无水硫酸镁,于10 000 r/min下冷冻离心3 min,过0.22 μm滤膜,待测。
1.3.2.2 田水准确量取100 mL (精确至0.1 mL) 已过滤的田水样品于500 mL分液漏斗中,加入5 g氯化钠溶解,用二氯甲烷萃取2次,每次50 mL;收集全部萃取液,于40 ℃水浴下浓缩氮吹至近干,用乙腈定容至2 mL,过0.22 μm滤膜,待测。
1.3.3 仪器分析条件色谱条件: Waters ACQUITY UPLC BEH C18色谱柱 (2.1 mm × 100 mm, 1.7 μm) 色谱柱,流动相为乙腈-0.1% 甲酸水溶液,流速 0.30 mL/min,采用梯度洗脱 (表 1),柱温 30 ℃,进样体积 5 μL。
|
|
表 1 超高效液相色谱的梯度洗脱条件 Table 1 Gradient elution condition of UPLC |
质谱条件:采用电喷雾离子源ESI (+),多重反应检测(MRM) 模式。毛细管电压3 kV,锥孔电压30 V,离子源温度120 ℃,脱溶剂温度350 ℃,脱溶剂气流量650 L/h,锥孔气流量50 L/h。检测参数见表 2。
|
|
表 2 质谱多重反应检测参数 Table 2 The parameters of multiple reaction monitoring |
1.3.4 标准溶液配制和标准工作曲线绘制
准确称取10.0 mg五氟磺草胺标准品,用10 mL丙酮溶解,配成质量浓度为1 000 mg/L的标准储备液,于-20 ℃下保存。
准确量取1 mL五氟磺草胺标准储备液,用乙腈稀释,配成0.005、0.01、0.05、0.1和0.5 mg/L系列质量浓度的标准溶液,用空白样品(基质) 提取液稀释成不同浓度的系列基质匹配标准溶液。按1.3.3节的条件检测,外标法定量[13]。以进样质量浓度为x轴、响应值为y轴绘制标准工作曲线。
1.4 膳食风险初步评估依照本研究建立的检测方法对糙米样品中五氟磺草胺的残留量进行检测,根据公式(1) 和公式(2)[14]计算风险商值,评估其长期膳食风险。

|
(1) |

|
(2) |
其中,中国规定五氟磺草胺的每日允许摄入量(acceptable daily intake, ADI) 为0.147 mg/kg bw[14];中国在WHO/GEMS (食品膳食数据库) 的所属区域范围内人均每日糙米(归类于谷物和面粉制品) 的摄食量为391.925 g/d[15]。最大残留量以最终残留试验高剂量处理下测得的五氟磺草胺最大残留量计,人体体重按60 kg计。当五氟磺草胺在糙米中的风险商值大于1表示存在不可接受的风险,数值越大,风险越大。当风险商值小于1表示风险可接受,数值越小,风险越小[16]。
2 结果与分析 2.1 检测条件的优化对液相色谱的流动相条件优化时,分别以甲醇-超纯水、乙腈-超纯水、乙腈-0.1%甲酸水溶液作为流动相,并采用梯度洗脱法对标准溶液进行进样分析。发现加入微量酸性溶液不仅有助于改善峰形,并且有助于使待测物离子化,从而提高检测灵敏度。因此,最终选择以乙腈-0.1%甲酸水溶液作为流动相。
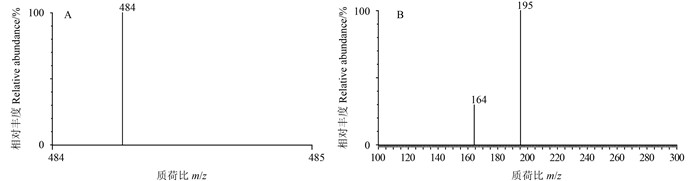
在优化质谱条件时,以流动注射方式注入电喷雾(ESI) 质谱。分别在正、负离子模式下进行母离子全扫描发现正离子模式的响应相对较高,因此选择正离子模式检测。在全扫描模式下,选择强度最高的[M + H]+峰作为基峰,在反应离子监测模式下,选择信号强且稳定的m/z 164、195为定性离子,以信号最强的m/z 195为定量离子。通过调节锥孔电压发现五氟磺草胺在30 eV时响应值最高。在此锥孔电压条件下,通过调节碰撞电压对比发现五氟磺草胺在碰撞电压为35 eV、25 eV时特征子离子碎片丰度达到最大(图 1)。
|
A.母离子质谱图;B.子离子质谱图。 A. Mass spectrum of the parent ion; B. Mass spectrum of the daughter ion. 图 1 五氟磺草胺的母离子和子离子质谱图 Fig. 1 Mass spectrum of parent ion and daughter ion of penoxsulam |
2.2 方法的灵敏度及线性范围
在优化的色谱条件(表 2和图 1) 下,五氟磺草胺的保留时间约为2.97 min,在水稻植株中的检出限(LOD) 为0.002 mg/kg,在糙米、土壤和田水中的LOD均为0.001 mg/kg。五氟磺草胺在水稻植株中的定量限(LOQ) 为0.005 mg/kg,在糙米中的LOQ为0.003 mg/kg,在土壤中的LOQ为0.004 mg/kg,在田水中的LOQ为0.003 mg/L。
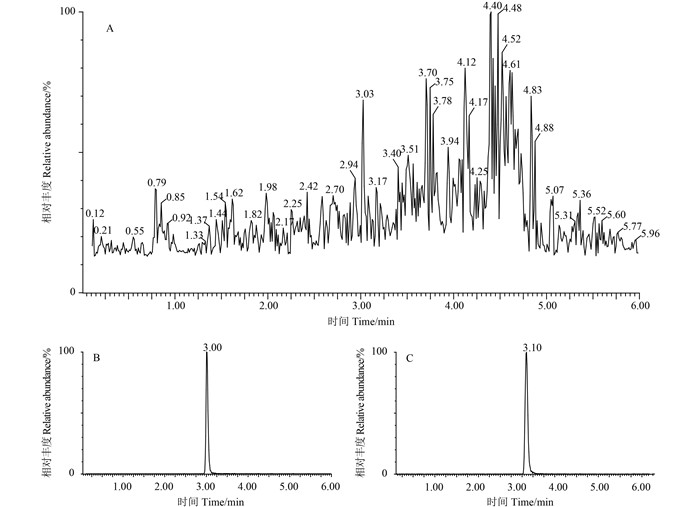
在0.005~0.5 mg/L范围内,五氟磺草胺的质量浓度与对应的峰面积间呈良好的线性关系。在水稻植株中的标准曲线方程为y=11 166x+41.378,在糙米中为y=47 358x -218.31,在土壤中为y=10 203x + 40.398,在田水中为y=46 128x -181.9,相关系数在0.999 3~0.999 7之间。典型色谱图见图 2。
|
A.植株空白;B.五氟磺草胺标准品(0.5 mg/kg);C.植株添加(0.05 mg/kg)。 A. Chromatograms of the blank soil sample; B. Chromatograms of the penoxsulam standards (0.5 mg/kg); C. Chromatogram of recovery of penoxsulam in plant (0.05 mg/kg). 图 2 在样品中添加五氟磺草胺的典型色谱图 Fig. 2 Typical chromatogram of spiked sample |
2.2 方法的准确度及精密度
取植株、糙米、土壤和田水样品,添加系列浓度的五氟磺草胺标准溶液进行回收试验,每浓度处理重复5次。结果(表 3) 显示:在0.005~0.5 mg/L添加水平下,五氟磺草胺的添加回收率及相对标准偏差分别为91%~92%、3.5%~5.9% (植株),92%~97%、4.5%~7.0% (糙米),92%~106%、2.8%~8.5% (土壤) 和89%~92%、3.5%~7.2% (田水)。表明本方法的添加回收准确度和精密度均较好,目标峰响应值较高,且附近未出现杂质峰(图 2),符合规范农药残留试验的要求[11-12]。
|
|
表 3 五氟磺草胺在植株、糙米、土壤和田水中的平均添加回收率和相对标准偏差 Table 3 Average fortified recoveries and RSD of penoxsulam in rice plant, husked rice, paddy soil and water samples |
2.3 五氟磺草胺在稻田中的消解动态
五氟磺草胺在浙江、福建和黑龙江3地植株、土壤和田水中的消解曲线方程、相关系数和消解半衰期见表 4。由表 4可知:五氟磺草胺在水稻植株、土壤和田水中消解规律符合一级动力学方程。其在植株中的消解半衰期为1.5~3.3 d,在土壤中为3.0~4.7 d,在田水中为1.6~3.0 d。该结果表明五氟磺草胺半衰期较短,在植株、土壤和田水中消解较快。
|
|
表 4 五氟磺草胺在植株、土壤和田水中的消解动态 Table 4 The dissipation dynamics of penoxsulami in rice plant, paddy soil and water samples |
2.4 五氟磺草胺在糙米中的最终残留及膳食风险评估
依照本研究所建立的方法,对样品中五氟磺草胺的残留量进行检测,发现以0.025%五氟磺草胺颗粒剂有效成分含量37.5和56.3 g/hm2分别施药1次,于成熟期和成熟后7 d采收,五氟磺草胺在糙米中的残留量均 < 0.005 mg/kg。
五氟磺草胺在中国登记的作物仅有水稻,因此以糙米中最终残留量和中国居民的人均膳食结构对其产生的长期膳食风险进行评估。结果表明:在水稻上施用0.025%五氟磺草胺颗粒剂后,其在在水稻中的估计暴露量为3.27 × 10-5 mg/kg,风险商值为2.22 × 10-4 (远小于1)。当以有效成分含量37.5和56.3 g/hm2分别施药1次时,其膳食风险较低,即对一般消费人群不会产生不可接受的风险。
3 讨论与结论目前,虽然已有通过液相色谱法检测五氟磺草胺残留的分析方法[6, 17-20],但传统色谱技术的最低检测浓度相对较高,无法满足水稻等基质背景较复杂的样品分析。遇璐等[21]利用超高效液相色谱-质谱联用(UPLC-MS/MS) 测定了西兰花中五氟磺草胺的残留量,但在0.005 mg/kg添加水平下的添加回收率仅为33%,刘亚娟等[22]也利用该法建立了五氟磺草胺在稻田土壤和田水中的残留分析方法,最低检测浓度达0.05 mg/kg,但该方法在水稻植株和糙米上的适用性有待于进一步验证。
快速、高灵敏度的分析方法可用于有效监测稻田环境中农药的残留量,同时也是农药生态风险和膳食风险评估的重要组成部分。本研究在前人所建立相关分析方法的基础上,进行了进一步优化后,五氟磺草胺在水稻植株中检出限(LOD) 为0.002 mg/kg,在糙米、土壤和田水中LOD为0.001 mg/kg。在水稻植株中最低检测浓度(LOQ) 为0.005 mg/kg,在糙米中LOQ为0.003 mg/kg,在土壤中LOQ为0.004 mg/kg,在田水中LOQ为0.003 mg/L。平均回收率为89%~106%,相对标准偏差在2.8%~8.5%之间。相比郝瑞辰等[6]在土壤基质中LOQ为0.1 mg/kg,本方法在准确度、精密度和灵敏度上均得到了较明显的提高。笔者进一步研究了五氟磺草胺在稻田中的消解动态。结果表明:其在植株中的消解半衰期为1.5~3.3 d,在土壤中为3.0~4.7 d,在田水中为1.6~3.0 d,属于易降解农药。五氟磺草胺在植株和田水中消解速率快于其在土壤中的消解速率。分析其原因,一是由于颗粒剂的缓释作用造成的[23];二是农药在植株和田水中的降解主要是通过光解作用介导的,而在土壤中则主要通过微生物降解的方式实现[2, 24],这表明光解对于五氟磺草胺的降解作用可能强于土壤微生物的降解作用;此外,由于消解动态试验时期处于水稻秧苗期,淹水条件可能在一定程度上削弱了土壤微生物的呼吸作用[25],从而抑制了其对五氟磺草胺的降解效率。基于此推断,需通过单因子模拟试验进一步明确引起五氟磺草胺在稻田环境中降解的主要生物和非生物因子。
以0.025%五氟磺草胺颗粒剂有效成分含量37.5和56.3 g/hm2分别施药1次,于成熟期和成熟后7 d采收,五氟磺草胺在糙米中的残留量均 < 0.005 mg/kg。在此基础上,结合膳食摄入结构模型分析,对五氟磺草胺的膳食风险进行初步评估,其风险商值为2.22 × 10-4,远小于1。表明按照推荐剂量和次数在稻田中施用0.025%五氟磺草胺颗粒剂,食用成熟期采收的糙米通常不会对一般人群健康产生不可接受的风险。目前,中国尚未制定五氟磺草胺在糙米中的最大残留限量(MRL) 值,本研究结果为制定五氟磺草胺在糙米中的MRL提供了数据支撑。
| [1] |
黄世文, 王玲, 黄雯雯, 等. 水稻重要病虫草害综合防治核心技术[J]. 中国稻米, 2009(2): 55–56.
HUANG S W, WANG L, HUANG W W, et al. Core technology of rice major disease. Pests and weeds integrated management[J]. China Rice, 2009(2): 55–56. |
| [2] |
陆永良, 周勇军, 赵航, 等. 苄·二氯(苄嘧磺隆+二氯喹啉酸)复配依据及其在直播稻田的应用前景[J]. 中国水稻科学, 2005, 19(4): 371–376.
LU Y L, ZHOU Y J, ZHAO H, et al. Compound basis of bensulfuron-methyl and quinclorac and prospect of its application in direct-seeded paddy[J]. Chin J Rice Sci, 2005, 19(4): 371–376. |
| [3] |
周传波, 王三勇, 吉训聪, 等. 苄嘧磺隆·丙草胺颗粒剂防除直播稻田杂草的效果[J]. 杂草科学, 2008(2): 62–64.
ZHOU C B, WANG S Y, JI X C, et al. Weed control with bensulfuron methyl·pretilachlor granule in direct[J]. Weed Sci, 2008(2): 62–64. |
| [4] | TEHRANI A S, DISFANI F A, HEDJAROUD G A, et al. Antagonistic effects of several bacteria on Verticillium dahliae the causal agent of cotton wilt[J]. Meded Rijksuniv Gent Fak Landbouwkd Toegep Biol Wet, 2001, 66(2a): 95–101. |
| [5] |
李社增, 鹿秀云, 马平, 等. 防治棉花黄萎病的生防细菌NCD-2的田间效果评价及其鉴定[J]. 植物病理学报, 2005, 35(5): 451–455.
LI S Z, LU X Y, MA P, et al. Evaluation of biocontrol potential of a bacterial strain NCD-2 against cotton Verticillium wilt in field trials[J]. Acta Phytopathologica Sinica, 2005, 35(5): 451–455. |
| [6] |
郝瑞辰, 梁兵兵, 姚远, 等. 固相萃取-高效液相色谱检测稻田土壤中五氟磺草胺的残留[J]. 农药, 2014, 53(12): 906–908.
HAO R C, LIANG B B, YAO Y, et al. Determination of penoxsulam residues in rice field soil by SPE-HPLC[J]. Agrochemicals, 2014, 53(12): 906–908. |
| [7] |
农业部农药检定所.
农药登记残留田间试验标准操作规程[M]. 北京: 中国标准出版社, 2007.
Institute for the Control of Agrochemicals. Standard operating procedures on pesticide registration residue field trials[M]. Beijing: Standards Press of China, 2007. |
| [8] | KOGAN M, ARAYA M, ALISTER C. Water and sediment dynamics of penoxsulam and molinate in paddy fields:field and lysimeter studies[J]. Pest Manage Sci, 2012, 68(3): 399–403. doi:10.1002/ps.2276 |
| [9] | KAUR P, KAUR K, BHULLAR M S. Quantification of penoxsulam in soil and rice samples by matrix solid phase extraction and liquid-liquid extraction followed by HPLC-UV method[J]. Environ Monit Assess, 2014, 186(11): 7555–7563. doi:10.1007/s10661-014-3947-7 |
| [10] |
张卉, 胡梅, 王骏, 等. 液相色谱-质谱测定蔬菜、水果中四种保鲜剂的残留量[J]. 食品科学, 2009, 30(2): 180–184.
ZHANG H, HU M, WANG J, et al. Determination of antistaling agent residues in vegetables and fruits with high performance liquid chromatography-mass spectrometry[J]. Food Sci, 2009, 30(2): 180–184. |
| [11] |
朱国念.
农药残留快速检测技术[M]. 北京: 化学工业出版社, 2008: 59-61.
ZHU G N. Rapid detection of pesticide residues[M]. Beijing: Chemical Industry Press, 2008: 59-61. |
| [12] |
农业部农药检定所.
农药残留量实用检测方法手册[M]. 北京: 中国农业科技出版社, 1995.
Institute for the Control of Agrochemicals. Handbook of practical methods for the determination of pesticide residues[M]. Beijing: China Agricultural Science and Technology Press, 1995. |
| [13] |
中国农业科学院农业质量标准与检测技术研究.
农产品质量安全风险评估——原理、方法和应用[M]. 北京: 中国标准出版社, 2007.
Institude of Quality Standard and Testing Technology for Agro-products of CAAS. Risk assessment for quality and safety of agro-foods-principles, methodologies and applications[M]. Beijing: Standards Press of China, 2007. |
| [14] |
张丽英, 陶传江.
农药每日允许摄入量手册[M]. 北京: 化学工业出版社, 2015.
ZHANG L Y, TAO C J. Handbook of pesticide acceptable daily intake[M]. Beijing: Chemical Industry Press, 2015. |
| [15] | WHO. Global environment monitoring system (GEMS/Food):food contamination monitoring and assessment programme[R]. Geneva:World Health Organization, 2012. |
| [16] | FU Y, ZHENG Z T, WEI P, et al. Distribution of thifluzamide, fenoxanil and tebuconazole in rice paddy and dietary risk assessment[J]. Toxicol Environ Chem, 2016, 98(1): 118–127. doi:10.1080/02772248.2015.1113288 |
| [17] |
刘敬民, 李万芳, 许霞, 等. 25 g/L五氟磺草胺可分散油悬浮剂的高效液相色谱测定方法[J]. 现代农药, 2015, 14(2): 40–41.
LIU J M, LI W F, XU X, et al. Determination of penoxsulam 25 g/L OD by HPLC[J]. Mod Agrochem, 2015, 14(2): 40–41. |
| [18] |
韩娟, 杨向黎, 周道煌, 等. 五氟磺草胺的高效液相色谱分析[J]. 农药, 2013, 52(9): 664–665.
HAN J, YANG X L, ZHOU D H, et al. Analysis of penoxsulam by HPLC[J]. Agrochemicals, 2013, 52(9): 664–665. |
| [19] |
姜宜飞, 李友顺, 王胜翔. 五氟磺草胺22%悬浮剂高效液相色谱分析方法研究[J]. 农药科学与管理, 2013, 34(7): 40–42.
JIANG Y F, LI Y S, WANG S X. Analytical method of penoxsulam 22% SC by HPLC[J]. Pestic Sci Admin, 2013, 34(7): 40–42. |
| [20] |
于晓萍, 王斌. 除草油悬浮剂中五氟磺草胺和氟胺磺隆含量的HPLC法快速分析[J]. 湖北农业科学, 2015, 54(15): 3751–3753.
YU X P, WANG B. Rapid HPLC analysis method for penoxsulam and triflulsulfuron-methyl content in herbicidal off suspensions[J]. Hubei Agric Sci, 2015, 54(15): 3751–3753. |
| [21] |
遇璐, 孙克, 张敏恒. 五氟磺草胺分析方法述评[J]. 农药, 2013, 52(9): 698–700.
YU L, SUN K, ZHANG M H. A review of analysis methods of penoxsulam[J]. Agrochemicals, 2013, 52(9): 698–700. |
| [22] |
刘亚娟, 侯志广, 梁爽, 等. 22%苄嘧磺隆·五氟磺草胺SC在水稻土壤及稻田水中的残留分析方法[J]. 农药, 2016, 55(4): 284–286.
LIU Y J, HOU Z G, LIANG S, et al. Residue analysis of bensulfuron-methyl and penoxsulam 22% SC in Rice Soil and Field Water[J]. Agrochemicals, 2016, 55(4): 284–286. |
| [23] |
华乃震. 农药剂型的进展和动向(上)[J]. 农药, 2008, 47(2): 79–81.
HUA N Z. Advance and trend of pesticide formulation development[J]. Agrochemicals, 2008, 47(2): 79–81. |
| [24] | CAO M C, LI S Y, WANG Q S, et al. Track of fate and primary metabolism of trifloxystrobin in rice paddy ecosystem[J]. Sci Total Environ, 2015, 518-519: 417–423. doi:10.1016/j.scitotenv.2015.03.028 |
| [25] |
左晓霞, 张赫琼, 曹楚彦, 等. 噻菌茂在稻田土壤中的微生物降解及对土壤细菌种群数量的影响[J]. 农药学学报, 2014, 16(4): 467–471.
ZUO X X, ZHANG H Q, CAO C Y, et al. Microbial dissipation of saijunmao and its impact on soil bacteria populations in paddy soils[J]. Chin J Pestic Sci, 2014, 16(4): 467–471. |
 2017, Vol. 19
2017, Vol. 19


