草莓(Fragaria ananassa Duch) 种植过程中易受多种病菌的感染,例如:由尖孢镰刀菌草莓专化型(Fusarium oxysporum f.sp.fragariae) 引起的草莓枯萎病[1];由灰葡萄孢菌(Botrytis cinerea Pers.) 引起的草莓灰霉病等[2]。
目前,中国针对草莓上的农药残留限量有明确规定的共有37种,而针对浆果类水果共有47种[3]。此外,中国在草莓上登记使用的农药共计13种,除了啶酰菌胺和克菌丹既属于登记使用农药,又有限量值外,其余11种登记使用的农药均无限量值规定;而欧盟、日本等对草莓有限量值规定的农药已超过400种[4],尤其是日本,对无限量值规定的农药均采用统一的0.01 mg/kg限量标准。
自Anastassiades等提出QuEChERS (Quick, Easy, Cheap, Effective, Rugged and Safe) 法[5],并将其应用于蔬菜水果基质中多农残的检测[6-7]以来,该法已被广泛用于不同基质中的多种农药残留检测[8-13]。例如:刘靖靖等[11]采用QuEChERS法实现了草莓中6种植物生长调节剂的快速检测;郭春景等[12]采用QuEChERS法,结合超高效液相色谱-串联质谱仪,实现了草莓中7种农药残留(包括3种植物调节剂) 的定性与定量检测。此外,鲁红等[13]也基于QuEChER法,建立了草莓中4种有机磷农药残留的检测方法。本研究针对草莓种植特点,选择草莓上施用频率较高的21种杀菌剂,结合其基质特点,通过优化传统的QuEChERS法,拟建立气相色谱-串联质谱法测定草莓中21种杀菌剂的分析方法,以期实现草莓中多种常用杀菌剂的快速、高效、准确定性与定量分析。
1 材料与方法 1.1 药剂与试剂螺环菌胺(spiroxamine)、甲霜灵(metalaxyl)、四氟醚唑(tetraconazole)、酞菌酯(nitrothal-isopropyl)嘧菌环胺(cyprodinil)、戊菌唑(penconazole)、氟吡菌酰胺(fluopyram)、氟菌唑(triflumizole)、嘧菌胺(mepanipyrim)、E-苯氧菌胺(E-metominostrobin)、抑霉唑(imazalil)、腈菌唑(myclobutanil)、醚菌酯(kresoxim-methyl)、环氟菌胺(cyflufenamid)、肟菌酯(trifloxystrobin)、丙环唑(propiconazol)、环酰菌胺(fenhexamid)、氟环唑(epoxiconazole)、咪唑菌酮(fenamidone)、啶酰菌胺(boscalid)和嘧菌酯(azoxystrobin)标准品,纯度均 > 97% (德国Dr. Ehrenstorfer公司);分散固相萃取材料:N-丙基乙二胺(primary secondary amine,PSA) 和石墨化碳黑(graphitized carbon blacks,GCB) (德国CNE公司);QuEChERS提取试剂包(4 g无水硫酸镁、1 g氯化钠、1 g含两个结晶水的柠檬酸三钠和0.5 g含1.5个结晶水的柠檬酸二钠,美国Agilent公司);乙腈、正己烷和丙酮均为色谱纯(美国Tedia公司);无水硫酸镁为分析纯。
1.2 仪器与设备GC-MS/MS-TQ8040三重四极杆气相色谱-质谱联用仪(日本岛津公司);WH-3微型涡旋混合仪(上海路西分析仪器厂有限公司);TGL-16LM离心机(湖南星科科学仪器有限公司)。
1.3 供试样品供试草莓品种为‘红颜’,产地为成都市双流区,购自当地草莓生产基地。匀浆后,于-4 ℃保存,备用。
1.4 样品前处理 1.4.1 样品的提取与净化准确称取已匀浆的草莓样品10.0 g (精确至0.01 g) 于50 mL离心管中,分别加入20 mL乙腈、QuEChERS提取试剂包,涡旋振荡1 min,于6 000 r/min下离心10 min;准确移取6 mL上清液于10 mL离心管中(预先装有450 mg PSA,5 mg GCB和750 mg无水硫酸镁),涡旋振荡1 min,于6 000 r/min下离心10 min;准确移取2 mL上清液,用氮气吹至近干,加入1.0 mLV (正己烷):V (丙酮)=9 : 1的混合溶液,待测。
1.4.2 PSA用量优化试验21种杀菌剂在0.10 mg/kg添加水平下,分别考察了PSA和GCB用量对其净化效果的影响。其中PSA用量分别为25、50、75、100和125 mg/mL (不添加GCB),GCB用量分别为5、10、15、20和25 mg/mL (均添加PSA 75 mg/mL)。重复5次,结果用标准品校准。
1.4.3 检测条件质谱条件:电子轰击(EI) 离子源;电子能量70 eV;传输线温度300 ℃;离子源温度230 ℃;溶剂延迟6 min;碰撞气为氩气;多反应检测模式(multiple reaction monitoring, MRM),二级质谱分析条件见表 1。
|
|
表 1 21种杀菌剂串联质谱多反应监测模式下的检测条件 Table 1 Multiple reaction monitoring conditions for the determination of 21 fungicides using GC-MS/MS |
1.4.4 标准溶液的配制及标准曲线的绘制
混合农药标准储备液的配制:分别准确量取1.0 mL标准储备液于100 mL容量瓶中,用丙酮稀释并定容,配成质量浓度为10.0 mg/L的混合农药标准储备液,于-18 ℃下保存,备用。
基质匹配标准溶液的配制:取匀浆后的草莓空白样品,按1.4.1节的条件处理,定容,作为空白基质溶液。用基质空白溶液稀释混合农药标准储备液,分别配成质量浓度为0.005、0.01、0.025、0.05、0.1和0.2 mg/L的标准工作溶液。
外标法定量。以标准溶液中待测农药的峰面积为纵坐标,对应的质量浓度为横坐标绘制标准曲线。
2 结果与讨论QuEChERS法的提取方法主要有3种:一是不加缓冲盐,只添加氯化钠和无水硫酸镁方法;二是采用醋酸缓冲体系的AOAC法;三是采用柠檬酸缓冲体系的欧盟方法。Lehotay等的研究结果表明,采用上述3种方法得到的提取液性质相差不大,但采用缓冲体系,对某些pH敏感农药的提取效率有所改善,醋酸缓冲体系下,提取液的pH值约为4.8,而柠檬酸缓冲体系下的pH值以5~5.5为宜[14]。因此,本研究在提取过程中采用了柠檬酸缓冲体系。此外,在前处理过程中,对净化液进行了浓缩,以提高检测灵敏度。
2.1 分散固相萃取净化方法的优化草莓基质中含有较高的糖分和果胶,这些成分容易富集在进样口、衬管和色谱柱前端,导致灵敏度下降和基质效应增强,从而对目标农药的响应值造成负面影响。QuEChERS方法中最常用的吸附剂有PSA、C18和GCB[15-16]。其中,PSA主要通过离子交换过程,吸附基质中的糖类、脂肪酸和甾醇等含有多个羟基的化合物;C18主要用于吸附基质中的非极性化合物,如脂肪、挥发油和脂溶性维生素等;GCB则对色素具有较强的吸附能力[17-18]。基于草莓基质的主要干扰成分,本研究选择PSA和GCB作为分散固相萃取净化过程的吸附剂。首先,通过考察不同PSA用量对待测杀菌剂准确度和精密度的影响,优化了PSA用量。图 1a为21种杀菌剂的回收率随着PSA用量逐步增加而变化。结果(图 1) 表明:随着PSA用量的增加,21种杀菌剂回收率的相对标准偏差(RSD) (n=5) 都有不同程度的增加。其中,螺环菌胺、醚菌酯、环酰菌胺和啶酰菌胺的回收率受PSA用量的影响较大,其在PSA不同用量下回收率的RSD大于10%。这表明PSA用量的增加会造成杀菌剂的精密度降低。最终,基于回收率和RSD,选择以75 mg/mL作为分散固相萃取净化过程中PSA的用量。
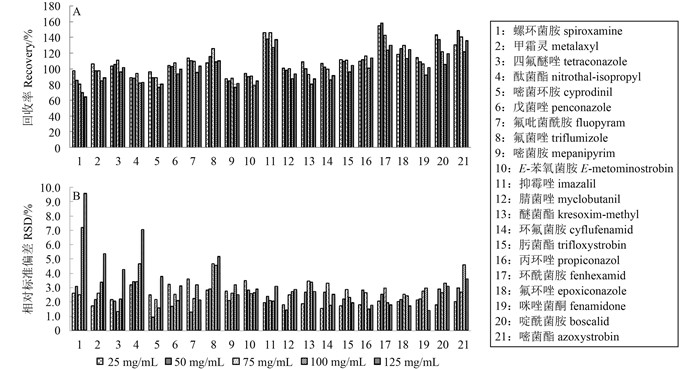
|
图 1 不同PSA用量下21种杀菌剂的回收率(A) 和相对标准偏差(B) (n=5) Fig. 1 Recoveries (A) and RSDs (B) of 21 fungicides purified with different amount of PSA |
结果(图 2) 表明:随着GCB用量的增加,大部分目标农药的RSD也不断增大。此外,随着GCB用量的增加,净化液逐渐由深橘红色变为淡红色,说明GCB有效去除了基质中色素类物质。螺环菌胺、嘧菌环胺和嘧菌胺的回收率对GCB用量较为敏感;而环酰菌胺回收率的RSD有明显增加;基于GCB用量和目标农药回收率及RSD试验结果,结合GCB的去色素能力,最终选择以5 mg/mL作为草莓中杀菌剂检测中GCB的净化用量。
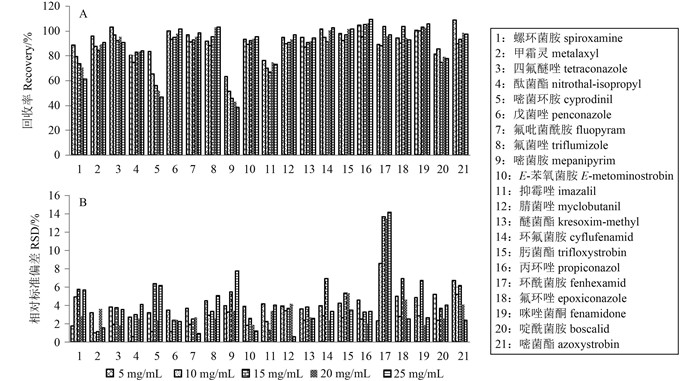
|
图 2 不同GCB用量下21种杀菌剂的回收率(A) 和相对标准偏差(B) (n=5) Fig. 2 Recoveries (A) and RSDs (B) of 21 fungicides purified with different amount of GCB |
2.2 检测条件的优化
待测的21种杀菌剂根据其化学结构分类,主要为酰胺类杀菌剂和杂环类杀菌剂。首先通过母离子全扫描谱图选择分子离子峰或峰度较高的特征碎片峰作为母离子。随后锁定母离子,获得子离子全扫描谱图,选择峰度较高的合理断裂碎片离子作为子离子。最后通过MRM,确定各农药的离子对的最佳碰撞能量(表 1)。图 3为草莓中MRM模式下21种杀菌剂(0.100 mg/L) 的选择离子对色谱图。
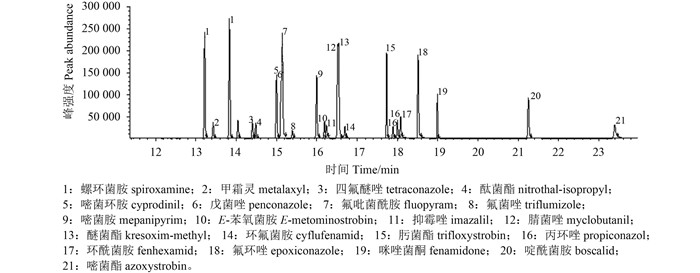
|
图 3 草莓中21种杀菌剂在多反应监测模式扫描下的色谱图(0.10 mg/kg) Fig. 3 Ion chromatogram of 21 fungicides (0.10 mg/kg) using MRM mode in strawberry |
2.3 方法的线性范围和定量限
结果表明:在0.005~0.2 mg/kg内,21种杀菌剂的质量浓度与对应的峰面积间呈良好线性关系,相关系数均大于0.99。依照欧盟标准333/2007[19],以10倍信噪比(S/N=10) 计算方法定量限,当计算得到的LOQs低于最低校准点时(即0.005 mg/L),LOQs即为0.005 mg/L, 对应于0.005 mg/kg;依次类推,LOQs均设定为高于该值的临近校准点。21种杀菌剂的LOQs见表 2。
|
|
表 2 21种杀菌剂的线性回归方程、相关系数和定量限 Table 2 Linear regression equations, correlation coefficients and detection limits of 21 fungicides |
2.4 方法的准确度和精密度
结果(表 3) 表明:在0.01、0.05和0.1 mg/kg 3个添加水平下,21种杀菌剂的回收率在70%~122%之间,相对标准偏差在1.9%~17.6%之间。
|
|
表 3 21种杀菌剂的添加回收率和相对标准偏差(n=5) Table 3 Recoveries and RSDs of 21 fungicides (n=5) |
3 实际样品的检测
采用本研究建立的杀菌剂分析方法,对市场上随机抽取的40份草莓样品进行分析,21种杀菌剂中共检出9种,检出率分别为:啶酰菌胺(23.6%)、醚菌酯(16.2%)、嘧菌环胺(11.8%)、腈菌唑(11.2%)、嘧菌酯(%)、肟菌酯(4.6%)、戊菌唑(4.0%)、甲霜灵(2.2%) 和丙环唑(0.8%)。GB 2763-2014[3]中对草莓有限量值规定的农药共计37种,对浆果类水果有限量值规定的农药共计47种。本方法筛查的21种杀菌剂,除啶酰菌胺、醚菌酯、嘧菌环胺、腈菌唑、戊菌唑、环酰菌胺和抑霉唑外,其余杀菌剂均无限量值规定。按照GB 2763-2014判定,啶酰菌胺超标样品1份,超标率为2.5%,戊菌唑超标样品2份,超标率为5.0%。检测结果表明,草莓中杀菌剂残留现象较为普遍。
4 结论本研究在QuEChERS方法的基础上,首先通过优化PSA和GCB的用量,建立了DSPE净化方式;随后采用串联四极杆质谱进行测定,保证了定性结果的准确性。通过考察该方法的性能参数表明,其线性范围、检测限、平均添加回收率及其相对标准偏差等指标均满足草莓中痕量杀菌剂残留的分析要求,该方法适合于草莓中杀菌剂的快速、准确定性与定量分析。
| [1] |
顾春波, 史晓斌, 姜莉莉, 等. 草莓枯萎病菌对多菌灵的抗性及其抗性菌株生物学特性[J]. 植物保护学报, 2010, 37(3): 266–272.
GU C B, SHI X B, JIANG L L, et al. Resistance of Fusarium oxysporum f. sp. fragariae to carbendazim and the biological characters of carbendazim-resistant strain[J]. Acta Phytophylacica Sinica, 2010, 37(3): 266–272. |
| [2] | NORMAN C. EPA sets new policy on pesticides cancer risks[J]. Science, 1988, 242(4877): 366–367. doi:10.1126/science.3175656 |
| [3] |
食品中农药最大残留限量:GB 2763-2014[S].北京:中国农业出版社, 2014.
National food safety standard-maximum residue limits for pesticides in food:GB 2763-2014[S]. Beijing:China Agriculture Press, 2014. |
| [4] | Regulation (Ec) No 396/2005 of the European parliament and of the council[S]. EU, Brussels, 2005. https://www.fsai.ie/uploadedFiles/Legislation/Food_Legisation_Links/Pesticides_Residues_in_food/Regulation_EC_No_396_2005.pdf |
| [5] | ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412–431. |
| [6] | LEHOTAY S J, de KOK A, HIEMSTRA M, et al. Validation of a fast and easy method for the determination of residues from 229 pesticides in fruits and vegetables using gas and liquid chromatography and mass spectrometric detection[J]. J AOAC Int, 2005, 88(2): 595–614. |
| [7] | LEHOTAY S J, MASTOVSKÁ K, LIGHTFIELD A R. Use of buffering and other means to improve results of problematic pesticides in a fast and easy method for residue analysis of fruits and vegetables[J]. J AOAC Int, 2005, 88(2): 615–629. |
| [8] | LEHOTAY S J, MASTOVSKÁ K, YUN S J. Evaluation of two fast and easy methods for pesticide residue analysis in fatty food matrixes[J]. J AOAC Int, 2005, 88(2): 630–638. |
| [9] |
陈晓水, 边照阳, 杨飞, 等. 对比3种不同的QuEChERS前处理方式在气相色谱-串联质谱检测分析烟草中上百种农药残留中的应用[J]. 色谱, 2013, 31(11): 1116–1128.
CHEN X S, BIAN Z Y, YANG F, et al. Comparison of three different QuEChERS sample treatment methods in the analysis of more than one hundred pesticide residues in tobacco by gas chromatography-tandem mass spectrometry[J]. Chin J Chromatogr, 2013, 31(11): 1116–1128. doi:10.3724/SP.J.1123.2013.03044 |
| [10] |
周勇, 王彦辉, 周小毛, 等. QuEChERS-气相色谱法检测苎麻及其土壤中8种有机磷农药残留[J]. 农药学学报, 2013, 15(2): 217–222.
ZHOU Y, WANG Y H, ZHOU X M, et al. Determination of 8 organophosphorus pesticide residues in ramie and soil by QuEChERS-gas chromatography[J]. Chin J Pestic Sci, 2013, 15(2): 217–222. |
| [11] |
刘靖靖, 宫萍, 张晓梅, 等. 液相色谱-四极杆飞行时间质谱法快速测定草莓中6种植物生长调节剂的残留量[J]. 色谱, 2012, 30(10): 1012–1016.
LIU J J, GONG P, ZHANG X M, et al. Determination of six plant growth regulator residues in strawberry by liquid chromatography-quadrupole time of flight mass spectrometry[J]. Chin J Chromatogr, 2012, 30(10): 1012–1016. |
| [12] |
郭春景, 王建忠, 郝晓莉. 利用QuEChERS-UPLC-MS/MS法测定甘蓝、草莓中7种农药残留的实验条件优化探索[J]. 质谱学报, 2013, 34(2): 121–127.
GUO C J, WANG J Z, HAO X L. The condition optimization determination of multi-residue of pesticides in cabbage and strawberry by QuEChERS-UPLC-MS/MS[J]. J Chin Mass Spectrom Soc, 2013, 34(2): 121–127. |
| [13] |
鲁红, 吴国杰, 梁世强, 等. MSPD/UPLC-TOFMS法测定草莓中4种有机磷农药残留[J]. 农药, 2012, 51(5): 360–363.
LU H, WU G J, LIANG S Q, et al. Determination of 4 pesticide residues in strawberry using MSPD/UPLC-TOFMS[J]. Agrochemicals, 2012, 51(5): 360–363. |
| [14] | LEHOTAY S J, SON K A, KWON H, et al. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables[J]. J Chromatogr A, 2010, 1217(16): 2548–2560. doi:10.1016/j.chroma.2010.01.044 |
| [15] | KOESUKWIWAT U, LEHOTAY S J, LEEPIPATPIBOON N. Fast, low-pressure gas chromatography triple quadrupole tandem mass spectrometry for analysis of 150 pesticide residues in fruits and vegetables[J]. J Chromatogr A, 2011, 1218(39): 7039–7050. doi:10.1016/j.chroma.2011.07.094 |
| [16] | LEE S W, CHOI J H, CHO S K, et al. Development of a new QuEChERS method based on dry ice for the determination of 168 pesticides in paprika using tandem mass spectrometry[J]. J Chromatogr A, 2011, 1218(28): 4366–4377. doi:10.1016/j.chroma.2011.05.021 |
| [17] | LAMBROPOULOU D A, ALBANIS T A. Methods of sample preparation for determination of pesticide residues in food matrices by chromatography-mass spectrometry-based techniques:a review[J]. Anal Bioanal Chem, 2007, 389(6): 1663–1683. doi:10.1007/s00216-007-1348-2 |
| [18] | KOESUKWIWAT U, SANGUANKAEW K, LEEPIPATPIBOON N. Rapid determination of phenoxy acid residues in rice by modified QuEChERS extraction and liquid chromatography-tandem mass spectrometry[J]. Anal Chim Acta, 2008, 626(1): 10–20. doi:10.1016/j.aca.2008.07.034 |
| [19] | Official Journal of the European Union:333/2007[S]. EU, Brussels, 2007. |
 2017, Vol. 19
2017, Vol. 19

