2. 湖南农业大学 植物保护学院, 长沙 410128
2. College of Plant Protection, Hunan Agricultural University, Changsha 410128, China
有机磷农药(organophosphorus pesticides, OPs) 多为磷酸酯类或硫代磷酸酯类化合物,具有品种繁多、药效强和杀虫谱广等特点[1],20世纪70 -80年代,该类药物被广泛用于农业生产中的病虫害防治,后因其毒性高被大量禁用[2-6]。其中,对硫磷、甲基对硫磷在中国已全面禁用[7],杀螟硫磷已在欧盟和澳大利亚禁用[8-9]。随着生活水平的提高及环保意识的增强,人们对农药残留问题愈加重视,建立并完善农药残留的检测及监督机制的需求与日俱增[10]。
有机磷农药残留分析方法主要包括:高效液相色谱法(high performance liquid chromatography, HPLC)[11]、气相色谱法(gas chromatography, GC)[12]、气相色谱-串联质谱法(gas chromatography-tandem mass spectrometry, GC-MS/MS)[13],这些分析方法因具有高效、灵敏和准确等特点被广泛应用,但对设备和技术要求较高,且样品前处理过程复杂,不适用于大范围的快速筛选。而免疫分析方法因其在灵敏度、特异性、操作步骤和材料价格上的优势,适用于快速筛选及检测,已逐渐成为一种重要的农药残留检测手段[14]。其中酶联免疫分析(enzyme-linked immunoassay, ELISA) 和化学发光酶联免疫分析(chemiluminescence enzyme immunoassay, CLEIA) 已在临床诊断、农(兽) 药残留、环境检测、食品安全和药物分析等领域得到应用[15-19]。
随着农药残留快速检测手段的迅速更新,为提高检测效率,适应实际生产需要,农药多残留检测越来越成为免疫快速检测领域的最大挑战和机遇[20]。关于有机磷农药多残留免疫分析的报道,主要以ELISA方法为主[21-27],其中以多克隆抗体(polyclonal antibody, PAb) 居多[21-23],也有部分单克隆抗体(monoclonal antibody, MAb)[24-27]。在实际样品检测中,因使用的抗体宽谱性不强,或对不同分析物的检测灵敏度不同,从而对各种农药的识别灵敏度差异较大[21-28],给农药的定性和定量分析带来困难。因此,在尽可能检测多种有机磷农药的同时,进一步提高其检测灵敏度,是实现高灵敏度多残留检测亟需解决的问题。王春梅等[25]在研究中指出,免疫半抗原和竞争半抗原结构不同的异源免疫分析方法不仅能最大限量地获得杂交瘤细胞株,筛选出宽谱型抗体,而且能进一步提高检测灵敏度。
本研究在前期采用异源ELISA筛选杂交瘤细胞,获得对多种有机磷农药亲和力较高且相近的宽谱抗体的基础上,利用鲁米诺在辣根过氧化物酶催化下产生化学发光,分别建立了直接竞争和间接竞争的CLEIA法,并通过优化方法的理化参数,对2种模式关于对硫磷、甲基对硫磷和杀螟硫磷的检测能力进行了比较,以期为检测多种有机磷农药残留提供更加简便快速、经济有效的检测方法和技术,为后期商品化免疫快速检测试剂盒以及流动层析免疫分析方法提供技术依据。
1 材料与方法 1.1 仪器与试剂UV-2550紫外-可见分光光度计(日本岛津公司);SpectraMax@i3多功能酶标仪(美国Molecular Devices公司);SpectraMaxL化学发光读板仪(美国Molecular Devices公司);HW2096酶标仪洗板机(华科瑞技术有限公司);96孔聚苯乙烯白板和黑板(美国Costar公司);HWS型智能恒温恒湿箱(江南仪器厂)。
99.7%对硫磷(parathion)、99.1%甲基对硫磷(parathion-methyl) 和99.0%杀螟硫磷(fenitrothion) 标准品(浙江省农药鉴定所,图式 1);经辣根过氧化物酶(horseradish peroxidase, HRP) 标记的羊抗鼠IgG抗体(北京博奥生物技术有限公司);邻苯二胺(o-phenylenediamine, OPD, 中国五联化工厂);30% H2O2 (浙江临安兰岭化工厂);辣根过氧化物酶化学发光底物超稳定型A液和B液(北京科跃中楷生物技术有限公司);免疫用半抗原、竞争半抗原、酶标半抗原、单克隆抗体(实验室自制)[30];其他化学试剂均为市售分析纯。

|
图式 1 两种半抗原、对硫磷及类似物的化学结构 Scheme1 Chemical structures of the two haptens used in the immunoassay, parathion and the similar analytes |
1.2 溶液的配制
包被缓冲液:碳酸盐缓冲液(carbonate buffered saline, CBS, 0.05 mol/L, pH 9.6);常规液:磷酸盐缓冲液(phosphate buffered saline, PBS, 0.01 mol/L, pH 7.4);封闭液:含质量分数为2%脱脂奶粉的PBS缓冲液;洗涤液:含0.05% Tween-20的PBS缓冲液;竞争反应缓冲液:磷酸盐缓冲液(phosphate buffer, PB, 0.1 mol/L, pH 8.5);酶标二抗缓冲液:质量分数为2%脱脂奶粉的PBS缓冲液;显色液:邻苯二钠(无水Na2HPO4 7.36 g, 柠檬酸5.16 g, 双蒸水定容至1 L);ELISA终止液:2 mol/L硫酸水溶液。
1.3 宽谱单克隆抗体的特异性分析采用兰美静等[29]筛选出的细胞株7B2进行小鼠腹水的制备与纯化,获得了能同时识别对硫磷、甲基对硫磷和杀螟硫磷的宽谱单克隆抗体。对该单克隆抗体采用间接竞争ELISA法进行特异性鉴定,采用之前筛选出的最佳异源包被抗原PA0304-OVA,在最佳抗原、抗体工作浓度下,使用酶标仪测定各孔在490 nm处的吸光值,即OD490 nm。以农药质量浓度为横坐标、抑制率为纵坐标,建立四参数logistic曲线,求出抑制率为50%时的农药质量浓度(抑制中浓度,IC50) 和抑制率为20%的农药质量浓度(IC20),根据公式(1) 计算各农药间的交叉反应率(cross reactivity, CR)。
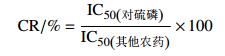
|
(1) |
2) 封闭:加入封闭液300 μL/孔,于37 ℃下温育1 h,洗涤;
3) 竞争反应:同时加入不同梯度稀释的农药标准溶液和缓冲液稀释的抗体溶液(PA-QA1-7B2) 各50 μL,振荡混匀1 min,于37 ℃下温育1 h,洗涤;
4) 加酶反应:加入缓冲液稀释的羊抗鼠IgG-HRP,100 μL/孔,于37 ℃下温育1 h,洗涤;
5) 添加底物:分别取化学发光底物A液和B液(体积比1:1),于避光、室温条件下静置20 min,混匀,按150 μL/孔的量添加;
6) 发光值检测:添加底物后,用化学发光读板仪SpectraMaxL测定425 nm处的发光值(RLU)。
1.4.2 直接竞争化学发光酶联免疫分析方法(dc-CLEIA)2) 封闭:加入封闭液300 μL/孔,于37 ℃下温育1 h,洗涤;
3) 竞争反应:同时加入不同梯度稀释的农药标准溶液和用缓冲液稀释的酶标半抗原溶液各50 μL,振荡混匀1 min,于37 ℃下温育1 h,洗涤;
4) 添加底物:分别取化学发光底物A液和B液(体积比1:1),于避光、室温条件下静置20 min,混匀,按120 μL/孔的量添加;
5) 发光值检测:添加底物后,用化学发光读板仪SpectraMaxL测定425 nm处的发光值(RLU)。
1.4.3 影响2种CLEIA检测性能的因素及其优化按照CLEIA操作步骤,固定单一变量,分别评价抗原工作浓度、抗体稀释倍数、缓冲体系中甲醇的体积分数、pH值以及离子强度等因素对方法检测性能的影响。以最大发光值、信噪比、IC50值以及RLUmax/IC50比值作为优化方案中的评价标准,选择最佳理化参数。
1.4.3.1 工作浓度优化在ic-CLEIA中,用CBS和PBS缓冲液分别将包被抗原、抗体倍比稀释;在dc-CLEIA中,用CBS和PBS缓冲液分别将包被抗体、酶标半抗原倍比稀释。在正交反应条件下,测定不同工作浓度下的方法灵敏度,选择最合适的工作浓度。
1.4.3.2 有机溶剂种类及含量优化分别用含甲醇体积分数为5%、10%、20%和30%的PBS溶液稀释农药标准溶液,建立CLEIA曲线,比较不同甲醇含量对CLEIA方法的影响。
1.4.3.3 pH值优化用pH值为6.5~9.2的PB缓冲液和pH值为7.4的PBS缓冲液稀释抗体或酶标半抗原,建立不同pH值下的曲线,考察缓冲体系中不同pH值对方法的影响。
1.4.3.4 离子强度优化分别用离子强度为0.01、0.05和1 mol/L的反应缓冲液稀释抗体或酶标半抗原,建立不同离子强度下的曲线,比较不同离子强度对方法的影响。
1.4.4 CLEIA标准曲线的建立在最佳优化条件下,运用Origin Pro 9.0软件,绘制对硫磷、甲基对硫磷和杀螟硫磷ic-CLEIA及dc-CLEIA方法的标准曲线,分别拟合线性方程。其中,横坐标取分析物质量浓度的对数值,纵坐标为对应的抑制率。按公式(2) 计算抑制率(I)。

|
(2) |
(2) 式中,RLUmax为不含分析物时的响应值,RLUx为标准溶液为x时的响应值,RLUmin为空白对照组的响应值。
运用Microsoft Office Excel 2010软件线性拟合标准曲线方程,拟合方程为y=aln (x) + b,根据方程确定线性范围并计算IC50值。
1.5 实际样品应用 1.5.1 样品前处理2) 糙米:称取5 g样品,加入10 mL去离子水浸润30 min,其余步骤与新鲜水果及蔬菜相同。
1.5.2 基质效应影响取空白样品按1.5.1节方法处理,经氮气吹干后用含体积分数10%甲醇的PB缓冲液分别稀释至目标倍数,得到一系列含不同浓度基质的缓冲液,按浓度梯度配制成标准溶液,分别建立标准曲线,考察不同浓度的基质对优化后ic-CLEIA和dc-CLEIA方法的影响,选择对方法性能影响最小的稀释倍数。
1.5.3 样品添加回收试验在空白样品中分别添加2种不同浓度的对硫磷、甲基对硫磷和杀螟硫磷农药标准溶液,按前处理方法处理样品后进行CLEIA检测,按照标准曲线计算实际农药含量及回收率。
2 结果与分析 2.1 宽谱单克隆抗体的特异性分析兰美静等[29]采用异源包被抗原icELISA法,筛选出7B2细胞株,其分泌的单克隆抗体能同时识别对硫磷、甲基对硫磷和杀螟硫磷。采用该7B2单克隆抗体的间接竞争ELISA法检测甲基对硫磷(IC50为11.90 μg/kg) 和杀螟硫磷(IC50为7.30 μg/kg) 的灵敏度高于对硫磷(IC50为26.20 μg/kg) (表 1)。虽然采用对硫磷的衍生物PA0204作为免疫半抗原,筛选获得的单克隆抗体特性不一,特别是对甲基对硫磷和杀螟硫磷表现出更高的亲和力,但基于该单克隆抗体的ELISA法对对硫磷的检测灵敏度未能满足该药的MRL值要求(0.01 mg/kg)[30],因此本研究以对硫磷为优先测试分析物,建立并优化CLEIA法,以期进一步提高检测灵敏度。
|
|
表 1 宽谱特异性抗体7B2对3种农药的交叉反应率 Table 1 Cross reactivity of the broad-specific antibody 7B2 toward the three pesticides |
2.2 CLEIA方法理化参数的优化 2.2.1 工作浓度
采用棋盘滴定法[31],筛选间接竞争法中的包被抗原和抗体及直接竞争法中的包被抗体和酶标半抗原的最佳组合浓度。选择信号值RLUmax值大于500 000、RLUmax/IC50比值高、信噪比S/N接近100、对农药抑制效果明显且用量少的组合。最终,间接竞争法选用1 μg/mL的包被抗原,0.625 μg/mL的抗体。直接竞争法选用2 μg/mL的包被抗体,0.078 μg/mL的酶标半抗原。
2.2.2 有机溶剂含量大多数有机磷农药为疏水性化合物,在水中溶解度较差,而在缓冲溶液中加入适量有机溶剂则有助于农药的溶解,但溶剂含量过高会影响抗原抗体反应[32-33]。本研究分别配制含体积分数为5%、10%、20%和30%甲醇的PBS缓冲液用于稀释标准溶液,比较不同甲醇含量对CLEIA方法的影响。结果(图 1) 表明:在ic-CLEIA中,随甲醇含量升高,最大发光值RLUmax和IC50均呈下降趋势,表明方法的灵敏度逐渐升高。而两者比值则呈先升后降再升的趋势,当甲醇的体积分数为10%时,达最高值,为6.11 × 104;当体积分数为20%时,达最低值,为5.49 × 104。在dc-CLEIA中,当甲醇体积分数为10%时,IC50达最小值,为4.58 μg/kg,RLUmax/IC50达最高值,为1.43 × 105。因此,在保证农药溶解度、最大信号值和检测灵敏度的条件下,2种CLEIA方法均选择含10%甲醇的PBS缓冲液用于配制农药标准溶液。

|
图 1 PBS缓冲液中不同甲醇含量对CLEIA的影响 Fig. 1 Effect of methanol on CLEIA performance |
2.2.3 缓冲液pH值和离子强度
考察了5个不同pH值的PB缓冲液对CLEIA表现性能和灵敏度的影响,并与实验室常用PBS缓冲液(0.01 mol/L, pH 7.4) 进行对比。结果(图 2) 表明:在ic-CLEIA中,pH值在6.5~8.5范围内,IC50值随pH值增大而减小。而当pH值超过8.5时,IC50值则随pH增大而增大,当pH值为8.5时,RLUmax/IC50达最高值,为3.27 × 104;在dc-CLEIA中,pH值、IC50和RLUmax/IC50比值均表现出与ic-CLEIA类似的趋势,同样当pH值为8.5时,RLUmax/IC50值达最高值,为7.54 × 104。

|
图 2 不同pH值的PB缓冲液对CLEIA的影响 Fig. 2 Effect of pH (PB) on CLEIA performance |
在pH值为8.5的PB缓冲液条件下研究了离子强度对CLEIA方法的影响,结果(表 2) 表明:在ic-CLEIA中,随离子强度的增大,IC50值减小、RLUmax/IC50值增大;在dc-CLEIA中,方法性能表现与ic-CLEIA的趋势类似,当离子强度为0.1 mol/L时,灵敏度达最高值,为4.54 μg/kg。综上,选择0.1 mol/L、pH 8.5的PB缓冲液作为反应缓冲液。
|
|
表 2 反应缓冲液中离子强度对CLEIA的影响 Table 2 Effects of ionic strength in reaction buffers on CLEIA performances |
ic-CLEIA法最终优化条件为:包被抗原2 μg/mL,抗体0.3125 μg/mL,甲醇体积分数10%,反应缓冲液为PB,pH值8.5,离子强度0.1 mol/L。
dc-CLEIA法最终优化条件为:包被抗体2 μg/mL,酶标半抗原0.078 μg/mL,甲醇体积分数10%,反应缓冲液为PB,pH值8.5,离子强度0.1 mol/L。
2.3 dc-CLEIA和ic-CLEIA与ELISA方法的比较dc-CLEIA和ic-CLEIA优化后的结果见表 3和表 4。ic-CLEIA方法优化后与所建立的宽谱特异性抗体的ELISA方法相比,均具有较高的灵敏度,且对对硫磷、甲基对硫磷和杀螟硫磷的灵敏度相近。其中dc-CLEIA法在材料用量(除了抗体)、操作步骤和反应时间上均优于ic-CLEIA,更适合开发成速测试剂盒产品。此外,所建立的2种方法对甲基对硫磷和杀螟硫磷的检测灵敏度(IC50) 较相似,且交叉反应率高,而对于其他常用有机磷农药的交叉反应率均小于 < 1%。
|
|
表 3 ic-CLEIA和dc-CLEIA方法理化参数比较 Table 3 Physical and chemical parameters of ic-CLEIA and dc-CLEIA |
|
|
表 4 CLEIA法对有机磷农药的IC50及交叉反应率 Table 4 IC50 and cross reactivity of CLEIA against organophosphorus pesticides |
目前,针对有机磷农药多残留分析已建立了多种ELISA方法,而CLEIA方法则建立得较少(表 5)。其中,单克隆抗体较多克隆抗体具有更高的灵敏度和检测范围,在实际应用中更为广泛:Liang等[21]基于宽谱特异性多克隆抗体,建立了检测马拉松等8种有机磷农药的icELISA方法,IC50范围为30.1~788.9 μg/kg;王春梅[25]基于宽谱特异性单克隆抗体的ELISA方法,可同时检测对硫磷等4种有机磷农药,IC50值为20.32~42.15 μg/kg;Shim等[26]基于单克隆抗体和多克隆抗体建立了ELISA方法,并在研究中发现,单克隆抗体除具有可无限繁殖的特性外,在提高方法特异性上也具有一定优势。目前,已建立的ELISA竞争法主要包括icELISA和dcELISA,2种方法在实际应用中各具优势,并已得到广泛应用。而近年来新兴的CLEIA法,反应中受发光底物激发酶类标记物产生化学发光,相比于传统的检测光吸收型信号的ELISA法,具有更高的灵敏度[34]。CLEIA法在农药多残留中的应用报道较少,邓浩等基于多克隆抗体,建立了检测对硫磷的CLEIA分析方法,虽然灵敏度高但未能实现同时检测其他有机磷农药[35]。本研究所建立的ic-CLEIA和dc-CLEIA方法,可同时检测对硫磷、甲基对硫磷和杀螟硫磷,在理化参数及检测性能上表现相似,其平均灵敏度高于表 5中所列的相关报道,而且该单克隆抗体对甲基对硫磷(CR≥242.17%)、杀螟硫磷(CR≥212.60%) 均有较高的亲和性。
|
|
表 5 有机磷农药多残留检测的ELISA、CLEIA分析方法比较 Table 5 ELISAs and CLEIAs for multi-residue detection of organophosphorus pesticide |
2.4 实际样品检测
根据检测需要,选取苹果、白菜和糙米作为检测样品,同时基于方法优化结果,选择材料用量、操作步骤和反应时间较少的dc-CLEIA方法进行实际样品检测。结果发现:以10%甲醇作溶剂,苹果和白菜按体积比1:10稀释、糙米按1:20稀释时,对方法性能的干扰可以忽略。故在前处理方法中,取1 mL上清液经氮气吹干后,分别用含体积分数10%甲醇的PB缓冲液将3种样品定容至5、5和10 mL,用于检测。在添加回收试验中,对硫磷、甲基对硫磷和杀螟硫磷在苹果、白菜样品中的添加水平分别为100和20 μg/kg,在糙米样品中的添加水平分别为200和40 μg/kg,采用dc-CLEIA法检测样品中的3种有机磷农药,回收率在73%~118%之间,相对标准偏差均小于12% (表 6)。
|
|
表 6 采用dc-CLEIA方法添加3种有机磷农药的回收试验结果(n=3) Table 6 Recovery test of three organophosphorus pesticides in samples (n=3) |
中国国家标准中规定了果蔬、谷物中硫代磷酸酯类有机磷农药最大残留限量(MRL):果蔬中,对硫磷MRL值为0.01 mg/kg,甲基对硫磷为0.02 mg/kg (苹果中为0.01 mg/kg),杀螟硫磷为0.5 mg/kg (结球甘蓝为0.1 mg/kg);谷物中,对硫磷为0.1 mg/kg,甲基对硫磷为0.1 mg/kg,杀螟硫磷为5.0 mg/kg (大米、小麦粉均为1.0 mg/kg)[31]。按照该标准,本研究建立的dc-CLEIA方法基本能满足3种有机磷农药在谷物和果蔬中的检测要求。
3 结论ELISA是免疫分析方法的基础方法,具有简便、价格低廉、易操作、检测时间短等优势,而基于此基础上发展而来的CLEIA灵敏度更高,检测时间进一步缩短。本研究基于有机磷农药宽谱特异性的单克隆抗体,建立了对硫磷、甲基对硫磷和杀螟硫磷同时检测的直接竞争和间接竞争CLEIA方法,为实现这3种农药的高灵敏度同时快速筛查提供了新途径,为研制有机磷农药多残留检测免疫试剂盒提供了材料基础和理论依据。
| [1] |
魏天龙.高效液相色谱法同时测定生活饮用水中七种有机磷农药残留研究[D].兰州:西北师范大学, 2013:5-9.
WEI T L. The research of simultaneous determination of seven kinds of oragnicphosphorus pesticide residues in drinking water by high performance liquid chromatography[D]. Lanzhou:Northwest Normal University, 2013:5-9. |
| [2] | BOUCHARD M F, CHEVRIER J, HARLEY K G, et al. Prenatal exposure to organophosphate pesticides and IQ in 7-year-old children[J]. Environ Health Perspect, 2011, 119(8): 1189–1195. doi:10.1289/ehp.1003185 |
| [3] | SHADNIA S, AZIZI E, HOSSEINI R, et al. Evaluation of oxidative stress and genotoxicity in organophosphorus insecticide formulators[J]. Hum Exp Toxicol, 2005, 24(9): 439–445. doi:10.1191/0960327105ht549oa |
| [4] | REDMOND E, EGESTON C, BRALLEY J A. Low level prenatal exposure to organophosphate pesticides significantly lowers IQ in children[J]. Townsend Lett, 2012, 12(7): 782–795. |
| [5] | BANKS C N, LEIN P J. A review of experimental evidence linking neurotoxic organophosphorus compounds and inflammation[J]. Neurotoxicology, 2012, 33(3): 575–584. doi:10.1016/j.neuro.2012.02.002 |
| [6] | MONTUORI P, AURINO S, NARDONE A, et al. Spatial distribution and partitioning of organophosphates pesticide in water and sediment from Sarno River and Estuary, Southern Italy[J]. Environ Sci Pollut Res, 2015, 22(11): 8629–8642. doi:10.1007/s11356-014-4016-z |
| [7] |
四部委联合发布禁止高毒农药使用相关事宜的公告第632号[J].农药科学与管理, 2006, 25(7):1.
The No. 632 of four ministries jointly issued a ban on high toxic pesticide use relevant matters announcement[J]. Pestic Sci Admin, 2006, 25(7):1. http://mall.cnki.net/magazine/Article/NYKG200607000.htm |
| [8] |
武丽辉. 欧盟将更多农药列入淘汰使用名单[J]. 农药科学与管理, 2007, 28(11): 15.
WU L H. The European Union:more pesticide will be eliminated[J]. Pestic Sci Admin, 2007, 28(11): 15. |
| [9] |
张宏军. 澳大利亚禁用杀螟硫磷[J]. 农药科学与管理, 2004, 26(7): 39.
ZHANG H J. Fenitrothion was disabled in Australia[J]. Pestic Sci Admin, 2004, 26(7): 39. |
| [10] | HANDFORD C E, ELLIOTT C T, CAMPBELL K. A review of the global pesticide legislation and the scale of challenge in reaching the global harmonization of food safety standards[J]. Integr Environ Assess Manag, 2015, 11(4): 525–536. doi:10.1002/ieam.v11.4 |
| [11] |
李培培, 陈敏, 王军. QuEChERS-高效液相色谱法检测红葡萄酒中多菌灵和甲霜灵杀菌剂残留[J]. 食品与发酵工业, 2015, 41(1): 202–206.
LI P P, CHEN M, WANG J. Determination of carbendazim and metalaxyl pesticides in red wine by QuEChERS-high performance liquid chromatography[J]. Food Ferment Indust, 2015, 41(1): 202–206. |
| [12] | ZHAO X S, KONG W J, WEI J H, et al. Gas chromatography with flame photometric detection of 31 organophosphorus pesticide residues in Alpinia oxyphylla dried fruits[J]. Food Chem, 2014, 162: 270–276. doi:10.1016/j.foodchem.2014.04.060 |
| [13] | WATANABE E, KOBARA Y, BABA K, et al. Aqueous acetonitrile extraction for pesticide residue analysis in agricultural products with HPLC-DAD[J]. Food Chem, 2014, 154: 7–12. doi:10.1016/j.foodchem.2013.12.075 |
| [14] | TAO X Q, CHEN M, JIANG H Y, et al. Chemiluminescence competitive indirect enzyme immunoassay for 20 fluoroquinolone residues in fish and shrimp based on a single-chain variable fragment[J]. Anal Bioanal Chem, 2013, 405(23): 7477–7484. doi:10.1007/s00216-013-7174-9 |
| [15] |
肖勤, 林金明. 化学发光免疫分析方法的应用研究进展[J]. 分析化学, 2015, 43(6): 929–938.
XIAO Q, LIN J M. Advances and applications of chemiluminescence immunoassay in clinical diagnosis and foods safety[J]. Chin J Anal Chem, 2015, 43(6): 929–938. doi:10.1016/S1872-2040(15)60831-3 |
| [16] | FEI Y, YU S C, YU L L, et al. Determination of residual enrofloxacin in food samples by a sensitive method of chemiluminescence enzyme immunoassay[J]. Food Chem, 2014, 149: 71–75. doi:10.1016/j.foodchem.2013.10.024 |
| [17] |
任世奇, 王栩, 唐宝军, 等. 微板式化学发光酶免疫分析法临床测定人血清中孕酮[J]. 分析化学, 2008, 36(6): 729–734.
REN S Q, WANG X, TANG B J, et al. Micro-plate chemiluminescence enzyme immunoassay for clinical determination of progesterone in human serum[J]. Chin J Anal Chem, 2008, 36(6): 729–734. doi:10.1016/S1872-2040(08)60038-9 |
| [18] |
李源珍, 生威, 刘恩梅, 等. 化学发光酶免疫法测牛奶中3种喹诺酮类药物[J]. 食品研究与开发, 2013, 34(16): 78–81.
LI Y Z, SHENG W, LIU E M, et al. Determination of QNs residues in milk by enhanced chemiluminescent enzyme immunoassay[J]. Food Res Dev, 2013, 34(16): 78–81. |
| [19] | MIKUIŠKA P, BRUŽEŇAK L, VEČEŘZ Z. Detection of peroxyacetyl nitrate in air using chemiluminescence aerosol detector[J]. Chem Papers, 2014, 68(1): 1482–1490. |
| [20] | JANG M S, LEE S J, XUE X P, et al. Production and characterization of monoclonal antibodies to a generic hapten for-class-specific determination of organophosphorus pesticides[J]. Bull Korean Chem Soc, 2002, 23(8): 1116–1119. doi:10.5012/bkcs.2002.23.8.1116 |
| [21] | LIANG Y, LIU X J, LIU Y, et al. Synthesis of three haptens for the class-specific immunoassay of O, O-dimethyl organophosphorus pesticides and effect of hapten heterology on immunoassay sensitivity[J]. Anal Chim Acta, 2008, 615(2): 174–183. doi:10.1016/j.aca.2008.03.050 |
| [22] | LI Y L, ZHAO F C, ZHAO L Y, et al. Development of a broad-specificity immunoassay for determination of organophosphorus pesticides using dual-generic hapten antigens[J]. Food Anal Methods, 2015, 8(2): 420–427. doi:10.1007/s12161-014-9906-7 |
| [23] | XU Z L, XIE G M, LI Y X, et al. Production and characterization of a broad-specificity polyclonal antibody for O, O-diethyl organophosphorus pesticides and a quantitative structure-activity relationship study of antibody recognition[J]. Anal Chim Acta, 2009, 647(1): 90–96. doi:10.1016/j.aca.2009.05.025 |
| [24] | ZHAO F C, HU C Y, WANG H M, et al. Development of a MAb-based immunoassay for the simultaneous determination of O, O-diethyl and O, O-dimethyl organophosphorus pesticides in vegetable and fruit samples pretreated with QuEChERS[J]. Anal Bioanal Chem, 2015, 407(30): 8959–8970. doi:10.1007/s00216-015-9055-x |
| [25] |
王春梅.有机磷高特异性和宽谱单克隆抗体的筛选与比较研究[D].杭州:浙江大学, 2010:40-44.
WANG C M. Preparation and comparison of high-specific and broad-selective monoclonal antibodies against organophosphorous pesticides[D]. Hangzhou:Zhejiang University, 2010:40-44. |
| [26] | SHIM J Y, KIM Y A, LEE Y T, et al. Monoclonal antibody-based enzyme-linked immunosorbent assays for the organophosphorus insecticide O-ethylO-4-nitrophenyl phenylphosphonothioate (EPN)[J]. J Agric Food Chem, 2010, 58(9): 5241–5247. doi:10.1021/jf904528y |
| [27] | XU Z L, ZENG D P, YANG J Y, et al. Monoclonal antibody-based broad-specificity immunoassay for monitoring organophosphorus pesticides in environmental water samples[J]. J Environ Monit, 2011, 13(11): 3040–3048. doi:10.1039/c1em10331h |
| [28] | KOLOSOVA A Y, PARK J H, EREMIN S A, et al. Comparative study of three immunoassays based on monoclonal antibodies for detection of the pesticide parathion-methyl in real samples[J]. Anal Chim Acta, 2004, 511(2): 323–331. doi:10.1016/j.aca.2004.01.047 |
| [29] |
兰美静, 刘蕊, 郭逸蓉, 等.异源竞争ELISA法筛选有机磷农药宽谱单克隆抗体[C]//全国农药交流会论文集.上海:中国农药工业协会, 2014:225-230.
LAN M J, LIU R, GUO Y R, et al. Heterologous screening of hybridomas for the development of broad-specific monoclonal antibodies against organophosphorus pesticides[C]//National Pesticide Conference. Shanghai:China Crop Protection Industry Association, 2014:225-230. |
| [30] |
食品中农药最大残留限量:GB2763-2014[S].北京:中国标准出版社, 2014.
Maximum residue limits for pesticides in food:GB2763-2014[S]. Beijing:Standards Press of China, 2014. http://www.cnki.com.cn/Article/CJFDTotal-ZBZD201404008.htm |
| [31] |
金茂俊.农药残留检测的荧光和化学发光免疫分析方法研究[D].杭州:浙江大学, 2009.
JIN M J. Development of fluorescence and chemiluminescence immunoassays for the determination of pesticide residue[D]. Hangzhou:Zhejiang University, 2009. http://www.cnki.com.cn/Article/CJFDTotal-FGGL201531058.htm |
| [32] | GUI W J, LIU Y H, WANG C M, et al. Development of a direct competitive enzyme-linked immunosorbent assay for parathion residue in food samples[J]. Anal Biochem, 2009, 393(1): 88–94. doi:10.1016/j.ab.2009.06.014 |
| [33] | ZENG K, YANG T B, ZHONG P, et al. Development of an indirect competitive immunoassay for parathion in vegetables[J]. Food Chem, 2007, 102(4): 1076–1082. doi:10.1016/j.foodchem.2006.06.050 |
| [34] | TANAKA R, TAKEMURA M, SATO M, et al. Comparison of chemiluminescence enzyme immunoassay (CLEIA) with ELISA for the determination of anti-cyclic citrullinated peptide antibodies[J]. Int J Clin Chem, 2010, 411(1-2): 22–25. |
| [35] |
邓浩, 孔德彬, 杨金易, 等. 对硫磷化学发光酶联免疫吸附分析方法的建立和评价[J]. 分析化学, 2013, 41(2): 247–252.
DENG H, KONG D B, YANG J Y, et al. Development of an indirect competitive chemiluminescence enzyme-linked immunoassay for parathion[J]. Chin J Anal Chem, 2013, 41(2): 247–252. |
 2017, Vol. 19
2017, Vol. 19


