作物叶面喷施农药是重要的农事生产活动之一。农药药液在靶标作物叶面经碰撞、弹跳、聚并、润湿、铺展等系列过程而最终以液滴形式存在,农药液滴在叶面上的蒸发过程、蒸发时间、铺展面积以及蒸发后药剂沉积形态等是影响农药有效利用率的关键因素[1]。
至今,学界对农药利用率影响因素的研究仍多集中在药液性质、喷雾机械性能、施药技术及环境条件等方面[2]。早在1979年,Young[3]就提出了农药“剂量转移(dose transfer)”的概念,认为农药一旦从喷洒机械喷出便开始了其剂量转移的过程。虽然喷施农药的目标是防治靶标生物,但在喷洒过程中不可避免地会有相当一部分农药进入环境或落到非靶标物上,从而造成农药流失。药剂的蒸发、飘移以及从植物表面脱落是农药流失的主要形式,而药液性能、雾滴粒径与运行速度、气象因子、靶标植物冠层与叶面特性是农药流失的主要影响因素。目前,通过添加表面活性剂改善药液性能,通过施药器械和使用技术改善雾滴粒径与运行速度,以及通过辅助喷雾与控制飘移技术提高雾滴对作物冠层的穿透能力等方面的研究都取得了显著进展,并得到了实际应用,但针对农药液滴沉积在靶标植物叶片后在叶片表面所形成液滴的蒸发现象与过程研究仍较少。
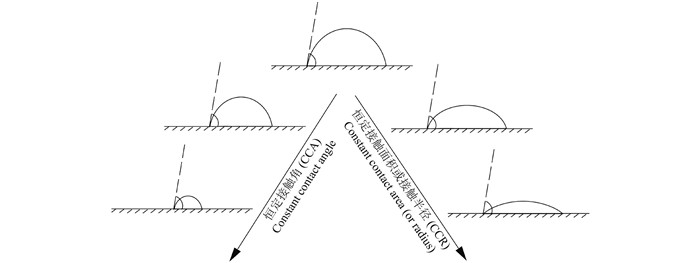
液滴蒸发过程的动力学以及热力学特性取决于多方面因素,例如界面的润湿性[4]、接触角的滞后性[5]以及界面的粗糙程度[6]等。Picknett等[7]研究了自然环境条件下液滴在光滑固体界面上的蒸发,证明液滴在光滑界面上的蒸发表现为两种模式:接触半径恒定的CCR (Constant contact radius) 模式和接触角恒定的CCA (Constant contact angle) 模式。自然界中大多数生物或非生物界面都是非光滑的,这种非光滑状态可以改变界面的润湿性。润湿性是指一种液体在一种固体表面铺展的能力或倾向性。固体按润湿性质一般分为两类:表面张力大于100 mN/m者为高能固体,易被液体所润湿;表面张力低于100 mN/m者为低能固体,不易被液体所润湿。润湿性一般用液体在固体表面的接触角表示,接触角越小,润湿性越好(或称界面亲水性越强);相反,则润湿性越差(或称界面疏水性越强)。疏水界面存在于许多自然及人工系统中,例如昆虫的翅膀、荷叶等,它们都带有一定的自清洁性[8-9]。研究者通过研究液滴在经人工修饰的超疏水界面的蒸发过程,发现液滴的蒸发过程同样是由CCR和CCA两种模式主导。同时,超疏水界面的表面形态还决定着液滴的蒸发时间[10]。
本文拟通过综述液滴在光滑固体界面、人工修饰后具有不同微观结构粗糙界面以及在不同植物界面上的蒸发动力学研究进展,提高对沉积在靶标植物叶面上农药液滴变化与调控的了解与认知,寻找适合表征农药液滴在靶标植物叶面上蒸发过程的模型,以期为指导农药表面活性剂的合理应用,减少农药液滴在靶标植物叶面的聚并和流失,提高农药有效利用率提供理论依据。
1 液滴在光滑固体界面的蒸发1977年,Picknett等[7]研究了乙酰乙酸甲酯液滴在聚四氟乙烯表面上质量和形态的变化。聚四氟乙烯表面为光滑的固体基质平面,在温度恒定、液滴体积足够小以符合球冠模型的条件下,发现液滴的蒸发过程可分为以下几种模式(图 1):1) CCA模式:接触角不变,接触半径逐渐减小;2) CCR模式:接触半径不变,接触角逐渐减小;3) 混合(Mix) 模式:接触角增大,接触半径减小,或接触角和接触半径同时减小。他们基于球冠几何形状发现了一种可以瞬时记录液滴蒸发速率和剩余体积的理论;同时发现,要满足这一理论,液滴质量需限定在1 pg~40 mg之间,且液体蒸气压小于50 Pa,如果液滴质量过大则会由于重力作用而导致液滴变形。随后在1989年,Birdi等[11]研究了水滴在光滑固体表面(玻璃界面) 上的蒸发行为,发现影响液滴蒸发速率的主要因素有接触角和固-液界面的相互作用等。挥发性液滴在低能固体表面上的蒸发分为两种情况:一是初始接触角小于90°,液滴蒸发速率随时间呈线性变化趋势,且蒸发过程呈现为接触半径恒定而接触角逐渐减小的CCR模式;二是初始接触角大于90°,液滴蒸发速率随时间呈非线性变化,蒸发模式为接触角恒定而接触半径逐渐减小的CCA模式。
1995年,Rowan等[12]对接触半径范围为0.293~0.585 mm的水滴在聚甲基丙烯酸甲酯上的接触角(小于90°)、接触半径和质量减少率进行了研究。结果表明,液滴质量减少率与其高度变化成正比,并且运用球冠几何模型和恒定接触半径理论对这一现象进行了解释。同时,他们还发现,接触角的变化可以通过公式计算准确得出,且在接触半径恒定的条件下,液滴高度和液滴接触角均随蒸发时间呈线性变化。Rowan等的理论模型建立在简单扩散的基础上,他们认为液滴表面的蒸气是均匀向外扩散的,无需考虑固体基质对液滴蒸发的影响。
Dmytro等[13]描述了一种测量蒸发过程中水滴质量和形态变化的方法。他们发现,在疏水硅基表面,直径在10 μm以下的液滴其蒸发动力学规律相似,且符合已有的蒸发规律,即液滴质量的2/3次方随蒸发时间呈线性趋势变化(m2/3∝t);而在亲水硅基表面上,通过运用非成像技术测量接触角和接触半径的变化,发现液滴蒸发规律变为液滴质量与蒸发时间呈线性相关(m∝t),并且在蒸发阶段的最后100 ms内,由于扁平状液滴的界面张力和水分薄膜的分离压力,会使得蒸发速率明显减慢。这也可能是由于二氧化硅表面的水合作用和水分薄膜的分离压力综合作用的结果。在Dmytro等[13]对水滴蒸发规律研究的基础上,2002年,Erbil等[14]运用视频显微镜和数字图像分析技术,研究了正丁醇、甲苯、正壬烷及正辛烷液滴在聚四氟乙烯表面的蒸发动力学,发现以上有机溶剂液滴在固体表面的蒸发均表现为CCA模式,且最初的接触角均小于90°,在整个蒸发过程中,液滴与固体表面接触半径的平方与蒸发时间呈线性相关。上述结果表明,这几种有机溶剂液滴在光滑固体表面的蒸发规律与水滴相似,因此,可以认为,不同液滴在光滑固体表面上的蒸发均基本符合Rowan的理论模型,但不同液滴在同种固体界面上的蒸发时间和蒸发模式可能有所不同。
通过以上研究发现,液滴在光滑固体界面的蒸发一般遵循简单的扩散原理,即蒸发速率随时间呈线性变化趋势,可忽略光滑固体界面对液滴蒸发的影响,因此液滴本身的特性成为影响其蒸发时间及蒸发模式的唯一变量。Rowan等提出的理论模型可作为实验室内研究不同液滴在平滑蜡面或聚四氟乙烯表面蒸发行为的理想模型,适用于农药喷雾助剂种类及用量的快速筛选或性能评价。
2 液滴在不同微观结构修饰后粗糙固体界面的蒸发2005年,McHale等[15]首次探索利用SU-8胶光刻技术,通过人工修饰得到由微型柱状晶格组成的超疏水平面,并发现该微观表面结构对液滴的蒸发模式有一定影响:在经微观结构修饰的超疏水界面上,液滴的接触角显著大于光滑的疏水平面,且液滴呈现非润湿(cassie-baxter) 状态。Wier等[16]通过显微镜研究了液滴在超疏水硅基表面的蒸发行为,发现浓缩液滴与界面上的乳突间存在很强的相互作用,如果液滴大小和界面粗糙度尺寸吻合,则液滴可能会渗透进入固体表面的凹陷处,形成强的粘附力,从而呈现润湿(wenzel) 状态。基于Rowan的理论模型,Xu等[10]近期通过标准光刻技术和深反应离子蚀刻技术,制成了具有不同固-液接触面积比值(即不同粗糙程度) 的固体界面,并通过聚四氟乙烯溶液涂布表面进行疏水化处理,研究了水滴在不同粗糙度固体表面的蒸发行为,揭示了不同微观结构修饰的超疏水表面上液滴蒸发模式和蒸发动力学之间的关系。
Xu等的研究表明,液滴在不同粗糙度固体表面的蒸发过程除存在CCR (图 2a) 和CCA (图 2b) 两种主要模式外,可能还存在混合模式(Mixed mode,图 2c) 及润湿现象(Wetting state,图 2d)。其基本原理为:当液滴落到粗糙的疏水界面上时,开始由于界面的疏水作用而使液滴处于非润湿状态[17];之后随着液滴的蒸发,当液滴内部的拉普拉斯压力(Laplace pressure) 显著增大,且大于维持气-液界面的临界毛细管压力时,液滴即从非润湿状态过渡为润湿状态[18],且随着固-液接触面积比值的减小(即疏水表面粗糙程度降低),CCR模式时间逐渐缩短,CCA模式时间逐渐延长。在CCR模式中,超疏水表面由于存在较窄的楔形区域而使接触角的函数变化与Rowan模型(其认为接触角的函数几乎不变) 不符。这主要是由于当液滴与疏水界面的接触角较大时,在其接触处存在一个小的楔形区域,该区域内液滴蒸气密度较大,其蒸发速率较慢,最终导致液滴蒸发时间延长;而当液滴蒸发由CCR模式转变为CCA模式后,由于接触角的变小而使得接触半径的动力学变化重新符合Rowan的理论模型。
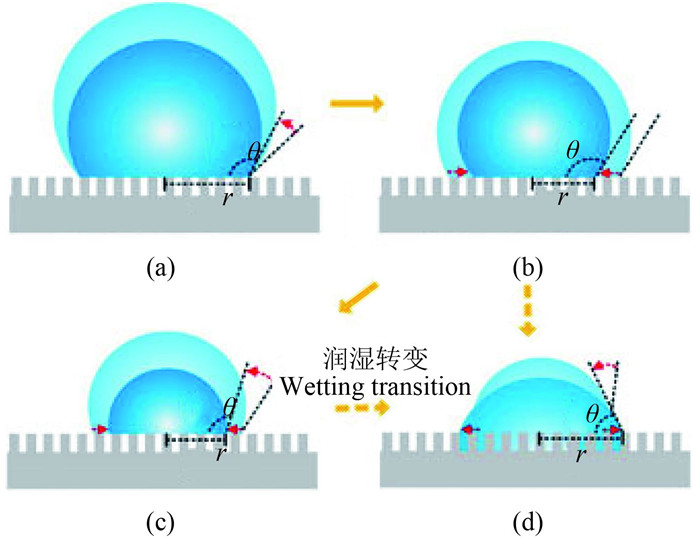
|
(a) 恒定接触半径模式 (CCR);(b) 恒定接触角模式 (CCA);(c) 混合模式;(d) 润湿现象 (在液滴随蒸发而体积不断减小的过程中,当内部的拉普拉斯压力大于疏水表面的毛细管压力后呈现的状态)。 注:接触角(θ) 和接触半径(r) 的变化通过红色虚线表示. (a) Constant contact radius (CCR) mode; (b) Constant contact angle (CCA) mode; (c) Mixed mode; (d) Wetting state (a wetting trasition can take place when the internal Laplace pressure of a droplet exceeds the capillary pressure of the hydrophobic surface structures). Note:The changes in the contact angle (θ) and the contact radius (r) of a droplet areindicated with red dotted arrows. 图 2 水滴在人工修饰超疏水界面上的典型蒸发模式示意图[10] Fig. 2 Schematics of typical evaporation modes occurring sequentially during the evaporation of a sessile droplet of water on a superhydrophobic surface[10] |
以上研究表明,液滴蒸发速率和蒸发模式受固体表面特性及粗糙程度影响,因此通过调整固体表面的粗糙程度可以有效调控液滴的蒸发动力学行为。考虑到不同靶标作物以及同一作物的不同生长时期等情况下其界面特性均不相同,因此研究不同特性界面上液滴的蒸发规律对于指导不同生长时期农药的使用以及确定制剂中表面活性剂用量均有很好的指导意义。
3 液滴在植物叶片上的蒸发 3.1 不同植物表面结构及特性对液滴蒸发的影响植物叶面的微观结构与农药液滴在其表面的润湿铺展速率密切相关,从而影响液滴的蒸发行为以及植物对农药有效成分的吸收效率。含有乙醇和酸类物质的叶片亲水性强,液滴易于展开;而含有蜡质层的叶片亲水性差,甚至具有防水性,液滴铺展速率慢[19-21]。首先,植物叶面上微小细毛的长度和密度会影响液滴的铺展速率。当微小细毛非常短而密时,可以形成小的屏障,使液滴与叶面脱离接触,从而降低液滴的铺展速率。其次,当植物叶面上存在大量的腺孔时,由于其表面粗糙度增加,会导致液滴在植物叶面的铺展速率加快[22]。植物叶面的亲、疏水程度通常用液滴与叶面的接触角来表示:当接触角 < 90°时,叶面表现为亲水,当接触角 > 90°时则表现为疏水[23-25]。而叶面的亲、疏水程度取决于叶片的表面结构、表面能量(按润湿性质分为高能或低能固体) 以及表面粗糙度和清洁度等[26]。
3.1.1蜡质层和绒毛状结构叶片对液滴蒸发的影响Yu等[27]研究了不同液滴直径大小、不同相对湿度、不同表面活性剂等因素对液滴在蜡质和绒毛状结构天兰葵属植物叶片上(图 3) 蒸发时间和最大铺展面积的影响。结果发现:在一定范围内,液滴蒸发时间随液滴直径的增加和相对湿度的增大而延长;液滴最大铺展面积随液滴直径的增加而增加,而受相对湿度影响不大;添加表面活性剂可以显著改变液滴的蒸发时间和最大铺展面积。在药液中添加表面活性剂烷基聚氧乙烯,能够有效缩短液滴在蜡质或绒毛状叶片上的蒸发时间;而添加非离子胶体聚合物类的漂移抑制剂,则可略微延长液滴的蒸发时间。但无论在喷雾中添加烷基聚氧乙烯还是漂移抑制剂,液滴在蜡质层结构叶片上的蒸发时间均较绒毛状结构叶片上的蒸发时间长。在具蜡质层结构的天兰葵属植物叶片上,整个蒸发过程中农药液滴的铺展面积逐渐减小;而在绒毛状结构的植物叶片上,在相同液滴体积和相对湿度条件下,液滴的铺展面积持续扩大直到快蒸发完为止。该研究表明,液滴在植物叶片表面的持留时间长短和润湿铺展面积大小受液滴大小、靶标作物叶片表面结构(蜡质层或绒毛状)、相对湿度及添加的表面活性剂等因素影响。据此可以指导农药在不同种类植物上的合理使用剂量和喷雾方法,以达到实现最佳生物效应和有效减少农药用量的目的。

|
图 3 扫描电子显微镜下放大300倍后的绒毛状(左) 及蜡质状(右) 天兰葵属植物叶片结构[27] Fig. 3 The fine-surface structures of hairy (left) and waxy (right) geranium leaves observed by scanning electronic microscope with 300 × magnification[27] |
以上研究表明,相同条件下,液滴在蜡质层结构叶片上的蒸发时间均较绒毛状结构叶片上长。而对于蜡质层结构叶片,由于其润湿性较差,液滴不易铺展,易从植物叶片表面滚落,因此,较长的蒸发时间更增加了液滴流失的几率。不论叶片表面具有蜡质层还是绒毛结构,为了保证农药的有效利用,喷雾液滴必须尽可能粘附在叶片表面而不是呈珠状滚落,同时必须先渗透到叶片表面的蜡质或绒毛中再通过细胞壁和气孔到达叶片组织,因此,叶片表面的润湿性是液滴在叶片上沉积、持留和铺展以及药液渗透的重要影响因素[28]。在实际农药喷施中,可通过添加表面活性剂来增大液滴在润湿性较差叶片上的铺展面积和延长其在润湿性较好叶片上的蒸发时间,以便更好地发挥药效。
3.1.2超疏水结构叶片对液滴蒸发的影响Zhang等[29]研究了水滴在自然超疏水荷叶上和仿生高聚物界面上的蒸发,并采用包含接触半径、液滴高度和接触角3个参数的椭球形帽状几何体模型进行模拟,发现模型模拟结果和实际试验数据相符。在粗糙的超疏水界面上,由于固-液接触处存在大量空气而使得液滴在界面上呈现非润湿状态,在该状态下水滴容易滚落。植物蜡质层组成成分复杂,包含许多极性基团如醇类、酮类及酸类等,当与水滴接触时,极性基团覆盖于叶片表面,结果使得水滴难润湿,形成较大的接触角,并且随着液滴的蒸发,水蒸气逐渐渗透进入固-液接触处粗糙的表面结构中,使水滴在固体表面从非润湿状态转变为润湿状态。Herminghaus等[30]研究表明,将超疏水界面长时间置于水中、施加压力及增大液滴质量等都可以促成这一模式的转变。Zhang[29]研究团队认为,对具有粗糙结构的超疏水表面(荷叶和高分子聚合物表面) 而言,在整个蒸发过程中,液滴在固、液、气三相接触处的扩散均被限制,这可能是由于水蒸气渗透到粗糙的表面结构中后,在水和植物蜡质层间形成了强的作用力,使液滴的粘附性增强,液滴的动态自由能不能克服三相接触处的阻力而完成扩散,从而导致固、液接触面积基本不变。其接触角在140°左右分成了两个斜率不同的线性变化阶段:先是缓慢减小,到140°以后则迅速减小直到液滴蒸发完。他们在相同条件下对不同体积(1、3及5 μL) 液滴的蒸发进行了研究,发现其规律基本一致,只是随着液滴体积增大,蒸发第一阶段的时间有所延长。说明在该试验范围内,液滴体积大小对其蒸发模式影响不大。
许多植物叶片由于表面蜡质层以及微纳米结构的存在而使其具有疏水特性,研究液滴在此类界面的蒸发过程及模式,对探索农药液滴在疏水植物叶片上的蒸发过程提供了一定的理论基础。例如水稻,由于其超疏水的叶面特性使得农药液滴极易从其表面滚落而造成流失,因此可考虑通过添加表面活性剂等措施使液滴蒸发遵循CCR模式,从而在增大铺展面积的同时使接触角快速减小,降低液滴滚落的几率。
3.2 添加表面活性剂对液滴蒸发的影响表面活性剂有助于消除液滴与植物叶面之间的微空气隔层,使植物叶面的亲水性增强。因此,在农药药液中添加适宜的表面活性剂,可以增大液滴在作物叶片表面的铺展面积,从而加快植物叶面对药液的吸收速率[31]。众多研究表明,添加适宜的表面活性剂可以减小喷液液滴的尺寸[32-34]。而Baur等[35]研究发现,小液滴较大液滴更有利于药液在叶片表面的有效持留和铺展。Holloway[36]等研究发现,表面活性剂的加入可促进叶片对药液的吸收和药液生物活性的发挥。但是其添加量应该控制在适宜的范围内,以免造成药液在叶片上的残留。
左雯等[1]研究了农乳500#、Fairland 2408和Tech-408 3种表面活性剂对农药液滴铺展面积和蒸发时间的影响。结果表明:添加表面活性剂可使农药液滴在甘蓝叶片表面的铺展面积明显增大,并缩短其蒸发时间;且不同表面活性剂对农药液滴铺展面积及蒸发时间的影响程度差异显著;随表面活性剂添加比例增大,液滴的铺展面积相应增大,其蒸发时间则相应缩短。
Xu等[28]研究发现,农药液滴在蜡质层(图 4) 和绒毛状(图 5) 叶片上的蒸发和沉积主要受喷雾剂型、液滴粒径和相对湿度的影响。其中,液滴蒸发速率以及在蜡质和绒毛结构叶片上的铺展随添加的表面活性剂种类的不同而不同,加入合适浓度改性后的籽油(modified seed oil,MSO)、非离子表面活性剂(a non-ionic surfactant adjuvant,NIS) 或混合油表面活性剂(a mixture of oil surfactant blend,OSB) 均能够有效提高喷雾药液的均匀性,增大液滴在蜡质和绒毛状结构植物叶片表面的铺展面积,减少农药用量、提高经济效益及降低环境污染。

|
图 4 添加(a) 和未添加(b) 表面活性剂(改性后籽油) 的水滴(直径500 μm) 在蜡质状结构叶片上的状态[28] Fig. 4 A 500 μm water droplet (a) with and (b) without the adjuvant MSO on the surface of a waxy leaf[28] |

|
图 5 添加(a) 和未添加(b) 表面活性剂(改性后籽油) 的水滴(直径500 μm) 在绒毛状结构叶片上的状态[28] Fig. 5 A 500 μm water droplet (a) with and (b) without the adjuvant MSO on the surface of a hairy leaf[28] |
Zhu等[37]研究了添加和不添加表面活性剂聚乙二醇辛基苯基醚(Triton X-100) 的水滴在蜡质层结构叶片不同位置上的蒸发速率及铺展面积变化规律。发现水滴的润湿铺展面积和蒸发时间因其在叶片的近轴面(正面)、远轴面(背面) 以及叶片不同部位(主脉、侧脉和脉间区域) 而异;添加表面活性剂后,不同直径液滴的铺展面积均增大,蒸发时间均缩短。就整个叶片表面而言,添加表面活性剂使得直径为300 μm的液滴的平均铺展面积增加了203%,蒸发时间减少了44%,而对直径为600 μm的液滴,添加表面活性剂后其平均铺展面积增加了275%,蒸发时间减少了19%。
一般而言,液滴铺展面积越大则蒸发时间越短,但液滴铺展面积并不是决定蒸发时间的惟一因素。气-液界面的接触面积、生物界面及气孔的吸收速率、叶片干燥程度、叶片疏水性以及周围环境的温湿度等都会影响液滴的蒸发时间。因此,对于特定的靶标植物,可以根据施药特性选择合适的表面活性剂及使用浓度,以调整其铺展面积和蒸发时间,使之达到更好的防治效果。
4 展望液滴在非生物界面和生物界面上的蒸发行为主要可归纳为以下几种模式:CCR (接触半径不变,接触角逐渐减小)、CCA (接触角不变,接触半径逐渐减小)、Mixed (接触角和接触半径均逐渐减小) 及Wetting (接触角减小而接触半径增大)。研究者可借鉴以上研究结论,深入开展农药液滴在靶标植物叶片上的蒸发动力学研究探讨。
1) 不同农药类别、不同助剂的添加及不同靶标植物叶片特性都会对液滴的蒸发造成影响。如:农药可分为内吸性和非内吸性农药。对于内吸性农药,当液滴沉降到叶面后,液滴蒸发越慢,蒸发时间越长,则通过叶片表面毛细孔吸收的农药有效成分就越多,农药对病虫害的防治效果就越好;而对于非内吸性农药,则应尽可能将药液喷洒到叶面上害虫或植物病害发生的区域,直接触杀害虫或控制病害,因此非内吸性农药液滴蒸发时间越短,液滴从植物叶片表面被吹落的几率越小,则农药对病虫害的防治效果就越好[31]。而对于一些易挥发的农药, 适当延长液滴的蒸发时间,可以增强农药液滴在靶标作物上的有效附着,从而提高农药对病虫害的防治效果。因此,可通过添加适宜的助剂合理延长或缩短液滴的蒸发时间,提高农药利用率。而针对不同靶标植物叶片表面特性的不同,对于亲水性叶片,由于其液滴铺展面积大,蒸发速率快,因此可添加增强持留性、抑制蒸发的助剂,适当延长药液的作用时间;而对于疏水性靶标作物叶片,由于液滴接触角较大,难润湿,易滚落,因此可添加有利于提高铺展性的助剂,降低液滴从植物叶片滚落的几率。
2) 液滴蒸发模式中的CCR模式表现为液滴接触半径不变,随体积减小接触角不断减小。这一模式的存在对提高农药利用率具有重要价值。接触角减小可以降低液滴从叶片上滚落的几率,尤其对于水稻等超疏水叶片而言。因此,可以通过人为调控适当延长CCR模式阶段,以减少液滴的聚并及滚落,从而提高农药的有效利用率。
3) 当液滴在靶标植物叶面上接触角很大时,在液滴与固体接触面间会存在一个小的楔形区域,由于该区域中蒸气扩散较慢而使液滴的蒸发时间延长。由此应加强对于疏水植物界面上农药液滴沉积后楔形区域的研究,以期通过添加功能性表面活性剂等措施,缩短或延长楔形区域存在时间,以缩短或延长液滴蒸发时间,进而根据有害生物防控对农药有效剂量的实际需求,对农药液滴蒸发进行调控。
4) 农药液滴是农药有效成分向靶标植物剂量传递的最直接载体,农药分散颗粒在液滴中的分散形态、界面特性等也是影响液滴蒸发的重要因素。因此,基于靶标植物叶面结构与特性,可以尝试通过改变农药分散形态、进行农药分散颗粒表面修饰等,使农药液滴中农药分散颗粒与靶标植物界面间产生一定的相互作用,以改善农药的对靶沉积性能,实现提高农药利用率的目的。
5) 室内研究农药液滴在靶标作物表面的蒸发规律与实际应用场景仍存在较大差距。如室内多控制单一变量,而实际应用中液滴蒸发受多因素(风力、温度、湿度等) 综合作用的影响;室内多采用坐滴法和悬滴法研究液滴蒸发,不考虑液滴与靶标界面接触前的状态,而实际应用中农药液滴是以一定的动能与靶标界面接触的。因此,为了与实际联系更紧密,应模拟田间条件开展试验,如进行风洞试验等;或开发、利用先进的仪器,使得液滴能以不同的动能落到靶标作物叶片上,据此研究液滴的动态变化及蒸发动力学规律,从而为实际应用提供理论依据。
| [1] |
左雯, 饶志坚, 吴国星, 等. 表面活性剂对农药雾滴在甘蓝菜叶面上扩展面积和蒸发时间的影响研究[J]. 西南大学学报(自然科学版), 2011, 33(9): 1–5.
ZUO W, RAO Z J, WU G X, et al. Influence of surfactants on deposition coverage areas and evaporation time of pesticide droplets on cabbage leaves[J]. J Southwest Univ (Nat Sci Ed), 2011, 33(9): 1–5. |
| [2] |
袁会珠, 杨代斌, 闫晓静, 等. 农药有效利用率与喷雾技术优化[J]. 植物保护, 2011, 37(5): 14–20.
YUAN H Z, YANG D B, YAN X J, et al. Pesticide efficiency and the way to optimize the spray application[J]. Plant Prot, 2011, 37(5): 14–20. |
| [3] | YOUNG B W. Studies on the retention and deposit characteristics of pesticide sprays on folliage[C]//Application meeting, IXth CIGR congress. East Lancing, M I, 1979:1-4. |
| [4] | BIRDI K S, VU D T. Wettability and the evaporation rates of fluids from solid surfaces[J]. J Adhes Sci Technol, 1993, 7(6): 485–493. doi:10.1163/156856193X00808 |
| [5] | KULINICH S A, FARZANEH M. Ice adhesion on super-hydrophobic surfaces[J]. Appl Surf Sci, 2009, 255(18): 8153–8157. doi:10.1016/j.apsusc.2009.05.033 |
| [6] | ANANTHARAJU N, PANCHAGNULA M, NETI S. Evaporating drops on patterned surfaces:transition from pinned to moving triple line[J]. J Colloid Interface Sci, 2009, 337(1): 176–182. doi:10.1016/j.jcis.2009.04.095 |
| [7] | PICKNETT R G, BEXON R. The evaporation of sessile or pendant drops in still air[J]. J Colloid Interface Sci, 1977, 61(2): 336–350. doi:10.1016/0021-9797(77)90396-4 |
| [8] | WAGNER T, NEINHUIS C, BARTHLOTT W. Wettability and contaminability of insect wings as a function of their surface sculptures[J]. Acta Zool, 1996, 77(3): 213–225. doi:10.1111/azo.1996.77.issue-3 |
| [9] | BARTHLOTT W, NEINHUIS C. Purity of the sacred lotus, or escape from contamination in biological surfaces[J]. Planta, 1997, 202(1): 1–8. doi:10.1007/s004250050096 |
| [10] | XU W, LEELADHAR R, KANG Y T, et al. Evaporation kinetics of sessile water droplets on micropillared superhydrophobic surfaces[J]. Langmuir, 2013, 29(20): 6032–6041. doi:10.1021/la400452e |
| [11] | BIRDI K S, VU D T, WINTER A. A study of the evaporation rates of small water drops placed on a solid surface[J]. J Phys Chem, 1989, 93(9): 3702–3703. doi:10.1021/j100346a065 |
| [12] | ROWAN S M, NEWTON M I, MCHALE G. Evaporation of microdroplets and the wetting of solid surfaces[J]. J Phys Chem, 1995, 99(35): 13268–13271. doi:10.1021/j100035a034 |
| [13] | GOLOVKO D S, BUTT H J, BONACCURSO E. Transition in the evaporation kinetics of water microdrops on hydrophilic surfaces[J]. Langmuir, 2009, 25(1): 75–78. doi:10.1021/la803474x |
| [14] | ERBIL H Y, MCHALE G, NEWTON M I. Drop evaporation on solid surfaces:constant contact angle mode[J]. Langmuir, 2002, 18(7): 2636–2641. doi:10.1021/la011470p |
| [15] | MCHALE G, AQIL S, SHIRTCLIFFE N J, et al. Analysis of droplet evaporation on a superhydrophobic surface[J]. Langmuir, 2005, 21(24): 11053–11060. doi:10.1021/la0518795 |
| [16] | WIER K A, MCCARTHY T J. Condensation on ultrahydrophobic surfaces and its effect on droplet mobility:ultrahydrophobic surfaces are not always water repellant[J]. Langmuir, 2006, 22(6): 2433–2436. doi:10.1021/la0525877 |
| [17] | CASSIE A B D, BAXTER S. Wettability of porous surfaces[J]. Trans Faraday Soc, 1944, 40: 546–551. doi:10.1039/tf9444000546 |
| [18] | WENZEL R N. Resistance of solid surfaces to wetting by water[J]. Ind Eng Chem, 1936, 28(8): 988–994. doi:10.1021/ie50320a024 |
| [19] | CHACHALIS D, REDDY K N, ELMORE C D. Characterization of leaf surface, wax composition, and control of redvine and trumpetcreeper with glyphosate[J]. Weed Sci, 2001, 49(2): 156–163. doi:10.1614/0043-1745(2001)049[0156:COLSWC]2.0.CO;2 |
| [20] | CHACHALIS D, REDDY K N, ELMORE C D, et al. Herbicide efficacy, leaf structure, and spray droplet contact angle among Ipomoea species and smallflower morningglory[J]. Weed Sci, 2001, 49(5): 628–634. doi:10.1614/0043-1745(2001)049[0628:HELSAS]2.0.CO;2 |
| [21] | HATTERMAN-VALENTI H M, PITTY A, OWEN M D K. Effect of environment on giant foxtail (Setaria faberi) leaf wax and fluazifop-P absorption[J]. Weed Sci, 2006, 54(4): 607–614. doi:10.1614/WS-04-158R2.1 |
| [22] | MCWHORTER C G. Epicuticular wax on johnsongrass (Sorghum halepense) leaves[J]. Weed Sci, 1993, 41(3): 475–482. |
| [23] | BREWER C A, SMITH W K. Patterns of leaf surface wetness for montane and subalpine plants[J]. Plant, Cell Environ, 1997, 20(1): 1–11. doi:10.1046/j.1365-3040.1997.d01-15.x |
| [24] | NEUFELD H S, JERNSTEDT J A, HAINES B L. Direct foliar effects of simulated acid rain. I. Damage, growth and gas exchange[J]. New Phytol, 1985, 99(3): 389–405. doi:10.1111/nph.1985.99.issue-3 |
| [25] | WAGNER P, FÜRSTNER R, BARTHLOTT W, et al. Quantitative assessment to the structural basis of water repellency in natural and technical surfaces[J]. J Exp Bot, 2003, 54(385): 1295–1303. doi:10.1093/jxb/erg127 |
| [26] | JOURNET C, MOULINET S, YBERT C, et al. Contact angle measurements on superhydrophobic carbon nanotube forests:effect of fluid pressure[J]. Europhys Lett, 2005, 71(1): 104–109. doi:10.1209/epl/i2005-10068-4 |
| [27] | YU Y, ZHU H, FRANTZ J M, et al. Evaporation and coverage area of pesticide droplets on hairy and waxy leaves[J]. Biosyst Eng, 2009, 104(3): 324–334. doi:10.1016/j.biosystemseng.2009.08.006 |
| [28] | XU L Y, ZHU H P, OZKAN H E, et al. Droplet evaporation and spread on waxy and hairy leaves associated with type and concentration of adjuvants[J]. Pest Manage Sci, 2011, 67(7): 842–851. doi:10.1002/ps.v67.7 |
| [29] | ZHANG X Y, TAN S X, ZHAO N, et al. Evaporation of sessile water droplets on superhydrophobic natural lotus and biomimetic polymer surfaces[J]. Chemphyschem, 2006, 7(10): 2067–2070. doi:10.1002/(ISSN)1439-7641 |
| [30] | HERMINGHAUS S. Roughness-induced non-wetting[J]. Europhys Lett, 2000, 52(2): 165–170. doi:10.1209/epl/i2000-00418-8 |
| [31] |
王穗, 彭尔瑞, 吴国星, 等. 植物叶面农药雾滴蒸发时间研究在我国的应用[J]. 广东农业科学, 2009(11): 104–107.
WANG S, PENG E R, WU G X, et al. Application of evaporation of pesticide droplets on plant leaves in China[J]. Guangdong Agric Sci, 2009(11): 104–107. |
| [32] | ELLIS M C B, TUCK C R, MILLER P C H. How surface tension of surfactant solutions influences the characteristics of sprays produced by hydraulic nozzles used for pesticide application[J]. Colloids Surf A Physicochem Eng Aspects, 2001, 180(3): 267–276. doi:10.1016/S0927-7757(00)00776-7 |
| [33] | RAMSDALE B K, MESSERSMITH C G. Nozzle, spray volume, and adjuvant effects on carfentrazone and imazamox efficacy[J]. Weed Technol, 2010, 15(3): 485–491. |
| [34] | STAINIER C, DESTAIN M F, SCHIFFERS B, et al. Droplet size spectra and drift effect of two phenmedipham formulations and four adjuvants mixtures[J]. Crop Protect, 2006, 25(12): 1238–1243. doi:10.1016/j.cropro.2006.03.006 |
| [35] | BAUR P. Impact of adjuvants on droplet spreading and droplet deposit area after spray application[J]. J ASTM Int, 2006, 3(9): 1–9. |
| [36] | HOLLOWAY P J, WONG W W C, PARTRIDGE H J, et al. Effects of some nonionic polyoxyethylene surfactants on uptake of ethirimol and diclobutrazol from suspension formulations applied to wheat leaves[J]. Pest Manage Sci, 1992, 34(2): 109–118. doi:10.1002/ps.v34:2 |
| [37] | XU L Y, ZHU H P, OZKAN H E, et al. Evaporation rate and development of wetted area of water droplets with and without surfactant at different locations on waxy leaf surfaces[J]. Biosyst Eng, 2010, 106(1): 58–67. doi:10.1016/j.biosystemseng.2010.02.004 |
 2017, Vol. 19
2017, Vol. 19