2. 辽宁省生物农药工程技术研究中心, 沈阳 110866
2. Engineering & Technological Research Center of Biopesticide, Shenyang 110866, China
昆虫病原线虫共生菌寄生于昆虫病原线虫肠道内,是革兰氏阴性细菌,属于肠杆菌科 (Enterobacteriaceae),包括发光杆菌 (Phothrabdus) 和致病杆菌 (Xenohrabdus) 两个属[1],其中致病杆菌与斯氏线虫共生[2-3]。携带有致病杆菌的线虫通过自然开口或伤口进入昆虫寄主体内,将致病杆菌释放到昆虫寄主的血淋巴中,导致寄主患败血症而死亡[4-6]。致病杆菌能够降解昆虫尸体,为线虫提供营养,同时可产生多种具有杀虫抑菌活性的次生代谢产物,为线虫的发育繁殖提供良好的生理环境[7]。
Madumycin II 是一类含唑环的 23 元大环内酯类化合物,含有共轭二烯键、羟基、酰氨基和羧基等具有生物活性的官能团,属于链阳菌素 (streptogramins) 类抗生素[8]。Madumycin II 最初由 Brazhnikova 等于 1976 年从游动放线菌代谢产物中首次分离获得[9]。Lefevre 等对其生物合成过程进行了阐述,发现其对革兰氏阳性细菌尤其是耐甲氧西林的金黄色葡萄球菌具有很强的抑制作用[10]。1996 年,Tavares 等对其进行了全合成研究[9]。此后,又依次发现了许多具有较高抑菌活性的 madumycin II 类似物,如 Virginiamycin M1、Virginiamycin M2 等链阳菌素类抗生素。本研究利用现代色谱技术,从伯氏致病杆菌 SN269 发酵液固相提取物中分离得到 madumycin II,并采用菌丝生长速率法测定了 madumycin II 对常见植物病原真菌的抑菌活性。
1 材料与方法 1.1 供试材料 1.1.1 供试菌株致病杆菌 SN269,于 2015 年 6 月从辽宁省凤城市鸡冠山蘑菇岭柞蚕林的土样中分离获得,保存于沈阳农业大学植物保护学院微生物次生代谢产物研究室。
1.1.2 供试病原真菌番茄灰霉病菌 Botrytis cinerea、辣椒疫霉 Phytophthoa capsici、稻瘟病菌 Magnaporthe oryzae、禾谷镰刀菌 Fusariumgramine arum、玉米大斑病菌 Exserohilum turcicum、小麦根腐病菌 Bipolaris sorokiniana、恶苗病菌 Fusarium moniliforme 和向日葵菌核病菌 Sclerotinia sclerotiorum,均由沈阳农业大学植物保护学院微生物次生代谢产物研究室提供。
1.1.3 培养基NBTA 培养基:牛肉膏 3.0 g/L,蛋白胨 10.0 g/L,氯化钠 5.0 g/L,琼脂粉 15 g/L,氯化三苯基四氮唑 0.040 g/L,溴百里酚蓝 0.025 g/L,蒸馏水 1 L;LB 培养基:胰蛋白胨 10 g/L,酵母提取物 5 g/L,氯化钠 10 g/L,蒸馏水 1 L;M 培养基:葡萄糖 6.13 g/L,蛋白胨 21.29 g/L,MgSO4 1.50 g/L,(NH4)2SO4 2.46 g/L,KH2PO4 0.86 g/L,K2HPO4 1.11 g/L,Na2SO4 1.72 g/L,蒸馏水 1 L;PDA 培养基:马铃薯 200 g/L,葡萄糖 20 g/L,琼脂 20 g/L,蒸馏水 1 L。pH 均为 7.0~7.2。
1.1.4 主要试剂和仪器甲醇、二氯甲烷和氯仿,分析纯 (国药集团化学试剂有限公司);柱层析硅胶 [筛孔径 150~74 μm (100~200 目),青岛海洋化工厂];Sephadex LH-20 柱层析凝胶 (瑞典 Pharmacia 公司);XAD-16 大孔树脂 (罗门哈斯国际贸易有限公司)。ZF-8 暗箱四用紫外线分析仪 (上海嘉鹏科技有限公司);N-1100 旋转蒸发仪 (上海爱朗仪器有限公司);Agilent6540 飞行时间质谱仪 (美国 Agilent 公司);AV-600 Hz 核磁共振仪 (德国 Bruker 公司);AP-300 型全自动旋光仪 (日本 Atago 公司)。
1.2 试验方法 1.2.1 菌株鉴定参照文献[11]中的方法对 SN269 菌株基因组的 DNA 进行提取,并以此为模板进行 PCR 扩增、扩增产物纯化后测序,利用 16S rDNA 序列比对分析对其进行分类鉴定。
1.2.2 菌株培养取保存的 SN269 菌株转接于 NBTA 固体培养基上,于 28 ℃ 下培养 48 h 后挑取初生型的蓝色单菌落,接种到装有 20 mL LB 培养基的 100 mL 三角瓶中,并在 28 ℃、180 r/min 下培养 24 h,作为发酵种子培养液。将种子培养液以 8% 的接种量接种到已经灭菌的装有 20 g XAD-16 大孔树脂、400 mL M 培养基的 2 L 三角瓶中,发酵液共 28 L,相同条件下发酵培养 5 d。
1.2.3 活性成分的分离收集发酵液中大孔树脂,用去离子水洗去菌体,用甲醇浸泡 12 h,收集洗脱液;重复洗脱 4 次,收集洗脱液并真空浓缩;利用 50% 的甲醇水溶液将其复溶,加入 1 倍体积的二氯甲烷萃取 4 次,收集二氯甲烷相,真空浓缩,得到 16 g 粗提物浸膏。利用正相硅胶柱分离纯化粗提物,以二氯甲烷和甲醇作为洗脱剂进行硅胶柱层析,依次分别用 2L 的二氯甲烷,V (二氯甲烷) : V (甲醇) =100 : 2、100 : 6、10 0: 12、1 : 1 和甲醇洗脱,每 200 mL 收集 1 份,经薄层层析 (TLC) 检测后合并相同组分。对 D 组分进行了多次凝胶柱层析 [V (二氯甲烷) : V (甲醇) = 1 : 1],最终收集得到纯度相对较高的目标产物 D3,进行分析检测。
1.2.4 活性成分结构鉴定分别利用 1H NMR、13C NMR 及高分辨质谱对纯化得到的目标产物 D3 进行分析,确定其相对分子质量及结构式。利用旋光仪测定其旋光度。
1.2.5 抑菌活性的测定采用菌丝生长速率法[12]。用 V (丙酮) : V (吐温-80) = 1 : 1 的混合溶剂溶解目标化合物,并加入到 PDA 培养基中,使化合物质量浓度分别为 50、25、12.5、6.25、3.125 μg/mL。以只含 V (丙酮) : V (吐温-80) = 1 : 1 的培养基作为对照。分别接入直径为 6 mm 的靶标菌菌饼,26 ℃ 恒温培养。每处理重复 3 次。5 d 后用十字交叉法测量菌落直径,按 (1) 式计算目标化合物对菌丝生长的抑制率。所得数据经 SPSS 软件处理,求得 EC50 值、毒力回归方程和相关系数。

|
(1) |
序列分析结果表明,菌株 SN269 的 16S rDNA 序列长度为 1 406 bp,将该序列上传至 NCBI GenBank 获得登记号 KU240003,与 GenBank 中的序列进行相似性比较,发现其与 Xenorhabdus bovienii TB30 (DQ208306.1) 的亲缘关系最近,因此初步鉴定其为伯氏致病杆菌 Xenorhabdus bovienii SN269。
2.2 活性成分分离对致病杆菌 SN269 的次生代谢产物粗提物分别进行了正相硅胶柱层析,共得到 A~F 6 个部分,其质量依次为 0.109、0.073、3.87、4.40、5.45 和 0.611 g。利用凝胶柱层析对 D 部分进一步纯化,得到了目标产物 D3 1.7 g。
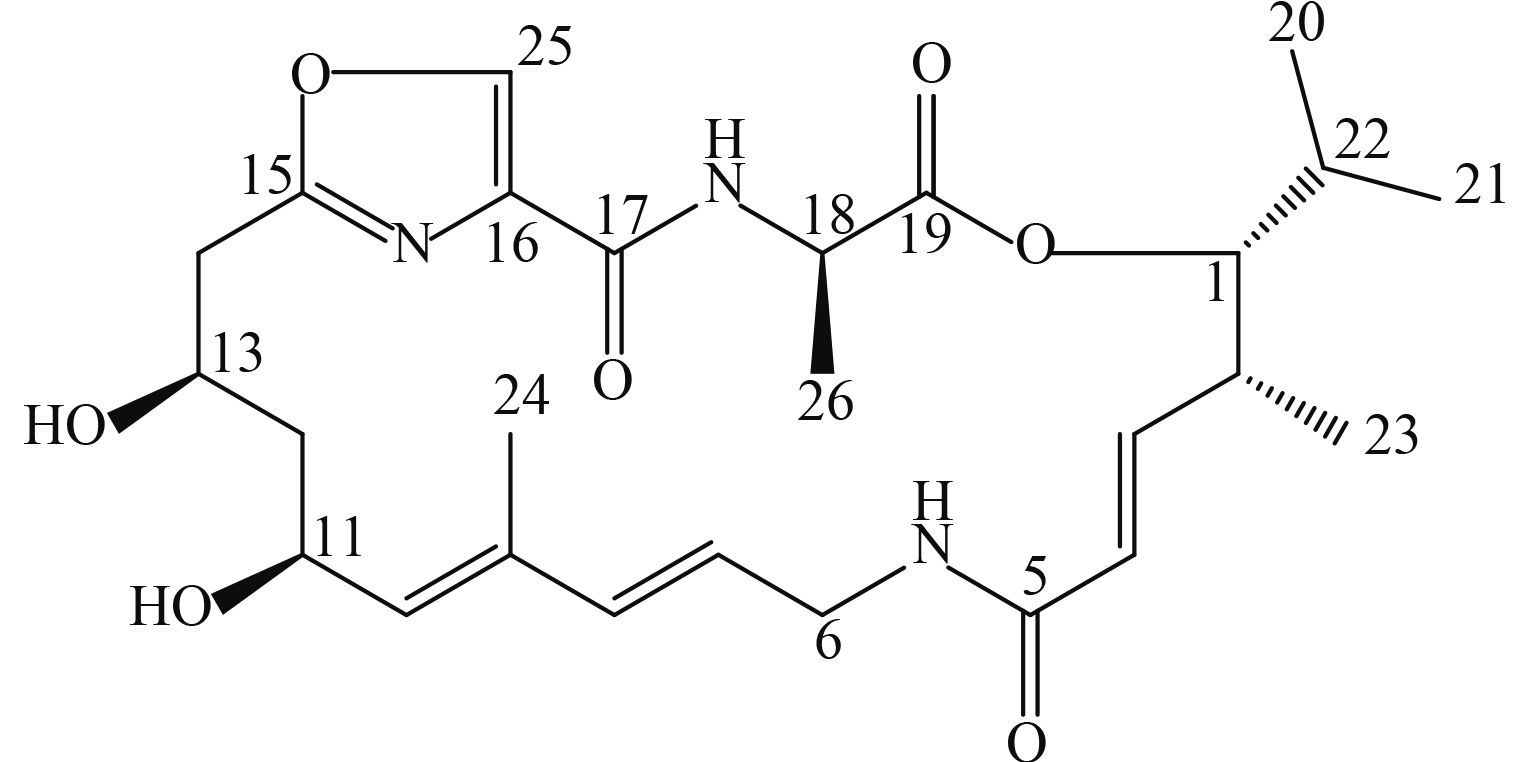
2.3 活性成分结构鉴定化合物 D3 为无色无味固体,易溶于氯仿,其比旋光度值为[α]D25-24.36°(c1.3, CHCL3)。高分辨质谱给出其准分子离子峰 [M+Na]+ 为 526.253 3,推出其分子式为 C26H37N3O7。分别利用 1H NMR 和 13C NMR 见(表 1) 结合其高分辨质谱对 D3 进行综合解析,将所得数据与文献数据[13-14]进行比对,发现其与 madumycin Ⅱ 的结构特征相符,因此确定该化合物为 madumycin Ⅱ。结构式见图式 1 。
|
|
表 1 化合物 D3 的 1H NMR 和 13C NMR 数据 Table 1 1H NMR and 13C NMR spectroscopic data of compound D3 |
|
图式 1 化合物 D3 (madumycin II) 的化学结构 Scheme1 Structure of compound D3 (madumycin II) |
2.4 化合物的抑菌活性
结果 (表 2) 表明:化合物 madumycin II 对 8 种病原真菌均有一定的抑制作用,其中对辣椒疫霉和番茄灰霉病菌的抑制活性最高,其 EC50 值分别为 35.32 和 35.40 mg/L,其次为对玉米大斑病菌。
|
|
表 2 化合物 madumycin II 对植物病原真菌的抑菌活性 Table 2 Antifungal activity of madumycin II against phytopathogenic fungi |
3 讨论
昆虫病原线虫共生菌的次生代谢产物具有广泛的杀虫和抑菌活性,对其活性成分进行分离纯化及结构鉴定将为新型生物农药的研发奠定基础。已有研究表明,madumycin Ⅱ 对革兰氏阳性细菌尤其是耐甲氧西林的金黄色葡萄球菌具有强烈的抑制作用[10]。本研究结果表明,该化合物对供试的 8 种植物病原真菌也有一定程度的抑制作用,其中对辣椒疫霉、番茄灰霉病菌和玉米大斑病菌具有较好的抑制作用,EC50 值均小于 50 mg/L,显示其在植物病原真菌生物防治方面的潜在应用前景。
尽管 Tavares 等对 madumycin Ⅱ 的全合成进行了研究,但合成路线长,副产物较多,转化率和回收率均较低,并且反应条件苛刻[9]。本研究前期筛选获得一株 madumycin Ⅱ 产量相对较高的伯氏致病杆菌 SN269 菌株,平均产量为 60.7 mg/L,并利用正相硅胶柱层析和凝胶柱层析的方法对其进行了分离纯化,获得 1.7 g madumycin Ⅱ,约占 SN269 所有次生代谢产物的 10.6%。与化学合成法相比,采用生物发酵法生产 madumycin Ⅱ 具有操作过程简单、反应条件温和等优点。本研究为进一步对 madumycin Ⅱ 进行结构修饰,获得具有更好生物活性的 madumycin Ⅱ 衍生物奠定了基础。
| [1] | FORST S, DOWDS B, BOEMARE N, et al. Xenorhabdus and Photorhabdus spp.:bugs that kill bugs[J]. Annu Rev Microbiol, 1997, 51 :47–72. doi:10.1146/annurev.micro.51.1.47 |
| [2] | RICHARDS G R, HERBERT E E, PARK Y, et al. Xenorhabdus nematophila lrhA is necessary for motility, lipase activity, toxin expression, and virulence in Manduca sexta insects[J]. J Bacteriol, 2008, 190 (14):4870–4879. doi:10.1128/JB.00358-08 |
| [3] | PARK J M, KIM M, MIN J, et al. Proteomic identification of a novel toxin protein (Txp40) from Xenorhabdus nematophila and its insecticidal activity against larvae of Plutella xylostella[J]. J Agric Food Chem, 2012, 60 (16):4053–4059. doi:10.1021/jf204351f |
| [4] | SERGEANT M, BAXTER L, JARRETT P, et al. Identification, typing, and insecticidal activity of Xenorhabdus isolates from entomopathogenic nematodes in United Kingdom soil and characterization of the xpt toxin loci[J]. Appl Environ Microbiol, 2006, 72 (9):5895–5907. doi:10.1128/AEM.00217-06 |
| [5] | SUNDAR L, CHANG F N. Antimicrobial activity and biosynthesis of indole antibiotics produced by Xenorhabdus nematophilus[J]. J Gen Microbiol, 1993, 139 (12):3139–3148. doi:10.1099/00221287-139-12-3139 |
| [6] | LI J X, CHEN G H, WEBSTER J M. Nematophin, a novel antimicrobial substance produced by Xenorhabdus nematophilus (Enterobactereaceae)[J]. Can J Microbiol, 1997, 43 (8):770–773. doi:10.1139/m97-110 |
| [7] | HOUARD J, AUMELAS A, NOËL T, et al. Cabanillasin, a new antifungal metabolite, produced by entomopathogenic Xenorhabdus cabanillasii JM26[J]. J Antibiot, 2013, 66 (10):617–620. doi:10.1038/ja.2013.58 |
| [8] | AHMED F, DONALDSON W A. Chemistry and biology of the streptogramin A antibiotics[J]. Mini-Rev Org Chem, 2007, 4 (2):159–181. doi:10.2174/157019307780599315 |
| [9] | TAVARES F, LAWSON J P, MEYERS A I. Total synthesis of streptogramin antibiotics. (-)-Madumycin II[J]. J Am Chem Soc, 1996, 118 (13):3303–3304. doi:10.1021/ja954312r |
| [10] | LEFEVRE J, KINGSTON D. Additions and corrrections-biosynthesis of antibiotics of the virginiamycin family. 4. Biosynthesis of A2315A[J]. J Org Chem, 1985, 50 (23):4666. |
| [11] |
奥斯伯F M, 金斯顿R E, 塞德曼J G, 等. 精编分子生物学实验指南[M]. 马学军, 跃龙, 译. 4版. 北京:科学出版社, 2005
AUSUBEL F M, KINGSTON R E, SEIDMAN J G, et al. Short protocols in molecular biology[M]. MA X J, YUE L, trans. 4th ed. Beijing:Scientific Press, 2005. |
| [12] |
祁之秋, 纪明山, 陆田, 等. 黄瓜褐斑病防治药剂的离体活性筛选[J]. 植物保护, 2009,35 (2):140–143.
QI Z Q, JI M S, LU T, et al. In vitro screening effective fungicides against Corynespora cassiicola[J]. Plant Protection, 2009, 35 (2):140–143. |
| [13] | CHAMBERLIN J W, CHEN S. A2315, New antibiotics produced by Actinoplanes philippinensis. 2. Structure of A2315A[J]. J Antibiot, 1977, 30 (3):197–201. doi:10.7164/antibiotics.30.197 |
| [14] | LEFEVRE J W, GLASS T E, KOLPAK M X, et al. Biosynthesis of antibiotics of the virginiamycin family, 2. Assignment of the 13C-NMR spectra of virginiamycin M1 and antibiotic A2315A[J]. J Nat Prod, 1983, 46 (4):475–480. doi:10.1021/np50028a008 |
 2016, Vol. 18
2016, Vol. 18


