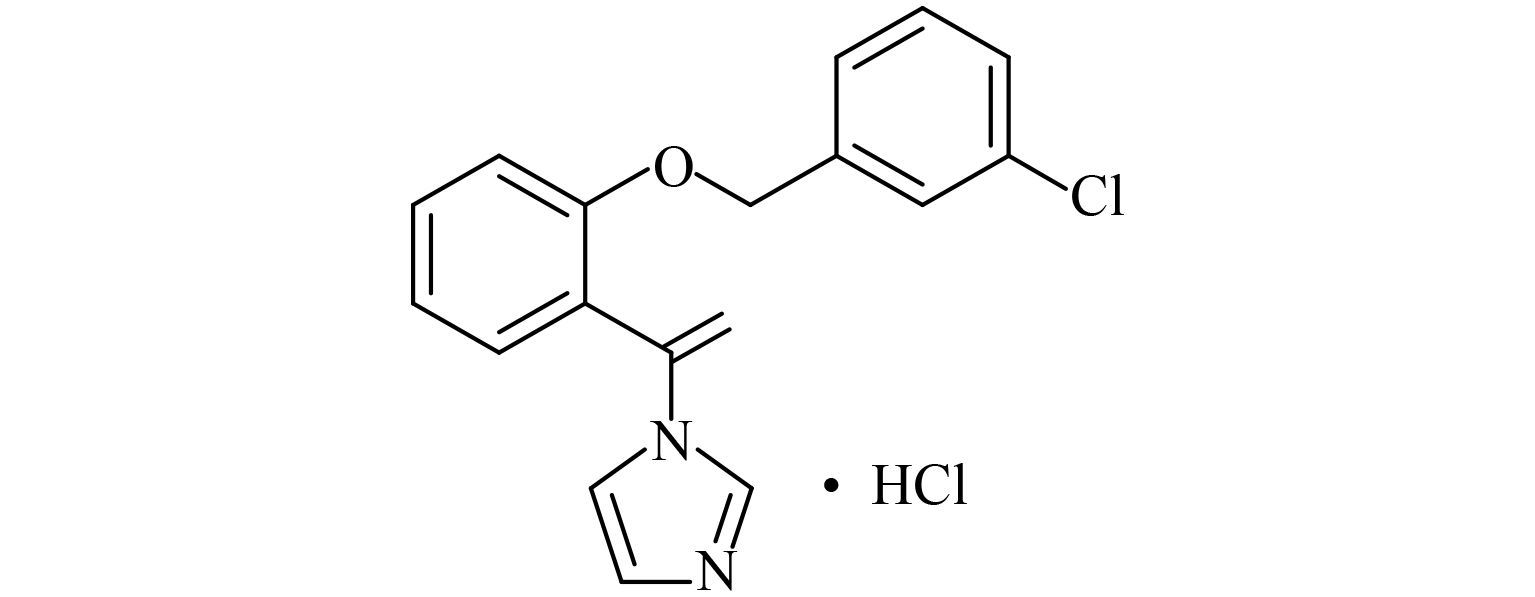
盐酸氯康唑 (croconazole hydrochloride),化学名称为 1-[1-[2-[(3-氯苯基)甲氧基]苯基]乙烯基] 咪唑盐酸盐 (结构式见图式 1),是一种高效、低毒的广谱抗真菌药物,主要用于手、足、股及体部皮癣,念珠菌性指间糜烂症及甲周炎等[1]。
|
图式 1 盐酸氯康唑结构式 Scheme1 The structure of croconazole hydrochloride |
1,2,4-三氮唑类衍生物具有独特的生物活性[2],毒性低,内吸性高,常被用作医药和农药的结构组成单元,在医药和农药合成方面起着重要的作用[3]。在农药界,1,2,4-三唑类化合物因具有高效广谱的抗菌、除草、杀虫以及调节植物生长等活性而受到高度重视,先后开发出一系列商品化农药新品种[4]。迄今为止,对该类化合物的结构改造主要是保留三唑环的分子结构,而对其他部分进行适当的改造和修饰,以达到进一步扩大杀菌范围和减少用药量[5-6]。
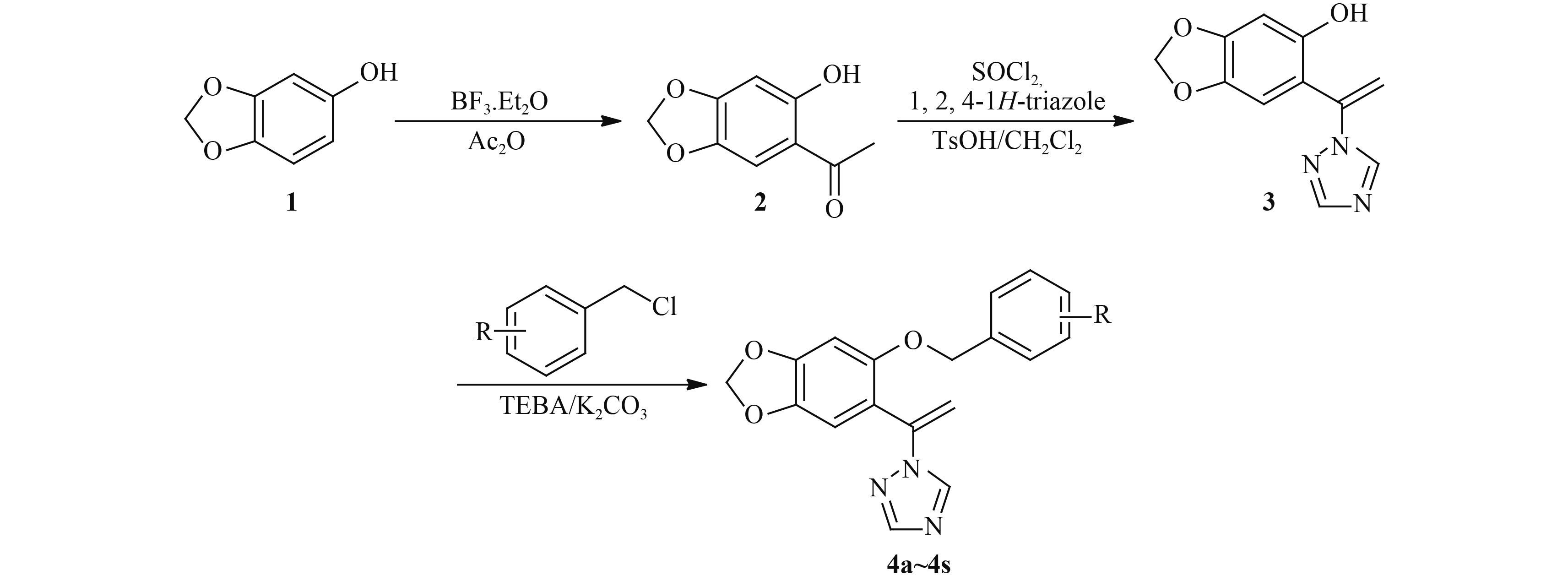
本研究在盐酸氯康唑的结构基础上,将咪唑基团替换成 1,2,4-三氮唑基,并将合成盐酸氯康唑时的底物苯酚换成 3,4-亚甲二氧基苯酚 (俗称芝麻酚),经过酰化、加成和醚化 3 步反应,得到 19 个未见文献报道的目标化合物,并初步测定其抑菌活性。目标化合物的合成路线见图式 2。
|
图式 2 目标化合物 4a~4s 的合成路线 Scheme2 The synthesis route of target compounds 4a~4s |
1 实验部分 1.1 仪器与药剂
XT-4 型显微熔点测定仪 (温度未校正,北京泰克仪器有限公司);Bruker Tensor 27 FF-IR 型红外光谱仪和 Bruker Avance Ⅲ 500 核磁共振仪 (瑞士 Bruker BioSpin 公司)(以 TMS 为内标,CDCl3 为溶剂);Finnigan Trace 型质谱仪 (美国 ThermoFisher 公司)。腈菌唑 (myclobutanil) 原药,纯度 98% (一凡生物科技集团有限公司);芝麻酚 (sesamol),纯度 98% (苏州大新助剂厂);二氯甲烷经无水处理,其他试剂均为市售分析纯。
1.2 化合物的合成 1.2.1 化合物 2参考文献[7]方法合成。淡黄色针状结晶,m.p.112~114 ℃,收率 76% (文献值[7] 收率 61%,m. p.112~114 ℃)。
1.2.2 化合物 3参考文献[8]方法合成。称取 3.067 g (0.010 mol) 1,2,4-三氮唑于三口瓶中,加入无水二氯甲烷,置于冰盐浴下搅拌。用恒压滴液漏斗缓慢滴加 0.8 mL (0.012 mol) 经适量无水二氯甲烷稀释的重蒸氯化亚砜,此时液体变成乳白色。5 min 后,再用恒压滴液漏斗缓慢滴加用无水二氯甲烷溶解的 2.000 g 化合物 2 (0.010 mol),液体变成黄色。滴毕,室温下搅拌 2 h。加入饱和碳酸氢钠溶液,有机相依次用饱和碳酸氢钠溶液、水、饱和氯化钠溶液洗涤,无水硫酸钠干燥。过滤,滤液中加入 0.190 g (0.001 mol) 对甲苯磺酸 (TsOH),采用二氯甲烷回流带水方法脱水,回流 1.5 h 后,溶液由黄色透明状变为红褐色浑浊状。抽滤,得滤液。滤液依次用饱和碳酸氢钠溶液、水、饱和氯化钠溶液洗涤,无水硫酸钠干燥,而后减压除去二氯甲烷,得粗产物,硅胶柱层析 [洗脱剂为 V (二氯甲烷) : V (甲醇) = 100 : 1],得 0.412 g黏稠状类白色产物 (3),收率为 20%。
1.2.3 目标化合物 4a~4s参考文献[9]方法合成。以 4a 为例:称取 0.343 g (1.258 mmol) 化合物 3,加入无水丙酮,待其溶解后加入 0.213 g (1.542 mmol) 碳酸钾和 0.023 g (0.100 mmol) 苄基三乙基氯化铵 (TEBA),室温下搅拌 15 min,再加入 0.3 mL (2.571 mmol) 氯苄,室温下搅拌 10 min 后移置油浴下回流,TLC [展开剂为 V (二氯甲烷) : V (甲醇) = 8 : 1] 监测反应进程,中间补加适量氯苄,19 h 后反应结束 (此时反应液呈淡红色,有未溶固体)。过滤,滤液减压除去丙酮,经柱层析 [洗脱剂为 V (二氯甲烷) : V (甲醇) = 150 : 1] 分离,得淡黄色结晶 0.290 g,收率 72%,m.p. 99~101 ℃。按照相同的方法合成化合物 4b~4s。
1.3 抑菌活性测定7 种供试病原菌均由西北农林科技大学无公害农药研究中心提供。以腈菌唑 (myclobutanil) 为阳性对照,丙酮为空白对照,采用抑制菌丝生长速率法[10-12]测试 19 个目标化合物在 50 μg/mL 下对 7 种供试病菌的抑菌活性,并对抑制率超过 85% 的化合物进行半数有效浓度 (EC50 值) 的测定。同样,以腈菌唑为阳性对照,丙酮为空白对照,采用抑制菌丝生长速率法[10-12]测试 2 个目标化合物对相应病原真菌的 EC50值。
2 结果与讨论 2.1 目标化合物的结构表征目标化合物的理化数据及 ESI-MS 数据见表 1,1H NMR 和 13CNMR 数据见表 2。在 1H NMR 谱图中,亚甲二氧基 (-OCH2O-) 的 H 由于吸电子的诱导效应,表现为单峰,δ 在 6.00 左右;目标化合物 4a~4s 的结构相似,只是与亚甲氧基 (-OCH2-) 相连苯环上的取代基有差异,1H NMR 谱图呈现一定的规律性。
|
|
表 1 化合物 4a~4s 的理化性质及质谱数据 Table 1 Physico-chemical properties and ESI-MS data of compounds 4a-4s |
|
|
表 2 目标化合物 4a~4s 的核磁共振氢谱及碳谱数据 Table 2 1H NMR, 13C NMR data of the target compounds 4a-4s |
2.2 抑菌活性 2.2.1 抑菌活性初筛
结果表明:在 50 μg/mL 下,所有目标化合物对 7 种供试病原菌均有不同程度的抑制作用。经过 3 次重复试验,化合物 4d 和 4m 对番茄早疫病菌的抑制率均超过 85%,其中 4m 对烟草赤星病原菌的抑制率尤佳,达到 93.2%。初步构效关系表明,苯环上取代基类型和位置的不同对化合物的抑菌活性有重要影响。
2.2.2 目标化合物的 EC50 值结果 (表 3 和表 4) 表明:尽管化合物 4d 和 4m 对番茄早疫病原菌以及 4m 对烟草赤星病原菌的 EC50 值均大于腈菌唑,但两者已在同一个数量级,具有开发为新型抗菌药物的潜能。
|
|
表 3 化合物 4d 和 4m 对番茄早疫病菌的毒性回归方程 (浓度-效应) 及其 EC50 值 Table 3 Toxicity regression equations for concentration-effect and EC50 values of compounds 4d and 4m against A. solani |
|
|
表 4 化合物 4m 对烟草赤星病菌的毒性回归方程 (浓度-效应) 及其 EC50 值 Table 4 Toxicity regression equations for concentration-effect and EC50 values of compound 4m against A. alternata |
| [1] |
周明德, 张文典. 盐酸氯康唑的合成[J]. 中国医药工业杂志, 1992,23 (8):101–102.
ZHOU M D, ZHANG W D. Synthesis of cloconazole hydrochloride[J]. Chin J Pharm, 1992, 23 (8):101–102. |
| [2] | ODDS F C, BROWN A J P, GOW N A R. Antifungal agents:mechanisms of action[J]. Trends Microbiol, 2003, 11 (6):272–279. doi:10.1016/S0966-842X(03)00117-3 |
| [3] | KALE P, JOHNSON L B. Second-generation azole antifungal agents[J]. Drugs Today (Barc), 2005, 41 (2):91–105. doi:10.1358/dot.2005.41.2.882661 |
| [4] | PRICE D A, GAYTON S, SELBY M D, et al. Initial synthesis of UK-427,857(Maraviroc)[J]. Tetrahedr Lett, 2005, 46 (30):5005–5007. doi:10.1016/j.tetlet.2005.05.082 |
| [5] |
张琨. 含噻嗪酰胺的新三唑类化合物的合成及抑菌活性研究[D]. 杨凌:西北农林科技大学, 2012
ZHANG K. Study on synthesis and antifungal activity of novel triazole compound containing thiazideamide[D]. Yangling:Northwest A & F University, 2012. |
| [6] |
何勇. 新三唑类化合物的合成及抑菌活性(Ⅲ)[D]. 杨凌:西北农林科技大学, 2008
HE Y. Synthesis and antifungal activity of novel triazole compounds(Ⅲ)[D]. Yangling:Northwest A & F University, 2008. |
| [7] |
史雯, 孙建军, 张雯, 等. 卡枯醇类似物的合成及抑菌活性[J]. 西北农业学报, 2015,24 (10):172–176.
SHI W, SUN J J, ZHANG W, et al. Synthesis and antifungal activities of kakuol analogues[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2015, 24 (10):172–176. |
| [8] | OGATA M, MATSUMOTO H, TAKAHASHI K, et al. Synthesis and antiarrhythmic activity of new 1-[1-[2-[3-(alkylamino)-2-hydroxypropoxy] phenyl]vinyl]-1H-imidazoles and related compounds[J]. J Med Chem, 1984, 27 (9):1142–1149. doi:10.1021/jm00375a010 |
| [9] |
龚军性, 周文明, 何勇, 等. 1-[(6-烷(苄)氧基-3,4-亚甲二氧基)苯基]-2-(1H-1,2,4-三唑)-乙酮(醇)类化合物的合成及抑菌活性[J]. 应用化学, 2009,26 (5):523–529.
GONG J X, ZHOU W M, HE Y, et al. Synthesis and fungicidal activities of 1-[6-alkoxy (benzyloxy-3, 4-methylenedioxypheny)-2-(1H-1, 2, 4-triazole-1-yl)-enthone(ol) compounds[J]. Chin J App Chem, 2009, 26 (5):523–529. |
| [10] |
吴文君.
植物化学保护实验技术导论[M]. 西安: 陕西科学技术出版社, 1998 .
WU W J. Introduction to experimental techniques of plant chemical protection[M]. Xi'an: Shaanxi Science and Technology Press, 1998 . |
| [11] | HOU Z, ZHU L F, YU X C, et al. Design, synthesis, and structure-activity relationship of new 2-aryl-3, 4-dihydro-β-carbolin-2-ium salts as antifungal agents[J]. J Agric Food Chem, 2016, 64 (14):2847–2854. doi:10.1021/acs.jafc.6b00505 |
| [12] | ZHANG W, SUI G Q, LI Y L, et al. Synthesis and in vitro antifungal activities of novel benzamide derivatives containing a triazole moiety[J]. Chem Pharm Bull, 2016, 64 (6):616–624. doi:10.1248/cpb.c16-00056 |
 2016, Vol. 18
2016, Vol. 18


