荠菜 Capsella bursa-pastoris 是中国小麦产区的主要恶性杂草之一[1-2]。以苯磺隆为代表的乙酰乳酸合成酶抑制剂类除草剂依靠其高活性、低毒、低残留及高选择性的特点,长期被用作为防除麦田荠菜的主要药剂。然而,由于苯磺隆作用位点单一,且大量、频繁使用,其在中国主要冬麦区对荠菜的防治效果已明显下降,部分地区甚至出现了防治失败的现象,表明荠菜已对苯磺隆产生了较高水平的抗性[3]。
乙酰乳酸合成酶 (简称 ALS,EC 4.1.3.18) 是植物及微生物体内亮氨酸、异亮氨酸及缬氨酸生物合成过程中第一阶段的关键酶[4-5]。目前,已研制开发的 ALS 抑制剂类除草剂主要有五大类:磺酰脲类 (sulfonylureas,SU)[6]、嘧啶硫代苯甲酸酯类 (pyrimidinylthiobenzoates,PTB)[7]、咪唑啉酮类 (imidazolinones,IMI)[8]、磺酰胺羰基三唑啉酮类 (sulfonylaminocarbonyltriazolinones,SCT)[9] 及三唑并嘧啶磺酰胺类 (triazolopyrimidines,TP)[10],其中以磺酰脲类、三唑并嘧啶磺酰胺类和咪唑啉酮类的商品化除草剂品种最多,在田间应用最为广泛[11]。自 1982 年第一个磺酰脲类除草剂品种氯磺隆获准注册登记后,仅使用了 5 年就发现了对其产生抗药性的野莴苣 Lactuca serriola[12] 和地肤 Kochia scoparia[13]。此后,对 ALS 抑制剂类除草剂产生抗性的杂草种类迅速增加,截至目前,全球已有 44 个国家的共计 159 种 (97 种双子叶和 62 种单子叶) 杂草对 ALS 抑制剂类除草剂产生了抗性,其中中国共报道了 14 例[14]。
目前,有关杂草对 ALS 抑制剂类除草剂抗性机理的研究主要集中在杂草对除草剂的代谢解毒、吸收与传导以及杂草中除草剂作用靶标基因突变 3 个方面[15]。其中,靶标基因突变是杂草对 ALS 抑制剂类除草剂产生抗性的重要原因之一[16-18]。目前已发现 8 个 ALS 氨基酸位点突变能够导致杂草对该类除草剂产生抗性,分别是第 122 位丙氨酸 (Ala)、第 197 位脯氨酸 (Pro)、第 205 位丙氨酸 (Ala)、第 376 位天冬氨酸 (Asp)、第 377 位精氨酸 (Arg)、第 574 位色氨酸 (Trp)、第 653 位丝氨酸 (Ser) 以及第 654 位甘氨酸 (Gly),其中已报道突变种类最多的是第 197 位的脯氨酸突变[19-21]。金涛和崔海兰分别在 2011 及 2012 年报道了 197 位脯氨酸 (Pro) 突变为丝氨酸 (Ser)、苏氨酸 (Thr)、组氨酸 (His) 及亮氨酸 (Leu) 是荠菜对 ALS 抑制剂类除草剂苯磺隆产生抗性的原因[22-23]。近年来,由于苯磺隆的持续使用,出现抗 ALS 抑制剂类除草剂杂草的地块持续增加,抗性杂草问题在中国小麦田日益恶化。为了进一步阐明荠菜对 ALS 抑制剂类除草剂产生抗性的分子机制,本研究测定了抗性种群对苯磺隆的抗性水平,同时扩增、比对了抗性及敏感荠菜种群的基因,并测定了抗性荠菜种群对不同 ALS 抑制剂类除草剂的交互抗性,以期为荠菜的抗性治理和延缓其抗性种群发展提供科学依据。
1 材料与方法 1.1 供试材料杂草种子:抗苯磺隆荠菜种群 15-ZMD-5 于 2015 年 5 月采自中国河南省驻马店市汝南县驿城区水屯村麦田,该麦田已连续十几年使用苯磺隆防除阔叶杂草;敏感种群 15-ZMD-1 采自同一地区的非麦田 (从未使用过除草剂)。
除草剂:75% 苯磺隆水分散粒剂 (tribenuron-methyl,WG),上海杜邦农化有限公司;10% 嘧草硫醚水剂 (pyrithiobac sodium,AS),山东华阳农药化工集团有限公司;50 g/L 双氟磺草胺悬浮剂 (florasulam,SC),山东绿霸化工股份有限公司;7.5% 啶磺草胺水分散粒剂 (pyroxsulam,WG),上海陶氏益农公司;70% 氟唑磺隆水分散粒剂 (flucarbazone-Na,WG),上海爱利思达生物化学品有限公司;10% 咪唑乙烟酸水剂 (imazethapyr,AS),山东滨农科技有限公司。
主要仪器:GA110 型万分之一电子天平,德国赛多利斯公司;5424R 型台式高速冷冻离心机,德国 Eppendorf 公司;T100梯度 PCR 仪,美国 Bio-Rad 公司;DYY-6C 电泳仪,北京六一仪器厂;RXZ 型人工气候箱,宁波江南仪器厂;ASS-4 型自动控制农药喷洒系统,国家农业信息化工程技术中心研制,北京盛恒天宝科技有限公司生产;ChampGel 6 000 紫外凝胶成像系统,北京赛智创业科技有限公司。
1.2 试验方法 1.2.1 荠菜对苯磺隆的抗性水平测定采用整株水平测定法[24]。选取籽粒饱满一致的荠菜种子,于直径 9 cm 的培养皿中催芽 (光照培养箱,光周期 L/D:12 h/12 h;温度:白天 20 ℃,晚上 15 ℃)至露白后,以每盆 15 粒的密度均匀播种于直径 12 cm 的塑料盆内,置于可控日光温室内常规培养 (自然光照,温度 18~33 ℃,相对湿度 50%~70%) 。待幼苗生长至 2 片叶后间苗,每盆保留 10 株长势基本一致、均匀分布的荠菜植株。待荠菜生长至 3~4 叶期,采用 ASS-4 型自动定量喷雾系统进行茎叶喷雾处理。设定喷雾压力为 0.275 MPa,喷液量为 450 L/hm2。
根据预试验结果确定苯磺隆的浓度 (按有效成分计)。15-ZMD-1 敏感种群分别喷施 0、0.001、0.01、0.1、1、10 及 100 g/hm2,15-ZMD-5 抗性种群分别喷施 0、0.01、0.1、1、10、100 及 1 000 g/hm2。每处理设 3 个重复,试验重复 2 次。喷药 21 d 后,剪取荠菜植株地上部分,于恒温干燥箱内 70 ℃烘干 72 h 后,称量干重。
1.2.2 荠菜抗性和敏感种群 ALS 基因差异检测 1.2.2.1 基因组 DNA 提取待荠菜生长至 4 叶期后,分别剪取抗性和敏感种群单株的幼嫩叶片,迅速用液氮研磨处理后,采用 CTAB 法[25] 提取 DNA。
1.2.2.2 引物合成根据 NCBI GenBank 登记的荠菜 ALS 基因序列 (HQ 880660.1) 设计了 2 对扩增引物以及 1 条测序引物 (表 1),由生工生物工程 (上海) 股份有限公司合成。
|
|
表 1 荠菜 ALS 基因扩增引物 Table 1 Primers designed for the ALS gene of C. bursa-pastoris |
1.2.2.3 ALS 基因序列扩增
PCR 序列扩增反应体系总体积为 25 μL,包括:1 μL 基因组 DNA 模板,1 μL 正向引物 (10 μmol/L),1 μL 反向引物 (10 μmol/L),0.5 μL Tap plus DNA 聚合酶 (2.5 U/μL),2.5 μL 10 × Tap plus Buffer,2μL dNTP Mixture (2.5 mmol/L),17 μL 双蒸水。反应条件为:94 ℃ 预变性 5 min;94 ℃ 变性 30 s,56 ℃ 退火 40 s,72 ℃ 延伸 90 s,34 个循环;72 ℃ 再延伸 10 min;4 ℃ 保存[26]。扩增区域包含了已报道的 ALS 区域的全部 8 个突变位点,扩增分两个反应进行,序列 1 长度为 1 196 bp,序列 2 长度为 1 081 bp,两组反应条件一致。
1.2.2.4 PCR 产物测序PCR 反应结束后,取 5 μL 扩增产物于含质量分数为 1% 琼脂糖的凝胶中进行电泳检测。将有特异性目的条带的阳性 PCR 产物样品送生工生物工程 (上海) 股份有限公司测序,所用测序引物为表 1 中的 Forward 1、Forward 2和 Forward 3。采用 Chromas 2.4.1 软件对测序结果进行分析。
1.2.2.5 PCR 产物克隆及测序参照毕亚玲等[27]的方法。 PCR 反应结束后,取 10 μL 扩增产物于 1% 的琼脂糖凝胶中电泳,对阳性目的产物条带进行回收。将回收后的目的条带连接到 pEASY-T1 载体上,转至冰浴融化的大肠杆菌感受态细胞 Trans1-T1 (存于 -80 ℃) 中,37 ℃ 恒温培养 2 h 后,均匀涂布于 LB 固体培养基 (含 Ampicilin 和 X-gal/IPTG) 上,37 ℃ 培养过夜。挑取白色菌落至 LB 液体培养基 (含 Ampicilin) 中振荡培养,以菌液为模板再次进行 PCR 鉴定。就所得目的条带进行阳性克隆测序验证,将测序结果在 NCBI 上与荠菜 ALS 基因进行 BLAST 比对,同时采用 DNAMAN 6.0.3 软件对扩增所得抗性和敏感种群荠菜 ALS 基因进行比对分析。
1.2.3 抗苯磺隆荠菜种群对 5 种 ALS 类除草剂的交互抗性采用 1.2.1 节方法测定 15-ZMD-1 和 15-ZMD-5 种群对嘧草硫醚、双氟磺草胺、啶磺草胺、氟唑磺隆和咪唑乙烟酸 5 种 ALS 类除草剂的敏感性,分析抗性种群对以上各除草剂的交互抗性。除草剂处理浓度 (有效成分) 见表 2。
|
|
表 2 荠菜对不同 ALS 类除草剂敏感性测定中除草剂的浓度 Table 2 The herbicide concentrations used for the determination of the sensitivity to ALS-inhibiting herbicides of C. bursa-pastoris |
1.3 数据处理分析
采用 SPSS 20.0 软件的 ANOVA 方法进行差异显著性分析,通过 SigmaPlot 12.5 软件的双逻辑非线性回归模型 y = C + {(D – C)/[1 + (x/GR50) b]} 计算抑制 50% 杂草生长所需的除草剂浓度 (GR50 值)。式中:y 为除草剂不同使用剂量下所测的杂草地上部分干重;x 为除草剂使用剂量;C 为剂量反应下限;D 为剂量反应上限;b 为斜率。抗性倍数 = 抗性种群 (15-ZMD-5) 的 GR50 值/敏感种群 (15-ZMD-1) 的 GR50 值。
2 结果与分析 2.1 荠菜对苯磺隆的抗性水平由表 3 中数据可知,荠菜 15-ZMD-5 种群对苯磺隆已产生了高水平抗性,其抗性倍数为 219.6。
|
|
表 3 荠菜对苯磺隆的抗性水平 Table 3 Resistance ratio to tribenuron-methyl of C. bursa-pastoris |
2.2 荠菜抗性及敏感种群 ALS 基因差异
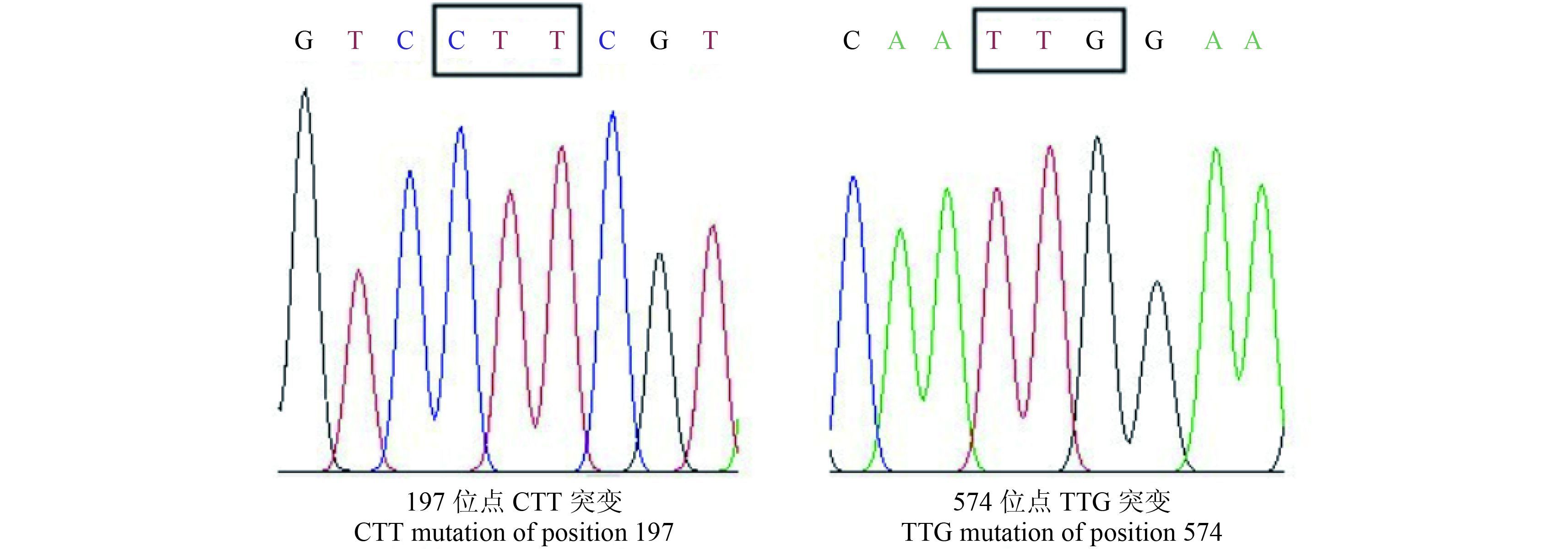
通过 DNAMAN 6.0.3 软件对扩增得到的抗性及敏感种群荠菜 ALS 基因 DNA 序列进行比对,发现 15-ZMD-5 种群中同时存在 CCT-197-CTT (脯氨酸突变为亮氨酸) 和 TGG-574-TTG (色氨酸突变为亮氨酸) 两种突变形式 (图 1)。为明确抗性种群 15-ZMD-5 发生两种形式突变的频率,本研究在 15-ZMD-5 种群中随机选取 100 个单株分别进行了基因组 DNA 提取、PCR 扩增和产物直接测序。结果发现,15-ZMD-5 种群中同时存在 197 位点突变,574 位点突变以及 197、574 位点同时突变3 种突变形式的植株。其突变频率见表 4。
|
图 1 荠菜抗性种群 15-ZMD-5 的 ALS 基因突变形式 Fig. 1 ALS gene mutations of the resistant population of C. bursa-pastoris (15-ZMD-5) |
|
|
表 4 抗性荠菜种群中基因突变形式及突变频率 Table 4 Mutation form and mutation ratio of resistant population of C. bursa-pastoris |
2.3 荠菜抗苯磺隆种群对 5 种 ALS 类除草剂的交互抗性
由表 5 可知,荠菜抗苯磺隆种群 15-ZMD-5 对嘧草硫醚、啶磺草胺和氟唑磺隆均产生了高水平的抗性,抗性倍数分别为 41.2、79.3 和 87.8;对双氟磺草胺和咪唑乙烟酸产生了低水平的抗性,抗性倍数为 8.5 和 5.6。
|
|
表 5 荠菜抗性种群 15-ZMD-5 对 5 种 ALS 类除草剂的交互抗性 Table 5 The resistance level of resistant populations of C. bursa-pastoris (15-ZMD-5) to 5 kinds of ALS-inhibiting herbicides |
3 讨论
Rubin[28] 以及张朝贤等[29] 报道,ALS 抑制剂连续重复使用 3~5 年以上,就可导致杂草对除草剂产生抗性。本研究中抗性种群采集地块使用苯磺隆防除阔叶杂草的历史已有 20 年以上,经整株水平法试验测定,15-ZMD-5 种群对苯磺隆产生了较高水平抗性,因此苯磺隆在该抗性种群采集地块已经失去应用价值。
基因突变是导致杂草对除草剂产生抗药性的重要原因。研究证实,ALS 序列中 8 个已知位点的氨基酸被取代后,均可导致杂草对 ALS 抑制剂类除草剂产生不同程度抗性[14]。本研究通过对抗性及敏感种群荠菜 ALS 基因区域进行提取、扩增、测序和比对后发现,15-ZMD-5 种群植株的 ALS 第 197 位和 574 位氨基酸发生了突变,197 位脯氨酸及 574 位色氨酸均突变成了亮氨酸。其中,574 氨基酸位点突变为第一次在荠菜种群中被发现。前人研究已证实,以上两种位点的突变均是导致杂草对 ALS 抑制剂类除草剂产生抗药性的重要分子基础[14]。因此,笔者认为 ALS 基因中 197 位点及 574 位点的突变是导致荠菜对 ALS 抑制剂类除草剂产生抗性的重要原因之一。但本研究仅对抗性种群中存在的靶标抗性进行了分析,对于该抗药性的产生是否与抗性种群荠菜本身吸收、传导及新陈代谢等非靶标因素有关仍需进一步研究证明。
本研究中随机选取的 100 株抗性种群荠菜经 PCR 产物直接测序发现,46% 发生了 Pro-197-Leu 突变,23% 发生了 Trp-574-Leu 突变,31% 同时发生了上述两种突变。由于在同一区域内长期使用作用机理相同甚至同一种除草剂而对杂草产生的高选择压,是导致该地区抗药性杂草生物型发生及发展的重要原因,随着抗性杂草的蔓延,将使得该地区杂草抗性问题日益严重。而当杂草种群中抗性群体所占比例上升,固有作用机理的除草剂防效呈现下降趋势时,盲目提高该类除草剂的使用浓度及使用频率会造成选择压的进一步增大,从而加剧杂草的抗性问题。关于上述 3 种突变形式在抗性种群中所占的比例是否会随着 ALS 抑制剂类除草剂的继续使用而发生变化,其中双突变种群的比例是否会随着选择压升高而进一步增大等,须待后续试验探究证明。
同时,本研究发现,抗苯磺隆荠菜种群对其他 ALS 抑制剂类除草剂也产生了不同程度的交互抗性。其中对嘧草硫醚、啶磺草胺和氟唑磺隆具有高水平交互抗性,对双氟磺草胺及咪唑乙烟酸具有低水平交互抗性。此结果与 Sibony 等[30] 发现 Pro-197-Leu 突变导致反枝苋 Amaranthus retroflexus 对三唑并嘧啶类、磺酰脲类、嘧啶硫代苯甲酸酯类及咪唑啉酮类除草剂抗药性的结论一致。Deng 等[31] 也报道,播娘蒿 Descurainia sophia 中的 Trp-574-Leu 突变导致其对 ALS 抑制剂类除草剂产生了抗性。关于荠菜抗性种群抗性分子机制及其对 ALS 抑制剂类除草剂交互抗性的研究,对新化合物的设计合成及新农药创制具有重要意义,同时对生产实践中合理选择应用不同作用机制的替代药剂,延缓和避免抗药性的发生及有效防治抗性荠菜种群,防止其抗药性问题持续恶化均具有重要的理论和现实意义。
| [1] |
刘君良, 王金信, 刘伟堂, 等. 中国北方部分地区麦田荠菜对苯磺隆的抗性水平[J]. 农药学学报, 2011,13 (4):347–353.
LIU J L, WANG J X, LIU W T, et al. Resistance level of Capsella bursa-pastoris to tribenuron-methyl in winter wheat fields in northern China[J]. Chin J Pestic Sci, 2011, 13 (4):347–353. |
| [2] |
毕亚玲, 刘君良, 王兆振, 等. 麦田抗性生物型荠菜对苯磺隆的抗性机制研究[J]. 农药学学报, 2013,15 (2):171–177.
BI Y L, LIU J L, WANG Z Z, et al. Mechanism of resistance to tribenuron-methyl in a resistant biotype of Capsella bursa-pastoris from wheat fields[J]. Chin J Pestic Sci, 2013, 15 (2):171–177. |
| [3] |
刘君良. 中国北方部分地区麦田杂草荠菜对苯磺隆的抗性研究[D]. 泰安: 山东农业大学, 2011: 1-18
LIU J L. The resistance of Capsella bursa-pastoris to tribenuron-methyl in winter wheat fields in northern China[D]. Tai'an: Shandong Agricultural University, 2011: 1-18. |
| [4] | DURNER J, GAILUS V, BÖGER P. New aspects on inhibition of plant acetolactate synthase by chlorsulfuron and imazaquin[J]. Plant Physiol, 1991, 95 (4):1144–1149. doi:10.1104/pp.95.4.1144 |
| [5] | UMBARGER H E. Amino acid biosynthesis and its regulation[J]. Annu Rev Biochem, 1978, 47 :533–606. doi:10.1146/annurev.bi.47.070178.002533 |
| [6] | CHALEFF R S, MAUVAIS C J. Acetolactate synthase is the site of action of two sulfonylurea herbicides in higher plants[J]. Science, 1984, 224 (4656):1443–1445. doi:10.1126/science.224.4656.1443 |
| [7] | STIDHAM M A. Herbicides that inhibit acetohydroxyacid synthase[J]. Weed Sci, 1991, 39 (3):428–434. |
| [8] | SHANER D L, ANDERSON P C, STIDHAM M A. Imidazolinones: potent inhibitors of acetohydroxyacid synthase[J]. Plant Physiol, 1984, 76 (2):545–546. doi:10.1104/pp.76.2.545 |
| [9] | SANTEL H J, BOWDEN B A, SORENSEN V M, et al. Flucarbazone-sodium: a new herbicide for grass control in wheat[J]. Weed Sci Soc Am Abstr, 1999, 39 :7. |
| [10] | GERWICK B C, SUBRAMANIAN M V, LONEY-GALLANT V I, et al. Mechanism of action of the 1, 2, 4-triazolo[J]. Pestic Sci, 1990, 29 (3):357–364. doi:10.1002/ps.v29:3 |
| [11] | WHITE A D, GRAHAM M A, OWEN M D K. Isolation of acetolactate synthase homologs in common sunflower[J]. Weed Sci, 2003, 51 (6):845–853. doi:10.1614/P2002-136 |
| [12] | MALLORY-SMITH C A, THILL D C, DIAL M J. Identification of sulfonylurea herbicide-resistant prickly lettuce (Lactuca serriola)[J]. Weed Technol, 1990, 4 (1):163–168. |
| [13] | PRIMIANI M M, COTTERMAN J C, SAARI L L. Resistance of kochia (Kochia scoparia) to sulfonylurea and imidazolinone herbicides[J]. Weed Technol, 1990, 4 (1):169–172. |
| [14] | HEAP I. The international survey of herbicide resistant weeds[DB/OL].[2016-09-10]. http://weedscience.org. |
| [15] |
彭学岗, 王金信, 刘君良, 等. 麦田抗性生物型猪殃殃对苯磺隆的抗性机制[J]. 农药学学报, 2009,11 (2):191–196.
PENG X G, WANG J X, LIU J L, et al. Mechanism of resistance to tribenuron-methyl in a resistant biotype of Galium aparine[J]. Chin J Pestic Sci, 2009, 11 (2):191–196. |
| [16] | EBERLEIN C V, GUTTIERI M J, MALLORY-SMITH C A, et al. Altered acetolactate synthase activity in ALS-inhibitor resistant prickly lettuce (Lactuca serriola)[J]. Weed Sci, 1997, 45 (2):212–217. |
| [17] | SIBONY M, RUBIN B. Molecular basis for multiple resistance to acetolactate synthase-inhibiting herbicides and atrazine in Amaranthus blitoides (prostrate pigweed)[J]. Planta, 2003, 216 (6):1022–1027. |
| [18] | MCCOURT J A, PANG S S, KING-SCOTT J, et al. Herbicide-binding sites revealed in the structure of plant acetohydroxyacid synthase[J]. Proc Natl Acad Sci USA, 2006, 103 (3):569–573. doi:10.1073/pnas.0508701103 |
| [19] | TRANEL P J, WRIGHT T R. Resistance of weeds to ALS-inhibiting herbicides: what have we learned?[J]. Weed Sci, 2002, 50 (6):700–712. doi:10.1614/0043-1745(2002)050[0700:RROWTA]2.0.CO;2 |
| [20] | YU Q, ZHANG X Q, HASHEM A, et al. ALS gene proline (197) mutations confer ALS herbicide resistance in eight separated wild radish (Raphanus raphanistrum) populations[J]. Weed Sci, 2003, 51 (6):831–838. doi:10.1614/02-166 |
| [21] | YU Q, HAN H P, POWLES S B. Mutations of the ALS gene endowing resistance to ALS-inhibiting herbicides in Lolium rigidum populations[J]. Pest Manag Sci, 2008, 64 (12):1229–1236. doi:10.1002/ps.v64:12 |
| [22] | JIN T, LIU J L, HUAN Z B, et al. Molecular basis for resistance to tribenuron in shepherd's purse (Capsella bursa-pastoris (L.) Medik.)[J]. Pestic Biochem Physiol, 2011, 100 (2):160–164. doi:10.1016/j.pestbp.2011.03.005 |
| [23] | CUI H L, LI X J, WANG G Q, et al. Acetolactate synthase proline (197) mutations confer tribenuron-methyl resistance in Capsella bursa-pastoris populations from China[J]. Pestic Biochem Physiol, 2012, 102 (3):229–232. doi:10.1016/j.pestbp.2012.01.007 |
| [24] | RYAN G F. Resistance of common groundsel to simazine and atrazine[J]. Weed Sci, 1970, 18 (5):614–616. |
| [25] |
李荣华, 夏岩石, 刘顺枝, 等. 改进的CTAB提取植物DNA方法[J]. 实验室研究与探索, 2009,28 (9):14–16.
LI R H, XIA Y S, LIU S Z, et al. CTAB-improved method of DNA extraction in plant[J]. Res Explor Lab, 2009, 28 (9):14–16. |
| [26] |
袁国徽, 王恒智, 赵宁, 等. 耿氏硬草对乙酰辅酶A羧化酶类除草剂抗性水平及分子机制初探[J]. 农药学学报, 2016,18 (3):304–310.
YUAN G H, WANG H Z, ZHAO N, et al. Resistance to acetyl-CoA carboxylase-inhibiting herbicides in Pseudosclerochloa kengiana and its molecular resistance mechanism[J]. Chin J Pestic Sci, 2016, 18 (3):304–310. |
| [27] |
毕亚玲, 吴翠霞, 郭文磊, 等. 抗精鰁唑禾草灵的日本看麦娘ACCase基因突变[J]. 植物保护学报, 2015,42 (3):447–452.
BI Y L, WU C X, GUO W L, et al. Mutation in the acetyl-CoA carboxylase confers resistance to fenoxaprop-P-ethyl in Alopecurus japonicus populations[J]. J Plant Prot, 2015, 42 (3):447–452. |
| [28] | RUBIN B. Herbicide-resistant weeds-the inevitable phenomenon: mechanisms, distribution and significance[J]. Z Pflanzenkr Pflanzenschutz, 1996, 15 :17–32. |
| [29] |
张朝贤, 倪汉文, 魏守辉, 等. 杂草抗药性研究进展[J]. 中国农业科学, 2009,42 (4):1274–1289.
ZHANG C X, NI H W, WEI S H, et al. Current advances in research on herbicide resistance[J]. Scientia Agricultura Sinica, 2009, 42 (4):1274–1289. |
| [30] | SIBONY M, MICHEL A, HAAS H U, et al. Sulfometuron-resistant Amaranthus retroflexus: cross-resistance and molecular basis for resistance to acetolactate synthase-inhibiting herbicides[J]. Weed Res, 2001, 41 (6):509–522. doi:10.1046/j.1365-3180.2001.00254.x |
| [31] | DENG W, YANG Q, ZHANG Y Z, et al. Cross-resistance patterns to acetolactate synthase (ALS)-inhibiting herbicides of flixweed (Descurainia sophia L.) conferred by different combinations of ALS isozymes with a Pro-197-Thr mutation or a novel Trp-574-Leu mutation[J/OL]. Pestic Biochem Physiol, 2016, http://dx.doi.org/10.1016/j.pestbp.2016.08.006. 10.1016/j.pestbp.2016.08.006 |
 2016, Vol. 18
2016, Vol. 18


