恶苗病 (bakanae 或 foolish seedling disease) 是水稻生产上较严重的种传真菌病害[1],主要致病菌为藤仓镰孢菌 Fusarium fujikuroi,在世界范围内均有发生[2]。植株发病后表现为徒长、细弱及叶色发黄,并且病原菌在侵染过程中还会产生真菌毒素,造成严重的产量损失[3]。
咪鲜胺是一种咪唑类广谱高效的内吸性杀菌剂,可通过抑制麦角甾醇的生物合成,破坏病原菌细胞膜的正常功能而发挥杀菌作用[4]。随着田间多菌灵对水稻恶苗病防治效果的下降,目前生产上已将咪鲜胺作为防治水稻恶苗病的主打药剂。但近年来由于该药剂的频繁使用,田间水稻恶苗病菌对咪鲜胺的抗药性问题已逐渐凸显[5]。
目前国内关于水稻恶苗病菌对咪鲜胺抗药性的研究主要集中于抗性检测方面。2007 年,陈夕军等报道,江苏省 13 个地区水稻恶苗病菌对咪鲜胺的抗性菌株频率仅为 1.5%,但抗性水平均为中抗及以上[6];而本研究室 2014 年的研究结果显示,江苏省 3 个地区 77 株水稻恶苗病菌对咪鲜胺的抗性频率已达到 100%,且均为中等及以上抗性水平[5]。2015 年,徐瑶的研究结果表明,黑龙江省 32 株水稻恶苗病菌对咪鲜胺的抗性频率为 93.7%,其中中等抗性菌株占 87.7%[7]。Shin 等和 Lee 等分别于 2008 年和 2010 年报道在韩国地区也检测到恶苗病菌对咪鲜胺产生了抗药性[8-9]。
以上研究表明,抗咪鲜胺水稻恶苗病菌可能具有较强的田间适合度,进而可以适应环境选择而发展成为优势群体。但目前鲜有研究揭示田间抗咪鲜胺水稻恶苗病菌的适合度。因此,本研究拟以对咪鲜胺抗性及敏感的田间水稻恶苗病菌为试验材料,重点评估抗性菌株的适合度,同时分析水稻恶苗病菌对咪鲜胺与几种常用杀菌剂的交互抗性,以期为水稻恶苗病菌防治药剂的选择以及延缓其对咪鲜胺抗药性的发展提供参考。
1 材料和方法 1.1 试验材料 1.1.1 供试药剂97% 咪鲜胺 (prochloraz) 原药,购于江苏辉丰农化股份有限公司;96.3% 丙环唑 (propiconazole) 和 95.2% 苯醚甲环唑 (difenoconazole)原药,购于江苏丰登农药有限公司;96% 氟环唑 (epoxiconazole) 和 90.2% 氰烯菌酯 (JS399-19) 原药,由南京农业大学周明国教授提供。所有供试原药均以甲醇为溶剂配制成 1 × 104 μg/mL 的母液,于 4 ℃ 冰箱保存备用。
1.1.2 培养基马铃薯蔗糖固体培养基 (Potato-Saccharose-Agar,PSA) 及马铃薯葡萄糖液体培养基 (Potato-Dextrose-Broth,PDB);12‰ 水琼脂培养基[10]。
1.1.3 供试菌株水稻恶苗病菌株由江苏省农业科学院植物保护研究所水稻病害与生物防治研究室分离保存,所有菌株均采用镰孢菌专用引物转录延伸因子 1-α基因 (TEF) 进行分子鉴定,均为 F. fujikuroi[11-12]。采用含咪鲜胺 3 μg/mL 的带药 PSA 平板对所有菌株进行筛选,挑选出对咪鲜胺不同敏感性的菌株共 12 株作为研究材料,其中敏感菌株 2 株,抗性菌株 10 株 (表 1)。
|
|
表 1 对咪鲜胺不同敏感性的水稻恶苗病菌菌株 Table 1 F. fujikuroi strains showed different sensitivitiesto prochloraz |
1.1.4 主要试剂和仪器
Eclipse 50i 型显微镜 (Nikon);QL-861 型涡旋混合器 (海门市麒麟医用仪器厂);XB-K-25 血球计数板 (上海求精生化试剂仪器有限公司);2420 手动金属计数器 (深圳市龙泰源贸易有限公司)。
1.2 试验方法 1.2.1 适合度测定 1.2.1.1 抗药性遗传稳定性将供试菌株在 PSA 平板上 28 ℃ 黑暗培养 6 d,当菌丝形成菌落时,打取直径 3.5 mm 的菌饼,转接于含系列质量浓度咪鲜胺的 PSA 平板上进行继代培养,采用菌丝生长速率法测量各菌株第 1 代和抗性菌株第 10 代对咪鲜胺的敏感性[13]。其中,敏感菌株 S17 和 S145 中咪鲜胺的质量浓度设置为 0、0.01、0.02、0.04、0.08 和 0.1 μg/mL,其他菌株为 0、0.1、0.5、1、2.5 和 5 μg/mL。以含等量甲醇的 PSA 培养基为对照。各处理重复 3 次。于 28 ℃ 下黑暗培养 6 d 后,用十字交叉法测量菌落直径,求出各处理对菌丝生长的抑制率、毒力回归方程、有效抑制中浓度 (EC50) 值及相关系数 (r) [14]。
1.2.1.2 温度敏感性测定在供试菌株菌落边缘同一圆周上打取 3.5 mm 菌饼,接种于 PSA 平板上 (每皿接种一个菌饼,每菌株 3 次重复),置于不同温度 (20、25、28、30 及 37 ℃) 下黑暗培养 6 d,十字交叉法测量各温度下各菌株的菌落直径。
1.2.1.3 菌丝生长速率测定在供试菌株菌落边缘同一圆周上打取 3.5 mm 菌饼,接种于 PSA 平板上 (每皿接种一个菌饼,每菌株 3 次重复),置于 28 ℃下黑暗培养 5 d 后,测量各菌株的菌落直径。
1.2.1.4 产孢及孢子萌发能力测定将供试菌株在 PSA 培养基上 28 ℃ 黑暗培养,待各菌株长满整个培养皿时,制备并收集各菌株的分生孢子悬浮液,在显微镜下观察并计算孢子悬浮液的浓度,并换算成每皿产生分生孢子的数量[15]。每处理 3 个重复。
制备浓度为 1 × 105个/mL 的分生孢子悬浮液,分别吸取其 150 μL 均匀涂布在 12‰ 的水琼脂平板上,置于 28 ℃ 培养箱中黑暗培养,分别在 7 h 和 16 h 后在显微镜下观察 100 个孢子,计数萌发的孢子数[15]。每处理 3 个重复。
1.2.1.5 致病力测定将供试菌株在 PSA 培养基上 28 ℃ 黑暗培养 6 d,打取 10 个新鲜的菌碟,转接于 PDB 培养基中,于 25 ℃、150 r/min 黑暗条件下摇培 6 d。用无菌水调整孢子悬浮液浓度至约 1 × 105个/mL,备用。挑选粒形饱满,表面无损伤、无斑点的健康水稻种子 (品种为两优培九),经消毒处理[2]后放入配制好的孢子悬浮液中,其中对照组种子放入未接菌的 PDB 培养基中,每瓶 50 粒,重复 3 次。于 28 ℃、150 r/min 黑暗条件下摇培 18 h 后倒去孢子悬浮液,并于 28 ℃ 黑暗条件下放置 2 d,观察种子的萌发率。挑选出芽一致的种子种于无菌土壤中,每盆 15 粒,重复 3 次。28 ℃ 光暗交替培养 (12 h/12 h),每天浇适量水,10 d 后记录正常发芽植株的高度,并根据公式 (1) 计算发病植株的徒长率。

|
(1) |
分别测定供试菌株对氰烯菌酯、丙环唑、苯醚甲环唑和氟环唑的敏感性,方法同 1.2.1.1 节。其中,氰烯菌酯质量浓度设置为 0、0.05、0.1、0.5、1、2.5 和 10 μg/mL,其他 3 种药剂设置为 0、0.01、0.05、0.1、0.5、1 和2.5 μg/mL。分别以对咪鲜胺和其他药剂的 EC50 的对数值为横、纵坐标作图。根据等级相关性 (Spearman rank correlation) 分析两类药剂间有无交互抗性,即当 P < 0.05,且ρ > 0.6 时,说明两者存在强的正交互抗性[16-17]。
2 结果与分析 2.1 抗药性遗传稳定性两株敏感的水稻恶苗病菌株 S17 和 S145 对咪鲜胺的 EC50 值分别为 0.09 和 0.03 μg/mL。抗性菌株第 1 和 10 代的 EC50 值测定结果 (表 2) 显示,与敏感菌株 S17 的 EC50 值相比,部分抗性菌株在连续转接 10 代后,抗性水平都比较稳定,个别菌株抗性倍数甚至有所上升,如 R85、R83、R73 和 R134 由 10.33、7.56、7.11 和 3.78 分别上升至 13.44、10.11、13.67 和 9.78。
|
|
表 2 对咪鲜胺产生抗性的水稻恶苗病菌株的抗药性遗传稳定性 Table 2 Resistance stability of the 1st and the 10th generation of F. fujikuroi strains resistant to prochloraz |
2.2 温度敏感性
对咪鲜胺敏感性不同的水稻恶苗病菌株在不同温度下的菌落生长情况 (表 3) 表明,在 20~30 ℃ 之间各菌株均能生长,最适温度均为 28 ℃,37 ℃ 下各菌株均停止生长。
|
|
表 3 对咪鲜胺不同敏感性的水稻恶苗病菌株对温度的敏感性 Table 3 Temperature sensitivity of F. fujikuroi strains with different sensitivities to prochloraz |
2.3 菌丝生长速率、产孢及孢子萌发能力
菌丝生长速率测定结果 (表 4) 显示:各抗性菌株的生长速率均显著高于敏感菌株 S17,但均显著低于敏感菌株 S145;而在抗性菌株中,R135 和 R73 的菌丝生长速率显著快于其他抗性菌株,抗性倍数达到 24 倍的 R64 菌株次之。各菌株产孢能力测定结果表明,除 R64、R63、R73 和 R77 外,其他抗性菌株产孢能力均显著高于敏感菌株。孢子萌发能力测定结果显示,7 h 时,R63、R33 和 R77 分生孢子萌发率均已大于 80%,萌发速率快于其他菌株;16 h 后,各菌株的分生孢子萌发率均接近 100%。
|
|
表 4 对咪鲜胺不同敏感性的水稻恶苗病菌株的生物学性状 Table 4 Biological characters of F. fujikuroi strains with different sensitivities to prochloraz |
2.4 致病力
致病力测定结果 (表 5) 显示:在供试水稻恶苗病菌株中,高抗菌株 R64 对水稻种子的萌发影响最大,萌发率仅为 76.67%;R63 和 R135 的影响很小,种子萌发率均大于 90%;其他菌株对种子萌发的影响相差不大,萌发率在 80% 至 90% 之间。而与对照组相比,经各菌株孢子悬浮液处理后,水稻苗均表现出不同程度的徒长,植株纤细、瘦弱 (图 1),其中经各抗性菌株处理组水稻植株的徒长率均显著高于敏感菌株 S145 处理组,且用抗性菌株 R63、R52、R83、R73 和 R33 处理过的水稻植株徒长率均大于 50%,表明上述菌株致病性均较强。
|
|
表 5 对咪鲜胺不同敏感性的水稻恶苗病菌株的致病性比较 Table 5 Pathogenicity comparison of F. fujikuroi strains with different sensitivities to prochloraz |

|
图 1 部分对咪鲜胺抗性及敏感的水稻恶苗病菌株对苗期水稻的致病性 Fig. 1 Pathogenicity of some resistant and sensitive strains of F. fujikuroi to prochloraz on rice seedling |
2.5 交互抗性
测定结果显示:咪鲜胺与三唑类杀菌剂丙环唑 (图 2A)、苯醚甲环唑 (图 2B)、氟环唑 (图 2C) 以及 2-氰基丙烯酸酯类杀菌剂氰烯菌酯 (图 2D) 之间均无交互抗性。
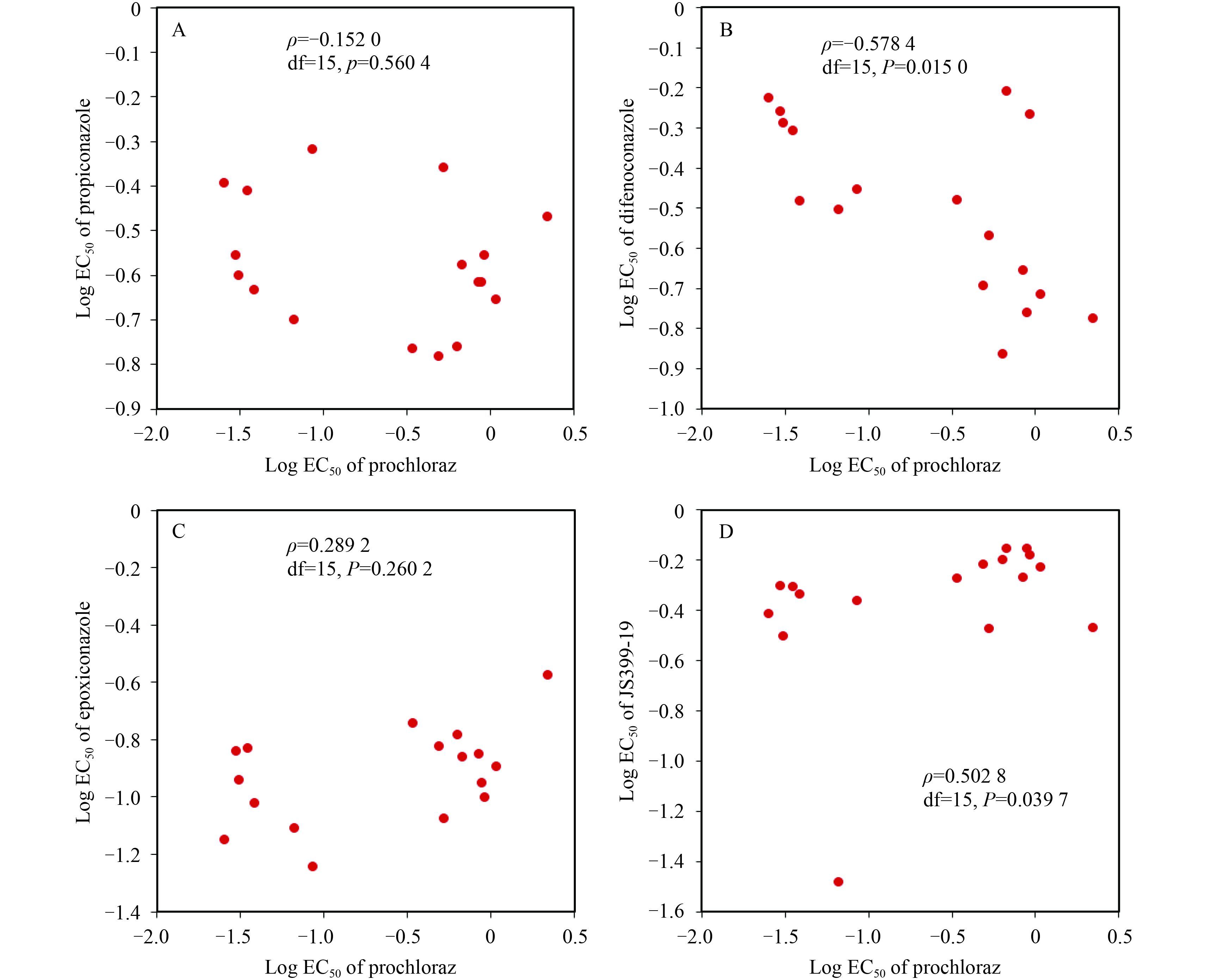
|
图 2 咪鲜胺与丙环唑 (A)、苯醚甲环唑 (B)、氟环唑 (C) 及氰烯菌酯 (D) 的交互抗性 Fig. 2 Cross-resistance between prochloraz and propiconazole (A) , difenoconazole (B) , epoxiconazole (C) , JS399-19 (D) |
3 讨论
病原菌对杀菌剂产生抗性后仍具有较强的适合度,表明其对杀菌剂的田间抗性可能发展较快,需引起重视。已有研究表明,随着咪鲜胺的频繁使用,水稻恶苗病菌对其的抗性频率正呈现逐年升高的趋势[5-6],因此推测其田间抗性菌株具有较强的适合度。
本研究从抗药性遗传稳定性、温度敏感性、菌丝生长速率、产孢量及致病力等方面综合分析了田间抗咪鲜胺水稻恶苗病菌的适合度。结果显示,抗性菌株抗药性均能稳定遗传,且部分菌株在继代培养 10 代其抗性水平反而有所提高,这可能是由于不同抗性菌株对咪鲜胺产生抗药性的机制不同,具体还有待于进一步进行抗性机制的研究;田间抗性菌株与敏感菌株在温度敏感性方面并无明显差别;部分抗性菌株在菌丝生长速率、产孢量及孢子萌发率方面显著高于田间敏感菌株;在致病力方面,除高抗菌株 R64 外,其他菌株对水稻种子萌发的影响较小,大部分抗性菌株的致病力与敏感菌株相当,甚至高于敏感菌株。综合以上结果表明,部分田间水稻恶苗病菌抗性菌株具有较强的适合度,在田间自然条件下有可能形成优势群体,从而造成抗性的大面积发生。本研究结果很好地支持了不同地区水稻恶苗病菌对咪鲜胺抗性频率较高的检测结果。
陈夕军等分析了抗咪鲜胺水稻恶苗病菌的竞争力,认为其抗性菌株竟争力较敏感菌株低,抗性不稳定,因此推测水稻恶苗病菌对咪鲜胺的田间抗性增长缓慢[6]。本研究结果与之存在差异,可能是由于菌株的个体差异性所致。陈夕军等共获得 8 株抗咪鲜胺水稻恶苗病菌,抗性频率仅为 1.5%,而本研究供试的抗性菌株是从抗性频率为 100% 的群体中选择的。二者的研究对象可能属于不同的群体,因而其在田间适合度方面可能存在较大的差别。后续通过结合不同群体水稻恶苗病菌遗传多样性的研究结果,将有助于揭示造成群体间田间适合度差异的原因。
此外,病原菌在有药及无药选择压力下,田间适合度可能表现不同。咪鲜胺作为防治水稻恶苗病的常规药剂,田间使用较频繁。如果抗性菌株在田间药剂选择压下表现出较强的适合度,其田间抗性可能就会发展很快;而如果在无药剂选择压力下抗性菌株适合度较弱,则可以通过选用其他作用机制的杀菌剂以达到降低抗咪鲜胺水稻恶苗病菌频率的目的。后续通过比较分析抗咪鲜胺水稻恶苗病菌在有药和无药选择压力下的竟争力,将有助于深入了解真实的田间适合度。
交互抗性测定结果表明,咪鲜胺与三唑类及 2-氰基丙烯酸酯类杀菌剂均无交互抗性。虽然同属于 DMIs 杀菌剂,但咪鲜胺属于其中的咪唑类[4]。已有研究表明,不同的 DMIs 杀菌剂之间存在不同的抗性机制[18],推测水稻恶苗病菌对三唑类和咪唑类杀菌剂可能存在不同的抗性机制。因此,在田间抗咪鲜胺水稻恶苗病菌抗性频率不断增高的情况下,迫切需要轮换使用不同作用机制的杀菌剂,以应对其抗药性的发生发展。
| [1] | HWANG I S, AHN I P. Multi-homologous recombination-based gene manipulation in the rice pathogen Fusarium fujikuroi[J]. Plant Pathol J, 2016, 32 (3):173–181. doi:10.5423/PPJ.OA.12.2015.0263 |
| [2] | WULFF E G, SØRENSEN J L, LÜBECK M, et al. Fusarium spp. associated with rice bakanae: ecology, genetic diversity, pathogenicity and toxigenicity[[J]. Environ Microbiol, 2010, 12 (3):649–657. doi:10.1111/emi.2010.12.issue-3 |
| [3] | JESTOI M. Emerging fusarium-mycotoxins fusaproliferin, beauvericin, enniatins, and moniliformin-a review[J]. Crit Rev Food Sci Nutr, 2008, 48 (1):21–49. doi:10.1080/10408390601062021 |
| [4] |
陈平, 柳训才. 咪鲜胺的应用概况及其残留检测研究[J]. 湖北农业科学, 2007,46 (3):478–480.
CHEN P, LIU X C. Progress on application and residue detection of the prochloraz[J]. Hubei Agric Sci, 2007, 46 (3):478–480. |
| [5] |
郑睿, 聂亚锋, 于俊杰, 等. 江苏省水稻恶苗病菌对咪鲜胺和氰烯菌酯的敏感性[J]. 农药学学报, 2014,16 (6):693–698.
ZHENG R, NIE Y F, YU J J, et al. Sensitivity of Fusarium fujikuroi to prochloraz and JS399-19 in Jiangsu province[J]. Chin J Pestic Sci, 2014, 16 (6):693–698. |
| [6] |
陈夕军, 卢国新, 童蕴慧, 等. 水稻恶苗病菌对三种浸种剂的抗性及抗药菌株的竞争力[J]. 植物保护学报, 2007,34 (4):425–430.
CHEN X J, LU G X, TONG Y H, et al. Resistance of Fusarium moniliforme rice bakanae disease pathogen to 3 fungicides for seed-treatment and competition ability of resistant strains[J]. Acta Phytophylacica Sinica, 2007, 34 (4):425–430. |
| [7] |
徐瑶. 水稻恶苗病菌对咪鲜胺敏感性分析与药剂防治研究[D]. 大庆: 黑龙江八一农垦大学, 2015
XU Y. Research on Fusarium moniliforme to prochloraz sensitivity analysis and chemical control[D]. Daqing: Heilongjiang Bayi Agricultural University, 2015. |
| [8] | SHIN M U, KANG H J, LEE Y, et al. Detection of the resistance of Fusarium spp. isolated from rice seeds to prochloraz and cross-resistance to other fungicides inhibiting sterol biosynthesis[J]. Kor J Pestic Sci, 2008, 12 (3):277–282. |
| [9] | LEE Y H, KIM S Y, CHOI H W, et al. Fungicide resistance of Fusarium fujikuroi isolated in Korea[J]. Kor J Pestic Sci, 2010, 14 (4):427–432. |
| [10] |
方中达.
植病研究方法[M].3版. 北京: 中国农业出版社, 1998 : 122 -124.
FANG Z D. Plant disease research methods[M].3rd ed. Beijing: China Agriculture Press, 1998 : 122 -124. |
| [11] | GEISER D M, JIMÉNEZ-GASCO M D M, KANG S, et al. A DNA sequence database for identifying Fusarium[J]. Eur J Plant Pathol, 2004, 110 (5):473–479. |
| [12] |
郝蓉蓉, 郭海东, 杨成德, 等. 西藏设施辣椒根腐病病原的分离及鉴定[J]. 西北农业学报, 2015,24 (12):139–143.
HAO R R, GUO H D, YANG C D, et al. Isolation and detection of the pathogen caused capsicum root rot in Tibet[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2015, 24 (12):139–143. |
| [13] |
张晓, 张艳军, 陈雨, 等. 嘧菌酯对番茄早疫病菌的抑制作用[J]. 农药学学报, 2008,10 (1):41–46.
ZHANG X, ZHANG Y J, CHEN Y, et al. Inhibitory effect of azoxystrobin on Alternaria solani[J]. Chin J Pestic Sci, 2008, 10 (1):41–46. |
| [14] |
黄彰欣.
植物化学保护实验指导[M]. 北京: 农业出版社, 1993 : 103 .
HUANG Z X. Experimental guidance of plant chemical protection[M]. Beijing: Agriculture Press, 1993 : 103 . |
| [15] |
赵志华, 张锡明, 范洁茹, 等. 咪鲜胺对水稻恶苗病菌及其抗药突变体生长发育的影响[J]. 农药学学报, 2007,9 (3):251–256.
ZHAO Z H, ZHANG X M, FAN J R, et al. Effect of prochloraz on growth and development of prochloraz-sensitive strain and its resistant mutants in Fusarium fujikuroi[J]. Chin J Pestic Sci, 2007, 9 (3):251–256. |
| [16] | LU X H, ZHU S S, BI Y, et al. Baseline sensitivity and resistance-risk assessment of Phytophthora capsici to iprovalicarb[J]. Phytopathology, 2010, 100 (11):1162–1168. doi:10.1094/PHYTO-12-09-0351 |
| [17] | ZHOU Y X, CHEN L, HU J, et al. Baseline sensitivity of natural population and resistance risk of Peronophythora litchii to four novel QoI fungicides[J]. Eur J Plant Pathol, 2016, 146 (1):71–83. doi:10.1007/s10658-016-0893-y |
| [18] |
邓维萍, 杨敏, 杜飞, 等. 葡萄胶孢炭疽菌对3种麦角甾醇脱甲基抑制剂类杀菌剂的敏感性[J]. 农药学学报, 2011,13 (3):245–252.
DENG W P, YANG M, DU F, et al. Sensitivity of Colletotrichum gloeosporioides causing grape anthracnose to three sterol demethylation inhibitor(DMI)fungicides[J]. Chin J Pestic Sci, 2011, 13 (3):245–252. |
 2016, Vol. 18
2016, Vol. 18


