2. 钦州学院 海洋学院, 广西 钦州 535011;
3. 华中师范大学 化学学院, 农药与化学生物学教育部重点实验室, 武汉 430079
2. Ocean College, Qinzhou University, Qinzhou 535011, Guangxi Zhuang Autonomous Region, China;
3. Key Laboratory of Pesticide & Chemical Biology(CCNU), Ministry of Education, Department of Chemistry, Central China Normal University, Wuhan 430079, China
稻瘟病是全球范围内最具有破坏性的水稻病害之一,其致病菌为稻瘟病菌 Magnaportheg risea。据相关报道,每年因稻瘟病导致的水稻减产高达 30% [1]。
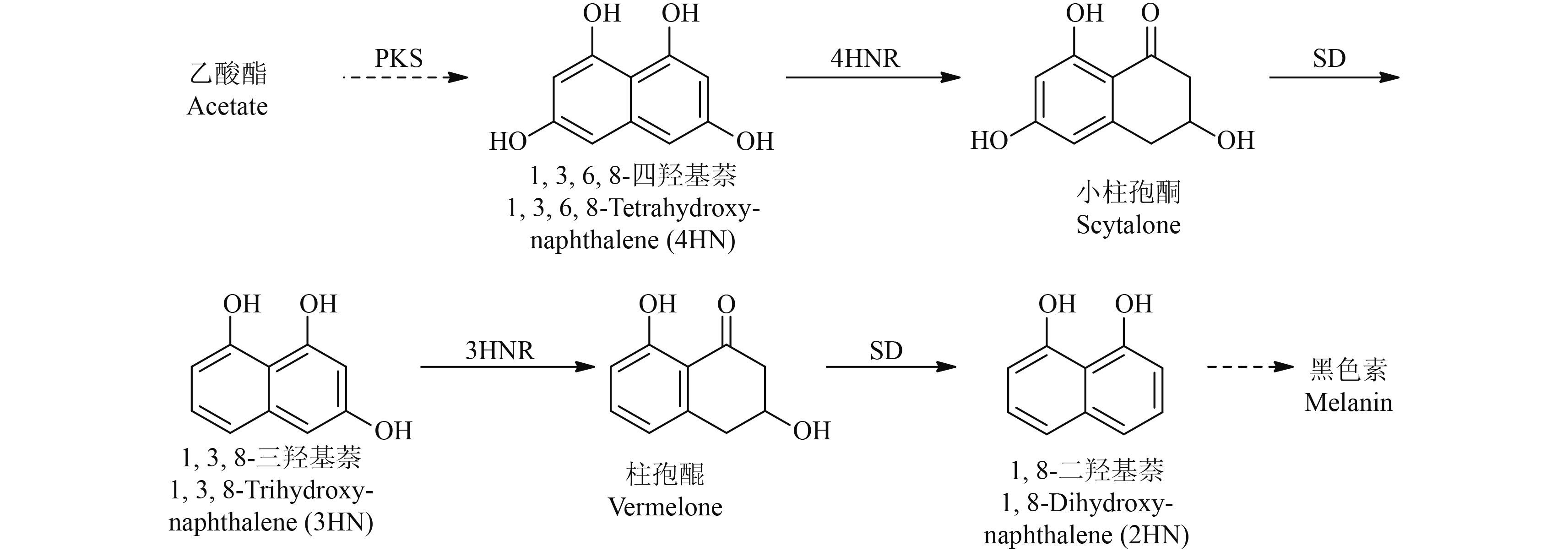
目前,防治稻瘟病最常用的抑制剂有两大类,分别是甾醇脱甲基化酶抑制剂 (DMIs) 及黑色素生物合成抑制剂 (MBIs)[2]。DMIs 是通过抑制病菌中 CYP51 参与的甾醇前体 14 位上的脱甲基化反应来抑制膜的重要组分麦角固醇的生物合成,从而影响稻瘟病菌的生长[3],其中,烯唑醇就是典型的 DMIs 商品化抑制剂;MBIs 是通过抑制稻瘟病菌附着孢中黑色素的生成而阻止病菌对植物进一步侵染的[4]。黑色素生物合成过程见图式 1。首先,乙酸酯类化合物在聚酮合成酶 (PKS) 的催化下转化成 1,3,6,8-四羟基萘 (4HN);然后,4HN 被四羟基萘酚还原酶 (4HNR) 还原成小柱孢酮 (scytalone);紧接着被小柱孢酮脱水酶 (SD) 催化生成 1,3,8-三羟基萘酚 (3HN);3HN 再在 1,3,8-三羟基萘酚还原酶 (3HNR) 的催化下被还原成柱孢醌 (vermelone),并继而在 SD 作用下脱水生成 1,8-二羟基萘酚 (2HN);单体 2HN 进一步聚合生成黑色素[5]。
MBIs 一直是水稻稻瘟病防治领域的研究热点[6]。根据作用靶标的不同,可将 MBIs 分成小柱胞酮脱水酶抑制剂 (MBI-Ds) 和羟基萘酚还原酶抑制剂 (MBI-Rs)。前者作用于 SD,后者作用于 3HNR 和 4HNR[7-8]。目前,MBI-Ds 主要是酰胺类抑制剂,长期使用会对水生动物产生危害[9],且有一定的抗性风险[8-9]。而 MBI-Rs 虽然应用得较为广泛,但鲜有关于对其产生抗性的报道,除了在实验室研究中发现过稻瘟病菌抗性突变体之外[10],尚未有经严格证实的野生型抗性稻瘟病菌的报道,表明 MBI-Rs 是比较有潜力的抗稻瘟病菌抑制剂[11]。
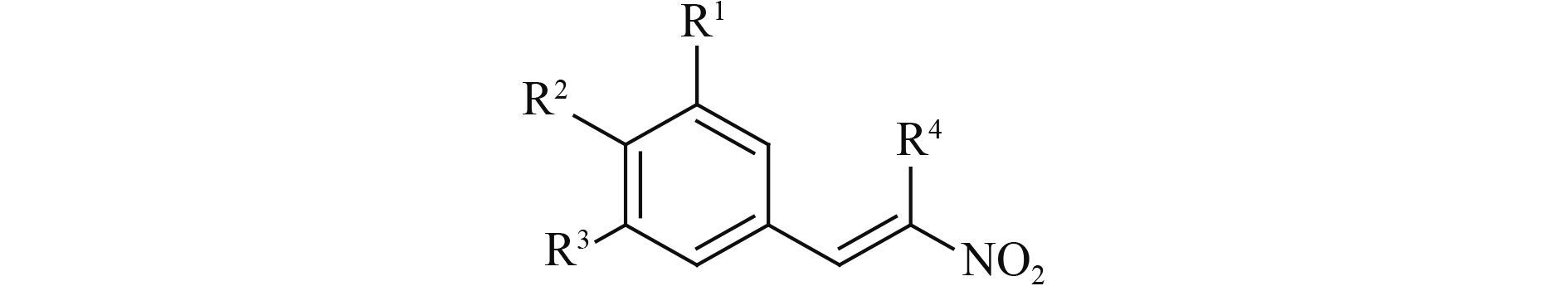
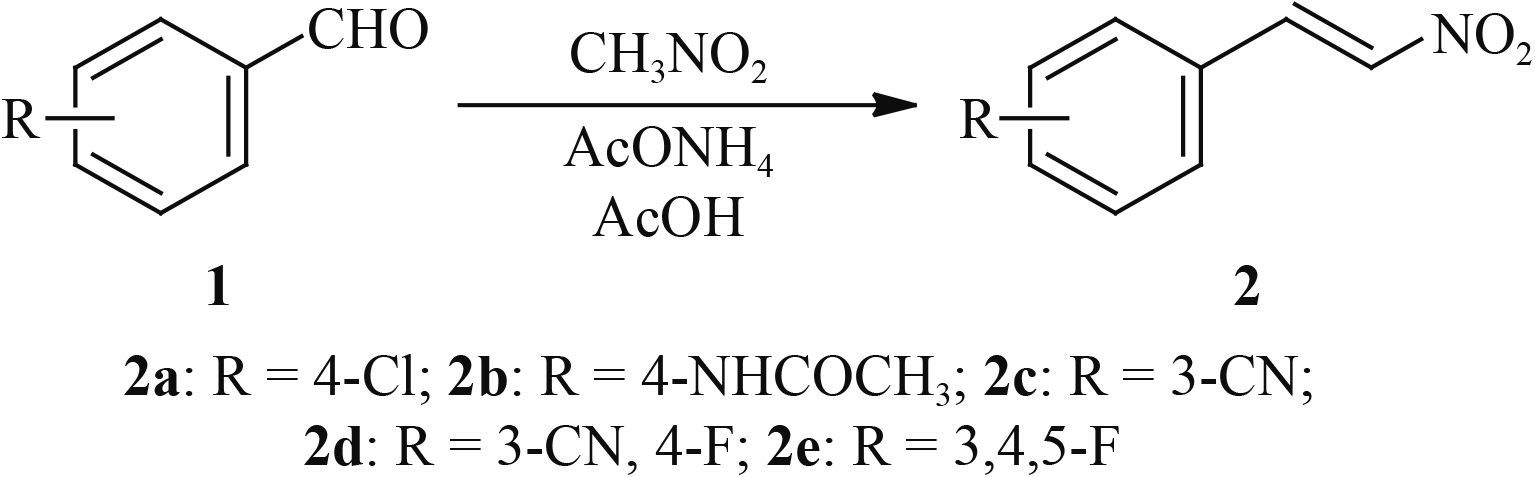
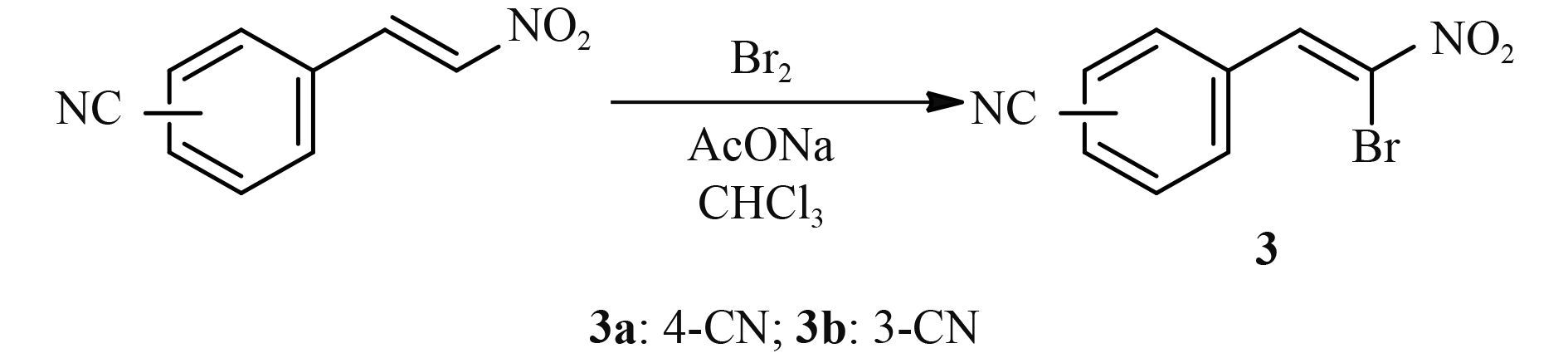
目前有关 MBIs 的报道较少,其中具有代表性的商品化药剂有三环唑 (tricyclazole)、咯喹酮 (pyroquilon) 和四氯苯酞 (phthalide) 等[4, 12-13],且已知有几种化合物与 3HNR 形成了晶体复合物[13-14]。以此研究为基础,Brunskole 等[15]基于弯孢叶斑病菌的 3HNR 虚拟筛选,筛选出了一些类黄酮化合物,发现其具有 3HNR 抑制活性。此后,Brunskole 等[16]再次基于 3HNR 活性空腔的结构,采用虚拟筛选的方法,又获得了一批对 3HNR 具有较好抑制活性的化合物。鉴于此,笔者基于稻瘟病菌 3HNR 活性位点的结构信息,通过虚拟筛选获得了 2-硝基-1-苯乙烯,初步研究表明:其对 3HNR 具有较好的抑制活性,其半数抑制浓度 (IC50 值) 为 3.8 μmol/L;在 50 μg/mL 下,其对稻瘟病菌的抑制率为 60%[17]。以此化合物作为先导设计合成了系列 2-硝基-1-芳乙烯 (2) 和 2-溴-2-硝基-1-芳乙烯 (3)。测定了其对稻瘟病菌及其 3HNR 的抑制效果,同时运用分子对接方法对目标化合物与 3HNR 可能的结合模式进行了分析。化合物 2 和 3 的合成路线分别见图示 2 和图示 3。
|
2a: R = 4-Cl; 2b: R = 4-NHCOCH3, 2c: R = 3-CN; 2d: R = 3-CN, 4-F; 2e: R = 3, 4, 5-F 图式 2 2-硝基-1-芳乙烯 (2) 的合成路线 Scheme2 Synthetic route of 2-nitro-1-arylethylene (2) |
|
图式 3 2-溴-2-硝基-1-芳乙烯 (3) 的合成路线 Scheme3 Synthetic route of 2-bromo-2-nitro-1-arylethylene (3) |
1 实验部分 1.1 仪器及试剂
Mercury Plus 400 MHz 核磁共振波谱仪 (1H NMR 频率为 400 MHz,13C NMR 频率为 100 MHz) 和 Varian VNMR 600 MHz 核磁共振波谱仪 (1H NMR 频率为 600 MHz,13C NMR 频率为 125 MHz)。安捷伦 6224 液相色谱-飞行时间质谱联用仪 (安捷伦科技有限公司);X-4 数字熔点仪 (上海精松仪电产品有限公司,温度未经校正)。BioTek Synergy2 多功能酶标仪 (美国伯腾仪器有限公司)。所用试剂皆为分析纯。对照药剂烯唑醇 (diniconazole),纯度 ≥ 95.02% (盐城市绿叶化工有限公司);三环唑 (tricyclazol),纯度 ≥ 95.3% (杭州南郊化学有限公司)。
1.2 化合物的合成 1.2.1 化合物 2a~2e 的合成以 2a 为例,参考文献[17]的方法制备。将 0.702 g (5 mmol) 4-氯苯甲醛和 0.925 g (12 mmol) 乙酸铵溶于 20 mL 乙酸中,加入 10 mL 硝基甲烷,搅拌下加热至 90 ℃ 反应。通过薄层层析 (展开剂为 V (乙酸乙酯) : V (石油醚) = 1:4) 监测至反应结束。反应液自然冷却至室温后,加入约 100 mL 水,乙酸乙酯 (3 × 50 mL) 萃取。合并有机相,用 50 mL 饱和氯化钠溶液洗涤,无水硫酸钠干燥。过滤并减压蒸馏除去溶剂,得粗产品,经甲醇重结晶得 2-硝基-1-(4-氯苯基) 乙烯 (2a) 0.726 g,产率 79%。
1.2.2 化合物 3a~3b 的合成以 3a 为例,参考文献[17]的方法制备。将 1.740 g (10 mmol) 4-(2-硝基乙烯基) 苯甲腈溶于 10 mL 氯仿,加入 0.984 g(12 mmol) 乙酸钠,反应液在冰盐浴中冷却至 0 ℃。小心滴加 0.62 mL (12 mmol) 溴,自然恢复至室温后,加热回流 8 h 至反应结束。冷却至室温后,加入饱和硫代硫酸钠溶液以除去过量的溴。二氯甲烷萃取 (3 × 20 mL)。合并有机相,无水硫酸钠干燥。过滤并减压蒸馏除去溶剂。所得粗产品以V (乙酸乙酯) : V (石油醚) = 8:1 为洗脱剂进行柱层析分离纯化,得 2-溴-2-硝基-1-(4-氰基苯基) 乙烯 (3a) 1.67 g,产率 66%。
1.3 化合物对稻瘟病菌3HNR的抑制效果测试稻瘟病菌 3HNR 的表达和纯化参照文献[18]方法进行。考虑到化合物在空气中的稳定性因素,采用模拟底物 2,3-二氢-2,5-二羟基-4H-苯并吡喃-4-酮 (DDBO) 代替天然底物 3HN 作为反应体系的底物[6, 19-20]。在反应过程中,DDBO 被氧化为 4,5-二羟基-2H-苯并吡喃-4-酮 (DBO),辅酶 NADP+ 被还原成 NADPH。通过酶标仪检测其在 340 nm 处吸光度的变化值监测反应。在 0.1 μmol/L 的 PBS 缓冲溶液中含有 400 μmol/L 的 NADP+、4.5 μg/mL 的 3HNR 和 200 μmol/L 的 DDBO,在 30 ℃,pH =7.4 的条件下进行反应。以化合物的浓度为横坐标,相对应的抑制率为纵坐标绘制抑制曲线,按 (1) 式计算化合物对 3HNR 的抑制率 (I1/%)。以三环唑为对照药剂。
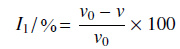
|
(1) |
(1) 式中,V0 表示最大反应速率 ([I] = 0 μmol/L),V 表示加入抑制剂时的反应速率。得到的抑制曲线用 Origin 7.0 软件中的 logistic 方程进行数据拟合,得到半抑制浓度 (IC50 值)。
1.4 室内抑菌活性测试参考文献[17]方法测定。化合物的最终质量浓度为 50 μg/mL,以商品化的三环唑和烯唑醇作为阳性对照,以未加目标化合物的等量的 DMSO 作为阴性对照。3 次重复。将直径为 5 mm 的菌饼接种于马铃薯葡萄糖琼脂 (PDA) 培养基中间,在27 ℃、黑暗条件下培养 7 d 后观察稻瘟病菌的生长情况及颜色。以公式 (2) 计算化合物对稻瘟病菌的抑制率 (I2/%)。
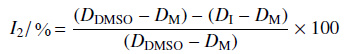
|
(2) |
(2) 式中,DDMSO、DI 和 DM 分别表示 DMSO 阴性对照的菌落直径、加了抑制剂后的菌落直径以及菌饼直径 (DM = 5 mm)。以化合物的的质量浓度为横坐标,各浓度所对应的抑制率为纵坐标绘制抑制曲线,用 Origin 7.0 软件的 logistic 方程进行非线性回归,计算化合物对稻瘟病菌的抑制中浓度 (EC50 值)。
1.5 分子对接采用 Sybyl-X 1.3 软件进行半柔性对接[21]。稻瘟病菌 3HNR 的晶体结构来自 RCSB 蛋白数据库 (PDB ID: 1G0N),蛋白加氢后通过 Amber 力场优化。目标化合物在 Sybyl-X 1.3 构建后通过 Tripos 力场和 Gasteiger-Huckel 电荷进行优化。最后将小分子通过 Surflex-Dock 对接到 3HNR 的活性空腔中[22]。
2 结果与讨论 2.1 化合物的合成化合物 2 是由对应的苯甲醛 (1) 和硝基甲烷反应缩合而成。该反应以乙酸和乙酸铵为催化剂,回流 5 h,产率为 62%~81%。合成化合物 3 时需要在 0 ℃ 时加入溴后再回流 8 h,产率为 62%~66%。目标产物的理化性质及质谱数据见表 1,核磁共振氢谱和碳谱数据见表 2。
|
|
表 1 目标化合物的理化性质和高分辨质谱数据 Table 1 Physicochemical and HRMS data of the target compounds |
|
|
表 2 目标化合物的核磁共振数据 Table 2 The NMR data of the target compounds |
2.2 化合物对稻瘟病菌 3HNR 的抑制效果及相应的构效关系
目标化合物对稻瘟病菌 3HNR 的抑制效果见表 3。可以看出,大部分目标化合物对 3HNR 具有较好的抑制活性,IC50 值接近或优于先导化合物 2-硝基-1-苯乙烯 (IC50 = 3.8 μmol/L)[17]。将 R4 固定为氢,在苯环 R1/R2/R3 位上引入其他基团可以发现,除 R2 为乙酰氨基时化合物对 3HNR 的抑制作用降低外,引入其他较小的基团如卤素和氰基,对化合物的抑制活性影响均不大。R2 位引入乙酰氨基抑制效果变差的原因可能是因为取代基较大,进入活性空腔存在一定的空间位阻。值得注意的是,当 R4 位引入溴原子 (化合物 3) 后,化合物的抑制活性有了很大的提高 (IC50 <1.0 μmol/L),与商品化的 3HNR 抑制剂三环唑 (IC50 = 0.31 μmol/L) 在同一个数量级。化合物 3b 与 2c 相比,其 IC50 值降低为原来的 1/5,表明其对 3HNR 的抑制活性有了很大提高。表明在 R4 位引入的溴原子有助于大幅提高化合物抑制 3HNR 的活性。
|
|
表 3 目标化合物对稻瘟病菌 3HNR 的抑制效果 Table 3 Inhibitory activity of target compounds against Magnaporthe grisea 3HNR |
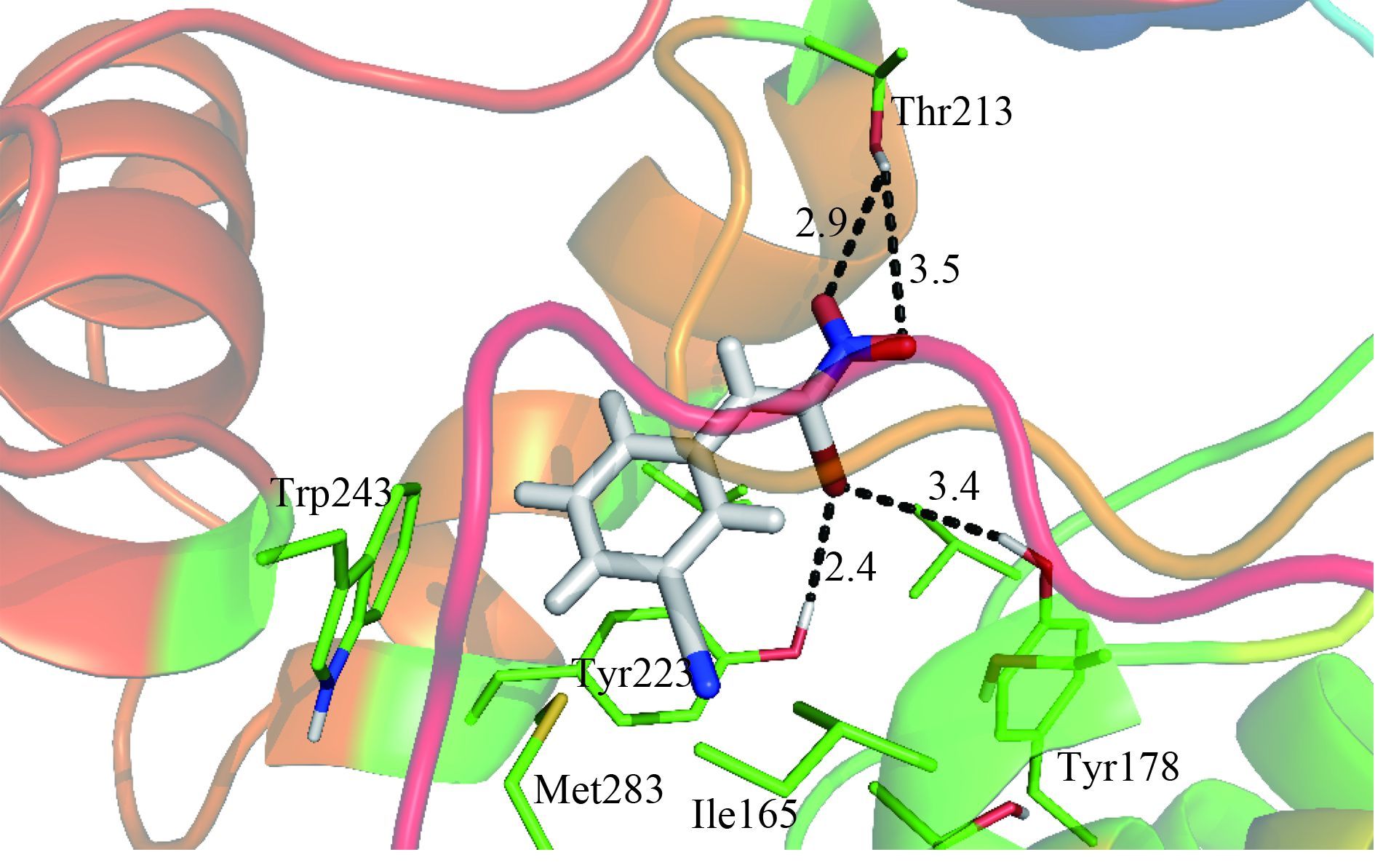
为了确定目标化合物与 3HNR 可能的结合模型,选择活性较好的化合物 3b,运用 Sybyl-X 1.3 的 Surflex-Dock 模块将 3b 对接入 3HNR 的活性空腔中[21],得到其可能的结合模式,见图 1。可以看出:化合物 3b 呈扁平状,位于 3HNR 的扁平状的疏水性的口袋中,与商品化的 3HNR 抑制剂三环唑、四氯苯酞以及咯喹酮在 3HNR 中的结合方式类似[13-14]。3b 的苯环会与 3HNR 中的氨基酸残基 Tyr223 的苯环有 π-π 相互作用,这点与三环唑等 3 个化合物与氨基酸残基 Tyr223 有 π-π 的作用模式类似[13-14];此外,3b 的硝基还可以和 Thr213 的羟基形成氢键。这两个重要的相互作用使得硝基苯乙烯类化合物 (2a~2e,3a和3b) 对 3HNR 有较高的抑制活性。在已经解析出的稻瘟病菌 3HNR 复合物晶体结构中,三环唑等化合物均能与 3HNR 中的重要氨基酸 Tyr178 形成氢键[13-14];而本研究也表明,R4 位的溴原子也可以与 Tyr223 及 Tyr178 的羟基形成氢键,这也从计算化学的角度解释了本研究结果,即 R4 为溴原子取代的化合物 3 比 R4 为氢原子的化合物 2 对 3HNR 具有更高的抑制活性。
|
图 1 化合物 3b 在 3HNR 活性空腔中可能的结合模式 Fig. 1 Possible binding-mode of 3b and residues in the active site of 3HNR |
2.3 化合物对稻瘟病菌的抑制活性
结果 (表 4) 表明,目标化合物 3a、3b 及 2e 对稻瘟病菌均有很好的抑制活性,50 μg/mL 下抑制率大于 96%。而当 R4 为溴原子时,化合物 3 不仅对 3HNR 有较高的抑制活性 (IC50 值为 0.53 μmol/L,表 3),对稻瘟病菌也有较高的抑制活性 (EC50 < 17 μg/mL,表 4)。其中抑菌活性最好的是 3b (EC50 = 11.6 μg/mL),活性与烯唑醇 (EC50 = 1.5 μg/mL) 虽然有一定的差距,但仍不失为很有潜力的化合物。
|
|
表 4 目标化合物对稻瘟病菌的抑制活性 Table 4 Fungicidal activity of target compounds against M. grisea |
3 结论
根据稻瘟病菌中 3HNR 活性位点的结构信息,合成了系列 2-硝基-1-芳乙烯化合物 (2a~2e,3a,3b),酶活测定结果显示,大部分目标化合物对稻瘟病菌的 3HNR 均有较好的抑制作用 (IC50 < 5.0 μmol/L),尤其是双键上有溴原子取代的化合物 (3a 和 3b) 抑制活性最好 (IC50 = 0.53 μmol/L)。此外,化合物 3b 对稻瘟病菌也具有较好的抑制作用 (EC50 = 11.6 μg/mL)。将活性较好的化合物 3b 对接到稻瘟病菌 3HNR 的活性空腔中,得到了化合物与 3HNR 活性空腔可能的结合模式,发现其双键上的溴原子可与 Tyr223 和 Tyr178 的羟基形成氢键,从而解释了 3a 和 3b 对 3HNR 有较好抑制效果的原因。本研究结果表明,2-硝基-1-芳乙烯化合物可以作为合成抑制稻瘟病菌生长的新型抑制剂的先导化合物。
| [1] | SHA Y, WANG Q, LI Y. Suppression of Magnaporthe oryzae and interaction between Bacillus subtilis and rice plants in the control of rice blast[J]. SpringerPlus, 2016, 5 (1):1238. doi:10.1186/s40064-016-2858-1 |
| [2] | KUNOVA A, PIZZATTI C, CORTESI P. Impact of tricyclazole and azoxystrobin on growth, sporulation and secondary infection of the rice blast fungus, Magnaporthe oryzae[J]. Pest Manag Sci, 2013, 69 (2):278–284. doi:10.1002/ps.2013.69.issue-2 |
| [3] | MERCER E I. Inhibitors of sterol biosynthesis and their applications[J]. Prog Lipid Res, 1993, 32 (4):357–416. doi:10.1016/0163-7827(93)90016-P |
| [4] | JORDAN D B, BASARAB G S, LIAO D I, et al. Structure-based design of inhibitors of the rice blast fungal enzyme trihydroxynaphthalene reductase[J]. J Mol Graph Modell, 2001, 19 (5):434–447. doi:10.1016/S1093-3263(00)00103-0 |
| [5] | THOMPSON J E, FAHNESTOCK S, FARRALL L, et al. The second naphthol reductase of fungal melanin biosynthesis in Magnaporthe grisea: tetrahydroxynaphthalene reductase[J]. J Biol Chem, 2000, 275 (45):34867–24872. doi:10.1074/jbc.M006659200 |
| [6] | BRUNSKOLE M, ŠTEFANE B, ZORKO K, et al. Towards the first inhibitors of trihydroxynaphthalene reductase from Curvularia lunata: Synthesis of artificial substrate, homology modelling and initial screening[J]. Bioorg Med Chem, 2008, 16 (11):5881–5889. doi:10.1016/j.bmc.2008.04.066 |
| [7] | KURAHASHI Y. Melanin biosynthesis inhibitors (MBIs) for control of rice blast[J]. Pestic Outlook, 2001, 12 (1):32–35. doi:10.1039/b100806o |
| [8] | SUZUKI F, YAMAGUCHI J, KOBA A, et al. Changes in fungicide resistance frequency and population structure of pyricularia oryzae after discontinuance of MBI-D fungicides[J]. Plant Dis, 2010, 94 (3):329–334. doi:10.1094/PDIS-94-3-0329 |
| [9] | KURAHASHI Y, KAGABU S, YAMADA N, et al. Resistance buster compounds for MBI-D insensitive rice blast fungus: inquiry on effective compounds among derivatives of MBI-D fungicides[J]. J. Pestic. Sci, 2006, 31 (2):85–94. doi:10.1584/jpestics.31.85 |
| [10] | ZHANG C Q, ZHU G N, MA Z H, et al. Isolation, characterization and preliminary genetic analysis of laboratory tricyclazole-resistant mutants of the rice blast fungus, Magnaporthe grisea[J]. J Phytopathol, 2006, 154 (7-8):392–397. doi:10.1111/jph.2006.154.issue-7-8 |
| [11] | ZHANG C Q, HUANG X, WANG J X, et al. Resistance development in rice blast disease caused by Magnaporthe grisea, to tricyclazole[J]. Pestic Biochem Physiol, 2009, 94 (1):43–47. doi:10.1016/j.pestbp.2009.03.001 |
| [12] | LIAO D I, THOMPSON J E, FAHNESTOCK S, et al. A structural account of substrate and inhibitor specificity differences between two naphthol reductases[J]. Biochemistry, 2001, 40 (30):8696–8704. doi:10.1021/bi0107243 |
| [13] | LIAO D I, BASARAB G S, GATENBY A A, et al. Structures of trihydroxynaphthalene reductase-fungicide complexes: implications for structure-based design and catalysis[J]. Structure, 2001, 9 (1):19–27. doi:10.1016/S0969-2126(00)00548-7 |
| [14] | ANDERSSON A, JORDAN D, SCHNEIDER G, et al. Crystal structure of the ternary complex of 1,3,8-trihydroxynaphthalene reductase from Magnaporthe grisea with NADPH and an active-site inhibitor[J]. Structure, 1996, 4 (10):1161–1170. doi:10.1016/S0969-2126(96)00124-4 |
| [15] | BRUNSKOLE M, ZORKO K, KERBLER V, et al. Trihydroxynaphthalene reductase of Curvularia lunata-A target for flavonoid action?[J]. Chem-Biol Interact, 2009, 178 (1-3):259–267. doi:10.1016/j.cbi.2008.10.023 |
| [16] | ŠVEGELJ B M, TURK S, BRUS B, et al. Novel inhibitors of trihydroxynaphthalene reductase with antifungal activity identified by ligand-based and structure-based virtual screening[J]. J Chem Inf Model, 2011, 51 (7):1716–1724. |
| [17] | CHEN H F, HAN X Y, QIN N, et al. Synthesis and biological evaluation of novel inhibitors against 1,3,8-trihydroxynaphthalene reductase from Magnaporthe grisea[J]. Bioorg Med Chem, 2016, 24 (6):1225–1230. doi:10.1016/j.bmc.2016.01.053 |
| [18] | GEORGIEVA D N, RYPNIEWSKI W, PERBANDT M, et al. Crystallization and preliminary X-ray diffraction studies of a toxic phospholipase A2, from the venom of Vipera ammodytes meridionalis, complexed to a synthetic inhibitor[J]. Biochim Biophys Acta, Proteins Proteomics, 2003, 1650 (1-2):1–3. doi:10.1016/S1570-9639(03)00210-3 |
| [19] | THOMPSON J E, JORDAN D B. Partition analysis of an enzyme acting concurrently upon two substrates in a continuous multiwavelength assay[J]. Anal Biochem, 1998, 256 (1):7–13. doi:10.1006/abio.1997.2490 |
| [20] | KLEIN J, POST K, SEIDEL A, et al. Quinone reduction and redox cycling catalysed by purified rat liver dihydrodiol/3α-hydroxysteroid dehydrogenase[J]. Biochem Pharmacol, 1992, 44 (2):341–349. doi:10.1016/0006-2952(92)90018-E |
| [21] | JAIN A N. Surflex-Dock 2.1: Robust performance from ligand energetic modeling, ring flexibility, and knowledge-based search[J]. J Comput Aided Mol Des, 2007, 21 (5):281–306. doi:10.1007/s10822-007-9114-2 |
| [22] | JAIN A N. Surflex: Fully automatic flexible molecular docking using a molecular similarity-based search engine[J]. J Med Chem, 2003, 46 (4):499–511. doi:10.1021/jm020406h |
 2016, Vol. 18
2016, Vol. 18