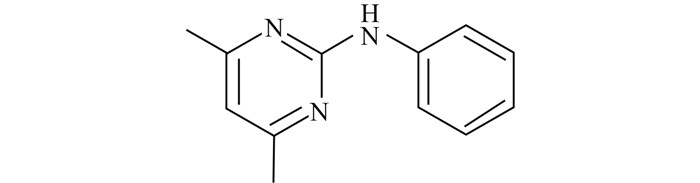
嘧霉胺(pyrimethanil,图式1),是由法国安万特公司研发的苯氨基嘧啶类杀菌剂,对蜜蜂、鸟类低毒,具有对水生生物中等毒性,具有对水生环境存在长期不良影响的风险[1-2]。嘧霉胺是防治灰霉病的特效药,其最初作用位点是胱硫醚β-裂解酶,可抑制菌丝内甲硫氨酸的生物合成,并可抑制病原菌胞外蛋白酶(包括水解酶)的分泌,阻止病原菌入侵[3-4]。
|
图式1 嘧霉胺化学结构式 Scheme1 Structure of pyrimethanil |
近年来,文献陆续报道了嘧霉胺在人参、元胡、浙贝母、白芍等14种常见中药材上的应用[5-6]。目前,关于嘧霉胺残留的检测方法包括液相色谱法[7-8]、液相色谱-串联质谱(LC-MS/MS)法[9]和气相色谱-质谱联用(GC-MS)法[10]、气相色谱-氮磷检测器(GC-NPD)法[11]等。而嘧霉胺在中药材上的残留分析方法,仅有关于其在人参及土壤中的残留规律研究[5],在其他中药材中的残留分析方法尚未见报道,且中国还未建立其在中药材上的最大残留限量标准。与果蔬中农药残留分析相比,中药材成分复杂,样品净化要求相对较高。为此,本研究采用二氯甲烷提取、常规层析柱净化,GC-NPD检测,基质匹配外标法定量,建立了嘧霉胺在元胡、浙贝母、白芍中残留的分析方法,为检测其他中药材中嘧霉胺残留提供参考。
1 材料与方法 1.1 主要仪器及试剂Agilent-7890A型气相色谱仪(配NPD检测器)、Agilent-7890B/7000C气相色谱-串联质谱仪(美国Agilent公司);DQ-102B椭圆形调节式中药切片机、DD01型中药粉碎机(浙江省温岭市大德中药机械有限公司);KQ5200DE型数控超声波清洗器(江苏省昆山市超声仪器有限公司);Heidolph Laborota 4010 digital旋转蒸发仪(德国Heidolph集团);WS-1PLUS振荡器(德国Wiggenhauser集团)。
嘧霉胺(pyrimethanil)标准品,纯度98.5%,购于德国Dr. Ehrenstorfer公司。元胡Corydalis yanhusuo W. T. Wang、浙贝母Fritillaria thunbergii Miq.、白芍Paeonia lactiflora Pall.干燥样品,购于浙江磐安药材市场(经检测不含嘧霉胺)。助滤剂545 (硅藻土载体),弗罗里硅土(粒径150~250 μm,分析纯),中性氧化铝(粒径48~75 μm,分析纯),无水硫酸钠(分析纯);分散净化剂(Agela):N-丙基乙二胺(PSA)、C18;固相萃取小柱(SPE,Agela):Pesti-Carb小柱(1 g/6 mL),弗罗里硅土固相萃取小柱(1 g/6 mL)。弗罗里硅土和中性氧化铝用前需600 ℃灼烧4 h,添加质量分数为3%的超纯水脱活;无水硫酸钠用前于160 ℃烘5 h。正己烷(色谱纯及分析纯),二氯甲烷、乙腈、乙酸乙酯(分析纯),均为市售。
1.2 分析方法将中药材样品用切片机切割、粉碎机粉碎,过20目(孔径830 μm)筛,于-20 ℃保存,备用。
1.2.1 样品的提取与净化1)提取:分别称取元胡样品5.00 g、浙贝母样品10.00 g和白芍样品10.00 g (精确至0.01 g),置于250 mL样品瓶中,加入约1 g助滤剂摇匀,准确加入50 mL二氯甲烷超声提取30 min;抽滤,用30 mL二氯甲烷分2~3次洗涤残渣,合并滤液,于45 ℃下旋蒸浓缩至约5 mL;转移至盛有40 mL质量分数为10%的氯化钠溶液的分液漏斗中,混匀,加入二氯甲烷(40 mL × 2),振荡提取2 min;有机相用10 g无水硫酸钠脱水,于45 ℃下减压浓缩至近干,用氮气吹干,用5 mL正己烷溶解并定容,待净化。
2)净化:常规层析柱填料由下至上分别为2 cm厚无水硫酸钠、5 g混合吸附剂(3 g中性氧化铝,2 g弗罗里硅土)及2 cm厚无水硫酸钠,敲实;用20 mL正己烷预淋洗柱,上样,用80 mL的V (二氯甲烷) : V (正己烷)=6 : 4混合溶液分3次(20、30、30 mL)洗脱。收集全部洗脱液,于45 ℃下旋蒸浓缩至近干。用氮气吹干,用正己烷定容至2 mL,待GC-NPD检测。
1.2.2 GC-NPD检测条件Agilent DB-5气相色谱柱(30 m × 0.32 mm,0.25 μm),进样口温度260 ℃;升温程序:70 ℃保持1 min,以20 ℃/min升温至220 ℃,保持5 min,以10 ℃/min升温至260 ℃,保持9.5 min,以10 ℃/min升温至280 ℃,保持1 min;检测器温度325 ℃;载气为高纯氮气(纯度≥99.999%),流速1.8 mL/min;氢气流速4 mL/min;空气流速60 mL/min;补偿气体流速5 mL/min;进样量1 μL,不分流进样。
1.2.3 GC-MS/MS检测条件Agilent HP-5MS色谱柱(30 m × 0.32 mm,0.25 μm),色谱条件同1.2.2节。传输线温度280 ℃;离子源温度230 ℃;电子轰击电离(EI)模式,轰击能量70 eV;碰撞气(氮气)流速1 mL/min;多反应监测模式(MRM)。母离子(m/z) 198.0,子离子(m/z) 183.1 (碰撞能量15 eV),158.1 (碰撞能量20 eV),118.0 (碰撞能量40 eV),90.0 (碰撞能量50 eV)等。嘧霉胺以118.0和183.1为定性离子,118.0为定量离子。
1.2.4 标准溶液配制及标准曲线的绘制采用基质匹配外标法定量。准确称取0.020 3 g的嘧霉胺标准品(精确到0.000 1 g)于50 mL容量瓶中,用正己烷溶解配成400 mg/L的标准储备液,分别用正己烷和空白基质溶液稀释,配制成10、5、1、0.5、0.1、0.05和0.02 mg/L的嘧霉胺溶剂标准溶液和基质匹配标准工作溶液,依据1.2.2节的条件平行测定6次。以标准溶液质量浓度为横坐标,峰面积响应值为纵坐标,建立线性回归方程,绘制标准曲线。
1.2.5 添加回收率试验分别向空白元胡、浙贝母、白芍中添加不同水平的嘧霉胺标准工作溶液进行添加回收试验。添加水平:元胡中为0.02、0.1和0.5 mg/kg,浙贝母和白芍中分别为0.01、0.1和0.5 mg/kg。日内添加回收试验每个添加水平5个重复,日间添加回收试验3个重复,计算平均回收率和相对标准偏差(RSD)。
1.2.6 基质效应的评价为准确评价3种基质对测定结果准确度的影响,同时选取正己烷和空白基质溶液分别配制的标准工作溶液,按文献[12]计算基质效应(ME):当ME>0时为增强效应;当ME<0时为减弱效应。
2 结果与讨论 2.1 提取溶剂的选择根据文献报道及嘧霉胺在溶剂中的溶解度,分别考察了二氯甲烷、乙酸乙酯和乙腈对提取效果的影响。结果表明:以乙酸乙酯为提取溶剂时,嘧霉胺在3种基质中的回收率仅为75%左右;以乙腈和二氯甲烷为提取溶剂时,嘧霉胺在3种基质中的添加回收率均达85%以上,但前者在液-液分配中,基质为浙贝母或白芍时,易出现乳化现象。综合考虑,最终选取二氯甲烷为提取溶剂,回收率高,杂质峰较少。
2.2 净化方法的选择陈达炜等[13]采用PSA和C18净化,建立了红葡萄酒中嘧霉胺等残留的分析方法;陈达捷等[14]采用固相萃取(SPE)——石墨化碳黑和弗罗里硅土小柱净化,建立了嘧霉胺等3种嘧啶胺类农药在食品中的残留分析方法。本研究比较了0.1 g PSA + 0.1 g C18、Pesti-Carb (1 g/6 mL)和3 g Al2O3 + 2 g弗罗里硅土3种净化方法对嘧霉胺在元胡、浙贝母及白芍中残留分析效果的影响。结果表明:3种净化方法的回收率均在80%以上,其中3 g Al2O3 + 2 g弗罗里硅土的净化效果最好,回收率在82%~96%之间,RSD在1.4%~6.4%之间,最终选择该净化方法。洗脱溶剂为80 mL V (二氯甲烷) : V (正己烷)=6 : 4混合溶液。
2.3 线性范围与基质效应评价经回归分析,在质量浓度0.02~10 mg/L范围内,以正己烷配制的系列标准工作溶液和3种空白基质分别配制的基质匹配标准工作溶液,其GC-NPD响应值与其质量浓度之间均具有良好的线性关系,R2大于0.999。元胡、浙贝母和白芍的ME值分别为14.02%、26.97%和35.97%,表明3种基质对嘧霉胺均存在基质增强效应。根据刘小勤等[15]关于基质效应的划分,ME=0为不存在基质效应;ME介于±20%为弱基质效应;ME介于±50%为中等基质效应。本研究中,元胡对嘧霉胺表现为弱基质效应,浙贝母和白芍均为中等基质效应。由于基质效应的存在,因此本研究中在GC-NPD分析嘧霉胺残留过程中采用基质匹配标准外标法对基质效应进行补偿。
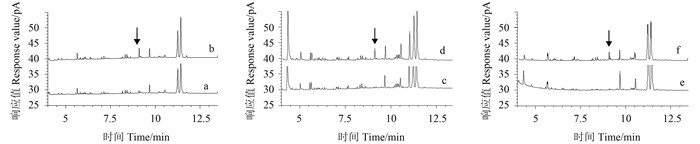
2.4 分析方法的准确度、灵敏度和精密度结果(表 1)表明:在0.01 (元胡中为0.02)、0.1和0.5 mg/kg 3个添加水平下,嘧霉胺添加回收率分别为78%~104% (元胡)、75%~98% (浙贝母)和76%~102% (白芍);3种基质的日内RSD均小于10.2% (n=5),日间RSD均小于9.0% (n=3)。以3倍信噪比(S/N=3)确定方法的检出限(LOD)为0.004 mg/kg (元胡)、0.002 mg/kg (浙贝母、白芍),以最小添加水平确定方法的定量限(LOQ)为0.02 mg/kg (元胡)、0.01 mg/kg (浙贝母、白芍)。相应图谱见图 1。方法的准确度、精密度和灵敏度均达到农药残留检测的要求[16]。
|
|
表 1 嘧霉胺在元胡、浙贝母和白芍中的添加回收率、相对标准偏差、定量限及检出限 Table 1 Average recovery, relative standard deviation, LOD and LOQ for pyrimethanil in Corydalis yanhusuo W. T. Wang, Fritillaria thunbergii Miq. and Paeonia lactiflora Pall. |
|
a.元胡空白样品;b.元胡添加样品(0.02 mg/kg);c.浙贝母空白样品;d.浙贝母添加样品(0.01 mg/kg); e.白芍空白样品;f.白芍添加样品(0.01 mg/kg)。箭头所指为嘧霉胺出峰位置。 a. Blank of C. yanhusuo; b. C. yanhusuo sample with 0.02 mg/kg pyrimethanil; c. Blank of F. thunbergii; d. F. thunbergii sample with 0.01 mg/kg pyrimethanil; e. Blank of P. lactiflora; f. P. lactiflora. sample with 0.01 mg/kg pyrimethanil. The arrow pointed to the position of pyrimethanil. 图 1 元胡、浙贝母和白芍空白和添加嘧霉胺色谱图 Fig. 1 Chromatograms of C. yanhusuo, F. thunbergii and P.lactiflora blank and spiked samples |
2.5 实际样品的检测结果
根据姚晓明等[6]对中国浙江省中药材上农药使用情况的调查结果,嘧霉胺在元胡、浙贝母和白芍种植过程中均有应用。采用本研究建立的方法对从浙江省磐安市浙八味中药材市场购买的元胡、浙贝母、白芍各6个批次进行嘧霉胺残留的检测。结果显示:元胡和浙贝母中各有一个批次检出嘧霉胺残留,其含量分别为0.017和0.007 mg/kg,均低于日本肯定列表规定的嘧霉胺在药草中0.05 mg/kg的MRL值[17]。其他批次样品均未检出嘧霉胺残留。
对3种基质的添加样品与市场抽样中检出嘧霉胺残留的样品进行GC-MS/MS验证分析,结果与GC-NPD检测结果一致,从而排除了假阳性现象,同时验证所建立的嘧霉胺在3种中药材中GC-NPD分析方法的有效性。
3 结论本研究建立了用二氯甲烷提取、柱层析净化、DB-5色谱柱分离、气相色谱-氮磷检测器(GC-NPD)检测元胡、浙贝母、白芍中嘧霉胺的残留分析方法,操作简单,定量、定性准确,灵敏度高。基质匹配外标法定量,对基质效应进行补偿;气相色谱-质谱联用(GC-MS/MS)定性分析验证,排除假阳性现象;通过柱层析净化、GC分析测定的方法,相对于GC-MS/MS、LC-MS/MS等分析方法,分析设备要求低,成本低,适用于设备落后的基层单位和中小企业。该方法针对中药材特点,适用于多种中药材上嘧霉胺的残留分析,具有很好的现实指导意义。
| [1] | Pesticide Properties Database (PPDB). Pyrimethanil[DB/OL].[2015-11-24]. http://sitem.herts.ac.uk/aeru/ppdb/en/Reports/573.htm http://sitem.herts.ac.uk/aeru/iupac/ |
| [2] |
苍涛, 赵学平, 吴长兴, 等. 嘧霉胺对环境生物毒性及安全评价[J]. 江西农业学报, 2009,21 (4):119–121.
CANG T, ZHAO X P, WU C X, et al. Toxicity and safety evaluation of pyrimethanil on environmental organisms[J]. Acta Agric Jiangxi, 2009, 21 (4):119–121. |
| [3] | MILLING R J, RICHARDSON C J. Mode of action of the anilino-pyrimidine fungicide pyrimethanil. 2. Effects on enzyme secretion in Botrytis cinerea[J]. Pestic Sci, 1995, 45 (1):43–48. doi:10.1002/ps.v45:1 |
| [4] |
胡伟群, 陈杰. 灰霉病的化学防治进展[J]. 现代农药, 2002 (4):8–11.
HU W Q, CHEN J. Chemical control of Botrytis cinerea[J]. Mod Agrochem, 2002 (4):8–11. |
| [5] |
崔小东.嘧霉胺在人参及土壤中的残留动态及最终残留研究[D].长春:吉林农业大学, 2012:13-20.
CUI X D. Studies on residual dynamics and final residues of pyrimethanil in ginseng and soil[D]. Changchun:Jilin Agricultural University, 2012:13-20. |
| [6] |
姚晓明, 施德, 何春龙, 等. 浙江省主要中药材病虫发生现状与防治对策[J]. 浙江农业科学, 2014 (12):1785–1788.
YAO X M, SHI D, HE C L, et al. Status quo and control countermeasures of pests and diseases of Chinese medicinal herbs in Zhejiang province[J]. J Zhejiang Agric Sci, 2014 (12):1785–1788. |
| [7] |
高智席, 敖克厚, 曾启华, 等. 西番莲果中嘧霉胺残留的SPE-RP-HPLC降解分析[J]. 分析试验室, 2012,31 (2):47–50.
GAO Z X, AO K H, ZENG Q H, et al. Degradation analysis of pyrimethanil residue in passion fruit by RP-HPLC with solid-phase extraction[J]. Chin J Anal Lab, 2012, 31 (2):47–50. |
| [8] | LIU C Y, LU D H, WANG Y C, et al. Pyrimethanil residue and dissipation in tomatoes and soil under field conditions[J]. Environ Monit Assess, 2013, 185 (11):9397–9402. doi:10.1007/s10661-013-3259-3 |
| [9] | PARK J H, PARK J S, ABD EL-ATY A M, et al. Analysis of imidacloprid and pyrimethanil in shallot (Allium ascalonicum) grown under greenhouse conditions using tandem mass spectrometry:establishment of pre-harvest residue limits[J]. Biomed Chromatogr, 2013, 27 (4):451–457. doi:10.1002/bmc.v27.4 |
| [10] |
崔淑华, 王开运, 钱家亮, 等. 嘧霉胺和乙霉威在大葱中的残留消解动态[J]. 农药学学报, 2010,12 (2):195–200.
CUI S H, WANG K Y, QIAN J L, et al. Field residue decline study of pyrimethanil and diethofencarb in welsh onion[J]. Chin J Pestic Sci, 2010, 12 (2):195–200. |
| [11] | VAQUERO-FERNÁNDEZ L, SANZ-ASENSIO J, LÓPEZ-ALONSO M, et al. Fate and distribution of pyrimethanil, metalaxyl, dichlofluanid and penconazol fungicides from treated grapes intended for winemaking[J]. Food Addit Contam, 2009, 26 (2):164–171. doi:10.1080/02652030802399026 |
| [12] | GILBERT-LÓPEZ B, GARCÍA-REYES J F, ORTEGA-BARRALES P, et al. Analyses of pesticide residues in fruit-based baby food by liquid chromatography/electrospray ionization time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom, 2007, 21 (13):2059–2071. doi:10.1002/(ISSN)1097-0231 |
| [13] |
陈达炜, 吕冰, 丁颢, 等. 超高效液相色谱-同位素稀释高分辨质谱法测定红葡萄酒中的18种农药残留[J]. 色谱, 2014,32 (5):485–492.
CHEN D W, LV B, DING H, et al. Determination of 18 pesticide residues in red wine by ultra high performance liquid chromatography-high resolution mass spectrometry with isotope dilution technique[J]. Chin J Chromatogr, 2014, 32 (5):485–492. doi:10.3724/SP.J.1123.2014.01012 |
| [14] |
陈达捷, 张志刚, 周昱, 等. 串联固相萃取-液相色谱-串联质谱法测定食品中嘧啶胺类杀菌剂残留[J]. 色谱, 2012,30 (9):896–902.
CHEN D J, ZHANG Z G, ZHOU Y, et al. Determination of fungicide anilinopyrimidine residues in food by series solid phase extraction-high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Chromatogr, 2012, 30 (9):896–902. |
| [15] |
刘小勤, 佟玲, 孟文婷, 等. 气相色谱-三重四极杆串联质谱法测定白芍中99种农药残留[J]. 色谱, 2015,33 (8):869–877.
LIU X Q, TONG L, MENG W T, et al. Determination of 99 pesticide residues in Paeoniae radix Alba by gas chromatography-triple quadrupole tandem mass spectrometry[J]. Chin J Chromatogr, 2015, 33 (8):869–877. doi:10.3724/SP.J.1123.2015.04005 |
| [16] |
农药残留试验准则:NY/T 788-2004[S].北京:中国农业出版社, 2004.
Guideline on pesticide residue trials:NY/T 788-2004[S]. Beijing:China Agriculture Press, 2004. |
| [17] | The Japan Food Chemical Research Foundation. Table of MRLs for agricultural chemicals[DB/OL].[2016-04-04]. http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=56100. |
 2016, Vol. 18
2016, Vol. 18


