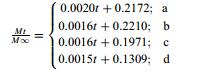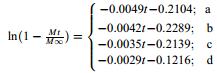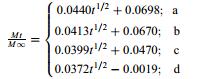毒死蜱是世界上应用最广泛的有机磷杀虫剂之一,可作为农用或卫生杀虫剂,但其存在有效成分释放速度快、药物持效期短、生态污染严重以及对光敏感等急需解决的问题,而将其制成缓释剂型有望解决上述问题[1-2]。介孔硅MCM-41具有内外表面易于修饰、比表面积和孔容积大等优点,可作为载体制成缓释药物制剂,并已在生物医学领域得到广泛的研究和应用[3-5]。与生物医学领域的缓释药物制剂相比,农药缓释制剂需要较高的载药量和更长的持效期[6-7],因而其相关研究还比较滞后;此外,MCM-41仅是借助其多孔的物理作用将药物负载于孔道中,其与药物之间作用力较弱,导致药物往往存在“突释”现象[8]。
为扩大MCM-41的应用范围,通常采取对其进行化学修饰改性的方法以提高载药量和缓释性能。Zhang等[9]用氨基和硫醇修饰改性介孔硅,并探究了该载药体系对治疗膀胱癌药物输送系统的效果。结果表明,巯基功能化的纳米颗粒有望应用于治疗膀胱癌药物输送系统。Zeng等[10]制备了氨基功能化的MCM-41,考察了其对阿司匹林的控制释放性能。结果表明,该载药体系对阿司匹林的缓释性能受到介孔材料孔壁的功能化及其程度的影响。曹渊等[11]利用共缩聚法制备了氨丙基修饰的介孔硅(MCM-41-(CH2)3NH2),探究了其对氢氯噻嗪在人工胃液中的控制释放行为。结果表明,MCM-41-(CH2)3NH2释药速率减慢,且其释药速率随着氨丙基接枝量的增加而减小。虽然氨基改性的MCM-41在医药领域和环境保护领域已得到较多的关注,但其作为农药缓释载体还鲜见报道。
本研究以十六烷基三甲基溴化铵(CTAB)为模板剂、正硅酸乙酯(TEOS)为硅源、3-氨丙基三乙氧基硅烷(APTES)为改性剂,通过共缩聚法制备了氨基化改性的介孔硅(NH2-MCM-41),并采用浸渍法将毒死蜱负载于改性的介孔硅中。利用X射线衍射(XRD)、氮气吸附-脱附、透射电子显微镜(TEM)、扫描电子显微镜(SEM)、Zeta电位和傅里叶红外光谱(FTIR)分别对MCM-41和NH2-MCM-41的结构、形貌、Zeta电位和毒死蜱的负载情况进行了表征,并着重探究了MCM-41和NH2-MCM-41对毒死蜱的吸附性能和缓释性能,以期为农药的缓释剂型研究提供参考。
1 材料与方法 1.1 药剂与仪器 1.1.1 主要试剂十六烷基三甲基溴化铵(CTAB)和氨水,分析纯,天津市大茂化学试剂厂;3-氨丙基三乙氧基硅烷(APTES),分析纯,阿拉丁试剂有限公司;正硅酸乙酯(TEOS)和无水乙醇,分析纯,国药集团化学试剂有限公司;毒死蜱(chlorpyrifos)原药,纯度≥98%,江苏景宏化工有限公司;盐酸,分析纯,广州化学试剂厂;去离子水,自制。
1.1.2 主要仪器D8 Advance型X射线衍射仪,德国布鲁克仪器公司;Quadrasorb SI型氮气吸附-脱附仪,美国康塔仪器公司;Tecnai G2 20型透射电子显微镜,美国FEI公司;S4800型扫描电子显微镜,日本日立有限公司;Zetasizer Nano ZS型Zeta电位分析仪,英国马尔文仪器有限公司;Spectrum100型傅立叶红外光谱仪,美国珀金埃尔默公司;T6新世纪紫外-可见分光光度计,北京普析通用仪器有限公司。
1.2 介孔硅(MCM-41)的制备参考文献[12]的方法制备。向三口烧瓶中依次加入1.0 g CTAB、100 mL去离子水和70 mL氨水,置于油浴锅中搅拌至CTAB完全溶解。滴加5 g TEOS,继续搅拌6 h。室温下晶化,过滤,洗涤,干燥。用质量分数为2.5%的盐酸乙醇溶液去除模板剂CTAB,洗涤,干燥,制得MCM-41,备用。
1.3 氨基化介孔硅的制备采用共缩聚法[13]制备。向三口烧瓶中依次加入1.0 g模板剂CTAB、100 mL去离子水和70 mL氨水,置于油浴锅中搅拌至CTAB完全溶解。滴加5 g TEOS;1 h后,滴加1 g APTES,继续搅拌6 h。室温下晶化,过滤,洗涤,干燥。用质量分数为2.5%的盐酸乙醇溶液去除模板剂,洗涤,干燥至恒重,制得氨基化介孔硅,记为NH2-MCM-41-5-1。重复上述试验,将APTES的质量分别改为1.67和0.71 g,其余操作不变,制得不同氨基含量的氨基化介孔硅,分别记为NH2-MCM-41-3-1和NH2-MCM-41-7-1。
1.4 载药介孔硅的制备采用浸渍法将毒死蜱分别负载于介孔硅和氨基化的介孔硅中。先将介孔硅或氨基化介孔硅在80 ℃真空活化6 h。取100 mg介孔硅加入到20 mL质量浓度为10 mg/mL的毒死蜱乙醇溶液中,于35 ℃恒温水浴中振荡24 h,过滤,洗涤,真空干燥,得到负载毒死蜱的介孔硅和氨基化介孔硅,分别记为CH-MCM-41、CH-NH2-MCM-41-5-1、CH-NH2-MCM-41-3-1和CH-NH2-MCM-41-7-1。
1.5 介孔硅的结构表征通过X射线衍射仪使用铜靶Kα射线测试并考察介孔硅的晶体结构;采用氮气吸附-脱附仪在-196 ℃测试,并分别采用BET法和BJH法计算其比表面积和孔容积、孔径分布,测试前样品在200 ℃脱气12 h;将样品置于无水乙醇中超声分散并于室温干燥后,用透射电子显微镜和喷金后用扫描电子显微镜分别观察其孔道结构和形貌;Zeta电位直接在pH=7下测定;采用KBr压片法,利用红外光谱分析其结构。
1.6 载药量测试采用紫外-分光光度(UV)法测量不同类型介孔硅对毒死蜱的吸附量。分别称取20 mg改性前后的介孔硅于锥形瓶中,加入10 mL 4 mg/mL的毒死蜱乙醇溶液,于25 ℃水浴中振荡24 h,过滤。收集滤液,在波长290 nm下测量吸附毒死蜱前后溶液的吸光度,通过标准工作曲线ρ=61.356A -0.061 3,R2=0.999 7,根据公式(1)和(2)分别计算吸附量AC (adsorption capacity)和载药量LC (loading content)。
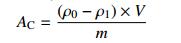
|
(1) |
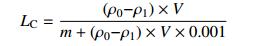
|
(2) |
式中:ρ0为原毒死蜱的质量浓度(mg/L);ρ1为吸附后毒死蜱的质量浓度(mg/L),V为液体体积(L),m为介孔硅的质量(g)。
1.7 缓释性能测试参考文献[14]方法测定。称取约100 mg (m1)载药后的介孔硅,放入透析袋中并置于装有50 mL质量分数为40%乙醇水溶液的锥形瓶中,间隔一定时间(t)后,移取1 mL样品液,并补加1 mL原溶液。在波长284 nm下用UV扫描并通过标准工作曲线ρ=48.672A + 0.032 2,R2=0.999 4,计算其吸光度,毒死蜱随时间的累积释放率为Ri,绘制t-Ri曲线,作为毒死蜱的缓释动力学曲线,详见公式(3)。
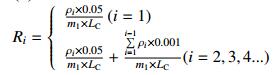
|
(3) |
式中:ρi为第i次取出液中毒死蜱的质量浓度(mg/L)。
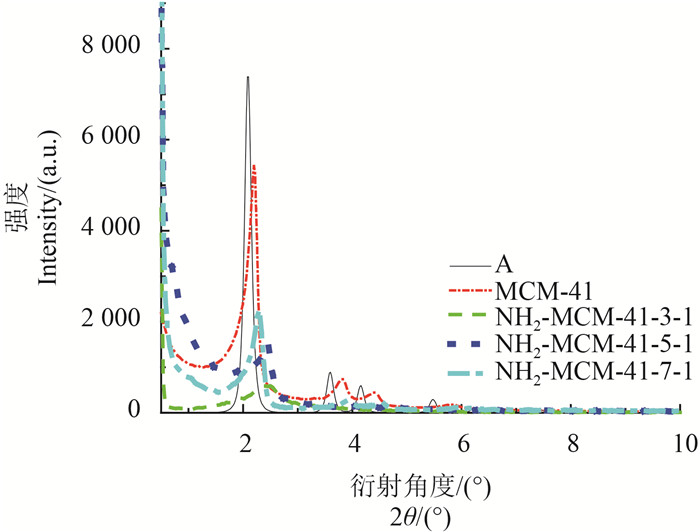
2 结果与讨论 2.1 XRD分析图 1为介孔硅(MCM-41)和不同类型氨基化介孔硅的XRD图。如图所示,MCM-41出现了3个特征衍射峰,分别属于(100)、(110)和(200)晶面,这与标准卡片MCM-41相一致,为典型的MCM-41型的XRD图谱,表明其具备有序的六方相孔道结构[15]。与MCM-41相比较,氨基化介孔硅衍射峰强度出现了显著性下降,且在(110)和(200)晶面处,随着APTES用量的增加,衍射峰强度逐渐减弱。这是因为体系中添加的APTES减弱了氨基化介孔硅的有序度[16],且其添加量越大,有序度越差,如NH2-MCM-41-3-1在(110)和(200)晶面处的衍射峰几乎消失,故呈现出上述结果。
|
注:A为标准卡片上的MCM-41。 Note:A is a standard card for MCM-41. 图 1 介孔硅(MCM-41)和不同类型氨基化介孔硅的XRD图 Fig. 1 XRD patterns of MCM-41, NH2-MCM-41-7-1, NH2-MCM-41-5-1 and NH2-MCM-41-3-1 |
2.2 氮气吸附-脱附分析
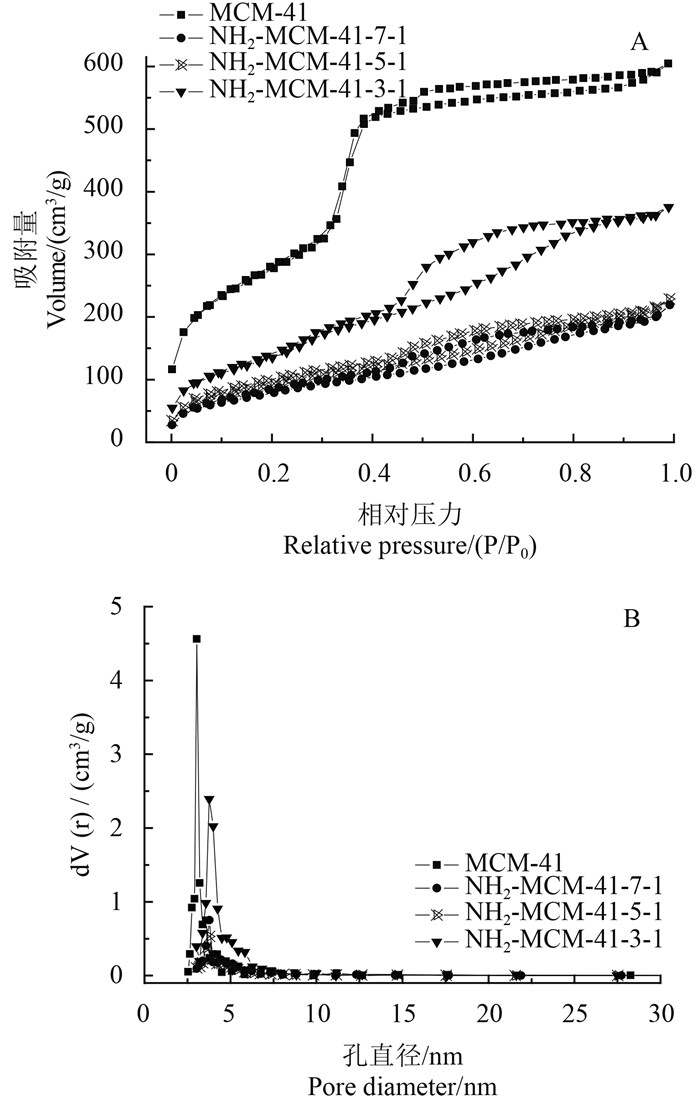
图 2为介孔硅和不同类型氨基化介孔硅的N2吸附-脱附等温线以及相应的孔径分布图。从图 2A可见,4者的等温线均属于Langmuir Ⅳ型,说明上述材料均为介孔的二氧化硅[11]。在相对压力小于0.1的低压区,MCM-41的吸附量急剧上升,而在相对压力为0.3~0.5的中压区,其吸附量垂直上升,发生显著性突跃,且出现滞后环,这是由于在MCM-41孔道内出现了毛细管凝聚现象[17]。3种类型的氨基化介孔硅的吸附等温线均属于H4型滞后环,表明其属于由层状结构产生的孔[18]。从表 1和图 2B可知,氨基化介孔硅的比表面积和孔容积均小于MCM-41,但孔径则大于MCM-41。
|
图 2 介孔硅(MCM-41)和不同类型氨基化介孔硅的氮气吸附-脱附等温线图(A)和孔径分布图(B) Fig. 2 N2 adsorption/desorption isotherms (A) and pore size distribution (B) of MCM-41, NH2-MCM-41-7-1, NH2-MCM-41-5-1 and NH2-MCM-41-3-1 |
|
|
表 1 介孔硅(MCM-41)和不同类型氨基化介孔硅的孔结构参数 Table 1 The pore structural parameters of MCM-41, NH2-MCM-41-7-1, NH2-MCM-41-5-1 and NH2-MCM-41-3-1 |
2.3 TEM分析
图 3为MCM-41和NH2-MCM-41-5-1的TEM图。由图 3A可知,MCM-41呈现出有序的六方相孔道结构,且单个介孔硅颗粒也为六方相形状。NH2-MCM-41-5-1也为有序的六方相结构(图 3B),但与MCM-41有所区别,主要是由于其电子束垂直于孔道方向而观察到了孔道的长程结构。

|
图 3 MCM-41和NH2-MCM-41-5-1的TEM图 Fig. 3 TEM image of MCM-41 and NH2-MCM-41-5-1 |
2.4 SEM分析
图 4为MCM-41和NH2-MCM-41-5-1的SEM图相。从图 4A可见,MCM-41的粒径较均一,为六方形状,且颗粒间没有出现团聚现象,表面存在较多的毛刺,展示出较为粗糙的表面形貌。同样,NH2-MCM-41-5-1也为六方相形状(见图 4B),且粒径较均一。

|
图 4 MCM-41和NH2-MCM-41-5-1介孔硅的SEM图 Fig. 4 SEM image of MCM-41 and NH2-MCM-41-5-1 |
2.5 Zeta电位分析
表 2为MCM-41和不同氨基化介孔硅的Zeta电位值。从表 2可知,氨基化介孔硅的Zeta电位值均大于MCM-41,这是由于氨基化介孔硅具有了带正电荷的氨基基团所致。此外,随着APTES用量的增加,氨基化介孔硅的Zeta电位值也逐渐增大,这是由于APTES用量增加,氨基化介孔硅的孔道内外具有了更多的氨基基团所致。
|
|
表 2 介孔硅(MCM-41)和不同氨基化介孔硅的Zeta吸附量和电位值 Table 2 The loading contents and Zeta potential of chlorpyrifos of MCM-41, NH2-MCM-41-7-1, NH2-MCM-41-5-1 and NH2-MCM-41-3-1 |
2.6 红外光谱分析
图 5为MCM-41、NH2-MCM-41-5-1及其对应的载药介孔硅的FTIR图,其中谱线a、b、c和d分别代表NH2-MCM-41-5-1、CH-NH2-MCM-41-5-1、MCM-41和CH-MCM-41。谱线a在ν=3 429 cm-1处为氨基和羟基的伸缩振动峰,在2 800~3 000 cm-1处的双峰为亚甲基的伸缩振动峰,而在1 077、793和460 cm-1处出现了二氧化硅骨架上Si-O-Si的特征振动峰,964 cm-1为Si-OH的弯曲振动峰。谱线b在1 413、1 548和833 cm-1处出现了毒死蜱特征振动峰,表明NH2-MCM-41已负载毒死蜱[14]。此外,谱线d与谱线c相比较,发现CH-MCM-41在1 413 cm-1处出现毒死蜱的特征吸收峰,说明毒死蜱已负载于MCM-41中。由红外谱图可知,MCM-41和NH2-MCM-41-5-1能够通过浸渍法将毒死蜱装载于介孔硅的孔道中。
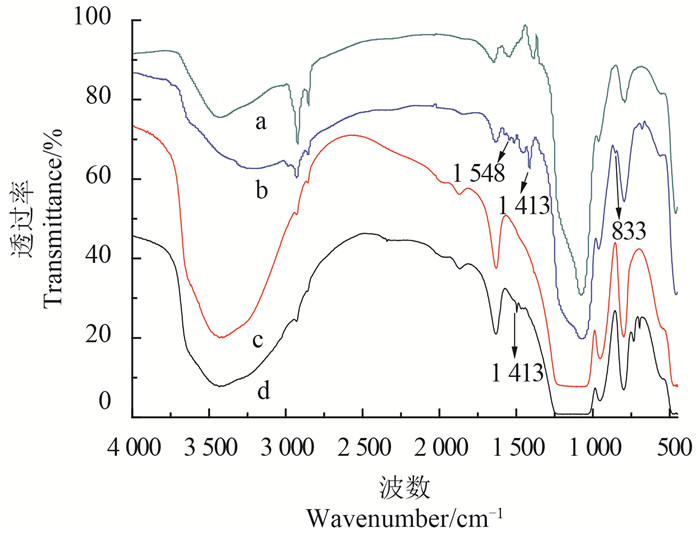
|
图 5 氨基化介孔硅(a)、载药氨基化介孔硅(b)、介孔硅(c)和载药介孔硅(d)的红外光谱图 Fig. 5 FTIR spectra of NH2-MCM-41-5-1 (a), CH-NH2-MCM-41-5-1 (b), MCM-41 (c) and CH-MCM-41 (d) |
2.7 吸附性能分析
表 2列出了在相同吸附条件下,介孔硅和不同氨基化介孔硅对毒死蜱的吸附量。从表中可知,氨基化介孔硅对毒死蜱的吸附量均大于介孔硅,且APTES用量越大,Zeta电位值越大,其对毒死蜱的吸附量也越大。其中MCM-41的吸附量为106 mg/g,NH2-MCM-41-3-1的吸附量则为178 mg/g,提高了67.9%。同时,由表 1可见,虽然MCM-41在4种研究体系中的比表面积最大,但其对毒死蜱的吸附量却最小,这表明载体介孔硅对药物的吸附不仅与其比表面积及孔容积有关,还与载体与药物间的作用相关联。在氨基化介孔硅中,随着APTES用量的增加,不仅增大了氨基化介孔硅的Zeta电位值(见表 2),还能增强其疏水作用,有利于其对非水溶性药物的吸附[19],从而使得NH2-MCM-41-3-1对毒死蜱的吸附量最大。
2.8 缓释性能分析图 6为不同类型介孔硅对毒死蜱的释放曲线图。从中可见,CH-MCM-41的释药速率最快。在释药151 h后,药物释放趋于平稳。这主要是由于MCM-41是通过多孔的物理作用而将毒死蜱装载于介孔硅中的,其相互之间作用力较弱,因而药物释放较快。相对而言,载药氨基化介孔硅的释药速率均比载药介孔硅慢,这是因为毒死蜱与氨基化介孔硅之间存在疏水作用而减缓了药物的释放。而且,不同载药氨基化介孔硅展示出了不同的释药速率,其中CH-NH2-MCM-41-3-1的释药速率明显慢于CH-NH2-MCM-41-7-1,这主要取决于氨基化介孔硅与毒死蜱之间疏水作用的强弱,直接表现在氨基化介孔硅Zeta电位值的不同(表 2),因而导致其药物释放速率的差异[20]。
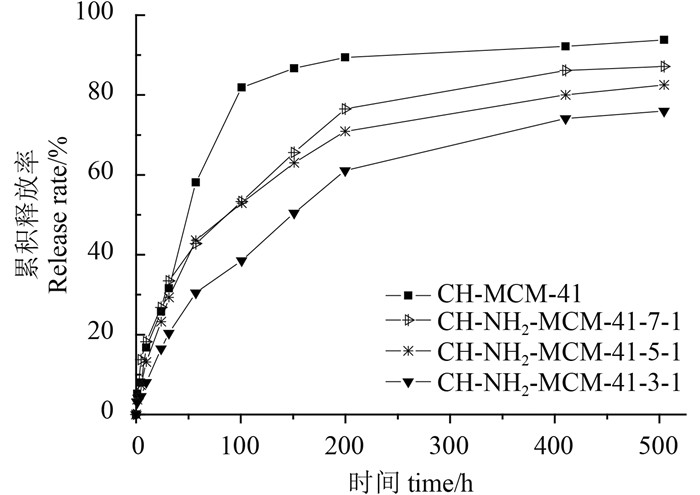
|
图 6 不同类型介孔硅载药体系对毒死蜱的缓释性能 Fig. 6 Effect of different types of mesoporous silica on released accumulation of chlorpyrifos |
为了进一步探究不同类型载药介孔硅的释药行为,对其药物释放数据分别进行了Zero-order、First-order和Higuchi动力学模型方程拟合。结果(表 3)表明,上述4种类型载药介孔硅的释药曲线均与Higuchi动力学模型的拟合度最好,R2高达0.94以上,说明其药物释放主要受扩散作用控制[21]。
|
|
表 3 载药介孔硅药物释放曲线拟合结果 Table 3 Fitting results for release curves of drug loaded mesoporous silica |
3 结论
介孔硅(MCM-41)及其改性材料氨基化介孔硅(NH2-MCM-41)均具有有序的六方相介孔结构。介孔硅仅通过多孔的物理作用负载了毒死蜱,其对毒死蜱的吸附量为仅106 mg/g;而氨基化介孔硅与毒死蜱之间存在作用力较强的疏水作用,其对毒死蜱的吸附量更高,其中NH2-MCM-41-3-1的吸附量最高,为178 mg/g。此外,氨基化介孔硅的Zeta电位值均比介孔硅高,且Zeta电位值越高,其对毒死蜱的吸附量和缓释性能越好。改性剂APTES的加入有利于改善介孔硅对毒死蜱的缓释性能,各载药体系的释药曲线符合Higuchi动力学模型。
| [1] |
汪立刚, 蒋新, 颜冬云, 等. 土壤中残留毒死蜱的作物效应[J]. 环境科学, 2006,27 (2):366–370.
WANG L G, JIANG X, YAN D Y, et al. Effect of chlorpyrifos residue in red soil on crops[J]. Environ Sci, 2006, 27 (2):366–370. |
| [2] | WANG Y, GAO Z D, SHEN F, et al. Physicochemical characteristics and slow release performances of chlorpyrifos encapsulated by poly(butyl acrylate-co-styrene) with the cross-linker ethylene glycol dimethacrylate[J]. J Agric Food Chem, 2015, 63 (21):5196–5204. doi:10.1021/acs.jafc.5b01378 |
| [3] | WANG Y, HAN N, ZHAO Q F, et al. Redox-responsive mesoporous silica as carriers for controlled drug delivery:a comparative study based on silica and PEG gate keepers[J]. Eur J Pharm Sci, 2015, 72 :12–20. doi:10.1016/j.ejps.2015.02.008 |
| [4] | ZHAO D Y, HUO Q S, FENG J L, et al. Correction to "nonionic triblock and star diblock copolymer and oligomeric surfactant syntheses of highly ordered, hydrothermally stable, mesoporous silica structures"[J]. J Am Chem Soc, 2014, 136 (29):10546. doi:10.1021/ja506344k |
| [5] |
王文谦, 陈林峰, 温永强, 等. 基于介孔二氧化硅纳米颗粒的可控释放体系[J]. 化学进展, 2013,25 (5):677–691.
WANG W Q, CHEN L F, WEN Y Q, et al. Mesoporous silica nanoparticle-based controlled-release system[J]. Prog Chem, 2013, 25 (5):677–691. |
| [6] |
郭月月, 白诗扬, 孙继红. pH敏感型双模型介孔SiO2的制备及其对布洛芬的缓控释性能[J]. 石油学报(石油加工), 2014,30 (1):181–186.
GUO Y Y, BAI S Y, SUN J H. Preparation of pH-responsive bimodal mesoporous silicas and their performances in controlled ibuprofen delivery[J]. Acta Petrolei Sinica (Petr Proc Sect), 2014, 30 (1):181–186. |
| [7] | PRASAD R, KUMAR V, PRASAD K S. Nanotechnology in sustainable agriculture:present concerns and future aspects[J]. African J Biotechnol, 2014, 13 (6):705–713. doi:10.5897/AJB |
| [8] |
袁悦, 郭卓, 包志红, 等. 有序介孔硅MCM-41对美洛昔康的包载及其形成的复合物MCM41-MX的溶出特征[J]. 东北师范大学学报(自然科学版), 2015,47 (2):93–96.
YUAN Y, GUO Z, BAO Z H, et al. Inclusion of meloxicam in ordered mesoporous silicate MCM-41 and dissolution property of MCM-41-MX[J]. J Northeast Normal Univ (Nat Sci Ed), 2015, 47 (2):93–96. |
| [9] | ZHANG Q, NEOK K G, XU L Q, et al. Functionalized mesoporous silica nanoparticles with mucoadhesive and sustained drug release properties for potential bladder cancer therapy[J]. Langmuir, 2014, 30 (21):6151–6161. doi:10.1021/la500746e |
| [10] | ZENG W, QIAN X F, YIN J, et al. The drug delivery system of MCM-41 materials via co-condensation synthesis[J]. Mater Chem Phys, 2006, 97 (2-3):437–441. doi:10.1016/j.matchemphys.2005.08.040 |
| [11] |
曹渊, 王晓, 白英豪, 等. 氨丙基修饰MCM-41的制备及载药释药性能研究[J]. 功能材料, 2010,41 (5):833–836.
CAO Y, WANG X, BAI Y H, et al. Study the performance of drug loadding and release on aminopropyl modified MCM-41-(CH2)3NH2/hydrochlorothlazide[J]. J Funct Mater, 2010, 41 (5):833–836. |
| [12] | YILMAZ M S, ÖZDEMIRÖ D, PIŞKIN S. Synthesis and characterization of MCM-41 with different methods and adsorption of Sr2+ on MCM-41[J]. Res Chem Intermed, 2015, 41 (1):199–211. doi:10.1007/s11164-013-1182-4 |
| [13] | ROSTAMIZADEH S, NOJAVAN M. An environmentally benign multicomponent synthesis of some novel 2-methylthio pyrimidine derivatives using MCM-41-NH2 as nanoreactor and nanocatalyst[J]. J Heter Chem, 2014, 51 (2):418–422. doi:10.1002/jhet.v51.2 |
| [14] |
林粤顺, 周新华, 周红军, 等. 毒死蜱/羽毛蛋白/海藻酸钠复合微球的制备及其缓释性能[J]. 农药, 2014,30 (12):892–896.
LIN Y S, ZHOU X H, ZHOU H J, et al. Preparation and slow-release performance of chlorpyrifos/feather keratin/sodium alginate microspheres[J]. Agrochemicals, 2014, 30 (12):892–896. |
| [15] | KANG J K, PARK J A, KIM J H, et al. Surface functionalization of mesoporous silica MCM-41 with 3-aminopropyltrimethoxysilane for dye removal:kinetic, equilibrium, and thermodynamic studies[J]. Desalin Water Treat, 2016, 57 (15):7066–7078. doi:10.1080/19443994.2015.1014856 |
| [16] | HARTONO S B, QIAO S Z, JACK K, et al. Improving adsorbent properties of cage-like ordered amine functionalized mesoporous silica with very large pores for bioadsorption[J]. Langmuir, 2009, 25 (11):6413–6424. doi:10.1021/la900023p |
| [17] |
周黄歆.功能介孔二氧化硅材料的制备、表征及应用[D].桂林:广西师范大学, 2014.
ZHOU H X. Synthesis, characterization and application of functionalized mesoporous silica[D]. Guilin:Guangxi Normal University, 2014. http://cdmd.cnki.com.cn/article/cdmd-10602-1014316904.htm |
| [18] |
杨峰, 宁正福, 张世栋, 等. 基于氮气吸附实验的页岩孔隙结构表征[J]. 天然气工业, 2013,33 (4):135–140.
YANG F, NING Z F, ZHANG S D, et al. Characterization of pore structures in shales throutgh nitrogen adsorption experiment[J]. Nat Gas Ind, 2013, 33 (4):135–140. |
| [19] |
牛德宝, 黎庆涛, 李利军, 等. 基于Zeta电位法分析新生亚硫酸钙对蔗汁胶体的吸附特性[J]. 南方农业学报, 2014,45 (10):1841–1845.
NIU D B, LI Q T, LI L J, et al. Adsorption characteristics of colloid in cane juice on newly-generated calcium sulfite based on Zeta potentiometry[J]. J Southern Agric, 2014, 45 (10):1841–1845. |
| [20] |
王莉, 李丽芳, 贾猛猛, 等. Zeta电位法选择农药悬浮剂所需润湿分散剂[J]. 应用化学, 2010,27 (6):727–731.
WANG L, LI L F, JIA M M, et al. Selection of wetting dispersant in pesticide suspension concentrate with Zeta potential method[J]. Chin J Appl Chem, 2010, 27 (6):727–731. |
| [21] |
冯辉霞, 张娟, 吴洁. 壳聚糖/改性凹土复合树脂的制备及其缓释性能研究[J]. 功能材料, 2013,44 (3):388–392.
FENG H X, ZHANG J, WU J. Preparation and slow release properties of chitosan、modified ATP composite resins[J]. J Funct Mater, 2013, 44 (3):388–392. |
 2016, Vol. 18
2016, Vol. 18