尖孢镰刀菌Fusarium oxysporum Schl.是一种危害严重的土壤习居菌,种内生理分化明显,种下可分为多个专化型和生理小种[1]。尖孢镰刀菌寄主范围广泛[2],能够侵染茄科、葫芦科、十字花科、豆科、石竹科及芭蕉科的蔬菜、花卉、水果等多种作物,导致枯萎病的发生[3]。枯萎病在植株的全生育期内均可发生[4],其症状常表现为植株萎蔫、变色、坏死,病情进一步发展则可导致叶片早落,维管束系统褐变、堵塞,甚至倒伏,最终使植株死亡,每年均造成巨大的经济损失[5]。目前,生产上对枯萎病的防控仍以化学药剂防治为主,但长期单一地使用同类药剂,可能引起病原菌对药剂产生抗性,导致防效降低[6]。
咪鲜胺是一种高效、广谱、低毒的甾醇脱甲基化抑制剂,其作用方式独特,可通过与细胞色素P450甾醇生物合成的必需酶14α-脱甲基酶(CYP51)的血红素铁相互作用而抑制真菌的生长[7]。咪鲜胺对由尖孢镰刀菌引起的枯萎病有较好的防治效果[8],但在中国尚未大面积推广应用。马东方等[9]测定了350株禾谷镰刀菌Fusarium graminearum对咪鲜胺的敏感性,结果表明,湖北省田间并未发现咪鲜胺抗性菌株。郑睿等[10]发现,在77株水稻恶苗病菌Fusarium fujikuroi中,已有18个菌株对咪鲜胺表现为中抗,59株表现为高抗,咪鲜胺高抗菌株已成为江苏省恶苗病菌的优势群体。
目前,有关尖孢镰刀菌F. oxysporum对咪鲜胺抗性风险的研究尚未见报道。为了评估尖孢镰刀菌对咪鲜胺的抗性风险,本研究采用菌丝生长速率法,测定了采自中国北京、山东及河北等未使用过咪鲜胺地区的112株瓜类尖孢镰刀菌对咪鲜胺的敏感性,建立了其敏感基线,并通过药剂驯化获得了咪鲜胺抗性突变株,测定了抗性突变株与其亲本菌株的菌丝生长速率、菌丝干重、致病力、抗性遗传稳定性及对不同作用机制杀菌剂的交互抗药性等生物学指标,旨在为咪鲜胺在生产中的科学合理应用提供参考。
1 材料与方法 1.1 供试材料 1.1.1 菌株2006-2015年,采集自北京、山东、河北等地未施用过咪鲜胺的黄瓜、甜瓜和西瓜等瓜类作物上的尖孢镰刀菌共112株,经单孢分离后,转接在含有马铃薯葡萄糖琼脂(PDA)培养基的试管中,4 ℃保存,备用。
1.1.2 药剂及试剂97%咪鲜胺(prochloraz)原药,乐斯化学有限公司;97% 
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水1 L。
马铃薯葡萄糖(PD)液体培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 L。
1.1.4 黄瓜种子供试黄瓜品种为中农6号,购自北京中蔬园艺良种研究开发中心。
1.2 试验方法 1.2.1 尖孢镰刀菌对咪鲜胺的敏感性测定采用菌丝生长速率法[11]。将供试菌株接种至PDA平板上,25 ℃黑暗倒置培养4 d,沿菌落边缘打取直径5 mm的菌饼,菌丝面向下接种到含系列浓度(1、0.5、0.25、0.1、0.05和0.01 μg/mL)咪鲜胺的PDA平板中央。每处理3次重复,并设空白和溶剂对照。25 ℃黑暗培养4 d后,测量菌落直径(cm)。按公式(1)计算各处理对菌丝生长的抑制率(%),建立毒力回归方程,计算有效抑制中浓度(EC50)及其相关系数r。

|
(1) |
采用药剂连续选择驯化的方法[12]。随机选取10株尖孢镰刀菌敏感菌株,在PDA平板上预培养2~3 d后,于菌落边缘打取直径为5 mm的菌饼,菌丝面朝下转接于含1 μg/mL咪鲜胺的PDA平板上(在此初始浓度下,敏感菌株不能正常生长或生长非常缓慢),25 ℃黑暗培养。每天观察各菌株菌丝块的生长状况,当菌株在含药平板上长出不规则的扇形菌落后,再转移至含有相同剂量咪鲜胺的PDA平板上,每菌株接种10皿,每皿5块。之后每隔7~10 d转接1次,并逐渐增加咪鲜胺的质量浓度,直至菌株能够在含10 μg/mL咪鲜胺的PDA平板上较好地生长为止。最后,在该浓度下继续驯化培养15代后得到抗性菌株。以各亲本菌株为对照,分别按公式(2)计算各抗药性突变株的抗性倍数。

|
(2) |
将抗药性突变株及其亲本菌株在PDA培养基上25 ℃黑暗培养4 d后,在靠近菌落边缘处打取直径5 mm的菌饼,接种到不含药的PDA平板上。各菌株接种3皿,于相同条件下培养。每间隔24 h测定一次菌落直径,计算各皿菌落的平均直径,比较抗药性突变株与其亲本菌株菌丝生长速率的差异。
1.2.3.2 咪鲜胺抗性突变株与亲本菌株菌丝干重差异测定分别将抗药性突变株及其亲本菌株接入到100 mL PD液体培养基中,每瓶接入5个菌饼,振荡培养(25 ℃,120 r/min) 7 d,抽滤,于80 ℃烘干,称量菌丝干重。各菌株重复3瓶。
1.2.3.3 咪鲜胺抗性突变株与亲本菌株致病力差异测定分别将抗药性突变株及其亲本菌株接入到100 mL PD液体培养基中,每瓶接入5个菌饼,振荡培养(25 ℃,120 r/min) 7 d,纱布过滤,5 000 r/min离心5 min,沉淀中加入无菌水,制备浓度为1 × 106个/mL的孢子悬浮液,备用。选取约300粒饱满的黄瓜种子,在55 ℃温水中浸种2 h后放入底部铺有纱布的保湿盒中,置于28 ℃温箱中催芽。当胚根长至2~3 mm时播种。采用灌根法接种[13]:待黄瓜苗长至2~3片真叶时,在距幼苗根部1 cm处扎一个3~4 cm深的小穴,造成局部根系伤口和缝隙,由此灌入10 mL菌悬液。以灌入10 mL无菌水的植株为对照。播种后,每天观察记录黄瓜植株的发病情况,按公式(3)计算病情指数。病情分级标准[13]:0级:无病症;1级:胚轴或子叶上出现轻微症状,但生长正常;2级:胚轴或子叶上出现明显的坏死斑,或一片子叶黄化,生长受到一定影响;3级:坏死斑引起局部性萎蔫,或一片子叶枯死,或生长僵化;4级:整体萎蔫,倒伏枯死。

|
(3) |
将所获各抗药性突变株和各亲本菌株在不含咪鲜胺的PDA平板上依次继代培养9代,原始亲本菌株记为F0代,按菌丝生长速率法分别测定F3、F6及F9代对咪鲜胺的敏感性。
1.2.3.5 咪鲜胺抗性突变株及其亲本菌株对不同杀菌剂的交互抗性测定采用1.2.1节菌丝生长速率法,分别测定所获抗咪鲜胺突变株及其亲本菌株对咪鲜胺、多菌灵、戊唑醇和鰁霉灵的敏感性。由敏感性变化趋势判断其交互抗性关系。
1.2.4 数据处理采用IBM SPASS 20.0软件对试验数据进行分析。采用Duncan氏新复极差法对各平均值进行差异显著性分析。对EC50值进行Pearson相关分析,当P<0.01时,表明咪鲜胺与其他药剂之间具有交互抗性,反之则无交互抗性。
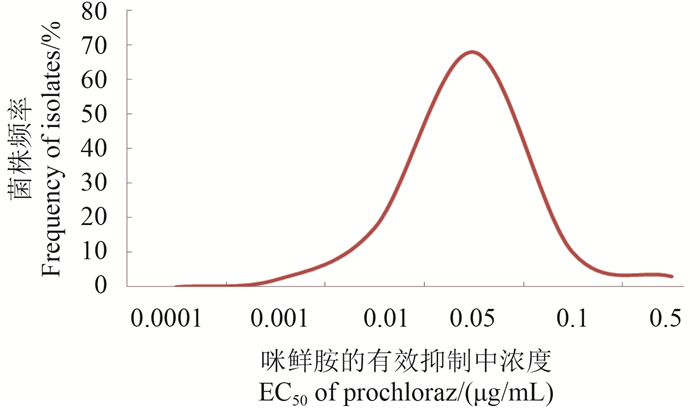
2 结果与分析 2.1 尖孢镰刀菌对咪鲜胺敏感基线的建立咪鲜胺对采自北京、山东、河北的112株瓜类尖孢镰刀菌的EC50值范围在0.000 5~0.125 8 μg/mL之间,其平均EC50值为(0.030 1±0.030 4) μg/mL。所有尖孢镰刀菌菌株对咪鲜胺的敏感性频率呈连续单峰曲线分布(图 1),未出现敏感性明显下降的病原菌亚群体,总体接近正态分布,因此可将该群体的平均EC50值(0.030 1±0.030 4 μg/mL)作为尖孢镰刀菌对咪鲜胺的敏感基线。
|
图 1 供试112株尖孢镰刀菌对咪鲜胺的敏感性频率分布 Fig. 1 Sensitivity of 112 field isolates of Fusarium oxysporum to prochloraz |
2.2 尖孢镰刀菌抗咪鲜胺突变株的获得及抗性倍数
通过药剂驯化方法对随机选取的10株尖孢镰刀菌菌株进行驯化后,仅以寄主为黄瓜的3个尖孢镰刀菌株HG080408、HG13052701和HGK87为亲本驯化获得了7株抗药性突变株,抗性倍数在6.2~26.8之间(表 1)。
|
|
表 1 尖孢镰刀菌抗药性突变株对咪鲜胺的抗性倍数 Table 1 Resistance level of the resistant mutants of F. oxysporum to prochloraz |
2.3 尖孢镰刀菌抗药性突变株主要生物学性状 2.3.1 菌丝生长速率和菌丝干重
由表 2可知:24 h内,7株抗咪鲜胺突变株的菌落直径均显著小于各自亲本菌株;随着培养时间的延长,在48和72 h内,仅菌株HG080408-R2的菌落直径与其亲本菌株差异不明显,其他6株突变株的菌落直径仍显著小于各自的亲本菌株(P=0.05)。7株抗药性突变株的菌丝干重均明显低于各自亲本菌株,各突变株菌丝干重减少量在20.72%~80.43%之间。
|
|
表 2 尖孢镰刀菌抗咪鲜胺突变株生长情况 Table 2 Growth of the resistant mutants of F. oxysporum to prochloraz |
2.3.2 致病力
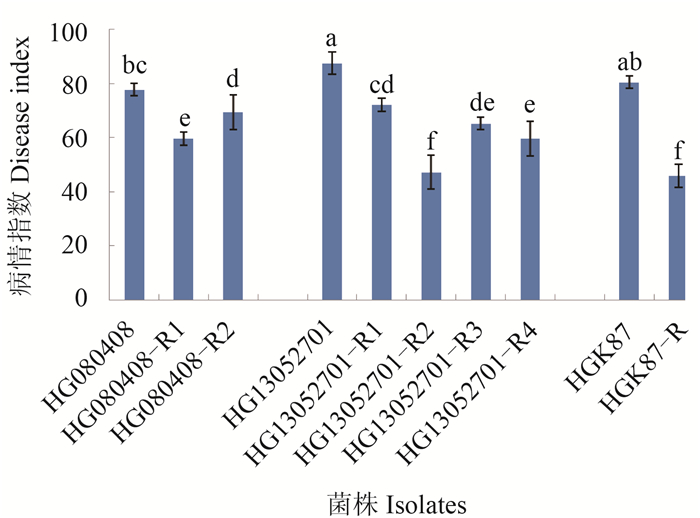
测定结果(图 2)表明,所有亲本菌株与抗性突变株均对黄瓜植株具有致病力,但突变株的致病力均显著低于亲本菌株。
|
注:HG080408、HG13052701和HGK87为亲本菌株,其余为抗药性突变株。图中不同字母表示亲本菌株及其突变株对黄瓜幼苗的致病力经Duncan氏新复极差法检验在P=0. 05水平差异显著。 Note: HG080408, HG13052701 and HGK87 are parent isolates; others are resistant mutants to prochloraz. The different letters in the figure show the virulence of parent isolates and its resistant mutants to the cucumber seedlings was significant difference at P=0. 05 level by Duncan's new multiple range tests. 图 2 尖孢镰刀菌抗咪鲜胺突变株及亲本菌株对黄瓜幼苗的致病力 Fig. 2 Virulence of prochloraz resistant mutants and parent isolates of F. oxysporum on cucumber seedlings |
2.3.3 咪鲜胺抗性突变株的抗性遗传稳定性
在不含咪鲜胺的PDA培养基上连续继代培养9代后,仅亲本菌株HG13052701产生的抗性突变株HG13052701-R1 F9代的EC50值与其F0代的EC50值接近,其余6株抗药性突变株对咪鲜胺的敏感性均呈明显上升趋势(表 3)。表明仅突变株HG13052701-R1的抗药性可以稳定遗传,其他6株突变株对咪鲜胺的抗药性均不能稳定遗传。
|
|
表 3 尖孢镰刀菌抗咪鲜胺突变株的抗药性遗传稳定性 Table 3 Resistance stability of the resistant mutants of F. oxysporum to prochloraz |
2.3.4 咪鲜胺抗性突变株及其亲本菌株对不同杀菌剂之间的交互抗性
结果表明:抗咪鲜胺突变株及其亲本菌株对其他3种杀菌剂的敏感性大小依次为戊唑醇>多菌灵>
|
|
表 4 尖孢镰刀菌抗咪鲜胺突变株及亲本对不同杀菌剂的敏感性 Table 4 Sensitivity of the prochloraz -resistant mutants of F. oxysporum to different fungicides |
|
|
表 5 尖孢镰刀菌抗咪鲜胺突变株及亲本对咪鲜胺与不同杀菌剂的交互抗性 Table 5 Cross-resistance of prochloraz-resistant mutants and parent isolates of F. oxysporum to prochloraz and other fungicides |
3 结论与讨论
目前已登记用于枯萎病防治的农药制剂有50%咪鲜胺可湿性粉剂和25%咪鲜胺乳油。研究证明,咪鲜胺和戊唑醇对尖孢镰刀菌引起的枯萎病具有较好的防治效果[12]。由于咪鲜胺在土壤中的半衰期长、持效性好[14],因此对长期处于含一定浓度咪鲜胺的土壤中的尖孢镰刀菌存在一定抗药性风险。
本研究结果表明,采自北京、河北、山东等地的112株瓜类尖孢镰刀菌对咪鲜胺均为敏感菌株。通过室内药剂连续选择驯化,共获得7株对咪鲜胺具有不同抗性水平的尖孢镰刀菌抗药突变株,说明在室内一定的连续选择压力下尖孢镰刀菌也可以对咪鲜胺产生抗药性。继代培养9代后,仅突变株HG13052701-R1的抗药性可以稳定遗传,其他6株突变株的抗药性均不能稳定遗传。虽然目前田间尚未检测到咪鲜胺抗性菌株,但本研究结果表明,抗性的产生是可能的,因此应采取适当的预防措施。
抗药突变株往往会伴有生物学性状的改变[14-15]。姜莉莉等[16]研究发现,草莓枯萎病菌Fusarium oxysporum f. sp. fragariae对戊唑醇产生抗性的同时,伴随着其生理生化特性的改变。本研究通过对抗药突变株与亲本菌株菌落生长直径、菌丝干重、致病力等主要生物学指标的比较测定,发现抗药突变株的生长繁殖能力明显低于亲本菌株,结合抗性遗传稳定性研究结果,推测瓜类枯萎病菌对咪鲜胺具有低等抗性风险。
在一种农药尚未大量使用前,明确其与其他不同类型药剂间是否存在交互抗性,有助于全面评估其应用前景,为科学用药提供理论依据。本文分析了咪鲜胺与多菌灵、戊唑醇和
| [1] | MA L J, GEISER D M, PROCTOR R H, et al. Fusarium pathogenomics[J]. Annu Rev Microbiol, 2013, 67 (1):399–416. doi:10.1146/annurev-micro-092412-155650 |
| [2] | LIEVENS B, GRAUWET T J M A, CAMMUE B P A, et al. Recent developments in diagnostics of plant pathogens:a review[M]//PANDALAI S G. Recent research developments in microbiology. Kerala, India:OAI, 2005:57-79. |
| [3] |
张吉祥, 凌键, 谢丙炎, 等. 尖孢镰刀菌专化型及生理小种分子检测研究进展[J]. 中国农学通报, 2013,29 (36):338–342.
ZHANG J X, LING J, XIE B Y, et al. Recent developments in the molecular detection of formae speciales and races of Fusarium oxysporum[J]. Chin Agric Sci Bull, 2013, 29 (36):338–342. |
| [4] |
裴月令, 曾凡云, 彭军, 等. 尖孢镰刀菌与寄主互作机理研究进展[J]. 热带生物学报, 2014,5 (1):92–100.
PEI Y L, ZENG F Y, PENG J, et al. Advances in Fusarium wilt disease and the mechanism of interaction between Fusarium and its host[J]. J Trop Biol, 2014, 5 (1):92–100. |
| [5] | MICHIELSE C B, REP M. Pathogen profile update:Fusarium oxysporum[J]. Mol Plant Pathol, 2009, 10 (3):311–324. doi:10.1111/mpp.2009.10.issue-3 |
| [6] |
石延霞, 徐玉芳, 谢学文, 等. 氟唑活化酯对黄瓜抗枯萎病的诱导作用[J]. 中国农业科学, 2015,48 (19):3848–3856.
SHI Y X, XU Y F, XIE X W, et al. Effects of FBT on induction of systemic resistance in cucumber against cucumber Fusarium wilt caused by Fusarium oxysporum f[J]. Sci Agric Sin, 2015, 48 (19):3848–3856. |
| [7] |
詹家绥, 吴娥娇, 刘西莉, 等. 植物病原真菌对几类重要单位点杀菌剂的抗药性分子机制[J]. 中国农业科学, 2014,47 (17):3392–3404.
ZHAN J S, WU E J, LIU X L, et al. Molecular basis of resistance of phytopathogenic fungi to several site-specific fungicides[J]. Scientia Agric Sin, 2014, 47 (17):3392–3404. |
| [8] | AMINI J, SIDOVICH D. The effects of fungicides on Fusarium oxysporum f. sp. lycopersici associated with Fusarium wilt of tomato[J]. J Plant Prot Res, 2010, 50 (2):172–178. |
| [9] |
马东方, 黄石, 黄文娣, 等. 小麦赤霉病菌对多菌灵和咪鲜胺的敏感性[J]. 贵州农业科学, 2016,44 (1):66–67.
MA D F, HUANG S, HUANG W D, et al. Sensitivity of Fusarium graminearum to carbendazim and prochloraz[J]. Guizhou Agric Sci, 2016, 44 (1):66–67. |
| [10] |
郑睿, 聂亚锋, 于俊杰, 等. 江苏省水稻恶苗病菌对咪鲜胺和氰烯菌酯的敏感性[J]. 农药学学报, 2014,16 (6):693–698.
ZHENG R, NIE Y F, YU J J, et al. Sensitivity of Fusarium fujikuroi to prochloraz and JS399-19 in Jiangsu province[J]. Chin J Pestic Sci, 2014, 16 (6):693–698. |
| [11] | GORGOLOUS S G, DEKKER J. Detection and measurement of fungicide resistance general principles[J]. FAO Plant Prot Bull, 1982, 30 (2):39–71. |
| [12] | JEE H J, LEE S M, CHO W D. Effects of prochloraz and tebuconazole on control of Fusarium bulb and root rot of oriental orchid, Cymbidium goeringii[J]. Res Plant Dis, 2003, 9 (2):72–78. doi:10.5423/RPD.2003.9.2.072 |
| [13] |
李新.黄瓜枯萎病的抗性遗传及其生理生化的研究[D].沈阳:沈阳农业大学, 2007:13-14.
LI X. Genetic properties and physiochemical characters of cucumber resistance to Fusarium oxysproum[D]. Shenyang:Shenyang Agricultural University, 2007:13-14. |
| [14] |
柳训才, 陈平, 程运斌, 等. 油菜体内及土壤中咪鲜胺的残留检测与消解动态[J]. 中国油料作物学报, 2006,28 (3):354–357.
LIU X C, CHEN P, CHENG Y B, et al. Study on residue detection and degradation of prochloraz in rapeseed and soil[J]. Chin J Oil Crop Sci, 2006, 28 (3):354–357. |
| [15] | ZIOGAS B N, MARKOGLOU A N, MALANDRAKIS A A. Studies on the inherent resistance risk to fenhexamid in Botrytis cinerea[J]. Eur J Plant Pathol, 2003, 109 (4):311–317. doi:10.1023/A:1023522213675 |
| [16] | HILBER U W, SCHWINN F J, SHÜEPP H. Comparative resistance patterns of fludioxonil and vinclozolin in Botryotinia fuckeliana[J]. J Phytopathol, 1995, 143 (7):423–428. doi:10.1111/j.1439-0434.1995.tb00287.x |
| [17] |
姜莉莉, 王红艳, 夏晓明, 等. 草莓枯萎病菌抗戊唑醇突变体ZY-W的生理生化特性[J]. 农药学学报, 2012,14 (1):42–50.
JIANG L L, WANG H Y, XIA X M, et al. Physiological and biochemical characteristics of tebuconazole-resistant isolate of Fusarium oxysporum ZY-W[J]. Chin J Pest Sci, 2012, 14 (1):42–50. |
| [18] | FAN J, CHEN F, DIAO Y, et al. The Y123H substitution perturbs FvCYP51B function and confers prochloraz resistance in laboratory mutants of Fusarium verticillioides[J]. Plant Pathol, 2014, 63 (4):952–960. doi:10.1111/ppa.2014.63.issue-4 |
 2016, Vol. 18
2016, Vol. 18


