化学杀虫剂的广泛应用导致越来越多的昆虫产生了抗药性,严重影响了对害虫的防治效果,同时加剧了对环境的破坏及对人类健康的威胁。拟除虫菊酯作为重要的杀虫剂种类,具有活性高、对哺乳动物低毒及易降解等特点,因而被广泛用于蚊、蝇等多种卫生害虫[1-4]以及大田和保护地鳞翅目、鞘翅目及蚜虫等多种农业害虫[5-7]的防治。在施用方式上,拟除虫菊酯类杀虫剂主要于多种作物的开花期喷雾使用,也可作为颗粒剂撒施或处理防虫网[8-9]。
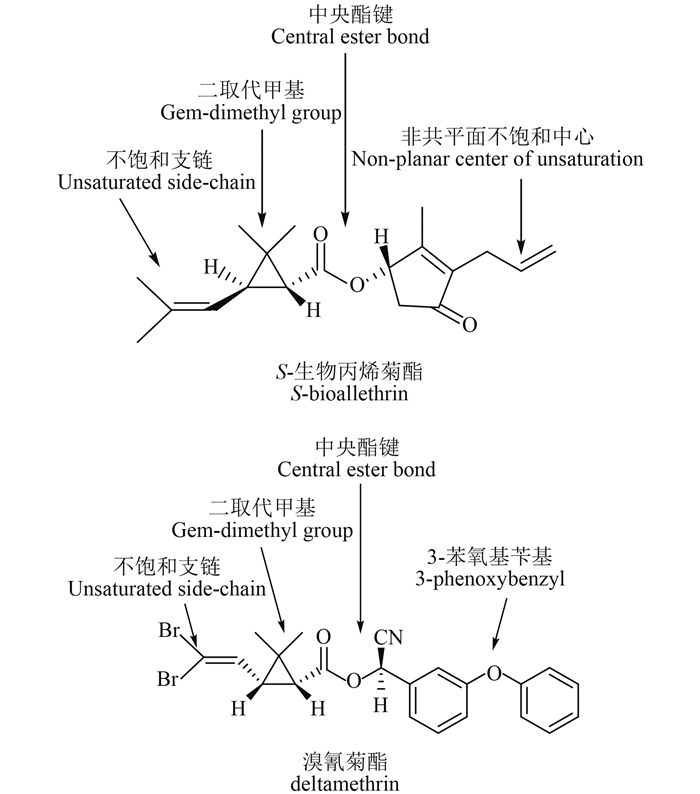
按照其结构中是否含有氰基以及对昆虫产生毒性作用的特点,可将此类化合物分为Ⅰ型和Ⅱ型拟除虫菊酯。图 1分别是Ⅰ型拟除虫菊酯代表——S-生物丙烯菊酯(S-bioallethrin)和Ⅱ型拟除虫菊酯代表——溴氰菊酯(deltamethrin)的结构示意图。
20世纪70年代已有关于昆虫对拟除虫菊酯类杀虫剂产生抗性的报道[12],随着相关报道的日益增多,其抗药性问题受到了越来越多的关注。
昆虫对杀虫剂的抗性机制主要包括靶标敏感性降低(即靶标抗性,target site resistance)和对杀虫剂解毒代谢作用的增强(即代谢抗性,metabolic resistance)等。其中,昆虫对拟除虫菊酯类杀虫剂的靶标抗性主要是由钠离子通道变异造成的。Martinez-Torres等[13]研究发现,在已对氯菊酯(permethrin)产生抗性的6个冈比亚按蚊Anopheles gambiae品系中,钠离子通道的基因突变频率与其对氯菊酯的抗性相关;抗溴氰菊酯德国小蠊Blattella germanica的L993F突变与其对溴氰菊酯的抗性相关[14];Zhen等[15]在绿盲蝽Apolygus lucorum中发现的L1015F突变与其对高效氯氟氰菊酯(lambda-cyhalothrin)的抗性相关;Liu[16]在2015年综述了蚊虫中发现的11处钠离子通道突变与其对拟除虫菊酯类杀虫剂的抗性相关。由于昆虫对拟除虫菊酯类杀虫剂的靶标抗性及机制不属于本综述的内容,故本文对此不作赘述。
除靶标抗性外,另一个重要的抗性机制就是由昆虫对拟除虫菊酯类杀虫剂解毒代谢作用增强所导致的代谢抗性。昆虫对拟除虫菊酯类杀虫剂的代谢抗性,与抗性昆虫体内主要解毒酶如酯酶(Est)、P450氧化酶(P450s)、谷胱甘肽S-转移酶(GSTs)等的变化密切相关。与靶标抗性相比,昆虫对拟除虫菊酯类杀虫剂的代谢抗性更为普遍存在,而且代谢抗性常会引起昆虫对其他杀虫剂的交互抗性。因此,掌握昆虫对拟除虫菊酯类杀虫剂的代谢抗性机制及其最新研究进展,可为该类杀虫剂的合理使用及其抗性治理提供重要基础。
近年来,有关昆虫对拟除虫菊酯类杀虫剂代谢抗性机制的研究已深入到分子水平,并取得了很多新成果。本文拟就昆虫对此类杀虫剂的代谢路径及代谢抗性机制的最新研究进展进行综述。
1 拟除虫菊酯类杀虫剂的代谢路径拟除虫菊酯类杀虫剂的代谢与其杀虫活性的发挥及对靶标生物和非靶标生物的选择毒性密切相关[17-18]。近年来,有关此类杀虫剂代谢与其对非靶标生物的氧化胁迫及相关毒性效应的关系已有研究报道[19]。
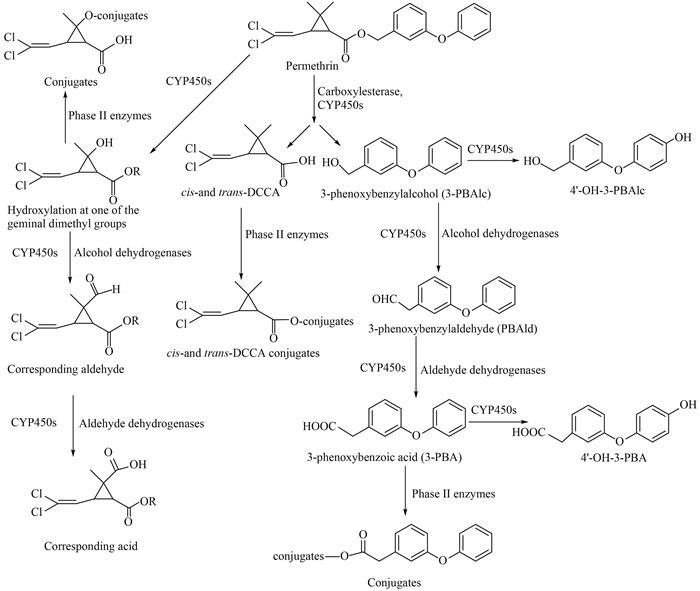
拟除虫菊酯类杀虫剂的生物代谢作用位点及代谢速率,与其结构、生物种类以及代谢酶等均密切相关。此类杀虫剂最主要的生物代谢反应是酯键的清除[17]。其中,反式结构的各种菊酸如反式-菊酸及反式-二氯菊酸等与伯醇反应形成的拟除虫菊酯中的酯键,可以很容易地被对有机磷和氨基甲酸酯类药剂敏感的酯酶所水解,而各种顺式结构的菊酸如顺式-菊酸与伯醇反应形成的拟除虫菊酯以及各种菊酸与仲醇反应所生成的拟除虫菊酯中的酯键,则水解非常缓慢或不能水解[17-18]。除水解酶外,氧化作用也可导致对拟除虫菊酯类药剂中酯键的清除。研究发现,还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的存在可加快对酯键的清除,尤其当酯酶活性被抑制后,微粒体酶制备液在NADPH存在下也可将酯键清除。这种对酯键的氧化清除可能是由于酯键相邻C原子上的氧化羟基化所致,也可能是由于拟除虫菊酯中酸部分或醇部分上其他位点的羟基化所致。但目前对于氧化清除酯键的具体机制尚不明确。
拟除虫菊酯类杀虫剂代谢产生的酸残基及醇残基也可进一步发生相应的代谢反应。Casida等[17]对此进行了综述。其中,酸残基如菊酸或二氯菊酸等,一方面可直接与葡萄糖或谷氨酸、甘氨酸、丝氨酸、牛磺酸等形成轭合物,另一方面,酸残基中的甲基也可以被氧化羟基化,形成羟甲基代谢物,这些代谢物可被继续氧化形成相应的醛或酸代谢物。如对于菊酸(2, 2-二甲基-3-(2-甲基-1-丙烯基)环丙烷羧酸),可将其2-甲基-1-丙烯基的甲基氧化羟基化后,再继续氧化为相应的醛及酸;而对二氯菊酸,氧化羟基化主要发生在环丙烷上连接的偕二甲基上(图 2)。
拟除虫菊酯类杀虫剂水解产生的醇残基,仅有少部分直接形成轭合物,大多数则继续氧化为醛,再氧化为酸,最后形成相应的轭合物。如一些菊酯水解产生的苄醇可被氧化为苯甲酸,然后再与糖基形成轭合物。对于α-氰基间苯氧基苄醇,羟基化主要发生在2-位和4-位,继续氧化生成3-苯氧基苄酸(3-PBA)及其2-位和4-位的羟基化产物后,再形成相应的轭合物(图 2)。
拟除虫菊酯类杀虫剂代谢的速率与其结构特征有关,如酸残基部分为顺式或反式结构,以及醇残基部分是否含有氰基等,均可显著影响其代谢。通常而言,反式-拟除虫菊酯的代谢速率显著高于顺式-拟除虫菊酯,而当其醇残基部分含有氰基时,则会大大降低代谢速率。
在拟除虫菊酯类杀虫剂的生物代谢中,目前对氯菊酯代谢路径的研究较为深入(图 2)。现有研究表明,在人体中,氯菊酯主要在羧酸酯酶的水解作用或P450s的氧化作用下发生酯键断裂,形成顺式-或反式-二氯菊酸(cis-,trans-DCCA)以及3-苯氧基苯甲醇(3-PBAlc),其中,3-PBAlc可被继续氧化为4'-OH-3-PBAlc、3-苯氧基苯甲酸(3-PBA)及4'-OH-3-PBA。其最终代谢物之一的3-PBA是在氯菊酯被水解为3-PBAlc后,再由醇脱氢酶催化3-PBAlc形成3-苯氧基苯甲醛(3-PBAld),最后由醛脱氢酶催化3-PBAld氧化形成3-PBA[19-20]。而DCCA及3-PBA可继续由II相轭合代谢酶催化形成轭合物,其中,反式-氯菊酯在哺乳动物尿中的主要代谢物是葡萄糖醛酸及甘氨酸的轭合物[19-20]。
氯菊酯的代谢涉及由P450s、醇脱氢酶(alcohol dehydrogenase)及醛脱氢酶(aldehyde dehydrogenase)参与的氧化,以及羧酸酯酶(CarE)参与的水解[19]。由于人肝脏中含有丰富的P450s及CarE,因此哺乳动物的肝脏是代谢氯菊酯等拟除虫菊酯类杀虫剂的主要器官[21]。此外,氯菊酯的生物代谢还具有一定的立体选择性。虽然顺式-氯菊酯和反式-氯菊酯具有相同的代谢路径,但顺式-氯菊酯比反式-氯菊酯的代谢速率慢了3倍[19];人体的I型和II型羧酸酯酶代谢反式-氯菊酯的速率也明显快于代谢顺式-氯菊酯[22-23]。
总之,拟除虫菊酯类杀虫剂主要是通过酯键的水解以及甲基、亚甲基、烷基及芳取代基的氧化作用而进行代谢的,所形成的代谢产物是相应的醇、酚、酸及其甘氨酸、硫酸盐、葡萄糖醛酸或葡萄糖苷等轭合物,可被昆虫、鸟及哺乳动物排出。但是,不同生物代谢拟除虫菊酯时的作用位点、形成的代谢轭合物以及代谢速率均有所不同。
2 酯酶介导的昆虫对拟除虫菊酯类杀虫剂的水解代谢抗性目前大多数商品化的拟除虫菊酯杀虫剂都是羧酸酯类,均带一个大且具高疏水性的羧酸残基和烷(芳)醇残基(图 1,图 2),可被羧酸酯酶水解,因此在昆虫对这类杀虫剂的抗性机制中,由酯酶介导的代谢抗性已被广泛报道。Gunning等[24]研究发现,在氰戊菊酯(fenvalerate)抗性品系棉铃虫Helicoverpa armigera中,羧酸酯酶同工酶谱带的颜色比敏感品系的深,且用酯酶抑制剂S, S, S-三丁基三硫代磷酸酯(S, S, S-tributyl phosphorotrithioate, DEF)处理抗性品系棉铃虫可有效降低其抗性水平,表明酯酶参与了棉铃虫对氰戊菊酯的抗性。
2.1 酯酶在昆虫对拟除虫菊酯类杀虫剂代谢抗性中的作用为明确酯酶在昆虫对拟除虫菊酯类杀虫剂抗性中的作用,通常先用酯酶抑制剂DEF抑制昆虫酯酶活性后,再考察其对拟除虫菊酯药剂敏感度的变化。如用DEF处理脐橙螟Amyelois transitella后,发现其对联苯菊酯(bifenthrin)和高效氟氯氰菊酯(beta-cyfluthrin)的敏感性均显著升高,说明羧酸酯酶参与了脐橙螟对这2种药剂的代谢抗性[25]。捕食性瓢虫Eriopis connexa抗高效氯氟氰菊酯品系的羧酸酯酶活性明显高于敏感品系,而且用DEF处理后其抗性水平明显降低,表明羧酸酯酶与其对高效氯氟氰菊酯的抗性有关[26]。Xi等[27]发现,经DEF处理后,抗性品系大豆蚜Aphis glycines对高效氯氟氰菊酯的抗性显著降低,表明酯酶也参与了大豆蚜对高效氯氟氰菊酯的代谢抗性。
2.2 昆虫酯酶活性升高导致的代谢抗性深入研究酯酶变化导致昆虫对拟除虫菊酯类杀虫剂产生抗性的生化机制,明确了酯酶活性升高可导致昆虫对此类杀虫剂的抗性。El-Latif等[28]研究了单头棉铃虫的酯酶活性与其对拟除虫菊酯类杀虫剂敏感性的关系,发现溴氰菊酯抗性品系棉铃虫的酯酶活性比敏感品系高,其中,与敏感品系相比,两个抗性品系幼虫中个体酯酶活性升高的频率分别为63%和90%,而敏感品系中只有14%的个体出现了酯酶活性升高,说明酯酶活性升高导致了棉铃虫对溴氰菊酯的抗性。Wu等[29]研究发现,抗氰戊菊酯(fenvalerate)棉铃虫品系的酯酶活性比敏感品系高1.9倍。通过纯化相应的酯酶并研究其对拟除虫菊酯类杀虫剂的体外代谢能力,并比较相关酯酶基因的表达量,从而最终明确了抗性棉铃虫中酯酶活性的升高导致了其对氰戊菊酯的代谢抗性[29]。Aponte等[30]发现,对氯菊酯产生抗性的埃及伊蚊Aedes aegypti的羧酸酯酶活性高于敏感品系。Roca-Acevedo等[31]报道,抗溴氰菊酯品系侵扰锥猎蝽Triatoma infestans卵期酯酶的活性也比敏感品系高。可见,酯酶活性升高在昆虫及其卵期对拟除虫菊酯类杀虫剂的抗性中均发挥了作用。
通过比较酯酶同工酶与底物的结合能力,以及采用体外蛋白表达等技术手段,可以直接探明由酯酶介导的昆虫对拟除虫菊酯类杀虫剂的代谢抗性机制。Thalavaisundaram等[32]报道,抗氟胺氰菊酯(fluvalinate)的7个田间西花蓟马Frankliniella occidentalis品系的酯酶活性均高于敏感品系,通过非变性凝胶电泳,发现敏感品系有3个酯酶同工酶,田间抗性品系只有2个酯酶同工酶,且田间抗性品系酯酶同工酶与α-NA的结合能力比敏感品系强,表明酯酶活性升高以及对底物的结合能力增强是西花蓟马对氟胺氰菊酯产生抗性的重要原因。Heidari等[33]将铜丽蝇Lucilia cuprina羧酸酯酶基因进行定点突变并在体外原核表达后,研究了其对多种不同种类拟除虫菊酯的水解代谢能力,发现野生型铜丽蝇的羧酸酯酶对不同种类拟除虫菊酯杀虫剂均具有较高的水解活性,且对不同拟除虫菊酯以及同一种拟除虫菊酯不同异构体的水解能力有所不同。当对酯酶基因进行诱导突变并表达后,导致其对不同拟除虫菊酯以及同种拟除虫菊酯不同异构体的水解能力均发生了变化。可见,由羧酸酯酶介导的昆虫对拟除虫菊酯类杀虫剂的抗性,不仅与酯酶同工酶数目及各种同工酶的量变有关,而且可能还涉及其基因突变,这些变化均可导致昆虫酯酶对拟除虫菊酯类杀虫剂水解代谢活性的增强,并最终导致抗药性的产生。
2.3 酯酶介导的代谢抗性分子机制目前,有关酯酶介导的昆虫对拟除虫菊酯类杀虫剂代谢抗性的分子机制研究已取得一些成果。Zhang等[34]比较了高效氯氰菊酯(beta-cypermethrin)抗性和敏感品系家蝇Musca domestica中羧酸酯酶基因的差异,发现抗性品系酯酶的MdαE7基因出现了过量表达。以高效氯氰菊酯的荧光类似物作底物,研究了羧酸酯酶对药剂的水解代谢能力,发现抗性品系家蝇羧酸酯酶水解荧光类似物的能力是敏感品系的9.05倍。该研究表明,羧酸酯酶基因的过量表达导致了家蝇对高效氯氰菊酯代谢能力的增强,最终导致了抗性的产生[34]。Xi等[27]发现,在高效氯氟氰菊酯抗性品系大豆蚜Aphis glycines中,与酯酶相关的DNA拷贝数和转录水平均较敏感品系高。因此,抗性昆虫中酯酶基因表达量上调,以及DNA拷贝数和转录水平的升高,均参与了昆虫对拟除虫菊酯类杀虫剂代谢抗性的产生。
2.4 昆虫酯酶对拟除虫菊酯类杀虫剂的代谢有研究者通过表征拟除虫菊酯类杀虫剂的代谢产物,研究了昆虫酯酶对此类杀虫剂的代谢能力,为进一步研究昆虫酯酶介导的代谢抗性奠定了基础。Ai等[35]通过采用超高效液相色谱-串联三重四极杆质谱法(UPLC-MS/MS)表征高效氯氰菊酯的代谢产物3-苯氧基苯甲酸(3-PBA),建立了3-PBA的超高效液相色谱分析方法,并利用该方法直接表征了棉铃虫酯酶和P450s对高效氯氰菊酯等拟除虫菊酯类杀虫剂的代谢能力。近年来,一些研究者通过合成与拟除虫菊酯结构类似、但其水解产物可被激发产生荧光的拟除虫菊酯类似物,并将其作为底物,通过研究昆虫水解酶水解这些类似物产生的荧光代谢物,从而表征昆虫对拟除虫菊酯类杀虫剂的代谢能力。该方法具有灵敏度高、抗基质干扰能力强以及不需纯化等优点,近年来已被用于相关研究。Yuan等[36]以氯氰菊酯(cypermethrin)和氰戊菊酯的8种荧光类似物作底物,研究了体外表达的22种与拟除虫菊酯抗性相关的羧酸酯酶蛋白对8种类似物的体外代谢能力,结果表明,菊酯荧光类似物可用于表征昆虫对拟除虫菊酯类杀虫剂的代谢能力及代谢抗性。
3 P450s介导的昆虫对拟除虫菊酯类杀虫剂的氧化代谢抗性P450s是细胞光滑内质网上的一种氧化酶系,主要由细胞色素P450、细胞色素b5、黄素蛋白-NADPH-P-450还原酶、黄素蛋白-NADH-细胞色素b5还原酶以及磷脂组成。细胞色素P450是整个酶系中的末端氧化酶,其不仅负责活化氧分子,同时负责与底物的结合,并决定酶系底物的专一性。
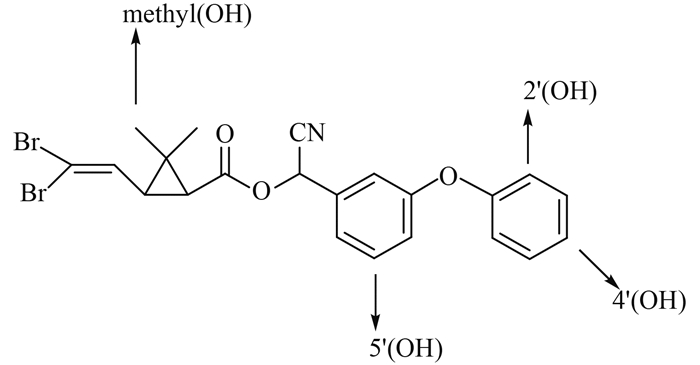
昆虫的P450s也是代谢菊酯类杀虫剂的重要解毒酶,P450s氧化代谢活性增强是昆虫对拟除虫菊酯类杀虫剂产生抗性的重要机制。已报道的由P450s介导的拟除虫菊酯类杀虫剂氧化代谢位点如图 3所示(以溴氰菊酯为例)。
3.1 P450s氧化代谢活性增强导致的抗性
研究P450s的抑制剂——增效醚(PBO)的增效作用,是从生化水平研究P450s是否参与了昆虫对拟除虫菊酯类杀虫剂抗性的重要手段。Yang等[38]用PBO分别处理氰戊菊酯、氯氰菊酯和溴氰菊酯抗性品系棉铃虫后,发现其对这些药剂的抗性明显降低,且抗性品系棉铃虫中肠微粒体对14C标记的溴氰菊酯的氧化代谢能力明显高于敏感品系,表明由P450s介导的氧化代谢作用增强是棉铃虫对拟除虫菊酯类药剂产生抗性的原因。用PBO处理抗氯菊酯品系冈比亚按蚊后,发现其对氯菊酯的敏感性显著增加,且抗性品系的P450s活性显著高于敏感品系,而其谷胱甘肽S-转移酶和酯酶活性与敏感品系并无明显差异,说明P450s活性升高是冈比亚按蚊对氯菊酯产生抗性的原因之一[39]。抗溴氰菊酯中华按蚊Anopheles sinensis的P450单加氧酶活性也明显高于敏感品系[40]。Arouri等[41]研究发现,PBO可抑制地中海实蝇Ceratitis capitata抗性品系对高效氯氟氰菊酯的抗性,使其LC50值从3 678 mg/L降低到72 mg/L,表明P450s参与了地中海实蝇对高效氯氟氰菊酯的抗性。用氯氰菊酯连续处理花生红灯蛾Amsacta albistriga 20代后,其抗性上升了21.5倍,且用PBO处理后对抗性品系的增效比高于敏感品系,说明P450s介导的氧化代谢在花生红灯蛾对氯氰菊酯的抗性中发挥了一定作用[42]。Shi等[43]用PBO处理朱砂叶螨Tetranychus cinnabarinus后,发现其对甲氰菊酯(fenpropathrin)的抗性倍数从101降低到了75,表明P450s介导的氧化代谢能力增强是朱砂叶螨对甲氰菊酯产生抗性的重要原因。由此可见,由P450s活性升高所导致的氧化代谢能力增强是昆虫对拟除虫菊酯类杀虫剂产生代谢抗性的普遍机制。
3.2 P450s介导的代谢抗性分子机制有关昆虫对拟除虫菊酯类杀虫剂氧化代谢抗性的分子机制已被广泛研究。其中,抗性昆虫通过提高P450s基因表达量而增强其对拟除虫菊酯类杀虫剂的代谢能力,最终导致抗性的产生是主要的抗性机制。
由于拟除虫菊酯类杀虫剂在病媒卫生害虫防治中的大量应用,其抗性问题已十分严重,因而对其抗性机制的研究也较为深入。研究发现,冈比亚按蚊抗氯菊酯品系雄成虫和雌成虫中P450s基因CYP6Z1的表达量分别是敏感品系的11和4.5倍[44]。而通过基因芯片研究发现,在已对氯菊酯产生不同程度抗性的多个冈比亚按蚊品系中,P450s基因CYP6P3和CYP6M2的表达量均高于敏感品系,其中采自尼日利亚Akron和Ojoo地区的两个抗性品系中,上述两个基因的表达量分别增加了12.4和7.4倍[45]。Müller等[46]也发现,CYP6P3基因在氯菊酯抗性冈比亚按蚊中呈过量表达。表明CYP6家族相关基因的过量表达与冈比亚按蚊对氯菊酯的抗性相关。此外,对拟除虫菊酯类杀虫剂已产生抗性的不吉按蚊Anopheles funestus可通过提高CYP6P9a和CYP6P9b基因的表达量来增强对药剂的代谢,从而导致了其对拟除虫菊酯类杀虫剂抗药性的产生[47-48]。Dusfour等[49]通过基因芯片技术研究发现,采自法国Guiana地区的溴氰菊酯抗性品系埃及伊蚊Aedes aegypti中CYP6BB2基因的表达量是敏感品系的33.83倍。
除卫生害虫外,以棉铃虫为代表的农业昆虫对拟除虫菊酯类杀虫剂的代谢抗性机制研究也取得了一些进展。Zhang等[50]发现,在氰戊菊酯抗性品系棉铃虫中,CYP6B7基因的表达量是敏感品系的5倍,且该基因的表达量随着棉铃虫幼虫的生长而升高,因此认为棉铃虫对氰戊菊酯的抗性与CYP6B7基因的过量表达有关。Joußen等[51]研究发现,澳大利亚一个棉铃虫品系对氰戊菊酯的抗性与其CYP337B3基因的过量表达有关,并通过体外代谢试验证明,CYP337B3具有将氰戊菊酯代谢为无毒的4-羟基氰戊菊酯的能力。Rasool等[52]发现,CYP337B3v2基因在抗氯氰菊酯的巴基斯坦棉铃虫品系中呈过量表达,而且CYP337B3v2可以将氯氰菊酯代谢为无毒的4-羟基氯氰菊酯。研究比较多个不同抗性水平棉铃虫品系中CYP337B3基因表达量与其对氯氰菊酯抗药性的关系,发现含有CYP337B3v2基因的棉铃虫品系比缺少该基因的品系对氯氰菊酯的耐药性高7倍[52]。上述结果均表明,棉铃虫对氰戊菊酯及氯氰菊酯的抗性与CYP337B3基因的过量表达有关。但Han等[53]的研究结果却表明,在中国采集的抗氰戊菊酯棉铃虫品系的抗性水平与CYP337B3基因的表达量并没有明显相关性。可见,不同棉铃虫品系对同一种杀虫剂的抗性机制也可能有所不同。
除棉铃虫外,在其他多种昆虫中也普遍存在由P450s基因过量表达导致的对拟除虫菊酯类杀虫剂的代谢抗性。Arouri等[41]发现,对高效氯氟氰菊酯产生抗性的地中海实蝇经PBO处理后敏感度明显上升,而且在不同地区的抗性品系中,P450基因CYP6A51的表达量升高了13~18倍,因此P450介导的代谢抗性是地中海实蝇对高效氯氟氰菊酯产生抗性的重要原因。Muthusamy等[42]通过荧光定量试验,发现在用氯氰菊酯连续处理20代的抗性品系花生红灯蛾中,CYP4M44、CYP9A77和CYP6B47等P450基因均呈过量表达。Zimmer等[54]对高效氯氟氰菊酯抗性品系油菜花露尾甲Meligethes aeneus的研究发现,CYP6BQ23基因在所有抗性品系中均呈过量表达,其最高表达量是敏感品系的938倍。
除细胞色素P450氧化酶外,研究发现P450还原酶也参与了昆虫对拟除虫菊酯类杀虫剂的代谢。Konus等[55]通过蛋白质组学,研究比较了田间抗性品系和敏感品系棉铃虫在蛋白表达上的差异,发现抗性品系中NADPH-细胞色素P450还原酶的表达量有所增加,使其在P450催化拟除虫菊酯类杀虫剂氧化代谢形成初级产物的过程中,所提供的电子数量有所增加,因而增强了棉铃虫对拟除虫菊酯类杀虫剂的氧化代谢能力,最终导致了代谢抗性的产生。此外,Shi等[56]通过克隆朱砂叶螨中编码细胞色素P450还原酶的cDNA全长发现,虽然其在所有虫态中均有表达,但当用甲氰菊酯处理后,其在抗性品系中的表达量比敏感品系明显上调;通过对甲氰菊酯抗性品系朱砂叶螨的P450还原酶进行RNA干扰,发现干扰后抗性品系对甲氰菊酯的敏感度明显升高;说明朱砂叶螨对甲氰菊酯的抗性与其P450还原酶的表达有关。
有研究者通过表征P450s相关基因的体外表达产物对拟除虫菊酯类杀虫剂的代谢能力,进一步明确了昆虫P450s参与的对拟除虫菊酯类杀虫剂的代谢抗性机制。如将在氯菊酯抗性品系冈比亚按蚊中过量表达的CYP6P3基因异源表达后,经高效液相色谱(HPLC)分析发现,该蛋白具有了代谢氯菊酯和溴氰菊酯的能力[46]。Stevenson等[57]通过体外表达CYP6M2后,使用高效液相色谱-质谱(HPLC-MS)表征了其对苄氯菊酯和溴氰菊酯的代谢产物,证明了体外表达的冈比亚按蚊CYP6M2具有代谢氯菊酯和溴氰菊酯的能力。Ibrahim等[47]研究了体外表达的抗性品系油菜花露尾甲中过量表达的CYP6BQ23,发现该蛋白可将溴氰菊酯代谢为无毒的4-羟基溴氰菊酯。
综上可见,在拟除虫菊酯类杀虫剂抗性品系昆虫中,部分P450s基因(表 1)的过量表达增强了其对拟除虫菊酯类药剂的代谢能力,从而导致了代谢抗性的产生。
|
|
表 1 与昆虫对拟除虫菊酯类杀虫剂代谢抗性相关的P450s基因 Table 1 Insects P450s genes involved in metabolic resistant to pyrethroid insecticides |
4 谷胱甘肽S-转移酶介导的昆虫对拟除虫菊酯类杀虫剂的Ⅱ相代谢
除了可进行Ⅰ相代谢外,也有一些研究报道了拟除虫菊酯类杀虫剂的Ⅱ相代谢及相关代谢抗性[58]。在哺乳动物中,已有研究表明拟除虫菊酯类杀虫剂可以诱导谷胱甘肽S-转移酶(GSTs)活性升高[59]。对昆虫的相关研究也表明,昆虫对拟除虫菊酯类杀虫剂产生抗性与其谷胱甘肽S-转移酶活性的增强有关,如在对氟氯氰菊酯(cyfluthrin)已产生抗性的赤拟谷盗Tribolium castaneum中,GSTs活性升高了4~6倍[60]。在乌干达地区,对溴氰菊酯等拟除虫菊酯类杀虫剂产生抗性的不吉按蚊的GSTs活性是敏感品系的3.47倍,表明GSTs活性升高与不吉按蚊对拟除虫菊酯类杀虫剂抗性的产生有关[61]。Adeyi等[62]用几种拟除虫菊酯类药剂处理臭腹腺蝗Zonocerus variegatus后,发现其GSTs活性明显高于对照组。此外,该研究还发现,经拟除虫菊酯类杀虫剂处理后,臭腹腺蝗死亡个体GSTs对底物的催化活性(最大反应速率Vmax值)高于存活的个体,而存活个体较死亡个体对底物的亲和力更高[62]。Silva等[63]研究发现,番茄斑潜蝇Tuta absoluta的GSTs活性与其对溴氰菊酯和氯菊酯的抗性水平相关,表明GSTs在其对拟除虫菊酯类杀虫剂的代谢抗性中发挥了作用。不同田间品系小亚璃眼蜱Hyalomma anatolicum的GSTs活性均显著高于其敏感品系,并且与其对溴氰菊酯的抗性相关[64]。
研究GSTs对拟除虫菊酯类杀虫剂的代谢机制发现,拟除虫菊酯类药剂可作为GSTs的底物或抑制剂[58, 65],但不能直接被GSTs降解[66-67]。Kostaropoulos等[68]通过抑制试验、竞争荧光和HPLC等研究,发现溴氰菊酯可与GSTs的活性中心结合,竞争性地抑制GSTs对1-氯-2, 4-二硝基苯(1-chloro-2, 4-dinitrobenzene, CDNB)的活性,但溴氰菊酯不能与还原型谷胱甘肽(GSH)轭合,表明GSTs在昆虫对拟除虫菊酯类药剂抗性机制中的作用是竞争性地与药剂分子结合,即属于螯合机制。此外,Vontas等[67]发现,GSTs还具有过氧化酶活性,可导致褐飞虱Nilaparvata lugens对氯菊酯产生抗性,并认为GSTs在褐飞虱对拟除虫菊酯类药剂抗性中的作用是保护昆虫组织免受过氧化损伤。
有关GSTs参与的昆虫对拟除虫菊酯类杀虫剂代谢抗性的分子机制也已有研究报道。David等[69]利用基因芯片技术研究了冈比亚按蚊的抗性相关基因,发现其GSTs基因GSTE2在氯菊酯抗性品系中呈过量表达,说明GSTs在冈比亚按蚊对氯菊酯抗性的产生中发挥了一定作用。在对氯菊酯产生抗性的尖音库蚊Culex pipiens中,GSTs的2个基因CpGSTd1和CpGSTd2的表达量比敏感品系高2倍,且外源表达这2个基因后,发现它们对CDNB和1, 2-二氯-4硝基苯(DCNB)的亲和力升高,但是外源表达的这2个蛋白对氯菊酯却没有代谢能力[70]。Konus等[55]针对采自田间的2个拟除虫菊酯抗性品系棉铃虫,通过双向电泳、基质辅助激光解吸电离飞行时间质谱(MALDI TOF-MS)并结合生化试验等研究,比较分析了其蛋白组,发现田间品系的GSTs活性明显升高,说明GSTs参与了棉铃虫对拟除虫菊酯类杀虫剂的代谢。Zhou等[71]研究了GSTs在家蚕Bombyx mori对拟除虫菊酯类杀虫剂代谢中的作用,发现在甲氰菊酯处理下,家蚕GSTs活性明显升高,且其GSTs家族中的一个基因BmGSTe2的表达量也明显升高,通过体外表达BmGSTE2,发现其具有过氧化物酶活性,并且在体外试验中其与CDNB的结合活性随着甲氰菊酯的加入而受到抑制,说明GSTs也参与了家蚕对拟除虫菊酯类杀虫剂的代谢。
综上所述,由GSTs介导的Ⅱ相代谢,在昆虫对拟除虫菊酯类杀虫剂的代谢抗性中也发挥着一定作用,但目前相关研究报道相对较少。因此,GSTs在昆虫对拟除虫菊酯类杀虫剂代谢抗性中的作用及其在昆虫抗药性治理中的意义,还有待进一步深入研究。
5 结论与展望昆虫对拟除虫菊酯类杀虫剂的代谢抗性机制与昆虫体内的三大主要解毒代谢酶系——P450s、CarE及GSTs活性的升高密切相关。目前已有许多关于昆虫对拟除虫菊酯类杀虫剂产生代谢抗性的报道,并且已从分子水平对其机制进行了探究。关于昆虫对拟除虫菊酯类杀虫剂代谢抗性分子机制的研究目前主要集中在对解毒酶基因表达量变化的考察方面,针对表达量有差异的基因,深入研究其体外表达蛋白对拟除虫菊酯杀虫剂的代谢能力及其在昆虫对此类杀虫剂代谢抗性中的作用等,目前研究报道还相对较少。
研究明确昆虫对拟除虫菊酯类杀虫剂的代谢抗性机制,可以为通过RNAi技术等提高昆虫对拟除虫菊酯类杀虫剂的敏感度,有效进行昆虫的抗药性治理提供依据。此外,对于拟除虫菊酯类杀虫剂的合理使用及轮用,延缓抗药性的产生及发展也具有重要的指导意义。
| [1] | ARTINEZ-TORRES D, CHEVILLON C, BRUN-BARALE A, et al. Voltage-dependent Na+ channels in pyrethroid-resistant Culex pipiens L. mosquitoes[J]. Pest Manage Sci, 1999, 55 (10):1012–1020. doi:10.1002/(SICI)1096-9063(199910)55:10<>1.0.CO;2-6 |
| [2] | HARGREAVES K, KOEKEMOER L L, BROOKE B D, et al. Anopheles funestus resistant to pyrethroid insecticides in South Africa[J]. Med Vet Entomol, 2000, 14 (2):181–189. doi:10.1046/j.1365-2915.2000.00234.x |
| [3] | MUTUNGA J M, ANDERSON T D, CRAFT D T, et al. Carbamate and pyrethroid resistance in the akron strain of Anopheles gambiae[J]. Pestic Biochem Physiol, 2015, 121 :116–121. doi:10.1016/j.pestbp.2015.03.001 |
| [4] | JOHNSON B J, FONSECA D M. Insecticide resistance alleles in wetland and residential populations of the West Nile virus vector Culex pipiens in New Jersey[J]. Pest Manage Sci, 2016, 72 (3):481–488. doi:10.1002/ps.2016.72.issue-3 |
| [5] | PALMQUIST K, SALATAS J, FAIRBROTHER A. Pyrethroid insecticides:use, environmental fate, and ecotoxicology[M]//PERVEEN F. Insecticides-advances in integrated pest management. INTECH Open Access Publisher, 2012:251-278. |
| [6] | LI Y, XU Z F, SHI L, et al. Insecticide resistance monitoring and metabolic mechanism study of the green peach aphid, Myzus persicae (Sulzer)(Hemiptera:Aphididae), in Chongqing, China[J]. Pestic Biochem Physiol, 2015, 132 :21–28. |
| [7] | PANSA M G, BLANDINO M, INGEGNO B L, et al. Toxicity and persistence of three pyrethroids for the control of cereal bugs on common wheat[J]. J Pest Sci, 2015, 88 (1):201–208. doi:10.1007/s10340-014-0572-8 |
| [8] | HE L M, TROIANO J, WANG A, et al. Environmental chemistry, ecotoxicity, and fate of lambda-cyhalothrin[M]//WHITACRE D M. Reviews of environmental contamination and toxicology. New York:Springer, 2008:71-91. |
| [9] | BIONDI A, ZAPPALÀ L, DESNEUX N, et al. Potential toxicity of acypermethrin-treated nets on Tuta absoluta (Lepidoptera:Gelechiidae)[J]. J Econ Entomol, 2015, 108 (3):1191–1197. doi:10.1093/jee/tov045 |
| [10] | SODERLUND D M, CLARK J M, SHEETS L P, et al. Mechanisms of pyrethroid neurotoxicity:implications for cumulative risk assessment[J]. Toxicology, 2002, 171 (1):3–59. doi:10.1016/S0300-483X(01)00569-8 |
| [11] | SODERLUND D M. Molecular mechanisms of pyrethroid insecticide neurotoxicity:recent advances[J]. Arch Toxicol, 2012, 86 (2):165–181. doi:10.1007/s00204-011-0726-x |
| [12] | PRIESTER T M, GEORGHIOU G P. Inheritance of resistance to permethrin in Culex pipiens quinquefasciatus[J]. J Econ Entomol, 1979, 72 (1):124–127. doi:10.1093/jee/72.1.124 |
| [13] | MARTINEZ-TORRES D, CHANDRE F, WILLIAMSON M S, et al. Molecular characterization of pyrethroid knockdown resistance (kdr) in the major malaria vector Anopheles gambiae s.s.[J]. Insect Mol Biol, 1998, 7 (2):179–184. doi:10.1046/j.1365-2583.1998.72062.x |
| [14] | TAN J, LIU Z, TSAI T D, et al. Novel sodium channel gene mutations in Blattella germanica reduce the sensitivity of expressed channels to deltamethrin[J]. Insect Biochem Mol Biol, 2002, 32 (4):445–454. doi:10.1016/S0965-1748(01)00122-9 |
| [15] | ZHEN C A, GAO X W. A point mutation (L1015F) of the voltage-sensitive sodium channel gene associated with lambda-cyhalothrin resistance in Apolygus lucorum (Meyer-Dür) population from the transgenic Bt cotton field of China[J]. Pestic Biochem Physiol, 2016, 127 :82–89. doi:10.1016/j.pestbp.2015.09.011 |
| [16] | LIU N N. Insecticide resistance in mosquitoes:impact, mechanisms, and research directions[J]. Annu Rev Entomol, 2015, 60 :537–559. doi:10.1146/annurev-ento-010814-020828 |
| [17] | CASIDA J E, RUZO L O. Metabolic chemistry of pyrethroid insecticides[J]. Pest Manage Sci, 1980, 11 (2):257–269. doi:10.1002/ps.v11:2 |
| [18] | CASIDA J E, GAMMON D W, GLICKMAN A H, et al. Mechanisms of selective action of pyrethroid insecticides[J]. Annu Rev Pharmacol Toxicol, 1983, 23 :413–438. doi:10.1146/annurev.pa.23.040183.002213 |
| [19] | WANG X, MARTÍNEZ M A, DAI M H, et al. Permethrin-induced oxidative stress and toxicity and metabolism. a review[J]. Environ Res, 2016, 149 :86–104. doi:10.1016/j.envres.2016.05.003 |
| [20] | CHOI J, ROSE R L, HODGSON E. In vitro human metabolism of permethrin:the role of human alcohol and aldehyde dehydrogenases[J]. Pestic Biochem Physiol, 2002, 74 (3):117–128. doi:10.1016/S0048-3575(02)00154-2 |
| [21] | CROW J A, BORAZJANI A, POTTER P M, et al. Hydrolysis of pyrethroids by human and rat tissues:examination of intestinal, liver and serum carboxylesterases[J]. Toxicol Appl Pharmacol, 2007, 221 (1):1–12. doi:10.1016/j.taap.2007.03.002 |
| [22] | LESTREMAU F, WILLEMIN M E, CHATELLIER C, et al. Determination of cis-permethrin, trans-permethrin and associated metabolites in rat blood and organs by gas chromatography-ion trap mass spectrometry[J]. Anal Bioanal Chem, 2014, 406 (14):3477–3487. doi:10.1007/s00216-014-7774-z |
| [23] | SCOLLON E J, STARR J M, GODIN S J, et al. In vitro metabolism of pyrethroid pesticides by rat and human hepatic microsomes and cytochrome P450 isoforms[J]. Drug Metab Dispos, 2009, 37 (1):221–228. doi:10.1124/dmd.108.022343 |
| [24] | GUNNING R V, MOORES G D, DEVONSHIRE A L. Esterases and fenvalerate resistance in a field population of Helicoverpa punctigera (Lepidoptera:Noctuidae) in Australia[J]. Pestic Biochem Physiol, 1997, 58 (2):155–162. doi:10.1006/pest.1997.2295 |
| [25] | DEMKOVICH M, SIEGEL J P, HIGBEE B S, et al. Mechanism of resistance acquisition and potential associated fitness costs in Amyelois transitella (Lepidoptera:Pyralidae) exposed to pyrethroid insecticides[J]. Environ Entomol, 2015, 44 (3):855–863. doi:10.1093/ee/nvv047 |
| [26] | RODRIGUES A R S, SIQUEIRA H A A, TORRES J B. Enzymes mediating resistance to lambda-cyhalothrin in Eriopis connexa (Coleoptera:Coccinellidae)[J]. Pestic Biochem Physiol, 2014, 110 :36–43. doi:10.1016/j.pestbp.2014.02.005 |
| [27] | XI J H, PAN Y O, BI R, et al. Elevated expression of esterase and cytochrome P450 are related with lambda-cyhalothrin resistance and lead to cross resistance in Aphis glycines Matsumura[J]. Pestic Biochem Physiol, 2015, 118 :77–81. doi:10.1016/j.pestbp.2014.12.002 |
| [28] | EL-LATIF A O A, SUBRAHMANYAM B. Pyrethroid resistance and esterase activity in three strains of the cotton bollworm, Helicoverpa armigera (Hübner)[J]. Pestic Biochem Physiol, 2010, 96 (3):155–159. doi:10.1016/j.pestbp.2009.11.004 |
| [29] | WU S W, YANG Y H, YUAN G R, et al. Overexpressed esterases in a fenvalerate resistant strain of the cotton bollworm, Helicoverpa armigera[J]. Insect Biochem Mol Biol, 2011, 41 (1):14–21. doi:10.1016/j.ibmb.2010.09.007 |
| [30] | APONTE H A, PENILLA R P, DZUL-MANZANILLA F, et al. The pyrethroid resistance status and mechanisms in Aedes aegypti from the Guerrero state, Mexico[J]. Pestic Biochem Physiol, 2013, 107 (2):226–234. doi:10.1016/j.pestbp.2013.07.005 |
| [31] | ROCA-ACEVEDO G, PICOLLO M I, CAPRIOTTI N, et al. Examining mechanisms of pyrethroid resistance in eggs of two populations of the Chagas' disease vector Triatoma infestans (Hemiptera:Reduviidae)[J]. J Med Entomol, 2015, 52 (5):987–992. doi:10.1093/jme/tjv078 |
| [32] | THALAVAISUNDARAM S, WILKES M A, MANSFIELD S, et al. Esterases and glutathione S-transferases contribute to pyrethroid resistance in western flower thrips, Frankliniella occidentalis[J]. Aust J Entomol, 2012, 51 (4):272–278. doi:10.1111/aen.2012.51.issue-4 |
| [33] | HEIDARI R, DEVONSHIRE A L, CAMPBELL B E, et al. Hydrolysis of pyrethroids by carboxylesterases from Lucilia cuprina and Drosophila melanogaster with active sites modified by in vitro mutagenesis[J]. Insect Biochem Mol Biol, 2005, 35 (6):597–609. doi:10.1016/j.ibmb.2005.02.018 |
| [34] | ZHANG L, SHI J, SHI X Y, et al. Quantitative and qualitative changes of the carboxylesterase associated with beta-cypermethrin resistance in the housefly, Musca domestica (Diptera:Muscidae)[J]. Comp Biochem Physiol Part B, 2010, 156 (1):6–11. doi:10.1016/j.cbpb.2010.01.011 |
| [35] | AI G M, ZOU D Y, SHI X Y, et al. HPLC assay for characterizing α-cyano-3-phenoxybenzyl pyrethroids hydrolytic metabolism by Helicoverpa armigera (Hübner) based on the quantitative analysis of 3-phenoxybenzoic acid[J]. J Agric Food Chem, 2009, 58 (2):694–701. |
| [36] | YUAN G, LI Y, FARNSWORTH C A, et al. Isomer-specific comparisons of the hydrolysis of synthetic pyrethroids and their fluorogenic analogues by esterases from the cotton bollworm Helicoverpa armigera[J]. Pestic Biochem Physiol, 2015, 121 :102–106. doi:10.1016/j.pestbp.2014.12.010 |
| [37] | RAY D E, FRY J R. A reassessment of the neurotoxicity of pyrethroid insecticides[J]. Pharmacol Ther, 2006, 111 (1):174–193. doi:10.1016/j.pharmthera.2005.10.003 |
| [38] | YANG Y, WU Y, CHEN S, et al. The involvement of microsomal oxidases in pyrethroid resistance in Helicoverpa armigera from Asia[J]. Insect Biochem Mol Biol, 2004, 34 (8):763–773. doi:10.1016/j.ibmb.2004.04.001 |
| [39] | AWOLOLA T S, ODUOLA O A, STRODE C, et al. Evidence of multiple pyrethroid resistance mechanisms in the malaria vector Anopheles gambiae sensu stricto from Nigeria[J]. Trans R Soc Trop Med Hyg, 2009, 103 (11):1139–1145. doi:10.1016/j.trstmh.2008.08.021 |
| [40] | ZHONG D B, CHANG X L, ZHOU G F, et al. Relationship between knockdown resistance, metabolic detoxification and organismal resistance to pyrethroids in Anopheles sinensis[J]. PLoS One, 2013, 8 (2):e55475. doi:10.1371/journal.pone.0055475 |
| [41] | AROURI R, LE GOFF G, HEMDEN H, et al. Resistance to lambda-cyhalothrin in Spanish field populations of Ceratitis capitata and metabolic resistance mediated by P450 in a resistant strain[J]. Pest Manage Sci, 2015, 71 (9):1281–1291. doi:10.1002/ps.2015.71.issue-9 |
| [42] | MUTHUSAMY R, SHIVAKUMAR M S. Resistance selection and molecular mechanisms of cypermethrin resistance in red hairy caterpillar (Amsacta albistriga walker)[J]. Pestic Biochem Physiol, 2015, 117 :54–61. doi:10.1016/j.pestbp.2014.10.009 |
| [43] | SHI L, ZHANG J, SHEN G M, et al. Silencing NADPH-cytochrome P450 reductase results in reduced acaricide resistance in Tetranychus cinnabarinus (Boisduval)[J]. Sci Rep, 2015, 5 :15581. doi:10.1038/srep15581 |
| [44] | NIKOU D, RANSON H, HEMINGWAY J. An adult-specific CYP6 P450 gene is overexpressed in a pyrethroid-resistant strain of the malaria vector, Anopheles gambiae[J]. Gene, 2003, 318 :91–102. doi:10.1016/S0378-1119(03)00763-7 |
| [45] | DJOUAKA R F, BAKARE A A, COULIBALY O N, et al. Expression of the cytochrome P450s, CYP6P3 and CYP6M2 are significantly elevated in multiple pyrethroid resistant populations of Anopheles gambiae s. s. from Southern Benin and Nigeria[J]. BMC Genomics, 2008, 9 (1):538. doi:10.1186/1471-2164-9-538 |
| [46] | MÜLLER P, WARR E, STEVENSON B J, et al. Field-caught permethrin-resistant Anopheles gambiae overexpress CYP6P3, a P450 that metabolises pyrethroids[J]. PLoS Genet, 2008, 4 (11):e1000286. doi:10.1371/journal.pgen.1000286 |
| [47] | IBRAHIM S S, RIVERON J M, BIBBY J, et al. Allelic variation of cytochrome P450s drives resistance to bednet insecticides in a major malaria vector[J]. PLoS Genet, 2015, 11 (10):e1005618. doi:10.1371/journal.pgen.1005618 |
| [48] | MULAMBA C, RIVERON J M, IBRAHIM S S, et al. Widespread pyrethroid and DDT resistance in the major malaria vector Anopheles funestus in East Africa is driven by metabolic resistance mechanisms[J]. PLoS One, 2014, 9 (10):e110058. doi:10.1371/journal.pone.0110058 |
| [49] | DUSFOUR I, ZORRILLA P, GUIDEZ A, et al. Deltamethrin resistance mechanisms in Aedes aegypti populations from three French overseas territories worldwide[J]. PLoS Negl Trop Dis, 2015, 9 (11):e0004226. doi:10.1371/journal.pntd.0004226 |
| [50] | ZHANG H, TANG T, CHENG Y, et al. Cloning and expression of cytochrome P450 CYP6B7 in fenvalerate-resistant and susceptible Helicoverpa armigera (Hübner) from China[J]. J Appl Entomol, 2010, 134 (9-10):754–761. doi:10.1111/jen.2010.134.issue-9-10 |
| [51] | JOUßEN N, AGNOLET S, LORENZ S, et al. Resistance of Australian Helicoverpa armigera to fenvalerate is due to the chimeric P450 enzyme CYP337B3[J]. Proc Natl Acad Sci USA, 2012, 109 (38):15206–15211. doi:10.1073/pnas.1202047109 |
| [52] | RASOOL A, JOUßEN N, LORENZ S, et al. An independent occurrence of the chimeric P450 enzyme CYP337B3 of Helicoverpa armigera confers cypermethrin resistance in Pakistan[J]. Insect Biochem Mol Biol, 2014, 53 :54–65. doi:10.1016/j.ibmb.2014.07.006 |
| [53] | HAN Y C, YU W T, ZHANG W Q, et al. Variation in P450-mediated fenvalerate resistance levels is not correlated with CYP337B3 genotype in Chinese populations of Helicoverpa armigera[J]. Pestic Biochem Physiol, 2015, 121 :129–135. doi:10.1016/j.pestbp.2014.12.004 |
| [54] | ZIMMER C T, BASS C, WILLIAMSON M S, et al. Molecular and functional characterization of CYP6BQ23, a cytochrome P450 conferring resistance to pyrethroids in European populations of pollen beetle, Meligethes aeneus[J]. Insect Biochem Mol Biol, 2014, 45 :18–29. doi:10.1016/j.ibmb.2013.11.008 |
| [55] | KONUS M, KOY C, MIKKAT S, et al. Molecular adaptations of Helicoverpa armigera midgut tissue under pyrethroid insecticide stress characterized by differential proteome analysis and enzyme activity assays[J]. Comp Biochem Physiol Part D, 2013, 8 (2):152–162. |
| [56] | SHI L, XU Z F, SHEN G M, et al. Expression characteristics of two novel cytochrome P450 genes involved in fenpropathrin resistance in Tetranychus cinnabarinus (Boisduval)[J]. Pestic Biochem Physiol, 2015, 119 :33–41. doi:10.1016/j.pestbp.2015.02.009 |
| [57] | STEVENSON B J, BIBBY J, PIGNATELLI P, et al. Cytochrome P4506M2 from the malaria vector Anopheles gambiae metabolizes pyrethroids:sequential metabolism of deltamethrin revealed[J]. Insect Biochem Mol Biol, 2011, 41 (7):492–502. doi:10.1016/j.ibmb.2011.02.003 |
| [58] | PRAPANTHADARA L, RANSON H, SOMBOON P, et al. Cloning, expression and characterization of an insect class I glutathione S-transferase from Anopheles dirus species B[J]. Insect Biochem Mol Biol, 1998, 28 (5-6):321–329. doi:10.1016/S0965-1748(98)00006-X |
| [59] | BUTLER R N, BUTLER W J, MORABY Z, et al. Glutathione concentrations and glutathione S-transferase activity in human colonic neoplasms[J]. J Gastroenterol Hepatol, 1994, 9 (1):60–63. doi:10.1111/j.1440-1746.1994.tb01217.x |
| [60] | REIDY G F, ROSE H A, VISETSON S, et al. Increased glutathione S-transferase activity and glutathione content in an insecticide-resistant strain of Tribolium castaneum (Herbst)[J]. Pestic Biochem Physiol, 1990, 36 (3):269–276. doi:10.1016/0048-3575(90)90035-Z |
| [61] | MORGAN J C, IRVING H, OKEDI L M, et al. Pyrethroid resistance in an Anopheles funestus population from Uganda[J]. PLoS One, 2010, 5 (7):e11872. doi:10.1371/journal.pone.0011872 |
| [62] | ADEYI A O, AKOZI G O, ADELEKE M A, et al. Induction and activity of glutathione S-transferases extracted from Zonocerus variegatus (Orthoptera:Pyrgomorphidae) exposed to insecticides[J]. Int J Trop Insect Sci, 2015, 35 (1):27–33. doi:10.1017/S174275841400054X |
| [63] | SILVA W M, BERGER M, BASS C, et al. Status of pyrethroid resistance and mechanisms in Brazilian populations of Tuta absoluta[J]. Pestic Biochem Physiol, 2015, 122 :8–14. doi:10.1016/j.pestbp.2015.01.011 |
| [64] | NANDI A, SINGH H, SINGH N K. Esterase and glutathione S-transferase levels associated with synthetic pyrethroid resistance in Hyalomma anatolicum and Rhipicephalus microplus ticks from Punjab, India[J]. Exp Appl Acarol, 2015, 66 (1):141–157. doi:10.1007/s10493-015-9884-5 |
| [65] | RANSON H, PRAPANTHADARA L, HEMINGWAY J. Cloning and characterization of two glutathione S-transferases from a DDT-resistant strain of Anopheles gambiae[J]. Biochem J, 1997, 324 (Pt 1):97–102. |
| [66] | GRANT D F, MATSUMURA F. Glutathione S-transferase 1 and 2 in susceptible and insecticide resistant Aedes aegypti[J]. Pestic Biochem Physiol, 1989, 33 (2):132–143. doi:10.1016/0048-3575(89)90004-7 |
| [67] | VONTAS J G, SMALL G J, HEMINGWAY J. Glutathione S-transferases as antioxidant defence agents confer pyrethroid resistance in Nilaparvata lugens[J]. Biochem J, 2001, 357 (Pt 1):65–72. |
| [68] | KOSTAROPOULOS I, PAPADOPOULOS A I, METAXAKIS A, et al. Glutathione S-transferase in the defence against pyrethroids in insects[J]. Insect Biochem Mol Biol, 2001, 31 (4-5):313–319. doi:10.1016/S0965-1748(00)00123-5 |
| [69] | DAVID J P, STRODE C, VONTAS J, et al. The Anopheles gambiae detoxification chip:a highly specific microarray to study metabolic-based insecticide resistance in malaria vectors[J]. Proc Natl Acad Sci USA, 2005, 102 (11):4080–4084. doi:10.1073/pnas.0409348102 |
| [70] | SAMRA A I, KAMITA S G, YAO H W, et al. Cloning and characterization of two glutathione S-transferases from pyrethroid-resistant Culex pipiens[J]. Pest Manage Sci, 2012, 68 (5):764–772. doi:10.1002/ps.v68.5 |
| [71] | ZHOU L, FANG S M, HUANG K, et al. Characterization of an epsilon-class glutathione S-transferase involved in tolerance in the silkworm larvae after long term exposure to insecticides[J]. Ecotoxicol Environ Saf, 2015, 120 :20–26. doi:10.1016/j.ecoenv.2015.05.027 |
 2016, Vol. 18
2016, Vol. 18