2. 福建省作物有害生物监测与治理重点实验室, 福州 350003
2. Fujian Key Laboratory for Monitoring and Integrated Management of Crop Pests, Fuzhou 350003, China
番茄灰霉病由真菌灰葡萄孢 Botrytis cinerea 引起,主要为害番茄的花、果和叶,在设施栽培番茄上发病尤为严重,影响番茄产量和品质,严重时可造成减产 50% 以上[1]。生产上对番茄灰霉病主要采用嘧霉胺、腐霉利、异菌脲、乙霉威、啶氧菌酯和啶酰菌胺等化学药剂进行防治,由于灰葡萄孢具有产孢量大、繁殖速度快、易产生遗传变异和适合度高等特点,因此极易产生抗药性。目前已检测到灰葡萄孢对苯并咪唑类、二甲酰亚胺类、N-苯基氨基甲酸酯类、苯胺基嘧啶类和甲氧基丙烯酸酯类等多种杀菌剂产生了抗药性[2-4, 5],因此迫切需要开发不同作用机理的替代杀菌剂。氟啶胺属于吡啶胺类保护性杀菌剂,具有杀菌谱广、持效期长等优点,可通过对氧化磷酸化的解偶联作用而中断真菌细胞能量的产生过程[6],从而抑制其孢子萌发、菌丝生长和孢子形成,对链格孢属、葡萄孢属、核盘菌属、丝核菌属及疫霉属等多种真菌及卵菌均具有良好的抑制效果[7]。
氟啶胺是目前国际上防治灰霉病的主要杀菌剂之一,而在中国主要登记用于根肿病及晚疫病的防治,尚未在防治灰霉病上登记使用。陈治芳等[8]研究了山东省和河北省灰葡萄孢对氟啶胺的敏感性,发现氟啶胺对供试菌株的抑制作用较强,其 EC50 值范围在 0.001 4~0.030 3 μg/mL 之间,且与嘧霉胺、多菌灵、异菌脲、乙霉威和啶酰菌胺均不存在交互抗性,但该研究中未包括福建省的菌株。福建省冬、春季温暖湿润的亚热带海洋性季风气候极适宜灰霉病的发生,与中国北方地区相比,其番茄灰霉病的发生和防治具有发病严重、为害时间长及施药次数多等特点,已成为制约番茄生产的最主要因素之一。因此,本研究测定了福建省番茄灰霉病菌对氟啶胺的敏感性及其与 4 种常用杀菌剂的交互抗性,旨在补充完善中国灰葡萄孢对氟啶胺的敏感性状况调查数据,为今后将氟啶胺用于灰霉病防治提供理论依据。
1 材料与方法 1.1 供试材料 1.1.1 杀菌剂94.5% 氟啶胺 (fluazinam) 原药 [中农住商 (天津) 农用化学品有限公司];96.6% 嘧霉胺 (pyrimethanil) 原药 (海南正业中农高科股份有限公司);97% 腐霉利 (procymidone) 原药及 96.7% 异菌脲 (iprodione) 原药 (沈阳化工研究院有限公司);95% 啶氧菌酯 (picoxystrobin) 原药(美国杜邦公司)。
1.1.2 菌株2013—2015 年从福建省从未使用过氟啶胺的番茄主要产区采集番茄灰霉病标本,经分离、鉴定,共获得 106 株番茄灰霉病菌。
1.1.3 培养基马铃薯葡萄糖培养基 (PDA):马铃薯 200 g,葡萄糖 20 g,琼脂粉 17 g,纯净水 1 L。
1.2 试验方法 1.2.1 番茄灰霉病菌对氟啶胺的敏感性测定采用菌丝生长速率法[9]。供试杀菌剂先用二甲基亚砜配成 1.0 × 104 μg/mL 的母液,再用含 0.1% 吐温-80 的无菌水稀释成系列浓度药液,根据预试验结果,制备药剂质量浓度分别为 0.001、0.005、0.01、0.05、0.1、0.5 和 1 μg/mL 的含药平板。每处理设 4 次重复,以不加药剂的处理为对照。根据各处理的平均菌落直径净增长值,利用 DPS 7.05 软件计算有效抑制中浓度 (EC50)。通过 SPSS 16.0 软件 K-S 法[10]对供试菌株的 EC50 值频率分布进行正态检验。
1.2.2 氟啶胺与不同杀菌剂间的交互抗性测定从供试菌株中随机选择 15 株对氟啶胺敏感性不同的番茄灰霉病菌,采用 1.2.1 节所述菌丝生长速率法分别测定其对嘧霉胺、腐霉利、异菌脲和啶氧菌酯的敏感性。嘧霉胺质量浓度分别设为 0.1、0.5、1、5、10、50 和 100 μg/mL,腐霉利和异菌脲分别为 0.01、0.05、0.1、0.5、1、5 和 10 μg/mL,啶氧菌酯分别为 0.05、0.1、0.5、1、5、10 和 50 μg/mL。每处理重复 4 次,以不加药剂的处理为对照。相应计算 EC50 值。
通过 SPSS 16.0 软件分析供试 15 株番茄灰霉病菌对氟啶胺与嘧霉胺、腐霉利、异菌脲和啶氧菌酯之间是否存在交互抗性关系。
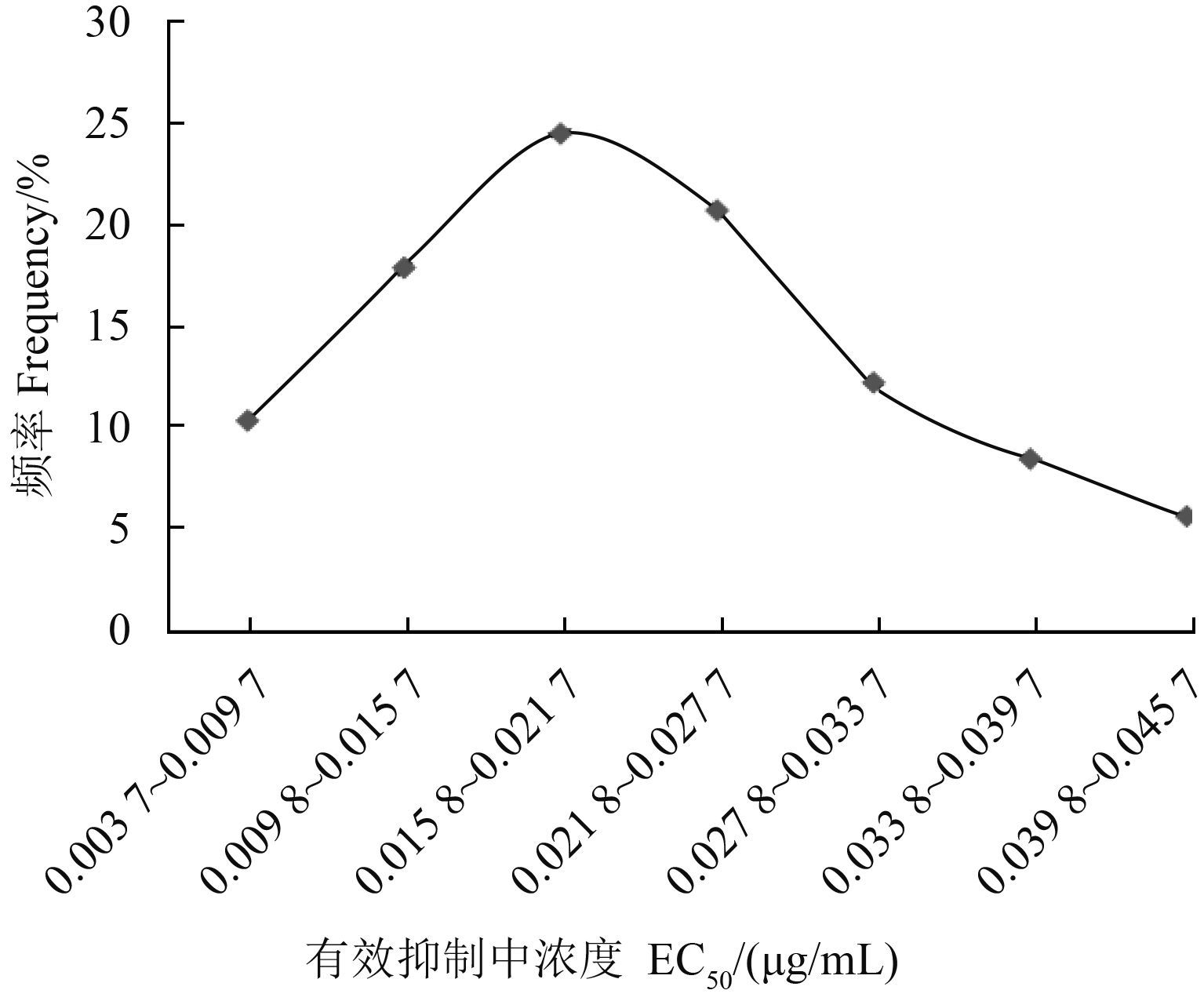
2 结果与分析 2.1 福建省番茄灰霉病菌对氟啶胺的敏感基线结果见图 1。供试番茄灰霉病菌对氟啶胺的敏感性频率分布呈连续单峰曲线变化,其 EC50 值范围为 0.003 7~0.045 2 μg/mL,相差 12.2 倍,平均值为 (0.022 1 ± 0.009 8) μg/mL。其正态检验 D = 0.058 0,P = 0.862(>0.05),表明 106 株供试番茄灰霉病菌对氟啶胺的敏感性分布呈近似正态分布,尚未出现敏感性下降的亚群体,因此可将该 EC50 平均值 (0.022 1 ± 0.009 8) μg/mL 作为福建省番茄灰霉病菌对氟啶胺的敏感基线,用于其田间抗药性监测。
|
图 1 番茄灰霉病菌对氟啶胺的敏感性分布 Fig. 1 Frequency distribution of the sensitivity of B. cinerea isolates to fluazinam |
2.2 交互抗性
敏感性测定结果 (表 1) 表明,氟啶胺对供试菌株菌丝生长的抑制作用最强,其次为异菌脲、腐霉利和啶氧菌酯,嘧霉胺的抑制作用较差。
|
|
表 1 供试 15 株番茄灰霉病菌对不同杀菌剂的敏感性 Table 1 Sensitivities of 15 B. cinerea isolates to different fungicides |
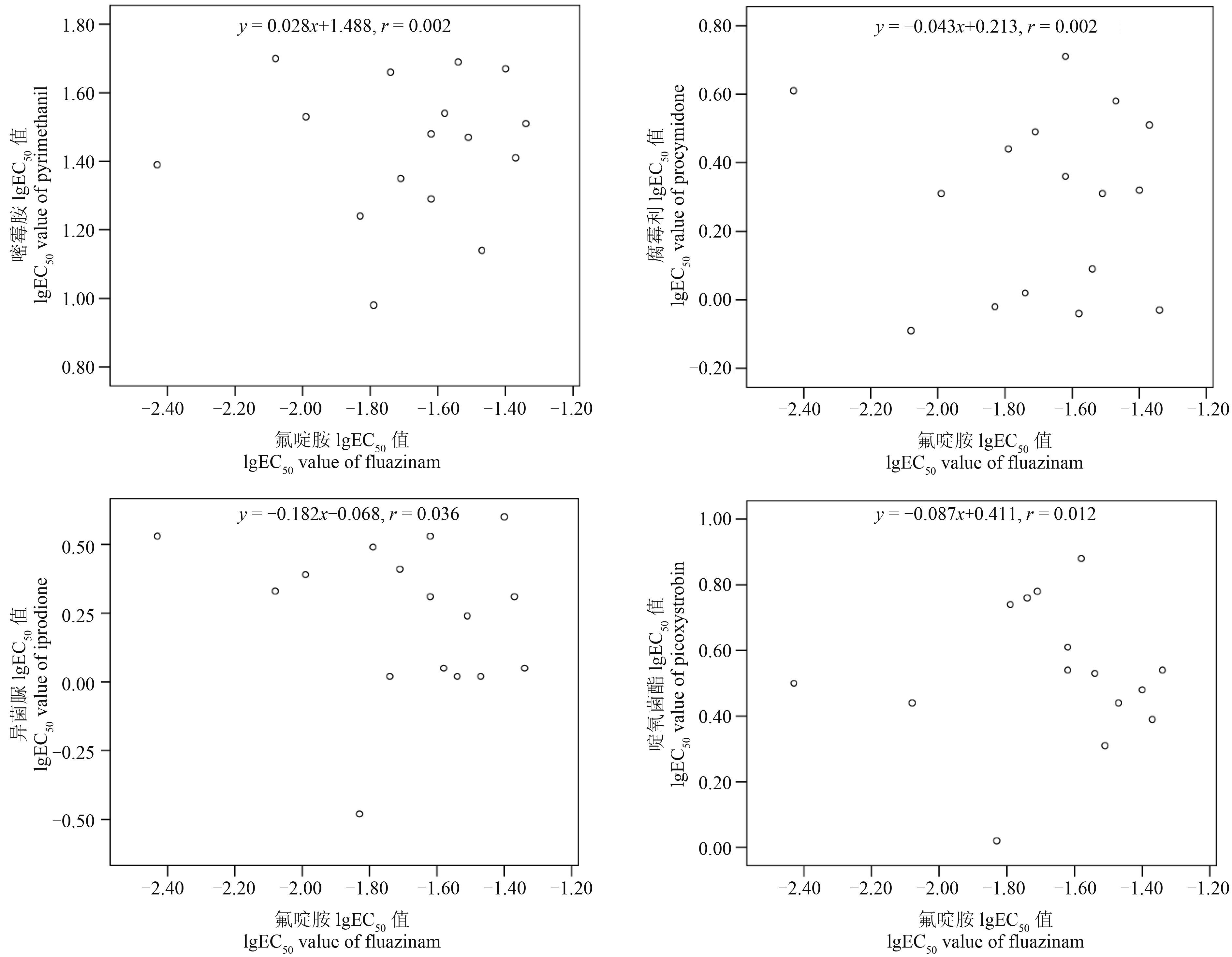
交互抗性分析 (图 2) 表明,氟啶胺对 15 株番茄灰霉病菌 EC50 的对数值与嘧霉胺、腐霉利、异菌脲和啶氧菌酯 EC50 对数值的相关系数分别为 0.039 (P = 0.885)、-0.047 (P = 0.862)、-0.188 (P = 0.484) 及 -0.108 (P = 0.691),均未达到差异显著水平,表明氟啶胺与嘧霉胺、腐霉利、异菌脲和啶氧菌酯之间均不存在交互抗性。
|
图 2 番茄灰霉病菌对氟啶胺与嘧霉胺等 4 种杀菌剂的交互抗性 Fig. 2 Cross-resistance in B. cinerea isolates to fluazinam and other 4 fungicides |
3 结论与讨论
在将不同作用机理的新型杀菌剂用于防治某种植物病害之前,建立其敏感基线有助于优化该杀菌剂的使用策略[11]。本研究中,106 株番茄灰霉病菌对氟啶胺的敏感性频率分布呈连续单峰曲线,符合正态分布,表明对氟啶胺而言,福建省番茄灰霉病菌还处于野生敏感种群阶段,因此可将氟啶胺对供试菌株的 EC50 平均值 (0.022 1 ± 0.009 8) μg/mL 作为福建省番茄灰霉病菌对氟啶胺的敏感基线。陈治芳等[8]的研究表明,氟啶胺对山东和河北省灰葡萄孢的敏感基线为 (0.015 1 ± 0.007 0) μg/mL,其敏感基线值更小,这可能与不同地域灰葡萄孢对氟啶胺的自然敏感性差异有关。
目前嘧霉胺、腐霉利、异菌脲及其复配制剂是中国登记用于防治灰霉病的主要杀菌剂品种。据报道,灰葡萄孢对嘧霉胺的抗性是由单基因控制的,因此嘧霉胺被认为是具有高抗药性风险的杀菌剂,已发现番茄灰霉病菌对嘧霉胺产生了抗性[5]。为了在相同条件下比较供试番茄灰霉病菌对不同杀菌剂的敏感性,本研究在测定番茄灰霉病菌对嘧霉胺的敏感性时也采用了 PDA 培养基,结果表明嘧霉胺对供试菌株菌丝生长的抑制作用较差,其 EC50 平均值为 (30.29 ± 12.52) μg/mL,分析这可能与所采用的培养基有关。Jalil 等[12]的研究表明,灰葡萄孢在 PDA、PDA0.5×(马铃薯和葡萄糖用量为 PDA 培养基的 0.5 倍)、麦芽琼脂 (MA) 和葡萄糖明胶琼脂 (GGA) 4 种培养基上对嘧霉胺的敏感性差异较大,最敏感的灰葡萄孢菌株在 GGA 和 PDA0.5× 培养基上的 EC50 值分别为 0.21 和 0.48 μg/mL,而在 MA 和 PDA 培养基上则分别为 1.28 和 1.33 μg/mL。贾晓华[13]发现,采用 L-asp 培养基测定嘧霉胺对油菜菌核病菌的活性时灵敏度较高,抑制效果明显优于采用 PDA 和麦芽膏琼脂 (MEA) 培养基。可见培养基成分对嘧霉胺的活性影响较大。这可能与嘧霉胺的作用机理相关:嘧霉胺能抑制离体灰葡萄孢菌丝体内甲硫氨酸的生物合成和胞外蛋白酶 (包括水解酶) 的分泌[14],在成分复杂的培养基上,由于存在游离的氨基酸和其他小分子营养物质,因此病原菌可以不依赖蛋白酶降解培养基成分来获取养分,而在合成的培养基上,病原菌必须通过分泌蛋白酶降解培养基成分以获取其生长所需的养分[13]。因此在测定灰葡萄孢对嘧霉胺的敏感性时宜采用合成培养基如 L-asp 培养基,而不宜采用成分复杂的培养基。腐霉利和异菌脲均属于二甲酰亚胺类杀菌剂,其主要通过抑制菌体内甘油三脂的合成,阻碍菌丝顶端正常细胞壁的合成而抑制菌丝的发育,具有保护和治疗作用,生产中已发现抗二甲酰亚胺类杀菌剂的灰葡萄孢[4, 15]。因此迫切需要开发与此类药剂作用机理不同的杀菌剂进行轮换施用,以减缓其抗药性的发生。本研究中敏感性测定结果及交互抗性分析表明,氟啶胺对番茄灰霉病菌菌丝生长的抑制作用强于嘧霉胺、腐霉利、异菌脲和啶氧菌酯,且与上述杀菌剂均不存在交互抗性,这与陈治芳等[8]的研究结果一致。因此应进一步通过田间试验明确氟啶胺的合理使用剂量、防治效果及对作物的安全性等问题,为将来其用于番茄灰霉病防治提供理论依据。
| [1] |
乔广行, 严红, 么奕清, 等. 北京地区番茄灰霉病菌的多重抗药性检测 [J]. 植物保护, 2011,37 (5)
:176–180.
QIAO G X, YAN H, YAO Y Q, et al. Detection of multiple fungicide resistance in Botrytis cinerea from tomato in Beijing [J]. Plant Protect, 2011, 37 (5) :176–180 . |
| [2] | FERNÁNDEZ-ORTUÑO D, GRABKE A, BRYSON P K, et al. Fungicide resistance profiles in Botrytis cinerea from strawberry fields of seven southern U.S.States [J]. Plant Dis, 2014, 98 (6) :825–833 . doi:10.1094/PDIS-09-13-0970-RE |
| [3] | FERNÁNDEZ-ORTUÑO D, CHEN F P, SCHNABEL G. Resistance to pyraclostrobin and boscalid in Botrytis cinerea isolates from strawberry fields in the carolinas [J]. Plant Dis, 2012, 96 (8) :1198–1203 . doi:10.1094/PDIS-12-11-1049-RE |
| [4] |
宋晰, 肖露, 林东, 等. 番茄灰霉病菌对腐霉利的抗药性检测及生物学性状研究 [J]. 农药学学报, 2013,15 (4)
:398–404.
SONG X, XIAO L, LIN D, et al. Detection of procymidone resistance and investigation of biological characteristics in Botrytis cinerea [J]. Chin J Pestic Sci, 2013, 15 (4) :398–404 . |
| [5] |
纪明山, 祁之秋, 王英姿, 等. 番茄灰霉病菌对嘧霉胺的抗药性 [J]. 植物保护学报, 2003,30 (4)
:396–400.
JI M S, QI Z Q, WANG Y Z, et al. Resistance of Botrytis cinerea to pyrimethanil in tomato [J]. Acta Phytophyl Sinica, 2003, 30 (4) :396–400 . |
| [6] | VITORATOS A G. Mode of action and genetic analysis of resistance to fluazinam in Ustilago maydis [J]. J Phytopathol, 2014, 162 (11-12) :737–746 . doi:10.1111/jph.2014.162.issue-11-12 |
| [7] | SMITH D L, GARRISON M C, HOLLOWELL J E, et al. Evaluation of application timing and efficacy of the fungicides fluazinam and boscalid for control of Sclerotinia blight of peanut [J]. Crop Protect, 2008, 27 (3-5) :823–833 . doi:10.1016/j.cropro.2007.11.010 |
| [8] |
陈治芳, 王文桥, 韩秀英, 等. 灰葡萄孢(Botrytis cinerea)对氟啶胺的敏感基线及对不同杀菌剂的交互抗性 [J]. 河北农业大学学报, 2011,34 (3)
:33–36.
CHEN Z F, WANG W Q, HAN X Y, et al. Baseline-sensitivity of Botrytis cinerea to fluazinam and cross-resistance against diverse fungicides [J]. J Agric Univ Hebei, 2011, 34 (3) :33–36 . |
| [9] |
张传清, 张雅, 魏方休, 等. 设施蔬菜灰霉病菌对不同类型杀菌剂的抗性检测 [J]. 农药学学报, 2006,8 (3)
:245–249.
ZHANG C Q, ZHANG Y, WEI F X, et al. Detection of resistance of Botryotinia fuckeliana from protected vegetables to different classes of fungicides [J]. Chin J Pestic Sci, 2006, 8 (3) :245–249 . |
| [10] |
毕秋艳, 马志强. 小麦白粉病菌对甲氧基丙烯酸酯类杀菌剂敏感性及其交互抗性 [J]. 植物病理学报, 2012,42 (3)
:315–318.
BI Q Y, MA Z Q. Sensitivity of Blumeria graminis f.sp.tritici to strobilurin fungicides and their cross-resistance [J]. Acta Phytopathol Sinica, 2012, 42 (3) :315–318 . |
| [11] | CHEN Y, YAO J, WANG W X, et al. Effect of epoxiconazole on rice blast and rice grain yield in China [J]. Eur J Plant Pathol, 2012, 135 (4) :675–682 . |
| [12] | JALIL C, APABLAZA G, LATORRE B A. Sensibilidad de Botrytis cinerea a pirimetanil y pruebas de resistencia cruzada a iprodione [J]. Fitopatologia, 1998, 33 (3) :141–145 . |
| [13] |
贾晓华.番茄灰霉病菌和油菜菌核病菌对嘧霉胺的敏感性基线及番茄灰霉病菌抗药性研究[D].南京:南京农业大学,2004:23.
JIA X H.Sensitivity baselines of Botrytis cinerea and Sclerotinia sclerotiorum to pyrimethanil and resistance of Botrytis cinerea[D].Nanjing:Nanjing Agricultural University,2004:23. |
| [14] | MILLING R J, RICHARDSON C J. Mode of action of the anilino-pyrimidine fungicide pyrimethanil.2.Effects on enzyme secretion in Botrytis cinerea [J]. Pestic Sci, 1995, 45 (1) :43–48 . doi:10.1002/ps.v45:1 |
| [15] |
礼茜, 严蕾艳, 童英富, 等. 浙江两地区草莓灰霉病菌(Botrytis cinerea)对扑海因的抗药性及其分子机制 [J]. 果树学报, 2007,24 (3)
:344–348.
LI Q, YAN L Y, TONG Y F, et al. Occurrence of iprodione-resistanct Botrytis cinerea strain from strawberry in Zhejiang and possible molecular mechanism [J]. J Fruit Sci, 2007, 24 (3) :344–348 . |
 2016, Vol. 18
2016, Vol. 18


