从天然产物中挖掘和发现具有生物活性的物质,一直是新农药创制研究的前沿与热点领域,同时也是获得绿色农药的有效途径之一[1]。香豆素类化合物是植物体内重要的植物化感物质,它是植物在发生苯丙氨酸代谢途径中产生的一类次生代谢产物[2],可抑制多种植物的生长和发育[3],具有开发成除草剂的潜力[4]。目前已有很多以天然产物为先导合成的具有除草活性的香豆素类化合物被报道,如张学良等[5]合成的 N-取代氨基香豆素类化合物,在 100 mg/L 下对反枝苋种子萌发的抑制率达 99%;刘斌等[6]合成的 3-苯甲酰基-4-羟基香豆素衍生物对双子叶植物油菜表现了很好的选择性;Araniti 等[7]合成的 3 种香豆素类物质可以抑制稗草和反枝苋种子的萌发和根长。
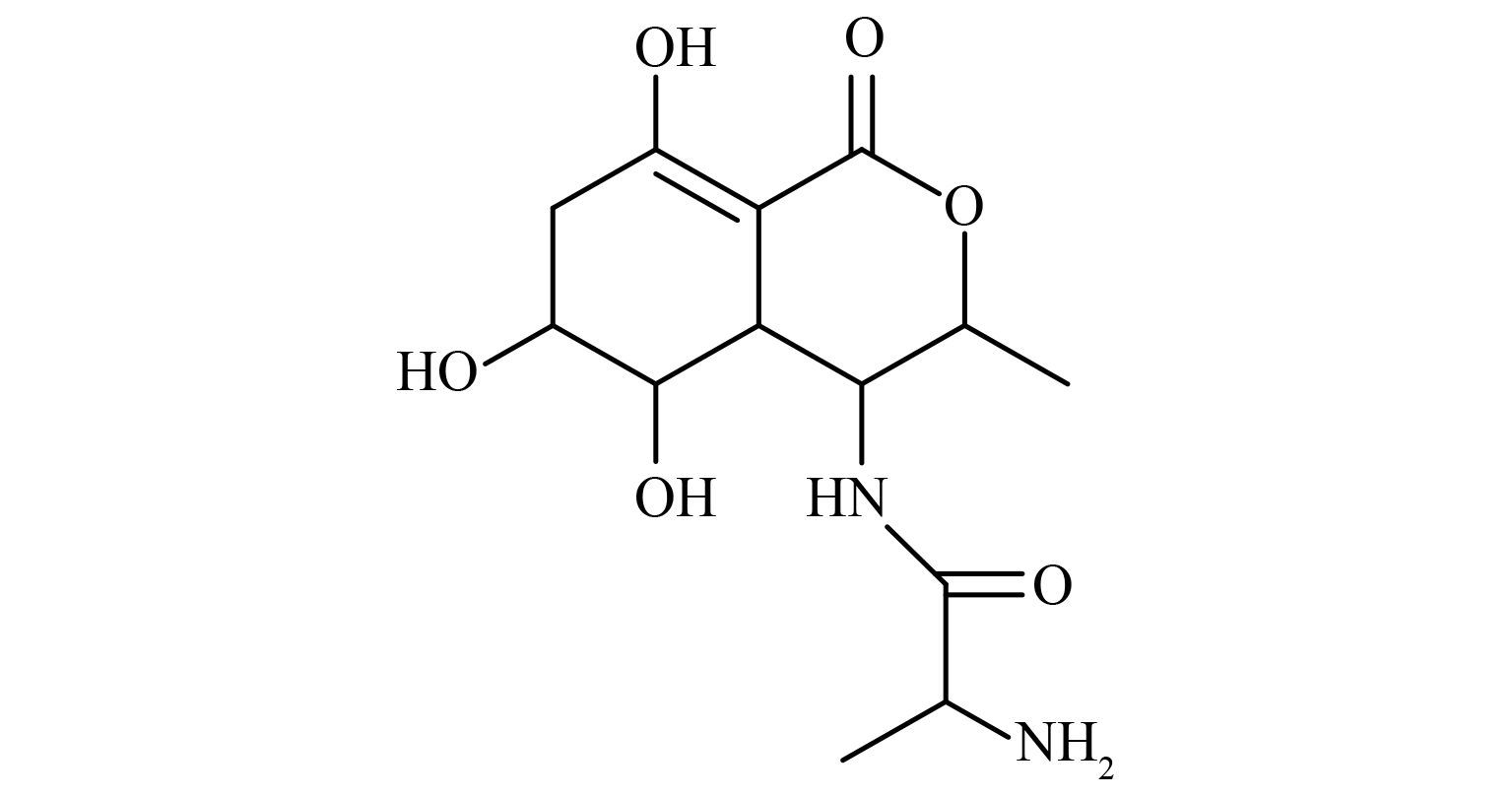
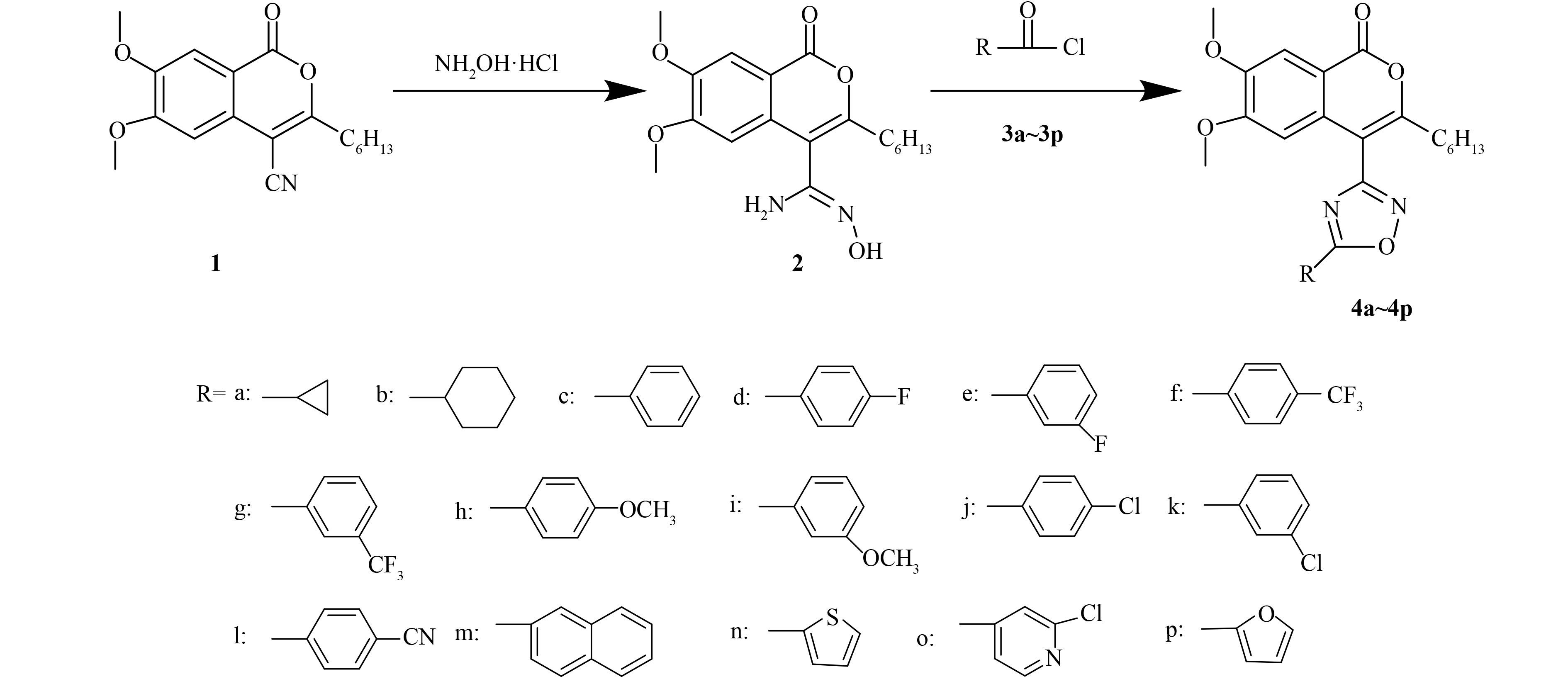
本实验室在前期的研究中,从黄顶菊体内提取出了一种具有除草活性的化合物——4-(2-氨基丙酰胺基)-3,4,5,6,7,8,9,10-八氢-5,6,8-三羟基-3-甲基异香豆素(图式 1,A),并在此基础上进行先导优化,设计合成了另一先导化合物——3-己基-4-氰基-6,7-二甲氧基异香豆素(图式 2中化合物 1)[8]。
|
图式 1 化合物 A Scheme1 Compound A |
|
图式 2 目标化合物的合成路线 Scheme2 Synthetic route of the target compounds |
为了寻找具有较高除草活性的异香豆素类化合物,笔者对化合物 1 进行了衍生化,将其与盐酸羟胺反应生成肟胺类化合物 (2),再将该产物与酰氯反应,制备了 16 个异香豆素噁二唑类目标化合物 (4),并对其除草活性进行了初步研究。
目标化合物的合成路线见图式 2。
1 实验部分 1.1 仪器与试剂精密显微熔点测定仪 (上海光学仪器六厂);Bruker Avance-400 Hz 型核磁共振仪 (Bruker Corporation,以 CDCl3 或者 DMSO-d6 为溶剂,TMS 为内标物);Agilent 6520 Q-TOF LC/MS2 液相色谱-质谱联用仪(Agilent 公司);97% 盐酸羟胺 (梯希爱化成工业发展有限公司);二氯亚砜 (分析纯,天津市化学试剂一厂);其余试剂均为化学纯或分析纯,未经处理直接使用。
1.2 化合物的合成 1.2.1 化合物 1 的合成参考文献[8] 的方法合成。产率 32.8%,熔点 153~154 ℃ (文献值[5]:153~155 ℃)。
1.2.2 化合物 2 的合成称取 6.30 g (0.02 mol)化合物 1 于 500 mL 单口瓶中,加入 300 mL 无水乙醇,室温搅拌 0.5 h 后,加入盐酸羟胺 5.73 g (0.08 mol) 和碳酸氢钠 6.72 g (0.08 mol),加热搅拌回流反应 6 h,反应过程中用氦气保护。采用薄层层析 (TLC) [V(石油醚):V(乙酸乙酯) = 1∶1] 监测至反应结束。将反应液倒入 100 mL 水中,室温搅拌 0.5 h,抽滤。固体用乙酸乙酯重结晶,得到白色晶体。收率 65.2%;熔点 89~91 ℃;(M + H)+: 349.175 7 (计算值:349.175 8)。
1H NMR (400 MHz,DMSO),δ: 7.53 (s,1H,Ar- H),7.00 (s,1H,Ar-H),3.94 (s,3H,O-CH3),3.90 (s,3H,O-CH3),2.96 (s,2H,CH2),1.69 (s,2H,CH2),1.45~1.20 (m,6H,3CH2),0.86 (t,J = 6.2 Hz,3H,CH3).
13C NMR (100 MHz,CDCl3),δ: 157.19,155.01,150.16,147.90,129.38,116.05,115.49,106.69,104.02,88.38,56.60,56.48,31.55,30.90,29.04,28.25,22.62,14.17.
1.2.3 化合物 3a~3p 的合成参考文献[9]的方法合成。不经纯化直接用于下一步反应。
1.2.4 目标化合物 4a~4p 的合成以化合物 4a 的合成为例。称取 0.348 g (1 mmol) 化合物 2 于 100 mL 单口瓶中,加入 20 mL 重蒸后的二氯甲烷。在冰盐浴下反应 15 min 后,加入 0.150 g (1.5 mmol) 三乙胺。待反应器内降到零度以下,缓慢滴加含 0.156 g (1.5 mmol) 新制得的化合物 3a 的重蒸二氯甲烷溶液。滴加完毕后,常温下搅拌过夜。用 TLC [展开剂 V (石油醚) : V (乙酸乙酯) = 4 : 1] 监测至反应结束。将反应液依次用饱和碳酸氢钠溶液、水溶液和饱和氯化钠溶液各 20 mL 洗涤。有机层用无水硫酸钠干燥,减压蒸馏去除溶剂,得到淡红色固体。经石油醚重结晶后,硅胶柱层析分离纯化 [洗脱液 V(石油醚) : V(乙酸乙酯) = 8 : 1] 得产物 4a。按上述方法,制得化合物 4b~4p。
1.3 除草活性测定准确称取一定量的供试药剂,用甲醇溶解并添加质量分数为 0.5% 的吐温-80,配制成 1 000 mg/L 的药剂进行除草活性初筛;对活性较高的化合物再依次分别设置 500 和 250 mg/L 两个质量浓度进行复筛。以 96.3% 莠去津 (atrazine) 原药 (山东侨昌化学有限公司) 作为对照药剂。
供试植物为马唐 Digitaria sanguinalis L. 和反枝苋 Amaranthus retroflexus L.,其种子由河北农业大学植物保护学院提供。取 7 cm × 7 cm × 10 cm 的花盆,装蛭石至 3/4 处,直接播种已催芽的供试植株种子 15 粒,覆土约 0.2 cm。待杂草长至 2~3 叶期时,采用茎叶喷雾法[10]处理,每处理重复 3 次。处理后,将植株置于温室 (白天 20 ℃ ± 2 ℃,夜间 10 ℃ ± 2 ℃) 中培养,5 d 后统计植株死亡情况,计算植株死亡率。
2 结果与讨论 2.1 化合物的合成与结构表征目标化合物均为白色粉末。其理化性质和高分辨质谱数据见表 1,核磁共振氢谱和碳谱数据见表 2。
|
|
表 1 目标化合物 4a~4p 的理化性质和高分辨质谱数据 Table 1 Physicochemical and HRMS data of target compounds 4a-4p |
|
|
表 2 化合物 4a~4p 的核磁共振氢谱和碳谱数据 Table 2 1H NMR and 13C NMR data of 4a-4p |
以异香豆素为母体结构进行衍生合成一直存在难度。在合成化合物 2 时,最初参考了 Bacchi 等[11]的方法,在常温下用巯基乙酸催化法合成,但由于原料的位阻较大,未获成功;之后又参考了 Al-Saffar 等[12]的方法,采用在加热条件下将化合物 1 与盐酸羟胺直接反应,最终成功。在碱的选择过程中,首先选用了以碳酸钠作碱,但反应产物经核磁检测发现,化合物 1 中异香豆素结构的内酯环断开;后使用碳酸氢钠作碱,得到了目标化合物。
有文献报道,肟胺类化合物与酰氯反应既可合成噁二唑类化合物[13],也可合成酰氧基脒类化合物[14]。本研究在合成化合物 4 时,经高分辨质谱确认,所得产物为噁二唑类化合物,证明合环反应成功。此外,在滴加酰氯的二氯甲烷溶液时,速度不宜过快,否则会因反应温度过高而发生副反应。化合物 4 的粗产物中有易溶于石油醚的有色副产物,需提前进行脱色处理。
2.2 除草活性目标化合物在 1 000 mg/L 下对马唐或反枝苋的除草活性初筛结果表明:多数化合物的活性较低,仅有化合物 4j 和 4n 表现出了较好的活性,其对马唐的致死率分别为 48% 和 88%,对反枝苋的致死率分别为 100% 和 84%。
复筛结果(表 3)表明:化合物 4j 的活性最好,在 500 mg/L 下马唐和反枝苋的死亡率分别为 64% 和 62%,但在 250 mg/L 下活性则明显降低。所有目标化合物的除草活性均不及对照药剂莠去津。
|
|
表 3 不同质量浓度下化合物 4j 和 4n 的除草活性 (茎叶处理) Table 3 Herbicidal activity of the compounds 4j and 4n at different concentrations (Foliage treatment) |
3 结论
本研究设计合成的 16 个未见文献报道的异香豆素噁二唑类化合物,合成方法简单,产率高,其为异香豆素类化合物提供了衍生策略。初步除草活性测定结果表明,化合物 4j (4-[5-(4-氯-苯基)-[1-2, 4]噁二唑-3-基]-3-己基-6,7-二甲氧基异香豆素) 具有较好的除草活性,有进一步研究的价值。
| [1] | GERWICK B C, SPARKS T C. Natural products for pest control:an analysis of their role,value and future [J]. Pest Manag Sci, 2014, 70 (8) :1169–1185 . doi:10.1002/ps.2014.70.issue-8 |
| [2] | VILADOMAT F,BASTIDA J.General overview of plant secondary metabolism[M]//BAHADUR B,RAJAM M V,SAHIJRAM L,et al.Plant biology and biotechnology.India:Springer,2015:539-568. |
| [3] | LUPINI A, ARANITI F, SUNSERI F, et al. Coumarin interacts with auxin polar transport to modify root system architecture in Arabidopsis thaliana [J]. Plant Growth Regul, 2014, 74 (1) :23–31 . doi:10.1007/s10725-014-9893-0 |
| [4] | NIRO E, MARZAIOLI R, DE CRESCENZO S, et al. Effects of the allelochemical coumarin on plants and soil microbial community [J]. Soil Biol Biochem, 2016, 95 :30–39 . doi:10.1016/j.soilbio.2015.11.028 |
| [5] |
张学良, 魏艳, 韦能春, 等. 10种N-取代氨基香豆素的合成及生物活性 [J]. 农药学学报, 2013,15 (1)
:37–42.
ZHANG X L, WEI Y, WEI N C, et al. Synthesis and bioactivity of 10 N-substituted amino coumarins [J]. Chin J Pestic Sci, 2013, 15 (1) :37–42 . |
| [6] |
刘斌, 谢龙观, 徐效华, 等. 3-苯甲酰基-4-羟基香豆素衍生物的合成、晶体结构及其除草活性研究 [J]. 有机化学, 2011,31 (12)
:2067–2073.
LIU B, XIE L G, XU X H, et al. Synthesis,crystal structure and herbicidal activity of 3-benzoyl-4-hydroxycoumarin derivatives [J]. Chinese J Org Chem, 2011, 31 (12) :2067–2073 . |
| [7] | ARANITI F, MANCUSO R, LUPINI A, et al. Phytotoxic potential and biological activity of three synthetic coumarin derivatives as new natural-like herbicides [J]. Molecules, 2015, 20 (10) :17883–17902 . doi:10.3390/molecules201017883 |
| [8] | DONG H J, BAN X D, Li C, et al. Synthesis of 3-hexyl-4-cyan-6,7-dimethoxy isocoumarin [J]. Asian J Chem, 2014, 26 (12) :3623–3625 . |
| [9] | KOSTITSYN A B, RUZEK H, HEYDT H, et al. Synthesis and spectral properties of cyclopropyl-substituted phosphaalkenes [J]. Russ Chem Bull, 1994, 43 (4) :635–640 . doi:10.1007/BF00699840 |
| [10] | ZHANG J L, ZHANG L H, LIU Y C, et al. The herbicidal activity of mutant isolates from Botrytis cinerea [J]. Agric Sci China, 2006, 5 (8) :622–628 . doi:10.1016/S1671-2927(06)60102-8 |
| [11] | BACCHI A, CARCELLI M, COMPARI C, et al. Investigating the role of metal chelation in HIV-1 integrase strand transfer inhibitors [J]. J Med Chem, 2011, 54 (24) :8407–8420 . doi:10.1021/jm200851g |
| [12] | AL-SAFFAR F,BERLIN S,MUSIL T,et al.Process for preparing protected amidines:US:81699806:A[P].2008-12-25. |
| [13] | FORTUNA C G, BONACCORSO C, BULBARELLI A, et al. New linezolid-like 1,2,4-oxadiazoles active against gram-positive multiresistant pathogens [J]. Eur J Med Chem, 2013, 65 :533–545 . doi:10.1016/j.ejmech.2013.03.069 |
| [14] | TRSTENJAK U, ILAŠ J, KIKELJ D. Low molecular weight dual inhibitors of factor Xa and fibrinogen binding to GPⅡb/Ⅲa with highly overlapped pharmacophores [J]. Eur J Med Chem, 2013, 64 :302–313 . doi:10.1016/j.ejmech.2013.03.056 |
 2016, Vol. 18
2016, Vol. 18


