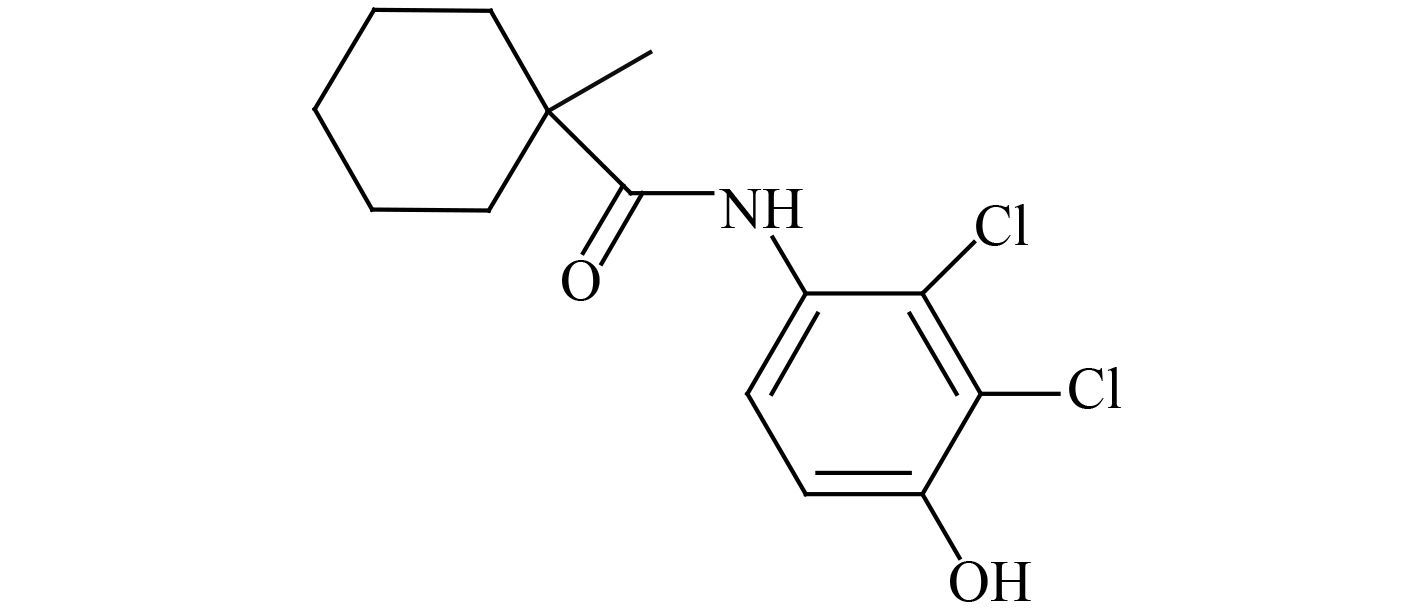
番茄灰霉病是番茄上危害较重且常见的病害,病原为灰葡萄孢菌 Botrytis cinema Peru,主要为害番茄果实和叶片,可引起果实腐烂,严重影响番茄的产量和品质[1]。环酰菌胺 (fenhexamid) 是由拜耳公司开发的一种具有内吸性、保护性新型酰胺类杀菌剂,其结构式如 (Ⅰ) 所示,主要用于灰霉病及菌核病、黑斑病等的防治[2]。
|
(Ⅰ) 环酰菌胺 (fenhexamid) |
目前,中国的施药技术多以手动和小型机为主,导致药剂在靶标叶片上的沉积量少,农药有效利用率低,同时会给空气、土壤及水体等造成严重污染[3]。发达国家在施药技术和施药机械上基本做到了精喷量、少污染和高功效,已研发出多种喷雾器械、多种喷头及配套多种喷雾技术,如风送液力式喷雾技术、静电式喷雾技术、超低量和低量喷雾技术等,大大提高了农药的有效利用率[4]。中国在农药施药器械及施药技术方面也有一些研究报道,如宋坚利等[5]针对农药利用率低等问题,研发出农药雾滴截留回收再利用的“Ⅱ”型循环喷雾机,性能测试结果显示,两侧喷杆交错喷雾和喷头能够使药液回收率分别提高 44.0% 和 18.4%,并能够增加冠层内部与叶片背面的药液沉积量;栅格端面罩盖能够有效改变气流方向,可使药液回收率提高 10% 左右。因此,改进施药器械性能,是提高农药利用率的有效途径之一。
为比较不同施药器械在保护地果蔬,特别是在相对密闭的环境中 (如大棚) 施药后农药的沉降情况,以及对灰霉病防治效果的差异,本研究室自行加工出性能指标均符相关标准的 10% 环酰菌胺可湿性粉剂[6],分别采用背负式电动喷雾器、静电喷雾器及烟雾器等开展了相关试验,并采用气相色谱法分析研究了经不同施药器械施药后环酰菌胺在番茄叶片上沉积量的差异,以及对番茄叶和果上灰霉病防控效果的影响。
1 材料与方法 1.1 材料及仪器 1.1.1 供试药剂99.5% 环酰菌胺 (fenhexamid) 标准品,购自四川省农药检定所;10% 环酰菌胺可湿性粉剂,由四川农业大学无公害农药研究室研制,主要配方 (质量分数):95% 环酰菌胺原药 (购自山东亿嘉农化有限公司) 10.53%,拉开粉 5%,亚甲基双萘磺酸钠 (NNO) 6%,以硅藻土补充至 100%)。
1.1.2 供试菌株灰葡萄孢 Botrytis cinema Peru 标准菌株,由华中农业大学植物病理实验室提供。
1.1.3 供试番茄将番茄种子用营养钵育苗,移栽,待番茄幼苗长至 20~30 cm 时,移栽至大棚中,种植密度为 (行距 × 窝距 = 45 cm × 50 cm)。待番茄开花时,采用不同施药器械喷施 10% 环酰菌胺可湿性粉剂。
1.1.4 供试仪器3WBD-16 型背负式电动喷雾器 (工作压力:0.2~0.4 mPa;工作电流:2.3~3.5 A;配置:2 600 r/min 水泵),购自汕头市澄海区东里永盛喷雾器厂;3WJD-18 静电喷雾器 (工作压力:0.15~0.42 mPa;工作电压:DC12V;静电形式:接触式),购自山东卫士植保机械有限公司;TSP-60 (S) 热力烟雾器 (药箱压力约 0.025 mPa;油箱压力约 0.026 mPa;药液输出量 L/H:(油基) 8-80),购自深圳隆瑞科技有限公司;BC/BD-629H 海尔冰箱,海尔集团;5-7044 固相萃取仪,美国 SUPELCO 公司;1 000 mg × 6 mL 弗罗里硅土 SPE 小柱和 GC6809 气相色谱仪 [带微量池电子捕获检测器 (GC-UECD)],安捷伦科技有限公司。
1.2 试验方法 1.2.1 接种番茄灰霉病菌将灰葡萄孢标准菌株用 PDA 培养基在 23 ℃ 培养箱中培养,待产出大量孢子时,用无菌水洗下孢子,制成孢子菌悬液,当其在 10 × 10 倍光学显微镜下每个视野有 60~80 个孢子时即可喷雾接种:将孢子菌悬液喷雾施于番茄植株上,用透明塑料薄膜覆盖保湿,并于每天早晚用无菌水补水。
1.2.2 试验小区设计根据不同施药器械,分别设置常规喷雾处理、静电喷雾处理和热力烟雾处理,同时设置空白对照,每个处理 3 次重复,共计12 个试验小区,各小区面积均为 40 m2,按照完全随机区组排列,每个小区之间设 2 m 安全距离。
1.2.3 施药方法在接种灰葡萄孢孢子菌悬液 1 d 后,分别采用 3 种施药器械喷施药剂。其中常规 3WBD-16 型背负式电动喷雾器和 3WJD-18 静电喷雾器按照 675 kg/hm2 药液量施药,环酰菌胺的质量浓度均设置为 1 000 μg/mL,每小区最终药液量为 2.7 L。施药时采用 1.5 m 高的塑料薄膜隔离各小区,同时降低喷头以确保药液均匀喷施在各试验小区内所有番茄植株上。采用 TSP-60 (S) 热力烟雾器时,按照 135 kg/hm2 药液量施药,每小区最终药液量为 0.54 L,环酰菌胺质量浓度为5 000 μg/mL;采用汽油剂型带动发动机形成热力烟雾,施药前采用薄膜将该小区直到大棚顶部全封闭,避免烟雾弥漫到邻近小区,待烟雾完全沉降后撤去薄膜。
1.2.4 取样方法于药剂施用 2 h 后,在每小区3 个采样点采集样品,每点分别采集番茄植株的上、中、下叶片 200 g。先采集对照区样本,再采集处理区样本。于 8 h 内将样品缩分、切碎、混匀、匀浆,于 -20 ℃ 保存[7-8]。
1.2.5 环酰菌胺在番茄叶片上的沉积量分析 1.2.5.1 提取方法称取番茄叶片样品 5.0 g (准确至 0.01 g) 于 250 mL锥形瓶中,准确加入 50.0 mL 乙腈,在 15 000 r/min 下匀浆 2 min。用滤纸过滤至 100 mL 比色管中,加入 6 g 氯化钠,充分振荡 2 min 后,静置 30 min。准确移取 10.0 mL 上清液于试管中,在 70 ℃ 水浴中用氮气吹至近干,加入 2 mL 正己烷溶解,涡旋 15 s,待净化[8]。
1.2.5.2 净化方法弗罗里硅 SPE 小柱,先用 6 mL V (正己烷) : V (丙酮) = 9 : 1 的混合溶液淋洗,再用 6 mL 正己烷淋洗,弃去淋洗液。将提取溶液完全转移至 SPE 小柱上,用 10 mL V (正己烷) : V (丙酮) = 9 : 1 混合溶剂分 3 次洗脱,收集全部洗脱液。在 70 ℃ 水浴中用氮气吹至近干。准确加入 10.0 mL 正己烷,涡旋 15 s,静置,待 GC-UECD 测定[9]。
1.2.5.3 气相色谱条件GC-UECD;DB-5 色谱柱 (30 m × 0.32 mm,0.25 μm);进样口温度 270 ℃;检测器温度 310 ℃;柱温 120 ℃ 保持 2 min,以 10 ℃/min 升温至 270 ℃,保持 8 min;载气为氮气,1.5 mL/min,尾吹 50 mL/min;不分流进样,进样量 1 μL;环酰菌胺保留时间约为 16.4 min。上述为典型操作条件,试验时可根据不同仪器特点适当调整,以获得最佳分析效果[10]。
1.2.5.4 分析方法的构建与确证称取环酰菌胺标准品 0.01 g (准确至 0.000 1 g),用正己烷溶解并配制成 100 mg/L 的标准溶液母液。用正己烷逐级稀释,得到质量浓度分别为 1、2、5、10、20 mg/L 的标准工作溶液,进行 GC-UECD 测定。以环酰菌胺标准溶液质量浓度为横坐标,峰面积平均值为纵坐标绘制标准曲线。
称取 4 个空白对照的番茄植株样品 25 g 于三角瓶中,分别添加 1 mL 20、100、250 和 500 μg/mL 的标准溶液,配成环酰菌胺添加量分别为 0.8、4、10、20 mg/kg 的处理,振荡摇匀后静置 30 min。按照上述样品前处理方法处理样品并进行气相色谱检测,测定其添加回收率。
1.2.5.5 环酰菌胺沉积量的测定在上述色谱条件下,待仪器基线稳定在 1.0 × 10-3 AU 范围内,将标准溶液连续进样多次,当相邻两次进样的峰面积比值变化 < 1.2% 时,用自动进样器分别吸取 1.0 μL 标准溶液和净化后的样品溶液注入色谱仪中,以双柱保留时间定性,以样品溶液峰面积和标准溶液峰面积比较定量。
1.2.5.6 分析结果计算将测得的两次样品溶液以及试样前后两次进样的标准溶液中环酰菌胺的峰面积分别取平均值,按公式 (1)[8]计算样品中环酰菌胺的质量分数 (w)。

|
(1) |
A1—标准溶液中环酰菌胺峰面积的平均值;A2—样品溶液中环酰菌胺峰面积的平均值;m—样品质量,g;V1—标准溶液进样体积;V2—样品溶液进样体积;V—样品最终定容体积;L1—样品提取体积;L2—样品移取体积;c1—标准溶液质量浓度。
1.2.6 防治效果调查在施药后 7、14 和 21 d,分别调查不同处理药剂对番茄灰霉病的防治效果。每小区采用五点法取样,每点调查 2~3 株,每株调查全部叶片及果实,并根据杜立新等[11]方法进行分级记录。
叶片被害分级方法:0 级:无病斑;1 级:单叶片有病斑 3 个;3 级:单叶片有病斑 4~6 个;5 级:单叶片有病斑 7~10 个;7 级:单叶片有病斑 11~20 个,部分密集成片;9 级:单叶片有病斑密集占叶面积 1/4 以上。
番茄果实被害分级方法: 0 级:无病斑;1 级:残留花瓣发病或柱头发病;3 级:柱头发病蔓延到果脐部;5 级:果脐部有浸润斑无霉层;7 级:果脐部有霉层但未扩展到其他部位;9 级:霉层扩展到果的其他部位。分别按 (2) 和 (3) 式计算病情指数及防治效果。

|
(2) |

|
(3) |
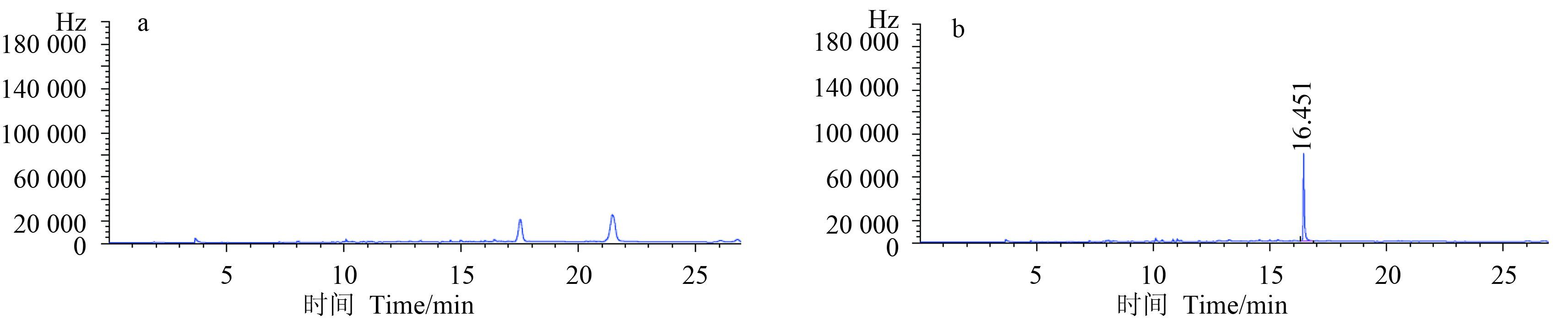
测定结果表明:在 1~20 mg/L 范围内,环酰菌胺峰面积与其质量浓度间呈良好的线性关系。其线性方程为 y=192 824x-15 488,相关系数 r=0.999 8。环酰菌胺的保留时间为 16.451 min。
2.1.2 方法的准确度和精密度添加回收试验结果 (表 1) 表明:在添加水平为 0.8~20 mg/kg 时,环酰菌胺的平均回收率在 90%~94%,相对标准偏差 (RSD) 为 2.4%~3.8%。
|
|
表 1 番茄叶片中环酰菌胺的添加回收率及相对标准偏差 Table 1 The added recovery and relative standard deviation of fenhexamid standard substance for the tomato leaves |
相关图谱见图 1。环酰菌胺的保留时间为 16.451 min,而空白样品在此处无干扰峰出现,表明本方法能准确测定环酰菌胺在番茄叶片上的沉积量。
|
图 1 空白番茄样品 (a) 及其添加 0.4 mg/kg 环酰菌胺标准品 (b) 气相色谱图 Fig. 1 Chromatogram of tomato blank control (a) and fortified with 0.4 mg/kg fenhexamid standard substance (b) |
2.2 环酰菌胺在番茄叶片上的沉积量
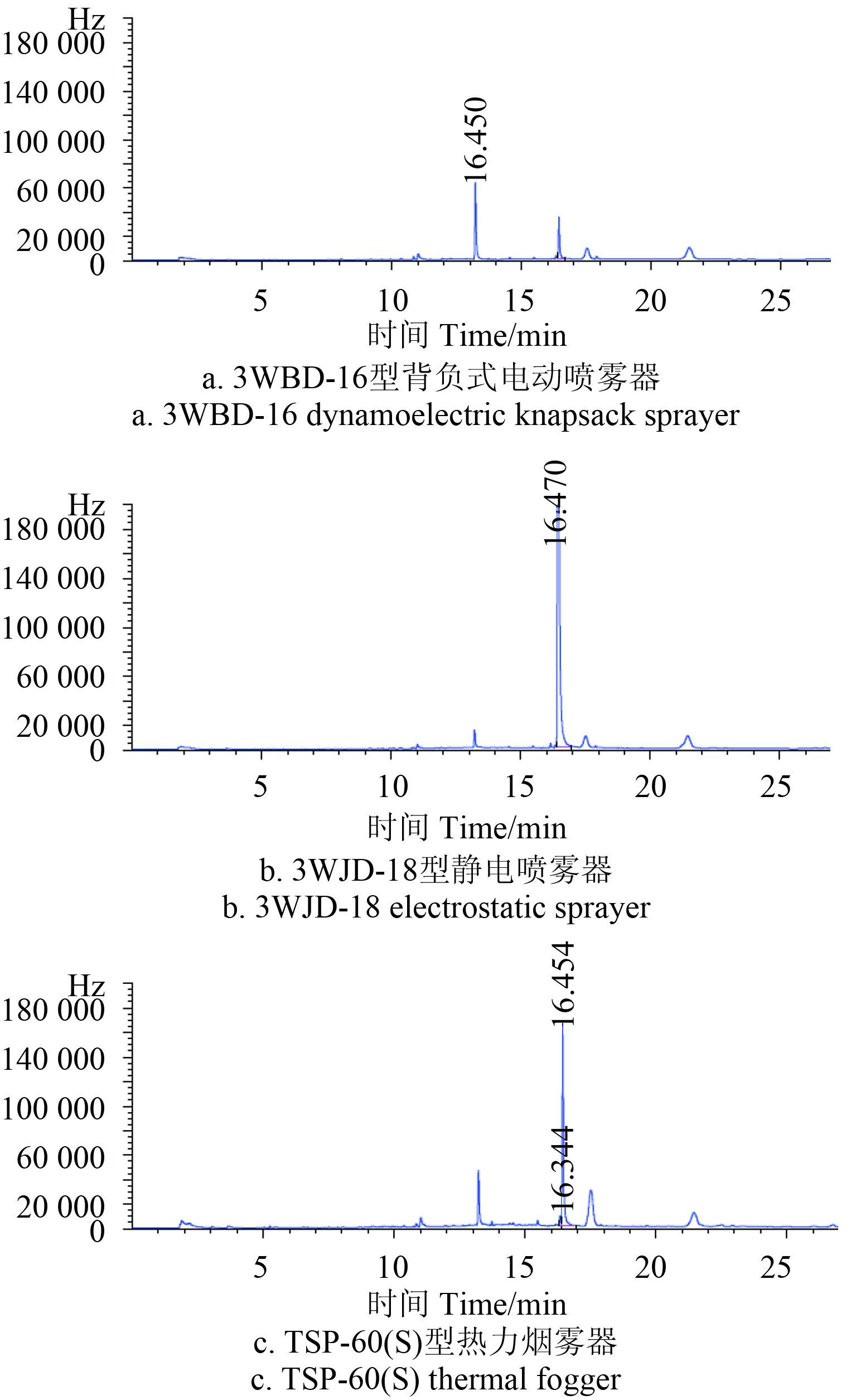
采用不同喷雾器喷施 10% 环酰菌胺可湿性粉剂后,环酰菌胺在番茄叶片上的沉积量见表 2。其中采用 TSP-60 (S) 热力烟雾器喷施,环酰菌胺的沉积量最高,达 12.83 mg/kg,与其余 2 种喷雾器处理的沉积量差异显著;采用 3WJD-18 静电喷雾器喷施,环酰菌胺的沉积量为 5.61 mg/kg,显著高于 3WBD-16 型背负式电动喷雾器处理的沉积量 (3.25 mg/kg)。典型色谱图见图 2。
|
|
表 2 采用不同喷雾器施药后环酰菌胺在番茄叶片的沉积量 Table 2 The deposition quantity of fenhexamid sprayed onto the tomato leaves by different sprayers |
|
图 2 采用不同施药器械施药后番茄叶片环酰菌胺气相色谱图 Fig. 2 Chromatogram of fenhexamid sprayed by difference sprayers for the tomato leaves |
2.3 不同施药器械对环酰菌胺对番茄灰霉病防控效果的影响
结果 (表 3) 表明:采用 TSP-60 (S) 型热力烟雾器施药,环酰菌胺对番茄叶部灰霉病防控效果最好,防效 86.53%,显著高于其他 2 个处理;采用 3WBD-16 型背负式电动喷雾器和 3WJD-18 型静电喷雾器对番茄叶片的处理效果相当,防效分别为 73.88% 和 77.45%;对于番茄果实灰霉病的防治效果,以 TSP-60 (S) 型热力烟雾器效果最好,达到 85.50%,显著高于 3WBD-16 型背负式电动喷雾器 (74.03%),与 3WJD-18 型静电喷雾器处理防效 (79.85%) 差异不显著。
|
|
表 3 不同施药器械喷施 10% 环酰菌胺可湿性粉剂对番茄灰霉病的防控效果 Table 3 The efficacies of 10% fenhexamid wettable powder sprayed by different sprayers for the control of Botrytis cinerea |
3 讨论
目前,关于农药沉积量的测定方法主要是计量雾滴数量和大小[12-13],但该方法存在较大的偏差;环酰菌胺痕量检测主要依靠高效液相色谱法,但其检测器灵敏度较气相色谱低,因此本研究构建了气相色谱法用于检测环酰菌胺在番茄叶片中的有效沉积量,准确度和精密度均达到中华人民共和国关于农药残留 (痕量) 的行业标准[14],方法可行。
在农药应用中,合适的喷雾器械及喷头可减少农药的飘逸,增加沉积量,提高农药利用率和最终防治效果。Zhao 等[15]研究了由莱克勒公司研发的 3 种扇形喷头 (LU120-02、AD120-02 和 IDK120-02) 喷施吡虫啉在小麦上的防漂移效应。结果表明:LU120-02 喷头效果最好,其次为 IDK120-02 喷头,AD120-02 喷头效果最差。张京等[16]研究了气-液两相感应式静电喷头。结果表明:与常规喷雾相比,该喷头的雾滴在叶片正面的沉积量和覆盖率分别增加了 43.03% 和 22.07%,药液在叶片背面的覆盖率达 30.95%;当气体流量为 1.4 m3/h、喷液量为 60 mL/min、电压为 1 000 V 时,荷质比可达 3.2 mC/kg,可以有效增加荷电沉积;最优工作参数组合为气液比 0.18、喷雾角度 0°、电压 1 000 V。本试验通过研究施药器械与药剂沉积量和防治效果关系发现:用 10% 环酰菌胺可湿性粉剂防治番茄灰霉病时,使用 TSP-60 (S) 热力烟雾器喷雾施药,药剂沉积量最高,达到 12.83 mg/kg,其对番茄叶片和果实上灰霉病的防治效果分别为 86.53% 和 85.50%,显著高于用 3WBD-16 型背负式电动喷雾器和 3WJD-18 静电喷雾器施药的效果,与秦曙等[13]的研究结果相差不大。本研究虽然未涉及喷雾器喷头类型的选择问题,但所得结果对于在局部相对封闭的环境 (如大棚等) 中施药防治灰霉病具一定的指导意义。
| [1] |
谢联辉.
普通植物病理学[M]. 北京: 科学出版社, 2013 .
XIE L H. General plant pathology[M]. Beijing: Science Press, 2013 . |
| [2] |
黄伟, 柴嫔姬, 谭成侠. 环酰菌胺合成工艺 [J]. 农药, 2012,51 (8)
:562–564.
HUANG W, CHAI P J, TAN C X. Synthesis of fenhexamid [J]. Agrochemicals, 2012, 51 (8) :562–564 . |
| [3] |
邓敏, 邢子辉, 李卫. 我国施药技术和施药机械的现状及问题 [J]. 农机化研究, 2014 (5)
:235–238.
DENG M, XING Z H, LI W. Actuality and problems of pesticide machinery and its application techniques in China [J]. J Agric Mechan Res, 2014 (5) :235–238 . |
| [4] |
翟长远, 朱瑞祥, 张佐经, 等. 精准施药技术现状分析 [J]. 农机化研究, 2010,32 (5)
:9–12.
ZHAI C Y, ZHU R X, ZHANG Z J, et al. Status analysis of precision pesticide application techniques [J]. J Agric Mechan Res, 2010, 32 (5) :9–12 . |
| [5] |
宋坚利, 何雄奎, 张京, 等. "Ⅱ"型循环喷雾机设计 [J]. 农业机械学报, 2012,43 (4)
:31–36.
SONG J L, HE X K, ZHANG J, et al. Design of Ⅱ-type recycling tunnel sprayer [J]. Trans Chinese Soc Agric Mach, 2012, 43 (4) :31–36 . |
| [6] |
徐汉虹.
植物化学保护学[M].4版. 北京: 中国农业出版社, 2007 : 28 -29.
XU H H. Plant chemical protection[M].4th ed. Beijing: China Agriculture Press, 2007 : 28 -29. |
| [7] |
新鲜水果和蔬菜取样方法:GB/T 8855-2008[S].北京:中国标准出版社,2008.
Fresh fruits and vegetables-sampling:GB/T 8855-2008[S].Beijing:China Standards Press,2008. |
| [8] |
宋淑然, 洪添胜, 王卫星, 等. 水稻田农药喷雾分布与雾滴沉积量的试验分析 [J]. 农业机械学报, 2004,35 (6)
:90–93.
SONG S R, HONG T S, WANG W X, et al. Testing analysis on deposit and distribution of pesticide spraying in rice fields [J]. Trans Chinese Soc Agric Mach, 2004, 35 (6) :90–93 . |
| [9] | HEM L, CHOI J H, PARK J H, et al. Residual pattern of fenhexamid on pepper fruits grown under greenhouse conditions using HPLC and confirmation via tandem mass spectrometry [J]. Food Chem, 2011, 126 (4) :1533–1538 . doi:10.1016/j.foodchem.2010.11.147 |
| [10] | LIKAS D T, TSIROPOULOS N G, MILIADIS G E. Rapid gas chromatographic method for the determination of famoxadone,trifloxystrobin and fenhexamid residues in tomato,grape and wine samples [J]. J Chromatogr A, 2007, 1150 (1-2) :208–214 . doi:10.1016/j.chroma.2006.08.041 |
| [11] |
杜立新, 冯书亮, 曹克强, 等. 枯草芽孢杆菌BS-208和BS-209菌株防治番茄灰霉病研究 [J]. 农药学学报, 2004,6 (3)
:37–42.
DU L X, FENG S L, CAO K Q, et al. Study on biological control of Botrytis cinerea by Bacillus subtilis strains BS-208 and BS-209 [J]. Chin J Pestic Sci, 2004, 6 (3) :37–42 . |
| [12] |
杨希娃, 代美灵, 宋坚利, 等. 雾滴大小、叶片表面特性与倾角对农药沉积量的影响 [J]. 农业工程学报, 2012,28 (3)
:70–73.
YANG X W, DAI M L, SONG J L, et al. Effect of droplet size,leaf characteristics and angle on pesticide deposition [J]. Trans Chinese Soc Agric Eng, 2012, 28 (3) :70–73 . |
| [13] |
秦曙, 庞斌, 乔雄梧, 等. 农药剂型、喷雾参数与采样方法对代森锰锌在小油菜上原始沉积量的影响 [J]. 农药学学报, 2010,12 (3)
:319–323.
QIN S, PANG B, QIAO X W, et al. Effects of formulation,spray parameters and sampling methods on initial residue of mancozeb in cole [J]. Chin J Pestic Sci, 2010, 12 (3) :319–323 . |
| [14] |
农药残留试验准则:NY/T 788-2004[S].北京:中国农业出版社,2004:29-33.
Guideline on pesticide residue trials:NY/T 788-2004[S].Beijing:China Agriculture Press,2004:29-33. |
| [15] | ZHAO H Y, XIE C, LIU F M, et al. Effects of sprayers and nozzles on spray drift and terminal residues of imidacloprid on wheat [J]. Crop Prot, 2014, 60 :78–82 . doi:10.1016/j.cropro.2014.02.009 |
| [16] |
张京, 宫帅, 宋坚利, 等. 气液两相感应式静电喷头性能试验 [J]. 农业机械学报, 2011,42 (12)
:107–110.
ZHANG J, GONG S H, SONG J L, et al. Performance of two-phase gas-liquid electrostatic induction nozzle [J]. Trans Chinese Soc Agric Mach, 2011, 42 (12) :107–110 . |
 2016, Vol. 18
2016, Vol. 18


