2. 江苏省苏科农化有限责任公司, 南京 211513
2. Jiangsu Province of Suke Agro-Chemistry Company, Nanjing 211513, China
近年来,设施蔬菜栽培面积迅速扩大,已成为高效农业发展的新产业[1]。然而,因设施大棚的密闭性和单一作物连作引起的土传病害爆发频繁,严重制约了该产业的可持续发展[2]。其中根结线虫是一类可对多种农作物造成严重危害的土传植物寄生线虫[3],每年给全世界主要农作物生产造成的损失高达 1 250 亿美元[4]。传统的防治方法 (如作物轮作、抗病育种和化学农药的使用等) 虽然可在一定程度上减轻线虫病害,但由其导致的作物产量损失仍然很严重[5]。因此,利用土壤中有益微生物防治设施蔬菜土传病害的研究备受关注,这些微生物可通过分泌抗菌物质、营养竞争和诱导植株产生抗病性等方式,促进植物生长,抑制病害发生及调节根区周围微生态结构,在防治设施蔬菜土传病害中发挥着重要作用[6]。
中国江苏省农业科学院植物保护研究所自 2006 年起开展设施蔬菜土传病害的生物防治研究,针对番茄枯萎病菌和青枯病菌进行了拮抗微生物的筛选,从 2 万多个土壤细菌菌株中分离出了具有较强拮抗能力的生防菌株——解淀粉芽孢杆菌 B1619[7]。该菌株可产生多种胞外蛋白水解酶、嗜铁素和抗生素类等物质,并能诱导植物产生抗病性,可有效减轻设施栽培中由番茄枯萎病、青枯病、根腐病及立枯病等重要土传病害引起的连作障碍[8]。目前,解淀粉芽孢杆菌 B1619 已获得国家发明专利 (专利号:ZL201210208366.9),由江苏省农科院植保所和江苏省苏科农化有限责任公司合作研发的生物杀菌剂“1.2 亿活芽孢/g 解淀粉芽孢杆菌 B1619 水分散粒剂”也已进入农药产品登记程序。
微生物杀菌剂水分散粒剂中的含菌量是产品质量的重要指标,同时与防治效果紧密相关,颗粒的含菌量越高,防控效果越好。为了最大限度降低加工工艺对生物杀菌剂 B1619 水分散粒剂中含菌量的影响,笔者采用正交试验法对 B1619 水分散粒剂的主要助剂配比和颗粒制备条件进行了优化,以期为制定 B1619 水分散粒剂的产业化生产工艺以及提高该制剂对设施番茄土传病害的防治效果提供科学依据。
1 材料与方法 1.1 供试材料 1.1.1 菌株解淀粉芽孢杆菌 B1619,由江苏省农业科学院植物保护研究所生物防治研究室提供。
1.1.2 培养基YPGA 培养基[9]:胰蛋白胨 5 g,酵母膏 5 g,葡萄糖 5 g,琼脂 17~20 g,用蒸馏水定容至 1 000 mL。
1.1.3 药剂及主要仪器药剂:粘结剂硅酸镁铝 (magnesium aluminum silicate)、分散剂萘磺酸盐甲醛 (naphthalenesul-fonic formaldehyde)、崩解剂硫酸铵 (ammonium nitrate) 以及十二烷基硫酸钠 (sodium dodecyl sulfate)、白炭黑 (white carbon black)、高岭土 (kaolin) 等助剂均为市场销售的工业级产品。
主要仪器:ZLB-80 旋转式挤压造粒机 (江苏张家港市开创机械制造有限公司);101-1 鼓风干燥箱 (南京知热干燥厂);PHS-3C pH 计 (上海大普仪器有限公司);DHZ-L 冷冻恒温振荡器 (太仓市强乐实验设备有限公司);JM-A6002 电子天平 (精确到 0.01 g,诸暨市超泽衡器设备有限公司)。
1.2 试验方法 1.2.1 水分散粒剂颗粒含菌量检测准确称取 1 g (精确到 0.01 g) 所制备的水分散粒剂颗粒,放入装有 100 mL 无菌水的 250 mL 三角瓶中,于 30 ℃、180 r/min 下振荡培养 1 h 后,采用平板菌落计数法[10]在 YPGA 平板上计算活菌数。
1.2.2 单因子筛选试验 1.2.2.1 主要助剂单因子筛选解淀粉芽孢杆菌 B1619 水分散粒剂助剂初始配比 (质量分数)[11]为:2% 硅酸镁铝、3% 萘磺酸盐甲醛缩合物、5% 硫酸铵、1% 十二烷基硫酸钠、2% 白炭黑、20%~25% 解淀粉芽孢杆菌 B1619 发酵原液 (活菌数为 8.00 × 109~1.20 × 1010 cfu/mL,以保证在加工水分散粒剂时加入量达到 2.40 × 109 cfu/g),以高岭土 (填料) 补足至 100%。
在此初始助剂配比的基础上,分别改变硅酸镁铝、萘磺酸盐甲醛和硫酸铵的比例 (表 1),制备成水分散粒剂,采用平板菌落计数法计算活菌数。以初始助剂配比下制备的水分散粒剂作对照。每处理重复 3 次。
|
|
表 1 主要助剂单因子筛选方案 Table 1 Single factor screening of primary additives |
1.2.2.2 制备条件单因子筛选
水分散粒剂颗粒的初始制备条件为:筛孔粒径 1.2 mm,在 50 ℃ 左右烘干 25 min。在此初始制备条件基础上,采用初始助剂配比,分别改变筛孔粒径、烘干温度和烘干时间 (表 2),制备得到水分散粒剂,采用平板菌落计数法计算活菌数。以初始制备条件下得到的水分散粒剂颗粒作对照。每处理重复 3 次。
|
|
表 2 颗粒制备条件单因子筛选方案 Table 2 Single factor screening of particle preparation conditions |
1.2.3 正交试验设计
分别对单因子试验筛选获得的 3 组硅酸镁铝、萘磺酸盐甲醛和硫酸铵配比进行 3 因素 3 水平的正交试验,对加工制备条件筛选获得的 3 组筛孔粒径、烘干温度及烘干时间进行 3 因素 3 水平的正交试验。采用 L9 (34) 正交表确定各因子的最佳组合,第 4 列为空白 (误差) 列。
1.3 方法验证将采用初始助剂配比和加工制备条件制得的水分散粒剂颗粒的含菌量和采用正交法优化后工艺制得颗粒的含菌量进行比较,按 (1) 式计算优化率。
优化率/% = [(优化后颗粒含菌量-优化前颗粒含菌量)/优化前颗粒含菌量] × 100(1)
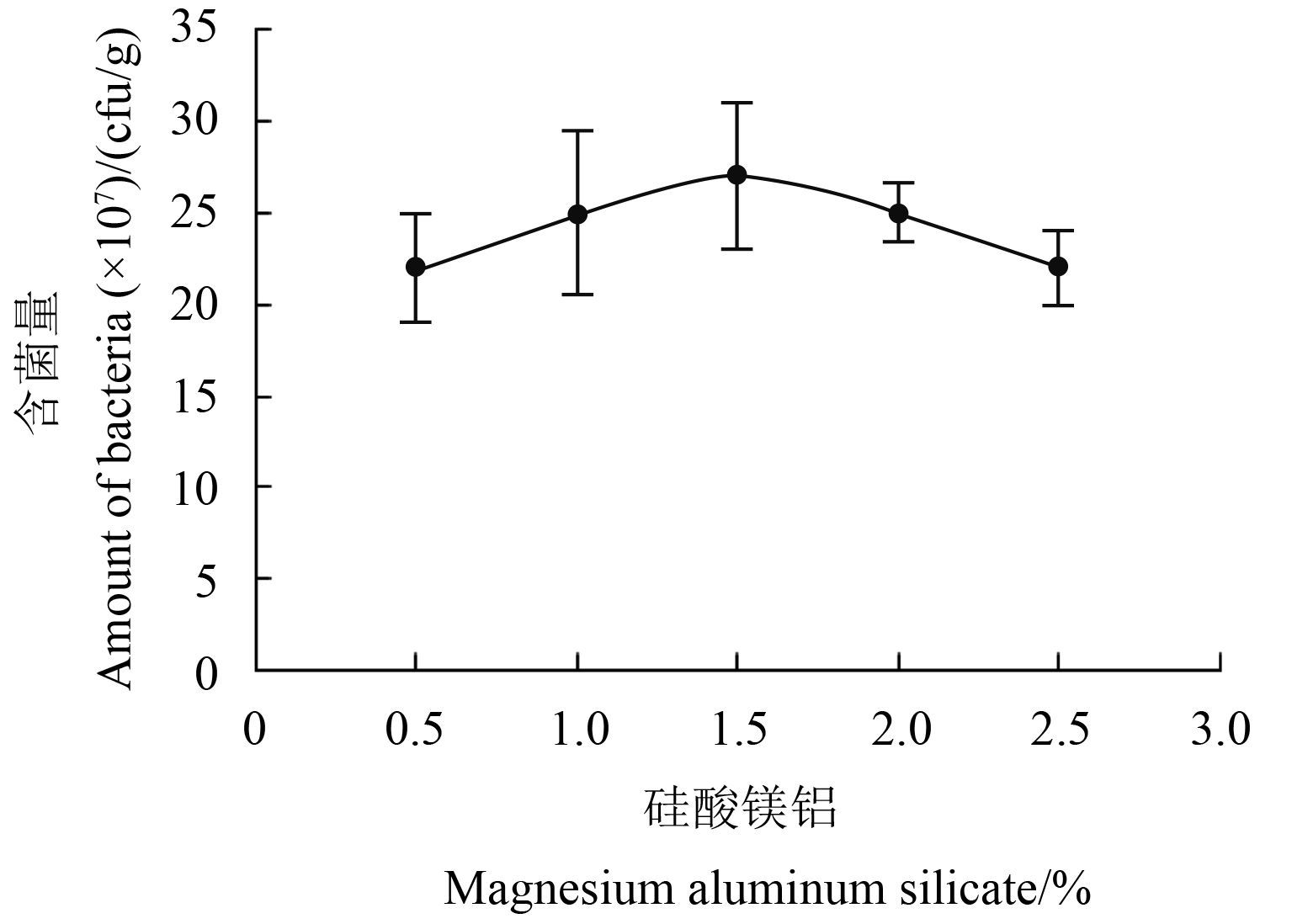
2 结果与分析 2.1 主要助剂配比单因子筛选结果粘结剂硅酸镁铝的单因子筛选结果见图 1。当其质量分数为 0.5%、1.0%、1.5%、2.0% 及 2.5% 时,制剂颗粒活菌含量分别为 2.20 × 108、2.50 × 108、2.70 × 108、2.50 × 108 和 2.20 × 108 cfu/g,即当硅酸镁铝质量分数为 1.0%、1.5% 和 2.0% 时,所制备水分散粒剂的活菌含量相对较高。
|
图 1 硅酸镁铝对 B1619 含菌量的影响 Fig. 1 Effects of magnesium aluminiumsilicate on the amount of bacteria in B1619 |
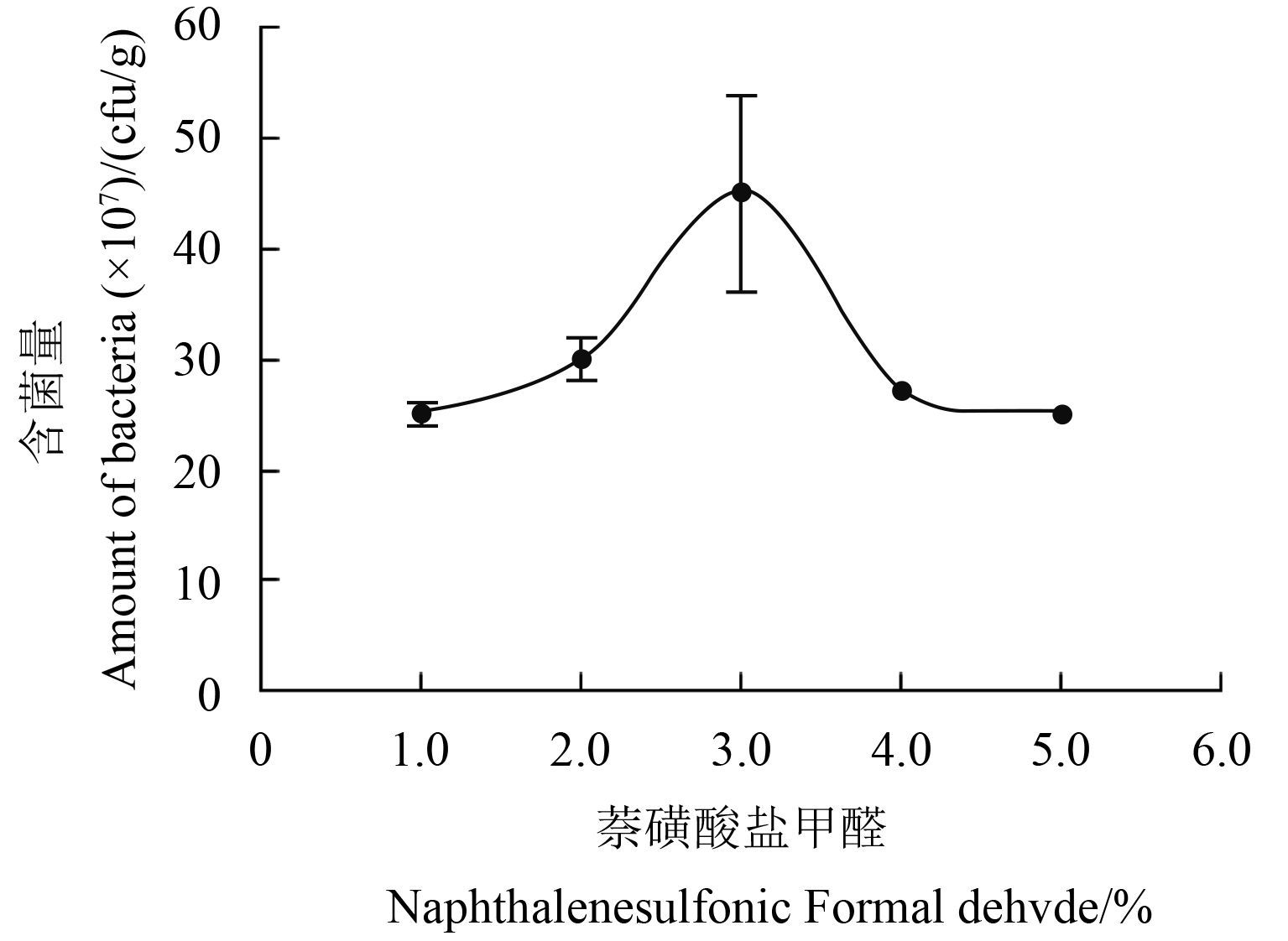
分散剂萘磺酸盐甲醛的单因子筛选结果见图 2。当其质量分数为 1.0%、2.0%、3.0%、4.0% 及 5.0% 时,制剂颗粒活菌含量分别为 2.50 × 108 、3.00 ×108、4.50 × 108、2.70 × 108 和 2.50 × 108 cfu/g,即当萘磺酸盐甲醛质量分数为 2.0%、3.0% 和 4.0% 时,所制备水分散粒剂的活菌含量相对较高。
|
图 2 萘磺酸盐甲醛对 B1619 含菌量的影响 Fig. 2 Effects of naphthylsulfonate formaldehyde on the amount of bacteria in B1619 |
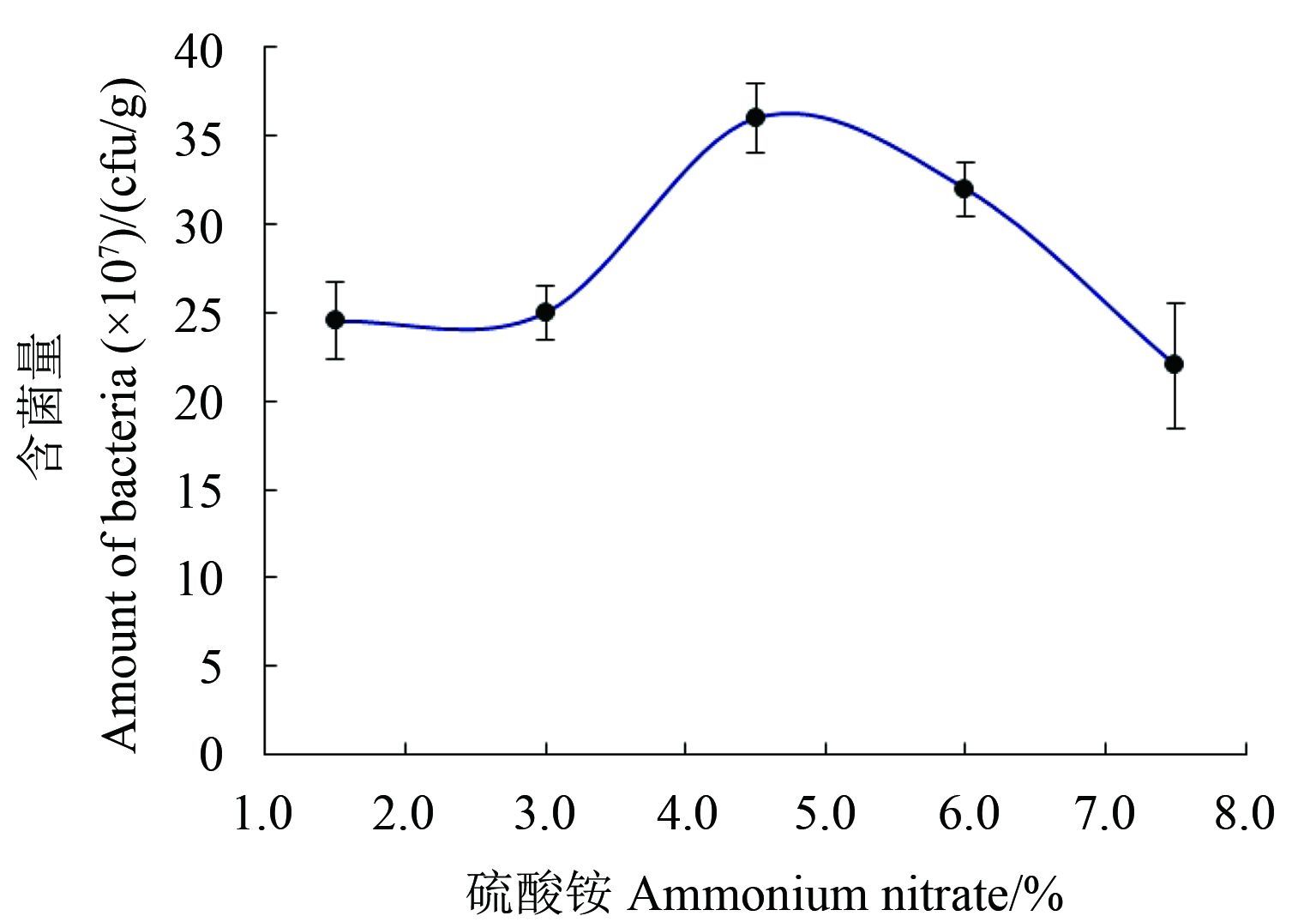
崩解剂硫酸铵的单因子筛选结果见图 3。当其质量分数为 1.5%、3.0%、4.5%、6.0% 和 7.5% 时,制剂颗粒活菌含量分别为 2.45 × 108、2.50 × 108、3.60 × 108、3.20 × 108 和 2.20 × 108 cfu/g,即当硫酸铵质量分数为 3.0%、4.5% 和 6.0% 时,所制备水分散粒剂的活菌含量相对较高。
|
图 3 硫酸铵对 B1619 含菌量的影响 Fig. 3 Effects of ammonium ulfate on the amount of bacteria in B1619 |
综合上述结果,最终选择硅酸镁铝质量分数为 1.0%、1.5%、2.0%,萘磺酸盐甲醛为 2.0%、3.0%、4.0%,硫酸铵为 3.0%、4.5%、6.0% 的 9 个处理进入正交试验。
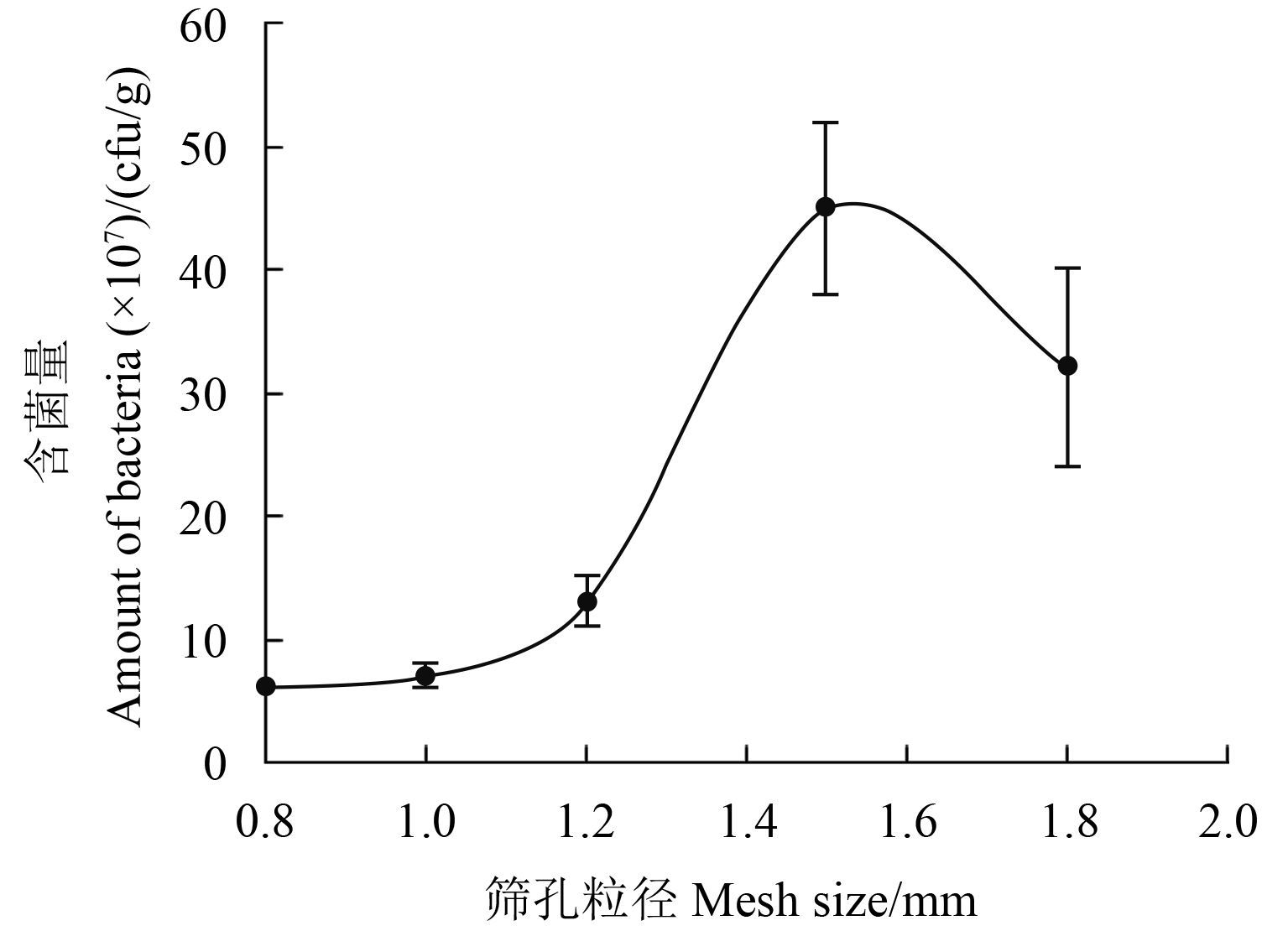
2.2 制备条件单因子筛选结果当筛孔粒径为 0.8、1.0、1.2、1.5 和 1.8 mm 时,制剂活菌含量分别为 6.00 × 107、7.00 × 107、1.30 × 108、4.50 × 108 和 3.20 × 108 cfu/g (图 4),即当筛孔粒径为 1.2、1.5 和 1.8 mm 时,所制备水分散粒剂颗粒的活菌含量相对较高。
|
图 4 筛孔粒径对 B1619 含菌量的影响 Fig. 4 Effects of mesh size on the amount of bacteria in B1619 |
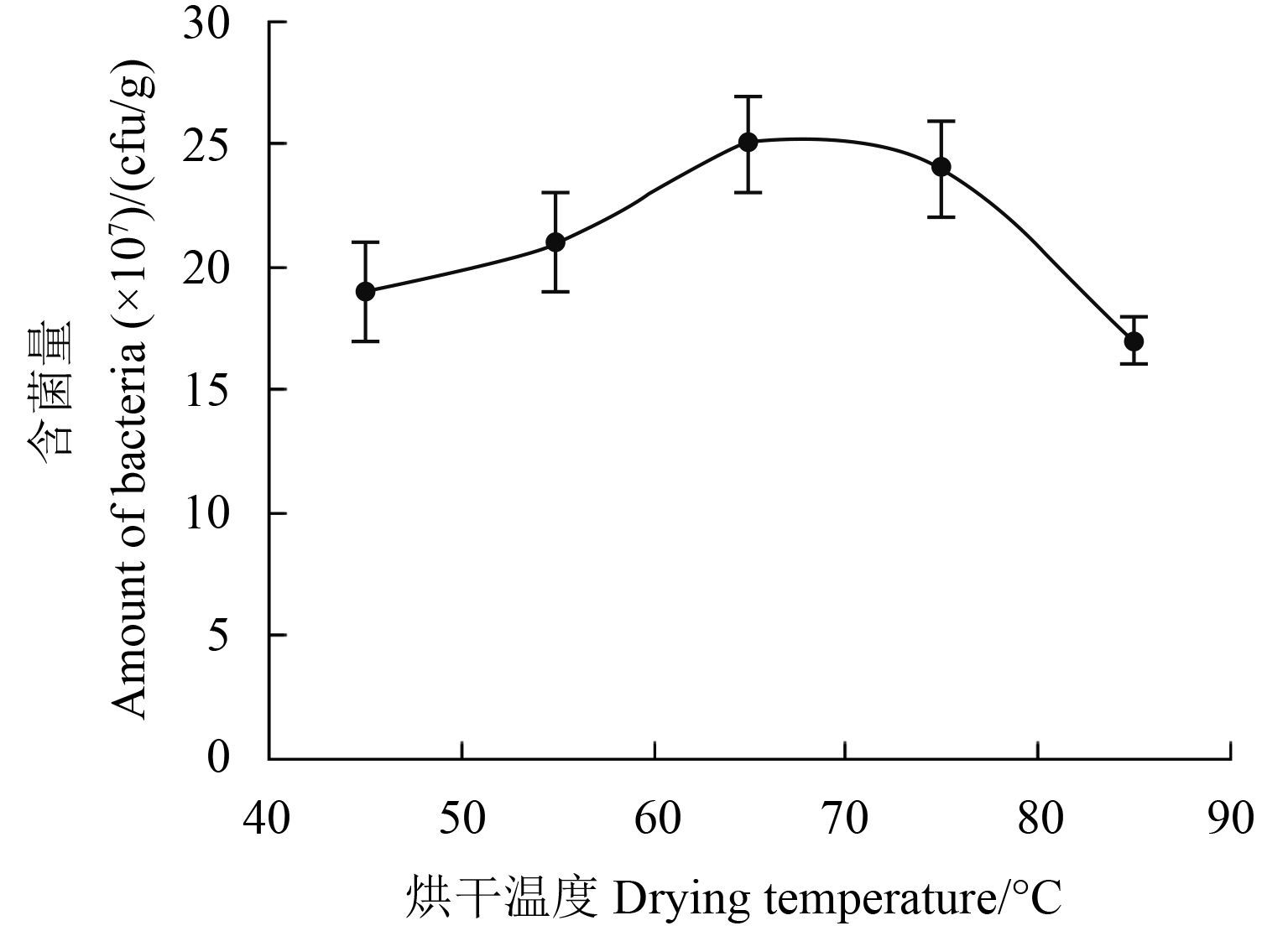
当烘干温度为 45、55、65、75 和 85 ℃ 时,制剂活菌含量分别为 1.90 × 108、2.10 × 108、2.50 × 108、2.40 × 108 和 1.70 × 108 cfu/g (图 5),即当烘干温度为 55、65 和 75 ℃ 时,所制备水分散粒剂颗粒的活菌含量较高。
|
图 5 烘干温度对 B1619 含菌量的影响 Fig. 5 Effects of drying temperature on the amount of bacteria in B1619 |
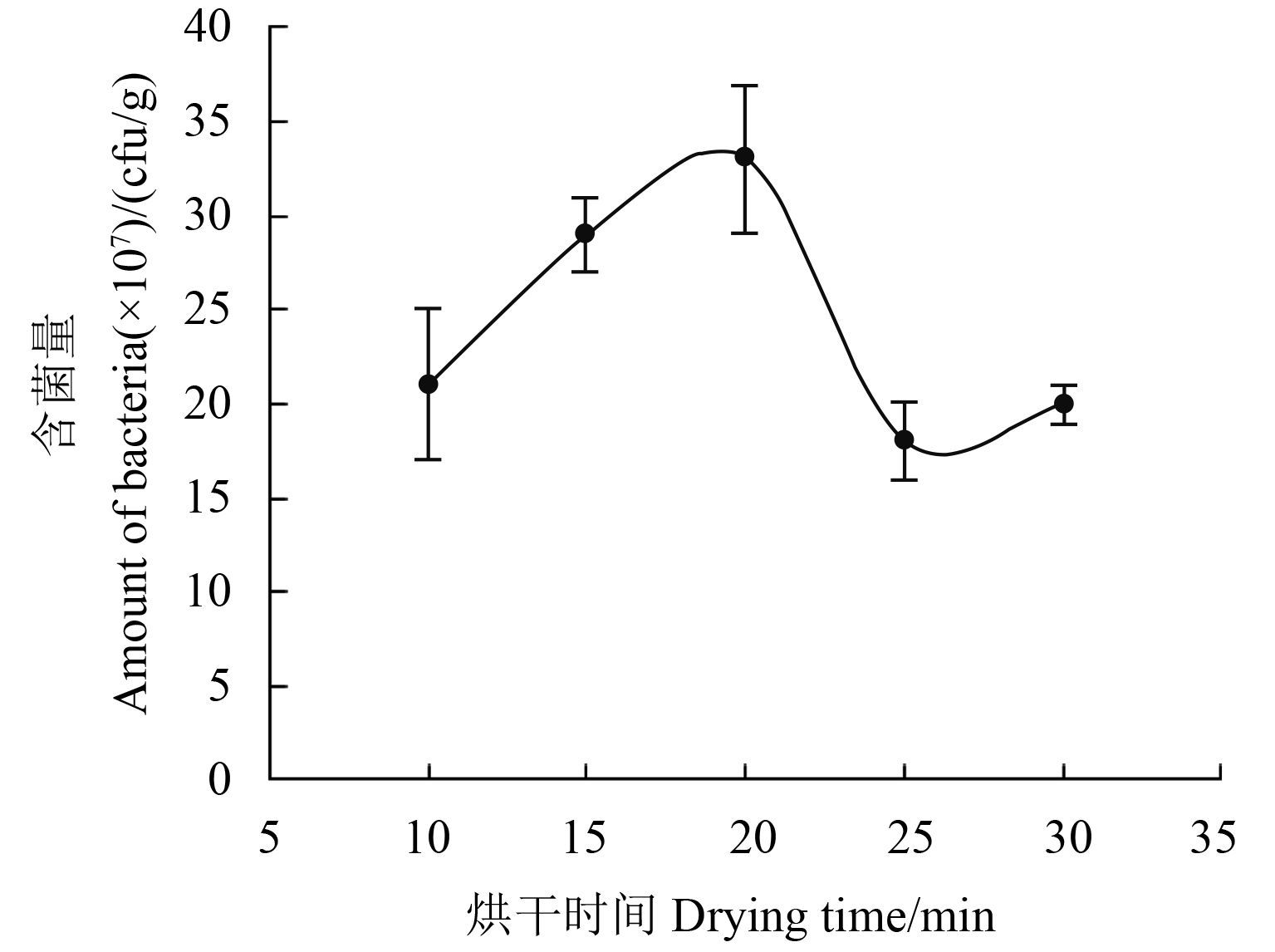
当烘干时间为 10、15、20、25 和 30 min 时,制剂活菌含量分别为 2.10 × 108、2.90 × 108、3.30 × 108、1.80 × 108 和 2.00 × 108 cfu/g (图 6),即当烘干时间为 10、15 和 20 min 时,所制备水分散粒剂颗粒的活菌含量较高。
|
图 6 烘干时间对 B1619 含菌量的影响 Fig. 6 Effects of drying time on the amount of bacteria in B1619 |
综上所述,最终选择筛孔粒径为 1.2、1.5、1.8 mm,烘干温度为 55、65、75 ℃,烘干时间为 10、15、20 min 的 9 个处理进入正交试验。
2.3 正交试验优化后的主要助剂配比及制备条件 2.3.1 主要助剂配比优化结果及分析主要助剂配比正交试验优化结果的极差评价 (直观分析) 见表 3。从中可知,各因子的最佳组合为 A1B2C2,即主要助剂最佳配比为 1.0% 的硅酸镁铝、3.0% 的萘磺酸盐甲醛和 4.5% 的硫酸铵。3 个因素的主次顺序为萘磺酸盐甲醛 (因素 B) > 硅酸镁铝 (因素 A) > 硫酸铵 (因素 C)。
|
|
表 3 主要助剂配比正交试验优化的极差评价结果 Table 3 The results of the range evaluation of the optimized ratio of main additives by orthogonal experiments |
主要助剂配比正交试验结果的方差评价见表 4。其中,因素 B 的 P 值 = 0.037 (< 0.05),即该因素对试验结果影响显著;因素 A 和 C 的 P 值 > 0.10,即因素 A 和 C 对试验结果影响不显著;各因素影响试验结果的主次顺序为萘磺酸盐甲醛 (因素 B) > 硅酸镁铝 (因素 A) > 硫酸铵 (因素 C)。此外,因素 C 的 F 值小于空白项,说明空白项中一定存在其他可影响试验结果的因素,且其作用要比 C 项明显,但由于两者的 F 值相差并不大,即该未知因素对试验结果的影响也不显著,故未进一步就该未知因素进行考察。
|
|
表 4 主要助剂配比正交试验优化的方差评价结果 Table 4 The results of the variance evaluation of the optimized ratio of main additives by orthogonal experiments |
根据表 3 的正交试验结果所得最佳组合为 A1B2C2,但从各因素总和 (K1、K2、K3) 结果分析,实际最佳组合应为 A3B2C2。为此,笔者对 A1B2C2 和 A3B2C2 组合进行了验证比较试验。结果表明:A1B2C2 组合的活菌数为 6.00 × 108 cfu/g,崩解时间 13 s,悬浮率为 96%,含水量为 2%;A3B2C2 组合的活菌数为 4.40 × 108 cfu/g,崩解时间为 17 s,悬浮率为 96%,含水量为 2%;因此本试验中各因素的最佳组合应为 A1B2C2。
按照方差分析的观点,只需针对有显著影响的因素选择其最佳水平,而其他对试验结果影响较小的因素则按实际需要选择适当的水平即可。据此得到的最佳组合为 A1B2C2,即最佳助剂配比为 1.0% 的硅酸镁铝、3.0% 的萘磺酸盐甲醛和 4.5% 的硫酸铵。该结论与直观分析法的相同。
2.3.2 颗粒制备条件优化结果及分析在使用初始助剂配方的情况下,颗粒制备条件正交试验优化的极差评价 (直观分析) 结果见表 5。从中可知,各条件最佳组合为 A2B2C3,即最佳颗粒制备条件为筛孔粒径 1.5 mm、烘干温度 65 ℃、烘干时间 20 min。3 个因素的主次顺序依次为:粒径 (因素 A) > 烘干温度 (因素 B) > 烘干时间 (因素 C)。
|
|
表 5 颗粒制备条件正交试验优化的极差评价结果 Table 5 The results of the range evaluation of the optimized particle preparation conditions by orthogonal experiments |
颗粒制备条件优化的方差评价结果见表 6。其中,因素 A 的 P 值 = 0.025 (< 0.05),即该因素对试验结果影响显著;因素 B 和 C 的 P 值 > 0.10,即因素 B 和 C 对试验结果影响不显著;各因素影响试验结果的主次顺序为筛孔粒径 (因素 A) > 烘干温度 (因素 B) > 烘干时间 (因素 C)。同 2.3.1 节,因素 C 的 F 值小于误差项,但两者相差并不大,故未进一步考察误差项中未知因素对试验结果的影响。
|
|
表 6 颗粒制备条件正交试验优化的方差评价结果 Table 6 The results of the variance evaluation of the optimized particle preparation conditions by orthogonal experiment |
同样,按方差分析观点得到的本试验中各因素的最佳组合为 A2B2C3,即最佳颗粒制备条件为:筛孔粒径 1.5 mm、烘干温度 65 ℃、烘干时间 20 min。结论与直观分析法的相同。
2.4 验证试验结果采用初始加工工艺 (助剂配方 + 制备条件) 生产的水分散粒剂颗粒的含菌量为 2.50 × 108 cfu/g。助剂配比优化后所得颗粒的含菌量为 6.30 × 108 cfu/g,优化率为 152.0%;制备条件优化后的含菌量为 6.50 × 108 cfu/g,优化率为 160.0%;加工工艺 (助剂配比 + 制备条件) 优化后所生产水分散粒剂颗粒的含菌量为 1.05 × 109 cfu/g,优化率为 320.0%。优化效果十分显著。
采用优化后加工工艺生产的 B1619 水分散粒剂样品的崩解时间为 13 s,悬浮率为 96%,含水量为 2%,各项技术指标均符合生物农药产品标准[12]要求。
3 结论与讨论目前生产上主要采取“化学农药处理土壤 + 夏季闷棚”的措施防治设施蔬菜土传病害[13],但效果并不理想,且大量使用化学药剂易导致蔬菜品质下降及残留量超标等问题,对人类健康具有潜在危害,因此推广应用生物药剂防控设施蔬菜土传病害已成为现代农业的发展方向。本研究中的 1.2 亿活芽孢/g 解淀粉芽孢杆菌 B1619 水分散粒剂由江苏省农科院植保所和江苏省苏科农化有限责任公司合作研发,田间示范试验结果表明,其对设施蔬菜土传病害根结线虫病具有良好的防控效果[14],并且对设施蔬菜植株有一定的促生长作用[15],具有很好的推广应用前景。
正交试验设计 (orthogonal experimental design) 是一种高效、快速、经济的试验设计方法,已在众多研究领域得到广泛应用。刘杰等[16]采用正交试验优化茁霉多糖发酵工艺,提高了其发酵产量;冉淦侨等[17]用正交试验优化青枯病工程菌 Hrp-菌株的发酵培养基配方,提高了发酵液的含菌量;李北兴等[18]用正交试验优化噻虫胺悬浮剂配方,提高了制剂的物理稳定性。由于生物杀菌剂 B1619 水分散粒剂加工工艺涉及的因素较多,因此我们根据已有的经验,首先进行了单因子水平筛选,然后再进入正交试验。结果表明,单因子水平筛选和正交试验相结合是一种很好的试验设计组合,能在较短的时间内确定加工工艺的关键参数。本研究优化后的加工工艺为:主要助剂配比 (质量分数) 为 1.0% 硅酸镁铝、3.0% 萘磺酸盐甲醛和 4.5% 硫酸铵,颗粒制备条件为筛孔粒径 1.5 mm、烘干温度 65 ℃、烘干时间 20 min。验证结果表明,采用优化后加工工艺生产的 B1619 水分散粒剂颗粒的含菌量为 1.05 × 109 cfu/g,与初始加工工艺下生产的 B1619 水分散粒剂颗粒的含菌量 2.50 × 108 cfu/g 相比,优化率高达 320.0%,优化效果十分显著。但该结果还有待于在产业化生产过程中进一步加以验证。
| [1] |
王亚坤, 王慧军. 我国设施蔬菜生产效率研究 [J]. 中国农业科技导报, 2015 (2)
:159–166.
WANG Y K, WANG H J. Studies on protected vegetable production efficiency in China [J]. J Agric Sci Technol, 2015 (2) :159–166 . |
| [2] |
刘琴, 王艳, 徐健, 等. 枯草芽杆菌Bs-1013的抑菌活性及其包衣对黄瓜发芽生长的影响 [J]. 江苏农业科学, 2013,41 (11)
:117–119.
LIU Q, WANG Y, XU J, et al. Antibiotic activity of Bacillus subtilis Bs-1013 and effect of its coating agent on seed germination and growth of cucumber [J]. Jiangsu Agric Sci, 2013, 41 (11) :117–119 . |
| [3] |
彭双, 杨茹, 闫淑珍, 等. 杀线虫植物内生细菌和根际放线菌对根结线虫的防效 [J]. 植物保护学报, 2012,39 (1)
:63–69.
PENG S, YANG R, YAN S Z, et al. Control effect of the antinematode endophytic bacteria and rhizosphere actinomycetes to root-knot nematodes of tomato plant [J]. Acta Phytophyl Sinica Contents, 2012, 39 (1) :63–69 . |
| [4] |
夏彦飞.拮抗植物寄生线虫的细菌菌株筛选及其杀线虫相关基因的鉴定[D].南京:南京农业大学,2010:1.
XIA Y F.Screening of bacteria antagonistic against plant-parasitic nematodes and identification of the nematicidal-related genes[D].Nanjing:Nanjing Agricultural University,2010:1. |
| [5] |
肖同建.Bacillus cereus X5的杀线活性及其生物有机肥对南方根结线虫的防治作用研究[D].南京:南京农业大学,2011:1.
XIAO T J.Nematocidal activity of Bacillus cereus X5 and its bio-organic fertilizer control meloidogyne incognita[D].Nanjing:Nanjing Agricultural University,2011:1. |
| [6] | VELUSAMY P, IMMANUEL J E, GNANAMANICKAM S S. Rhizosphere bacteria for biocontrol of bacterial blight and growth promotion of rice [J]. Rice Sci, 2013, 20 (5) :356–362 . doi:10.1016/S1672-6308(13)60143-2 |
| [7] |
陈志谊, 刘邮洲, 乔俊卿, 等. 利用芽孢杆菌生防菌防控土传病害引起的设施蔬菜连作障碍 [J]. 中国蔬菜, 2012,1 (15)
:29–30.
CHEN Z Y, LIU Y Z, QIAO J Q, et al. Prevention and control protected vegetable continuous cropping obstacle caused by soil-borne disease using biocontrol bacteria bacillus [J]. Chin Veget, 2012, 1 (15) :29–30 . |
| [8] |
刘邮洲, 陈志谊, 梁雪杰, 等. 番茄枯萎病和青枯病拮抗细菌的筛选、评价与鉴定 [J]. 中国生物防治学报, 2012,28 (1)
:101–108.
LIU Y Z, CHEN Z Y, LIANG X J, et al. Screening,evaluation and identification of antagonistic bacteria against Fusarium oxysporum f.sp.lycopersici and Ralstonia solanacearum [J]. Chin J Biol Control, 2012, 28 (1) :101–108 . |
| [9] |
乔俊卿, 刘邮洲, 夏彦飞, 等. 生防菌B1619在番茄根部的定殖及对根际微生态的影响 [J]. 植物保护学报, 2013,40 (6)
:507–511.
QIAO J Q, LIU Y Z, XIA Y F, et al. Root colonization by Bacillus amyloliquefaciens B1619 and its impact on the microbial community of tomato rhizosphere [J]. Acta Phytophyl Sinica, 2013, 40 (6) :507–511 . |
| [10] |
方中达.
植病研究方法[M].3版. 北京: 中国农业出版社, 1998 : 191 .
FANG Z D. Research methods of plant disease[M].3rd. Beijing: China Agriculture Press, 1998 : 191 . |
| [11] |
明亮, 刘程程, 杨晓云, 等. 生物杀菌剂解淀粉芽孢杆菌B1619水分散粒剂配方及助剂筛选 [J]. 中国生物防治学报, 2015,31 (4)
:529–535.
MING L, LIU C C, YANG X Y, et al. Screening on formula and auxiliaries for biological germicide Bacillus amyloliquefaciens B1619 [J]. Chin J Biol Control, 2015, 31 (4) :529–535 . |
| [12] |
王以燕, 袁善奎, 李富根. 微生物农药登记管理 [J]. 农药, 2009,48 (2)
:79–81.
WANG Y Y, YUAN S K, LI F G. Microbial pesticide registration and management [J]. Agrochemicals, 2009, 48 (2) :79–81 . |
| [13] |
王治林, 朱剑花, 岳菊, 等. 茄果类蔬菜枯萎病及其综合防治 [J]. 江苏农业科学, 2011 (6)
:168–171.
WANG Z L, ZHU J H, YUE J, et al. Integrated control of solanaceae vegetable fusarium wilt [J]. Jiangsu Agric Sci, 2011 (6) :168–171 . |
| [14] |
蒋盼盼,陈志谊,陆凡.解淀粉芽孢杆菌B1619对设施蔬菜根结线虫病的防治效果[C]//病虫害绿色防控与农产品质量安全——中国植物保护学会2015年学术年会.北京:中国植物保护学会,2015.
JIANG P P,CHEN Z Y,LU F.Control effect of Bacillus amyloliquefaciens B1619 to protected vegetable[C]//2015 Annual Conference of China Society of Plant Protection.Beijing:China Society of Plant Protection,2015. |
| [15] |
杨晓云, 陈志谊, 蒋盼盼, 等. 解淀粉芽孢杆菌B1619对番茄的促生作用 [J]. 中国生物防治学报, 2016,32 (3)
:349–356.
YANG X Y, CHEN Z Y, JIANG P P, et al. Growth-promotion effect of Bacillus amyloliquefaciens B1619 on tomato plant [J]. Chin J Biol Control, 2016, 32 (3) :349–356 . |
| [16] |
刘杰, 苏安祥, 冯印, 等. 正交实验设计优化茁霉多糖发酵工艺 [J]. 食品科技, 2011,36 (10)
:2–6.
LIU J, SU A X, FENG Y, et al. Optimization of fermentation process for production of pullulan from Aureobasidium pullulans by orthogonal experimental design [J]. Food Sci Technol, 2011, 36 (10) :2–6 . |
| [17] |
冉淦侨, 朱昌雄, 田云龙, 等. 防治青枯病工程菌Hrp-菌株的发酵培养基配方优化 [J]. 中国生物防治, 2010,26 (1)
:73–79.
RAN G Q, ZHU C X, TIAN Y L, et al. Optimization of carbon and nitrogen sources for fermentation of Hrp-mutant of Ralstonia solanacearum as biocontrol agent of bacterial wilt [J]. Chin J Biol Control, 2010, 26 (1) :73–79 . |
| [18] |
李北兴, 王伟昌, 张大侠, 等. 正交设计和均匀设计在优化噻虫胺悬浮剂物理稳定性上的应用 [J]. 中国农业科学, 2015,48 (2)
:280–292.
LI B X, WANG W C, ZHANG D X, et al. Application of orthogonal design and uniform design in physical stability promotion of clothianidin suspension concentrate [J]. Sci Agric Sinica, 2015, 48 (2) :280–292 . |
 2016, Vol. 18
2016, Vol. 18


