2. 西北农林科技大学 植物保护学院, 陕西 杨凌 712100
2. College of Plant Protection, Northwest A & F University, Yangling 712100, Shaanxi Province, China
由植物病原真菌葡萄灰霉病菌 Botrytis cinerea Pers. 引起的葡萄灰霉病是全世界葡萄生产中危害最为严重的病害之一[1],可导致成熟期果实腐烂或裂果,完全丧失商品价值,严重发生时可造成高达50%左右的产量损失,对葡萄产业影响极大[2-3]。随着设施栽培葡萄的兴起,大棚内温、湿度小气候环境十分有利于葡萄灰霉病菌的侵染与为害,使得灰霉病逐渐发展成为设施葡萄生产的主要病害之一。
B. cinerea 是一种强腐生性致病菌,寄主范围广,不同寄主植物间的 B. cinerea 可相互侵染致病,在作物种质资源中尚未发现完全抗病的材料,也很难培育出抗病品种。因此目前对灰霉病仍以化学防治为主,辅以生物防治和生态防治。常用杀菌剂包括苯并咪唑类、二甲酰亚胺类及甲氧基丙烯酸酯类等[4-5],但由于 B. cinerea 群体结构多样,繁殖速度快,菌株变异速率快且突变菌系田间适应性强等原因,病原菌对上述杀菌剂产生了不同程度的抗药性,某些地区农药防效明显下降,增加了灰霉病防治的难度[6-9]。同时,化学农药的长期使用也带来了农药残留和环境污染等问题,因此采用低毒、低残留、不污染环境的拮抗微生物防治葡萄灰霉病成为了近年的研究热点。
植物内生枯草芽孢杆菌 Em7 菌株为本课题组前期从小麦根部分离获得[10]。研究发现,Em7 对多种植物病原真菌具有抑制作用,其中对苹果褐腐病菌 Monilinia fructigena、梨腐烂病菌 Valsa ambiens、小麦纹枯病菌 Rhizoctonia cerealis、油菜菌核病菌 Sclerotinia sclerotiorum、玉米弯孢病菌 Curvularia lunata、葡萄白腐病菌 Coniothyrium diplodiella 和胶孢炭疽菌 Colletotrichum gloeosporioides 等有良好的抑制效果,也可以有效抑制黄瓜霜霉病菌游动孢子囊的萌发[11]。通过大田和温室防效试验发现,Em7 能够有效降低油菜菌核病的发病率和严重程度,田间防效为 50%~70%[12]。
本研究通过室内抑菌试验以及电镜技术测定了 Em7 菌液对葡萄灰霉病菌的抑制效果,从细胞学角度揭示了其抑制葡萄灰霉病菌的超微结构变化特征,并通过孢子萌发和室内离体果实接种试验测定了其生防效果,为将其运用于葡萄灰霉病防治提供依据。
1 材料与方法 1.1 供试材料供试葡萄品种为红地球 Vitis vinifera cv. Red Globe,采自中国陕西省杨凌区。
供试植物内生枯草芽孢杆菌 Em7 菌株,于–80 ℃下保存在含 25% 甘油的 NBY 培养基 (蛋白胨 5 g,牛肉粉 3 g,酵母粉 3 g,蒸馏水 1 000 mL) 中。试验时在 LB (酵母粉 5 g,蛋白胨 10 g,氯化钠 10 g,蒸馏水 1 000 mL;固体加入 10~15 g 琼脂粉) 培养平板上活化,用接种环挑取新鲜单菌落接入含有 100 mL LB 培养液的 250 mL 三角瓶中,于 28 ℃、150 r/min 条件下振荡培养 48 h,于 4 ℃下保存,备用。
葡萄灰霉病菌 B. cinerea 采自河南省新乡县,按常规方法在 PDA 培养基 (马铃薯 200 g,葡萄糖 20 g,琼脂粉 10~15 g,蒸馏水 1 000 mL) 上繁殖培养并于 4 ℃ 斜面保存。
1.2 Em7 菌株的拮抗效果观察 1.2.1 Em7 菌液对葡萄灰霉病菌菌丝生长的抑制作用采用杯碟法[13]。在 PDA 平板距中心 3 cm 的对称位置接种 2 块直径为 5 mm 的菌饼,平板中心放置 1 个内径为 6 mm 的牛津杯,杯内分别加入 200 μL 菌液原液及其 10、50、100 倍稀释液,每处理 3 次重复,置于 25 ℃ 恒温箱内培养;另设灭菌 LB 液体培养基为对照。培养 5 d 后,测定抑菌圈直径。
1.2.2 Em7 菌液对葡萄灰霉病菌分生孢子萌发的影响参照崔志峰等的方法[14]配制葡萄灰霉病菌分生孢子悬浮液。取 50 μL 孢子悬浮液滴加于 1.5% 水琼脂块上,涂布均匀,再分别滴加 50 μL Em7 菌液及其 10、50、100 倍稀释液,每处理 3 次重复,以滴加灭菌 LB 液体培养基为对照。涂布均匀后置于 25 ℃ 下暗培养 6、12 和 24 h。于 6 h 时在 40 × 物镜 (LEICA DM LS2) 下镜检,一个视野镜检孢子 60 个左右,统计萌发孢子数,分别按公式 (1) 和 (2) 计算萌发率和抑制率,并观察 12 和 24 h 时孢子的萌发情况。

|
(1) |
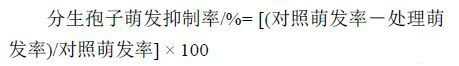
|
(2) |
采用杯碟法培养 5 d 后,在抑菌圈最前端边缘处取样。参照康振生等[15]的方法进行扫描电镜 (Hitachi S4800) 和透射电镜 (Hitachi HT7700) 制样。观察病原菌菌丝形态以及亚细胞结构的变化。
1.3 Em7 室内离体果实接种试验选取大小、成熟度一致的葡萄果实,分别在 Em7 菌液及其 10、50、100 倍稀释液中充分浸润,晾干表面水分后刺伤直径为 4 mm 的圆形伤口,接种直径为 5 mm 的葡萄灰霉病菌菌饼,以浸泡于灭菌 LB 液体培养基的处理作对照。每处理 15 粒果实,3 次重复。置于直径为 12 cm 的玻璃培养皿中,于 27 ℃恒温、12 h 光/12 h 暗交替、保湿培养 7 d 后观察病部大小。葡萄灰霉病分级标准为:0 级,全果无病;1 级,25% 以下果粒腐烂;2 级,25%~50% 果粒腐烂;3 级,50%~75% 果粒腐烂;4 级,75% 以上果粒腐烂,按公式 (3) 和 (4) 计算病情指数和相对防效[16]。

|
(3) |

|
(4) |
利用 Excel 2013 软件进行平均值和标准偏差的计算,通过 SPSS 16.0 进行数据的差异显著性分析。
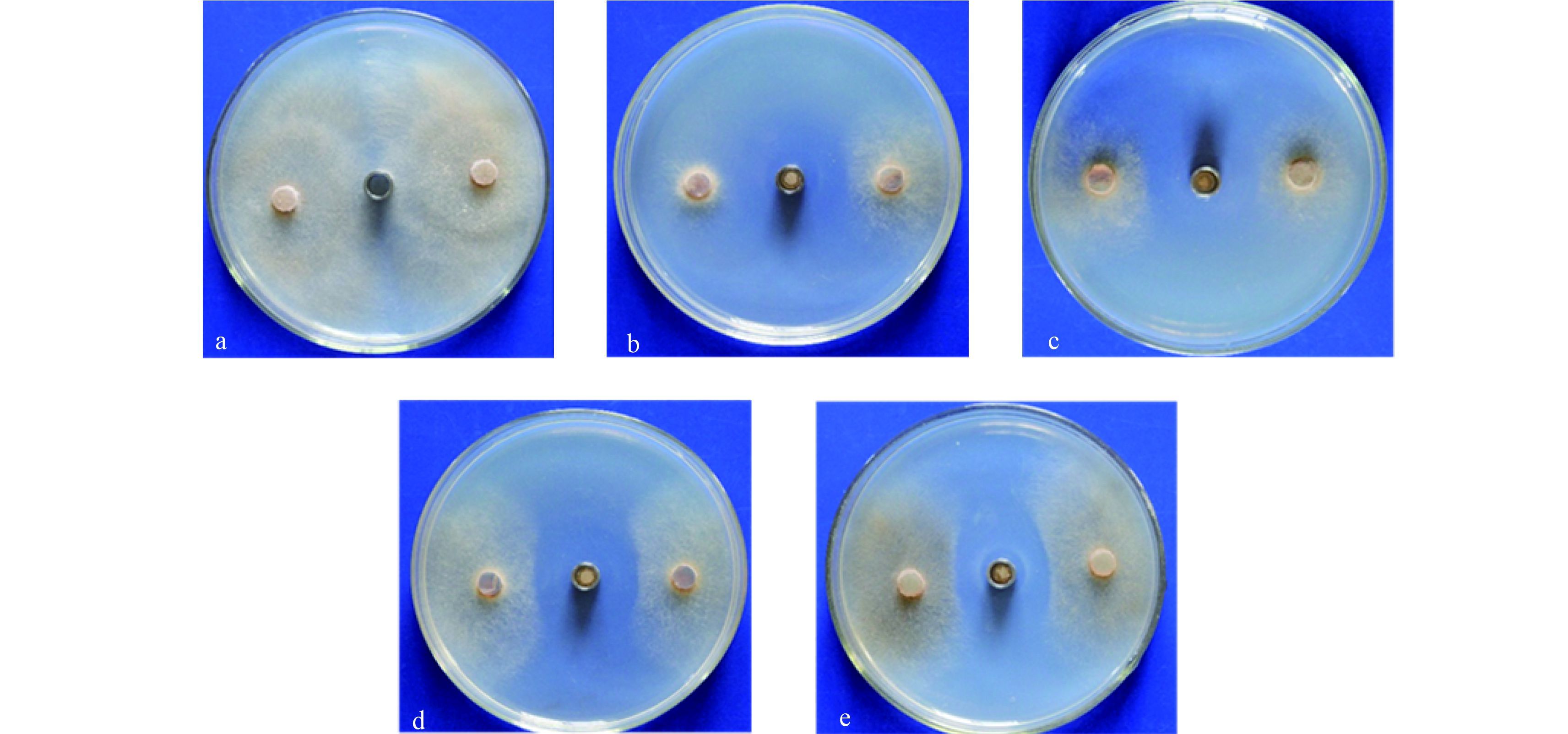
2 结果与分析 2.1 Em7 菌液对葡萄灰霉病菌菌丝生长的影响结果 (图 1) 表明:对照葡萄灰霉病菌正常生长,而 Em7 菌液处理过的菌株菌丝生长明显受到抑制,抑菌圈直径达到 2.81 cm;且随 Em7 菌液稀释倍数增加抑菌效果逐渐减弱,但与原液处理相比抑菌圈大小无明显差异,而与对照相比则差异显著。
|
a:灭菌 LB 液体培养基处理;b~e:Em7 菌液不同稀释浓度处理 (b. 原液;c. 10 倍稀释液;d. 50 倍稀释液;e. 100 倍稀释液)。 a: Treated with sterilized LB liquid culture medium; b-e: Treated with different concentrations of gradients of Em7 bacteria solution (b. Stock solution; c. 10 times dilution; d. 50 times dilution; e. 100 times dilution) 图 1 Em7 菌液对葡萄灰霉病菌的抑制作用 Fig. 1 The inhibition of Em7 bacteria solution against B. cinerea |
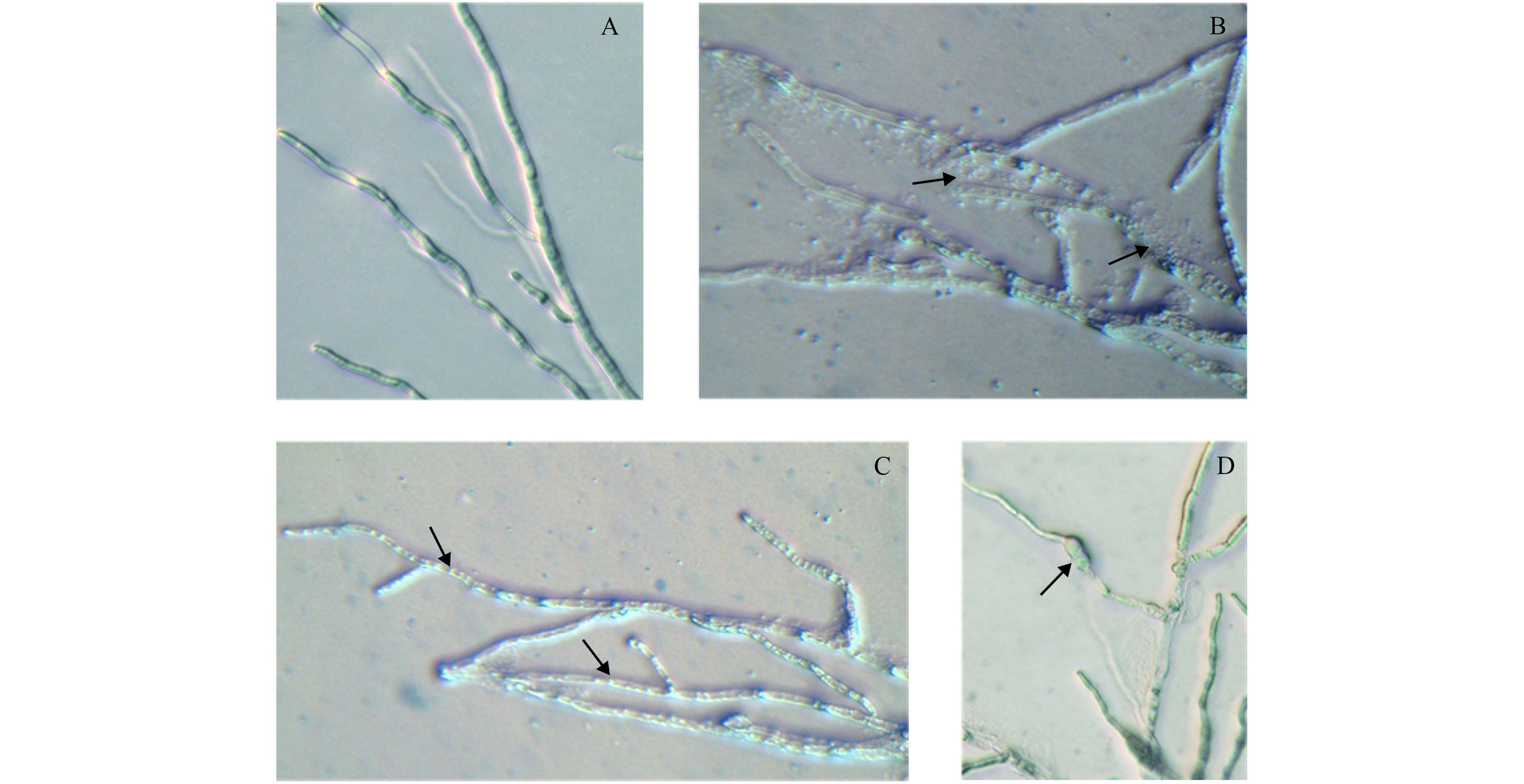
显微观察 (图 2) 发现:与对照相比,经 Em7 菌液处理后,葡萄灰霉病菌菌丝生长异常,表现为原生质体渗漏、原生质囊泡化或颗粒化以及新生菌丝局部形成节状膨大。
|
A:正常生长菌丝;B:原生质体泄露(箭头);C:原生质体原生质囊泡化或颗粒化;D: 新生菌丝局部形成节状膨大(箭头)。标尺 = 10 μm。 A: Normal hyphae; B: Leakage of protoplast (arrow); C: Protoplast were destroyed, and formed vesicles or granulation (arrow); D: New hyphae formed local intumescentia gangliformis (arrow). Bar = 10 μm. 图 2 Em7 菌液处理后葡萄灰霉病菌菌丝生长情况 Fig. 2 The growth of the mycelium of B. cinerea treated with Em7 bacteria solution |
2.2 Em7 菌液对葡萄灰霉病菌孢子萌发的影响
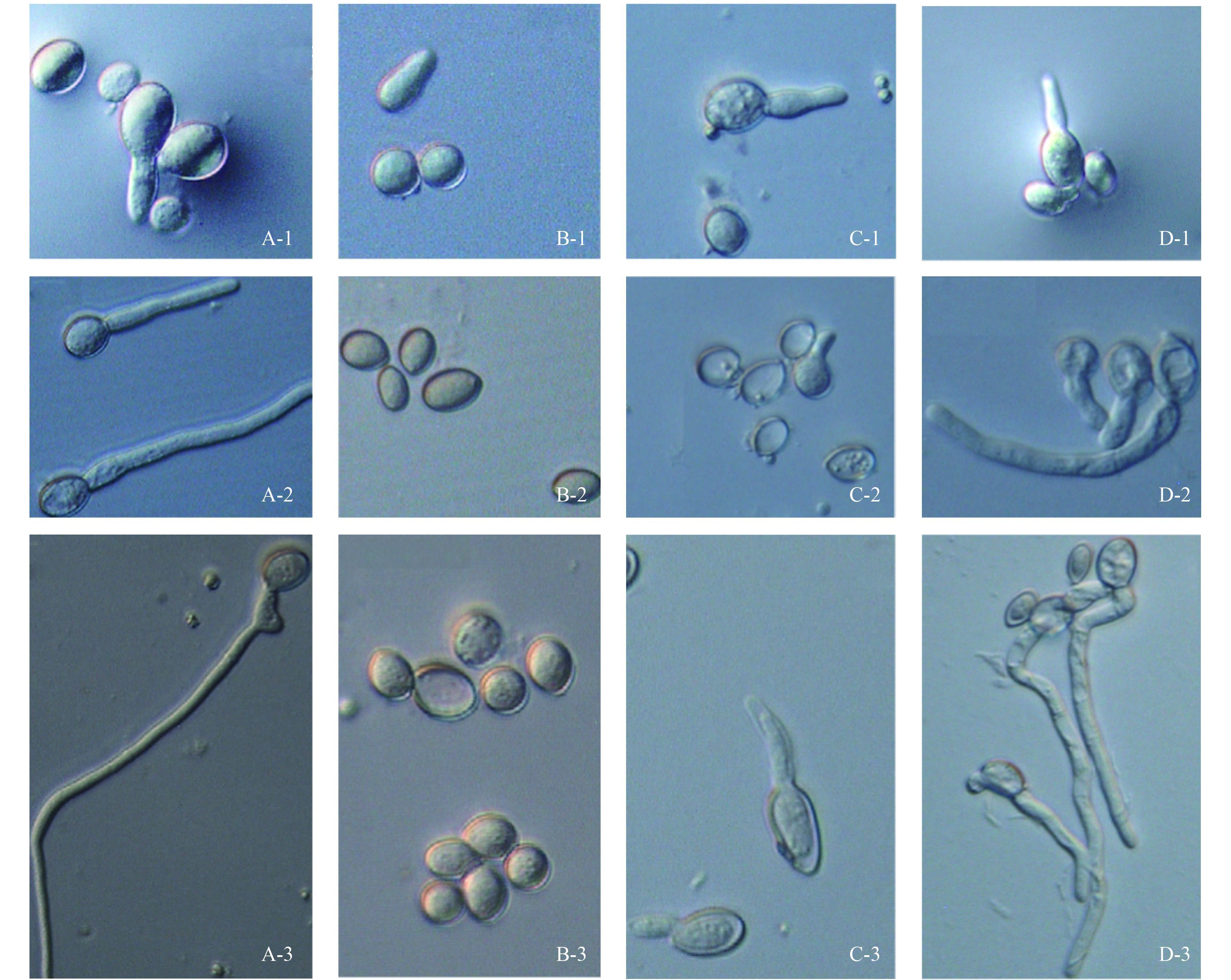
分生孢子萌发试验结果 (图 3) 表明:对照葡萄灰霉病菌分生孢子能正常萌发,而经 Em7 菌液及不同倍数稀释液处理过的葡萄灰霉病菌分生孢子萌发异常,表现为不萌发或异常萌发,异常萌发的分生孢子出现原生质体外漏、质壁分离以及皱缩现象。
|
1~3:观察时间 (1 = 6 h; 2 = 12 h; 3 = 24 h)。A:灭菌 LB 液体培养基处理;B~D:Em7 菌液不同稀释浓度处理 (B. 原液;C. 10 倍稀释液;D. 50 倍稀
释液;E. 100 倍稀释液)。标尺 = 10 μm。 1-3:The time of observation (1 = 6 h; 2 = 12 h; 3 = 24 h). A: Treated with sterilized LB liquid culture medium; B-D: Treated with Em7 bacteria solutions at different concentrations (B. Stock solution; C. 10 times dilution; D. 50 times dilution). Bar = 10 μm. 图 3 Em7 菌液处理后葡萄灰霉病菌分生孢子萌发情况 Fig. 3 The germination of conidia of B. cinerea after treated with Em7 bacteria solution |
经 Em7 菌液处理后,葡萄灰霉病菌分生孢子萌发率为 10.34%,萌发抑制率为 88.65% (表 1)。Em7 菌液 10、50、100 倍稀释液处理组分生孢子萌发率明显高于 Em7 原液处理,其中 50 和 100 倍稀释液处理对孢子萌发抑制效果最差。各处理与对照间差异显著。
|
|
表 1 Em7 菌液处理后葡萄灰霉病菌分生孢子萌发率以及萌发抑制率 Table 1 The germination rate and inhibition rate for germination of conidia of B. cinerea after treated with Em7 bacteria solution |
2.3 Em7 菌液对菌丝形态和结构的影响 2.3.1 Em7 菌液对菌丝形态的影响
扫描电镜观察发现,对照葡萄灰霉病菌菌丝纤细,粗细均匀一致,线条流畅,菌丝表面光滑饱满,伸展良好,分枝较少 (图 4-A)。经 Em7 菌液处理后菌丝形态生长异常,畸形明显,表现为菌丝局部膨大成球型(图 4-B),表面皱缩凹陷,菌丝顶端膨大 (图 4-C),以及菌丝塌陷和破裂 (图 4-D)。
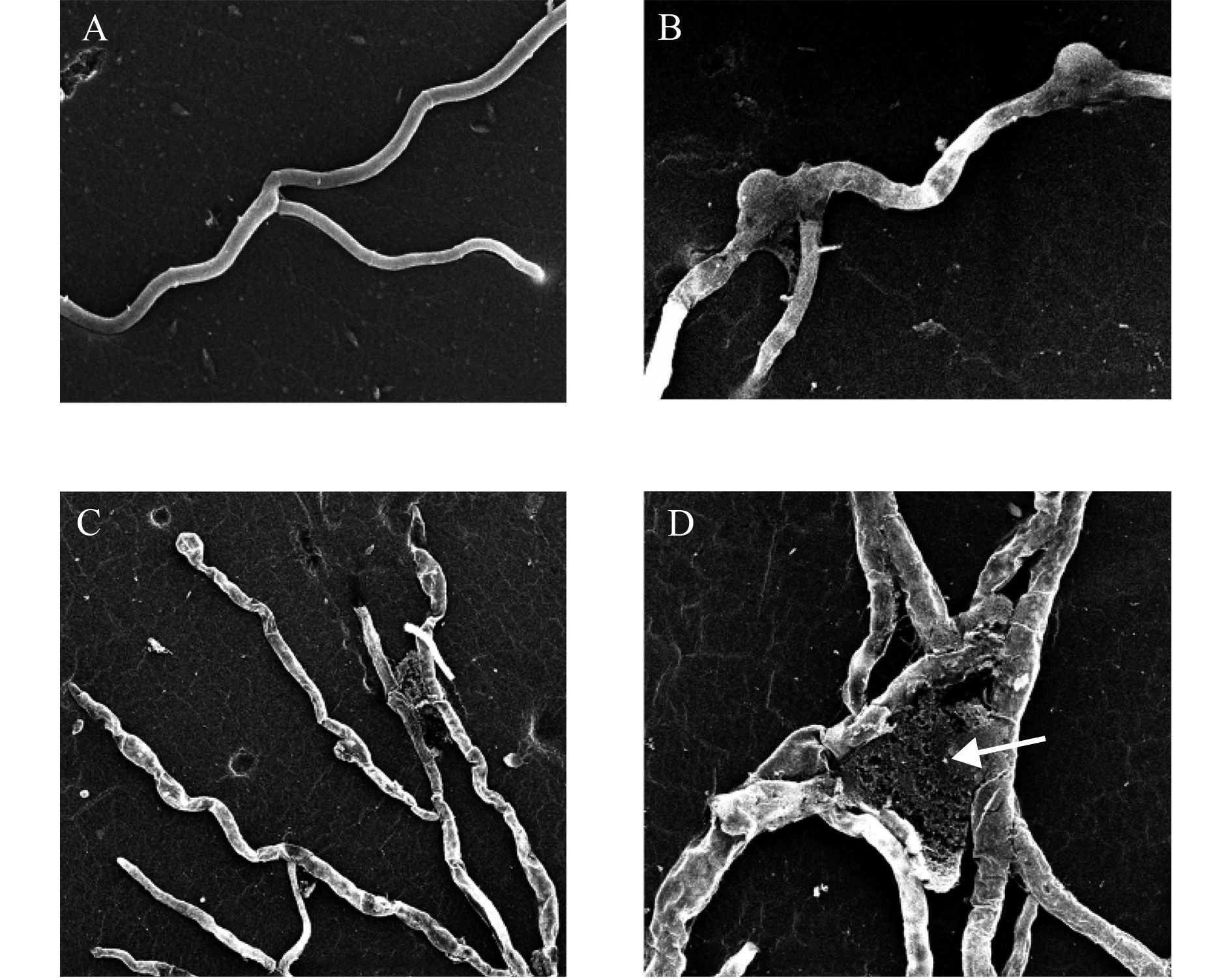
|
A:正常菌丝,细长光滑,标尺 = 50 μm;B~D: 经过 Em7 菌液处理后,菌丝局部膨大 (B. Bar = 20 μm),表面皱缩凹陷,菌丝顶端膨大(C. Bar = 50 μm),菌丝破裂,原生质体泄露 (D 中箭头所示,Bar =20 μm)。培养 5 d 后取样。 A: The normal mycelium, slender and smooth. Bar = 50 μm; B-D: The malformed mycelium treated with Em7, appeared irregularly local enlargement (B. Bar = 20 μm), shrinkage and depression, enlargement of hyphal tip (C. Bar = 50 μm), and leakage of cytoplasm from ruptured hyphae (arrow D. Bar = 20 μm). Sampled collected 5 d after culture 图 4 正常葡萄灰霉病菌菌丝和经 Em7 菌液处理后菌丝的扫描电镜图 Fig. 4 The SEM images of normal mycelium and mycelium of B. cinerea treated with Em7 bacteria solution |
2.3.2 Em7 菌液对菌丝结构的影响
透射电镜观察发现,对照菌丝体内原生质稠密均匀,液泡很少,细胞壁厚度一致,胞外无外渗物 (图 5-A);经Em7处理后菌丝体出现了内质壁分离现象,液泡明显增多,原生质凝集 (图 5-B,C,D),细胞质密度增加,产生了非膜结构的内含体,且多与液泡聚集在一起 (图 5-C),菌丝细胞壁出现非常明显的不规则增厚 (图 5-D)。
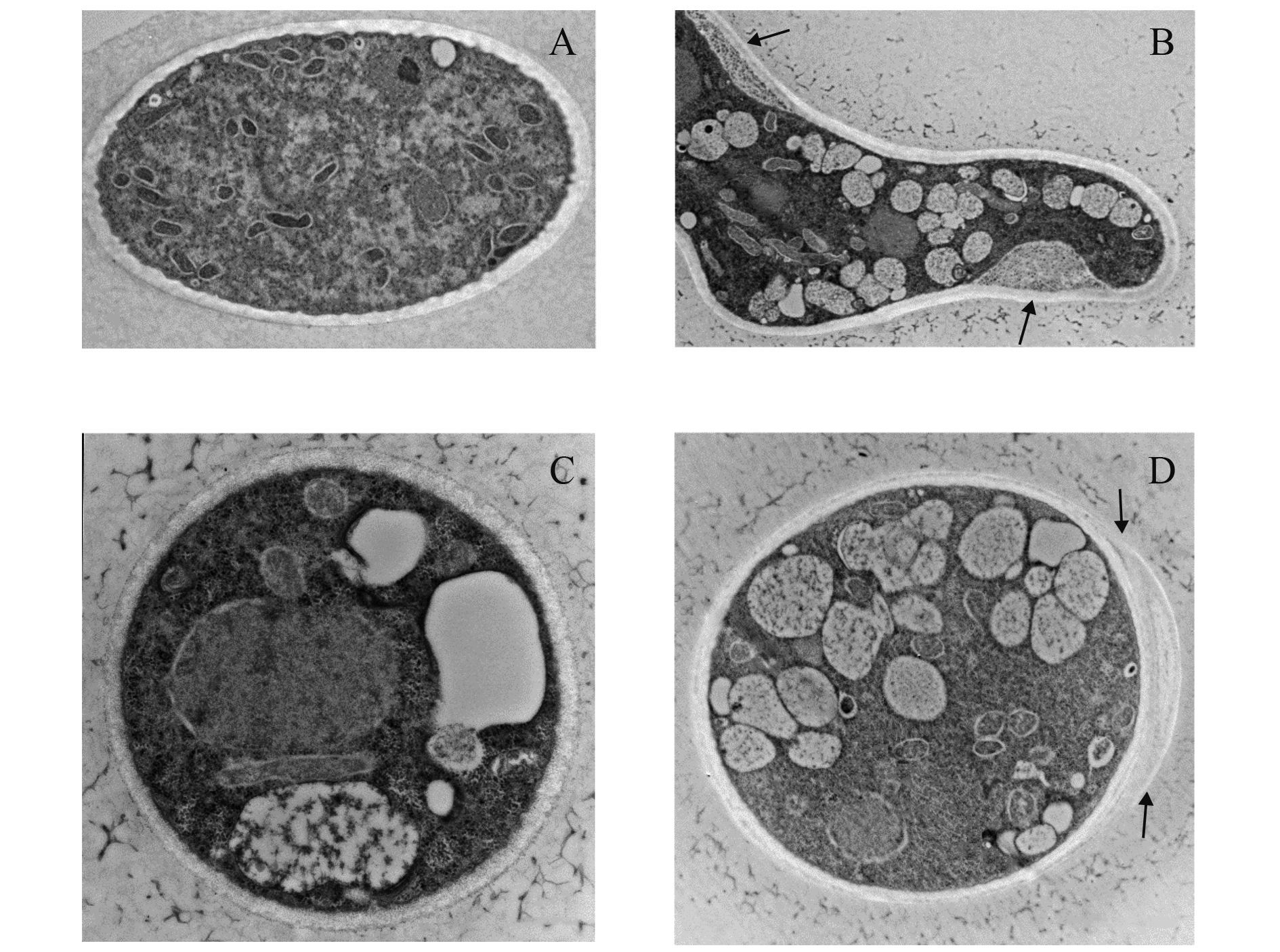
|
A:正常菌丝横断面,标尺 = 2 μm;B~D:Em7 菌液处理后菌丝横断 面,质壁分离 (B 中箭头所示,标尺 = 2 μm),非膜结构内含体产生 (C,标尺 = 500 nm),细胞壁不规则加厚 (D 中箭头所示,标尺 = 2 μm)。 A: The transverse section of normal mycelium. Bar = 2 μm; B-D: The transverse section of mycelium treated with Em7, induced plasmolysis (B. arrow, Bar = 2 μm), informed white inclusion body inside cells (C. Bar = 500 nm), and thickening of cells wall (D. Bar = 2 μm, arrow). 图 5 正常葡萄灰霉病菌菌丝和经 Em7 菌液处理后菌丝的透射电镜图 Fig. 5 The TEM images of normal mycelium and mycelium of B. cinerea treated with Em7 bacteria solution |
2.4 室内离体果实接种结果
离体果实接种试验结果表明:对照葡萄果粒在接种葡萄灰霉病菌 7 d 后完全发病,表现为全果粒腐烂或大面积腐烂,而经 Em7 菌液处理的葡萄果粒接种葡萄灰霉病菌后大多数表现为不发病。相对于 Em7 原液,其稀释液处理后葡萄果粒表现为发病,但大多数未出现全果粒腐烂或大面积腐烂现象。经 Em7 菌液处理后,灰霉病病情指数为 15.0,显著低于对照 (70.83) (图 6),相对防效达 78.92%。因此,Em7 菌液可以有效抑制葡萄灰霉病菌在葡萄果实上的侵入和扩展。
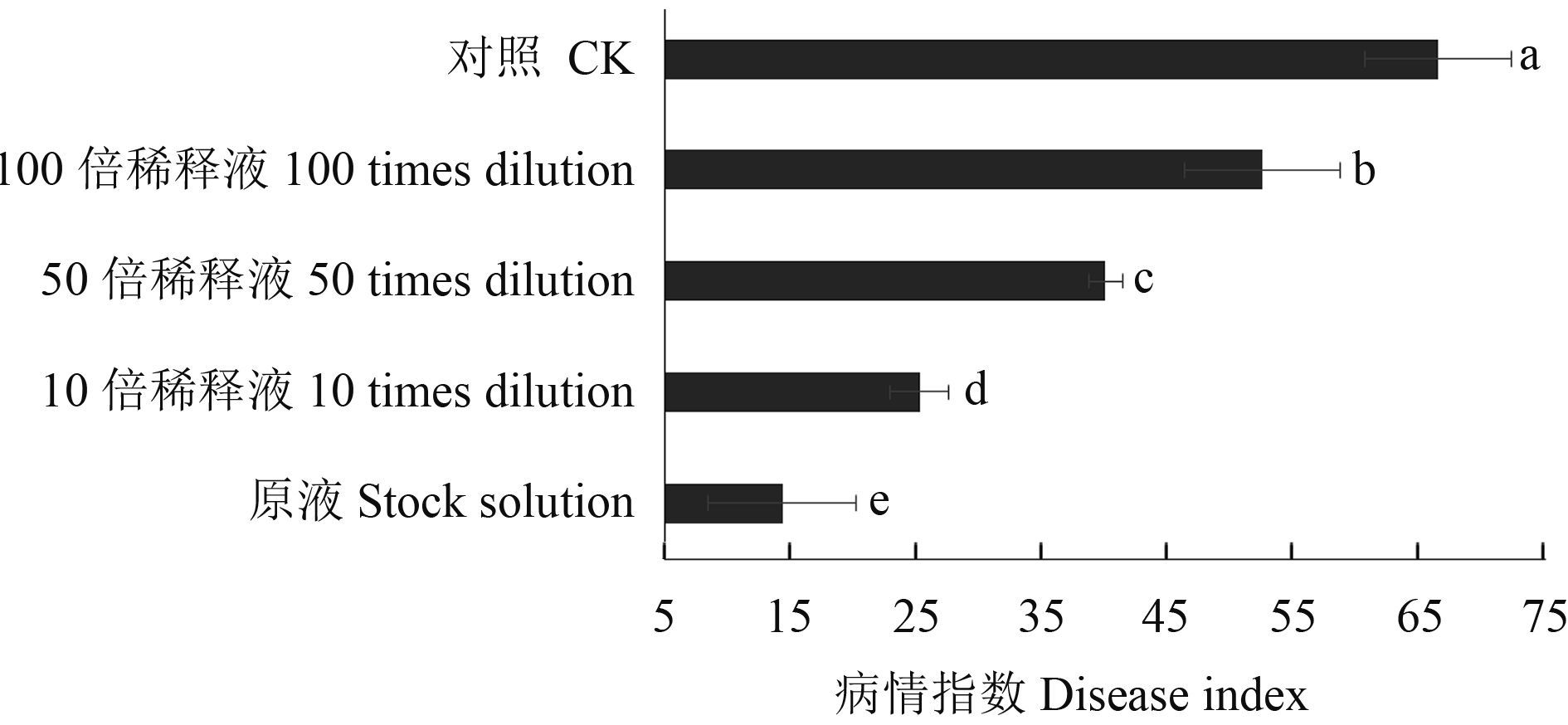
|
CK 为灭菌 LB 液体培养基处理,于 27 ℃、12 h 光/12 h 暗 交替培养,接种病原菌 5 d 后观察结果。通过 SNK 方法比较,图中不 同字母表示差异显著 (P = 0.05)。 The treatment with sterilized LB liquid culture medium was set as CK. Cultured with a photoperiod of 12 h (light/dark, respectively) at 27 ℃, the results were checked 5 d after inoculation. Different letters in the figure indicate significant differences (P = 0.05) between five treatments by SNK test. 图 6 Em7 菌液处理离体葡萄果实接种病情指数 Fig. 6 The disease index of in vitro grape fruit inoculated with B. cinerea after treated with Em7 bacteria solution |
3 结论与讨论
本研究通过室内抑菌试验和离体果实接种试验,测定了植物内生枯草芽孢杆菌 Em7 菌株对葡萄灰霉病菌的抑制效果。结果表明,Em7 对葡萄灰霉病菌有良好的抑制作用,并且在葡萄果实离体条件下可以有效控制葡萄灰霉病的发生。
植物内生细菌具有资源丰富和代谢产物多样性等特征,已被广泛用作植物病害的生防因子[17]。其中,枯草芽孢杆菌通过成功定殖至植物根际、体表或体内,与病原菌竞争植物周围的营养[18-21],分泌抗菌物质,如细菌素、细胞壁水解酶等酶类和活性蛋白质类物质,以抑制病原菌生长[22-23],同时诱导植物防御系统抵御病原菌入侵[21-24],从而达到生物防治的目的。
目前,枯草芽孢杆菌被广泛应用于作物灰霉病的生物防治。有研究发现,B. subtilis JA 可通过释放多种挥发性物质破坏葡萄灰霉病菌菌丝原生质体的正常生长[25]。B. subtilis BS2 可作用于灰霉病菌侵染循环的各个环节,有效抑制其菌丝生长和产孢[26]。本研究发现,枯草芽孢杆菌 Em7 菌株可以造成葡萄灰霉病菌菌丝和分生孢子的畸变,导致菌丝不能正常生长以及分生孢子异常萌发或不萌发;同时,采用枯草芽孢杆菌 Em7 菌液处理离体葡萄果实后,可有效抑制葡萄灰霉病菌的侵染和扩展,表现为良好的保护作用,因此是一种很有应用前景的生防菌。
本课题组前期研究发现,采用枯草芽孢杆菌 Em7 菌液处理油菜菌核病菌 S. sclerotiorum 后,其菌丝出现粗细不均、皱缩、畸形、细胞液外渗等现象,且菌丝细胞的超微结构也会发生变化,表现为液泡数量增加、细胞器紊乱、细胞壁溶解和细胞质外渗等[12]。本研究发现,经 Em7 菌液处理的葡萄灰霉病菌菌丝形态和结构同样发生了明显的变化,表现为生长异常、细胞壁不规则加厚、液泡增多及细胞破裂等。同时,细胞壁破裂后观察到可能是组织液外渗的现象,这需要进一步试验验证。陈安良等[27]用丙烷脒处理灰霉病菌后,菌丝细胞线粒体体积增大、数目增多,细胞核崩解,细胞内出现囊泡,并含有大量的无膜透明内含物,形成较大空腔,细胞壁外围沉积大量外渗物。因此,笔者推测 Em7 菌液中的抑菌成分对葡萄灰霉病菌的作用机理可能与某些化学农药相似,而 Em7 菌液中抑菌成分的作用靶标还有待进一步研究。
| [1] | MLIKOTA GABLER F, SMILANICK J L. Postharvest control of table grape gray mold on detached berries with carbonate and bicarbonate salts and disinfectants [J]. Am J Enol Vitic, 2001, 52 (1) :12–20 . |
| [2] | KELLER M, VIRET O, COLE F M. Botrytis cinerea infection in grape flowers:defense reaction,latency,and disease expression [J]. Phytopathology, 2003, 93 (3) :316–312 . doi:10.1094/PHYTO.2003.93.3.316 |
| [3] | WILLIAMSON B, TUDZYNSKI B, TUDZYNSKI P, et al. Botrytis cinerea:the cause of grey mould disease [J]. Mol Plant Pathol, 2007, 8 (5) :561–580 . doi:10.1111/mpp.2007.8.issue-5 |
| [4] | ROSSLENBROICH H J, STUEBLER D. Botrytis cinerea-history of chemical control and novel fungicides for its management [J]. Crop Protect, 2000, 19 (8-10) :557–561 . doi:10.1016/S0261-2194(00)00072-7 |
| [5] |
韩君, 范怀峰, 王海娜, 等. 防治灰霉病药剂的开发进展 [J]. 农药研究与应用, 2011,15 (3)
:5–10.
HAN J, FAN H F, WANG H N, et al. Development progress of fungicides Botrytis cinerea [J]. Agrochem Res Appl, 2011, 15 (3) :5–10 . |
| [6] | RAPOSO R, DELCAN J, GOMEZ V, et al. Distribution and fitness of isolates of Botrytis cinerea with multiple fungicide resistance in Spanish greenhouses [J]. Plant Pathol, 1996, 45 (3) :497–505 . doi:10.1046/j.1365-3059.1995.d01-140.x |
| [7] | LATORRE B A, SPADARO I, RIOJA M E. Occurrence of resistant strains of Botrytis cinerea to anilinopyrimidine fungicides in table grapes in Chile [J]. Crop Protect, 2002, 21 (10) :957–961 . doi:10.1016/S0261-2194(02)00074-1 |
| [8] | KIM B S, PARK E W, CHO K Y. Population dynamics of sensitive and resistance phenotypes of Botrytis cinerea to benzimidazole,dicarboximide and N-phenylearbamate fungicides in Korea [J]. J Pest Sci, 2000, 25 (4) :385–386 . doi:10.1584/jpestics.25.385 |
| [9] |
张玮, 乔广行, 黄金宝, 等. 中国葡萄灰霉病菌对嘧霉胺的抗药性检测 [J]. 中国农业科学, 2013,46 (6)
:1208–1212.
ZHANG W, QIAO G H, HUANG J B, et al. Evaluation on resistance of grape gray mold pathogen Botrytis cinerea to pyrimethanil in China [J]. Scientia Agricultura Sinica, 2013, 46 (6) :1208–1212 . |
| [10] |
乔宏萍, 黄丽丽, 康振生. 小麦内生细菌及其对根茎部主要病原真菌的抑制作用 [J]. 应用生态学报, 2006,17 (4)
:690–694.
QIAO H P, HUANG L L, KANG Z S. Endophytic bacteria isolated from wheat and their antifungal activities to soil-borne disease pathogens [J]. Chin J Appl Ecol, 2006, 17 (4) :690–694 . |
| [11] |
高小宁.内生细菌Em7对油菜菌核病的防治作用及机理初探[D].杨凌:西北农林科技大学,2006:20-22.
GAO X N.Study on the biocontrol efficacy of endophytic bacterium Em7 isolate against Sclerotinia sclerotiorum on oilseed rape[D].Yangling:Northwest A & F University,2006:20-22. |
| [12] | GAO X N, HAN Q M, CHEN Y F, et al. Biological control of oilseed rape Sclerotinia stem rot by Bacillus subtilis strain Em7 [J]. Biocontrol Sci Technol, 2014, 24 (1) :39–52 . doi:10.1080/09583157.2013.844223 |
| [13] |
周德庆.
微生物学实验手册[M]. 上海: 上海科学技术出版社, 1986 : 121 -123.
ZHOU D Q. Microbiology laboratory manual[M]. Shanghai: Shanghai Science and Technology Publishing House, 1986 : 121 -123. |
| [14] |
崔志峰, 丁贞科, 冯贻安, 等. 灰葡萄孢产孢和孢子萌发条件 [J]. 浙江农业学报, 2008,20 (6)
:441–445.
CUI Z F, DING Z K, FENG Y A, et al. The conditions of sporulation and spore germination of Botrytis cinerea [J]. Acta Agriculturae Zhejiangensis, 2008, 20 (6) :441–445 . |
| [15] |
康振生.
植物病原真菌的超微结构[M]. 北京: 中国科学技术出版社, 1995 : 1 -29.
KANG Z S. Ultra structure of plant pathogenic fungi[M]. Beijing: China Science and Technology Press, 1995 : 1 -29. |
| [16] |
陈宇飞.葡萄果实抗灰霉病机制研究[D].哈尔滨:东北农业大学,2006:9.
CHEN Y F.Resistant mechanism of grape fruit to gray mould blight[D].Harbin:Northeast Agricultural University,2006:9. |
| [17] | STONE J K, BACON C W, WHITE J F J R. An overview of endophytic microbes:endophytism defined[M]. New York: Marcel Dekker, 2000 . |
| [18] | LUGTENBERG B, KAMILOVA F. Plant-growth-promoting rhizobacteria [J]. Annu Rev Microbiol, 2009, 63 (1) :541–556 . doi:10.1146/annurev.micro.62.081307.162918 |
| [19] | SHODA M. Bacterial control of plant diseases [J]. J Biosci Bioeng, 2000, 89 (6) :515–521 . doi:10.1016/S1389-1723(00)80049-3 |
| [20] | EMMERT E A B, HANDELSMAN J. Biocontrol of plant disease:a (Gram-) positive perspective [J]. FEMS Microbiol Lett, 1999, 171 (1) :1–9 . doi:10.1111/fml.1999.171.issue-1 |
| [21] | KILIAN M, STEINER U, KREBS B, et al. FZB24® Bacillus subtilis-mode of action of a microbial agent enhancing plant vitality [J]. Pflanzenschutz-Nachrichten Bayer, 2000, 1 (1) :72–93 . |
| [22] | FALARDEAU J, WISE C, NOVITSKY L, et al. Ecological and mechanistic insights into the direct and indirect antimicrobial properties of Bacillus subtilis lipopeptides on plant pathogens [J]. J Chem Ecol, 2013, 39 (7) :869–878 . doi:10.1007/s10886-013-0319-7 |
| [23] | FARACE G, FERNANDEZ O, JACQUENS L, et al. Cyclic lipopeptides from Bacillus subtilis activate distinct patterns of defense responses in grapevine [J]. Mol Plant Pathol, 2015, 16 (2) :177–187 . doi:10.1111/mpp.2015.16.issue-2 |
| [24] | KLOEPPER J W, RYU C M, ZHANG S A. Induced systemic resistance and promotion of plant growth by Bacillus spp [J]. Phytopathology, 2004, 94 (11) :1259–1266 . doi:10.1094/PHYTO.2004.94.11.1259 |
| [25] | CHEN H, XIAO X, WANG J, et al. Antagonistic effects of volatiles generated by Bacillus subtilis on spore germination and hyphal growth of the plant pathogen,Botrytis cinerea [J]. Biotechnol Lett, 2008, 30 (5) :919–923 . doi:10.1007/s10529-007-9626-9 |
| [26] |
李永刚, 郭晓慧. 枯草芽孢杆菌BS 2对葡萄灰霉病菌抑菌机制的初步探索 [J]. 微生物学通报, 2010,37 (5)
:721–725.
LI Y G, GUO X H. Preliminary exploration for inhibitory mechanism of Bacillus subtilis strain BS 2 to Botrytis cinerea [J]. Microbiol China, 2010, 37 (5) :721–725 . |
| [27] |
陈安良, 冯美杰, 冯俊涛, 等. 丙烷脒对灰霉病菌菌丝形态和超微结构的影响 [J]. 中国农业科学, 2007,40 (3)
:633–637.
CHEN A L, FENG M J, FENG J T, et al. Effects of propamidine on mycelial morphology and ultrastructure of Botrytis cirerea [J]. Scientia Agricultura Sinica, 2007, 40 (3) :633–637 . |
 2016, Vol. 18
2016, Vol. 18


