2. 浙江工业大学 环境学院, 杭州 310014
2. College of Environment, Zhejiang University of Technology, Hangzhou 310014, China
目前,因农药大量使用所导致的环境污染以及人类健康问题引起了广泛的关注[1]。与此同时,农药的环境毒理学更侧重于慢性毒理学及致毒机制的相关研究,主要包括神经系统、免疫以及生殖系统等方面的毒理机制研究[2]。环境内分泌干扰化合物 (environmental endocrine chemcals,EDCs) 从激素合成到释放各个阶段均可影响生物体的内环境稳态,从而威胁机体健康[3-5]。目前的研究结果显示,多种农药具有 EDCs 的特性,其中包含部分手性农药。手性农药虽然其原子组成相同,但因空间结构不同,故在生物体中会产生不同的毒理和生理学效应。手性农药的异构体会因与生物大分子酶、DNA 交互作用模式或亲和力不同,而产生毒性、活性、新陈代谢以及生物效应的差别。虽然已有研究证明了手性农药存在异构体毒性差异,但目前尚缺乏其对哺乳类动物特别是雌性动物的生殖发育慢性毒理机制方面的评定工作。
氯菊酯 (permethrin,以下简称 PM) 是典型的拟除虫菊酯类农药,主要用于棉花、果树、茶叶等经济作物上的病虫害防治[6]。其属于低毒农药,原药大鼠急性经口 LD50 > 2 000 mg/kg。PM 具有两个手性中心,存在两对对映异构体[7],其结构式见图式 1。
|
图式 1 氯菊酯的异构体 Scheme1 Isomers of permethrin |
已有研究表明,PM 具有雌激素受体介导的类雌激素效应,且 1S-trans-PM 雌激素效应最强[8]。人类的胎盘组织是妊娠期的一个临时性器官,但具有营养交换、内分泌、母胎屏障等多种功能,对于维持胎儿正常发育具有重要作用。胎盘组织兼有神经内分泌的功能,也是 EDCs 主要的靶器官,而胎盘滋养层细胞对于维持胎盘功能具有重要意义,也是研究胎盘功能常用的试验模型[9]。人类绒毛膜癌 JEG-3 细胞株通常被用作人类滋养层细胞模型[10]。该模型能在妊娠期间产生保持胚胎生长的激素[11]。相关研究证明,有机氯农药对滋养层细胞的活力与内分泌调节的干扰构成了对母婴健康的威胁[12, 13],但目前关于具有内分泌干扰效应的、广泛使用的菊酯类农药对胎盘功能的影响研究还未见报道。
本研究选取体外培养的 JEG-3 细胞为模型,通过研究氯菊酯及其异构体对促性腺激素释放激素 (GnRH) 的调节与类固醇雌激素代谢相关基因表达的影响,客观评价氯菊酯异构体的污染对妊娠期母婴健康可能的威胁。
1 材料与方法 1.1 仪器与试剂7300 型实时荧光定量 PCR 仪 (ABI,美国);Jasco LC-2000 系列高效液相色谱仪 (Jasco,日本) 和 ChromPass 色谱工作站 (Version 1.7.403.1);Chiralcel OJ 手性色谱柱 (Daicel,日本);DFC 300 FX 荧光倒置显微镜 (Leica,德国);6890 N 气相色谱仪 (Agilent,美国);R-210 旋转蒸发器 (BUCHI,瑞士);680 型酶标仪 (Bio-Rad,美国); MH-I 型微量振荡器 (海门市其林贝尔仪器制造有限公司);SW-CJ-1FD 型垂直流净化工作台和 3111 型水套式二氧化碳培养箱 (Thermo,USA) 等。
二甲基亚砜及氯菊酯 (permethrin) 标准品 (纯度为 99.5%) 购自 Sigma 公司;色谱纯乙醇、正己烷和异丙醇购自天津登峰化学试剂厂。将氯菊酯溶于乙醇配制成 2 000 mg/L 的储备液,用于高效液相色谱拆分及气相色谱、液相色谱定量分析[7];人类绒毛膜癌 JEG-3 细胞株购自中国科学院上海细胞库;胰蛋白酶、DMEM/F-12 培养基和胎牛血清购自美国 Hyclone 公司;RNAiso Plus、SYBR Premix EX Taq 和 PrimeScript® RT reagent Kit With gDNA Eraser 购自 TaKaRa 公司。
1.2 色谱条件 1.2.1 氯菊酯的拆分及纯度检测采用高效液相色谱 (HPLC) 仪,使用正相手性色谱柱 Chiralcel OJ 柱[25 cm × 4.6 mm (ID),5 μm];流动相为 V (正己烷) : V (乙醇) = 98 : 2,流速 0.8 mL/min;柱温 25 ℃。圆二色检测器的检测波长 236 nm。
1.2.2 氯菊酯的定量分析条件采用 6890 N 气相色谱仪带电子捕获检测器 (GC-ECD),HP-5 型石英毛细管色谱柱[30 m × 0.25 mm (ID),0.25 μm],不分流进样。恒压,进样量 1 μL;进样口温度 250 ℃;氮载气流速 1.0 mL/min;升温程序:200 ℃,持续 2 min,然后以 10 ℃/min 升至 260 ℃,保持 2 min。
1.3 细胞培养和处理 1.3.1 细胞培养在 25 cm2 培养瓶中,将 JEG-3 细胞常规贴壁培养于含 10%胎牛血清 (FBS) 的 DMEM/F12 液体培养液中,于 37 ℃、二氧化碳体积分数为 5%、相对湿度饱和的培养箱中培养至对数生长期。间隔 1~2 d 更换 1 次培养液。
1.3.2 细胞处理取对数生长期的细胞,置于试验用液 (不含酚红,经 5% 萄聚糖-活性炭处理的 FBS) 中常规培养 24 h,以提升细胞对雌激素的敏感性;之后按 1 × 106 个/mL 的细胞密度传代于35 cm2 细胞培养皿中。分别加入氯菊酯及其异构体至终浓度为 1 × 10–6 mol/L,继续常规培养 24 h后提取总 RNA。
1.4 mRNA 提取与 cDNA 合成将培养液吸去,用 PBS 小心洗涤 2 次,离心收集细胞,使用 RNAiso Plus 提取总 RNA,具体操作见 TaKaRa 公司总 RNA 提取试剂说明书。以纯化的总 RNA 为模版,参照 PrimeScript® RT reagent Kit 说明书进行 cDNA 模板的合成。反应结束后,于 –20 ℃下保存,备用。
1.5 实时荧光定量反转录聚合酶链式反应使用实时荧光定量反转录聚合酶链式反应 (RT-PCR) 对相关基因进行定量检测。选取促性腺激素释放激素及其受体基因 4 个,白细胞抗原 G 基因 1 个,类固醇基因 8 个作为目的基因,以 β-Actin 为内参基因 (表 1)。查询序列,设计引物,用 SYBR Green 方法进行实时定量 PCR,反应体系为 20 μL,包括 SYBR Premix Ex Taq II (Tli RNaseH Plus) (2 ×) 10 μL,ROX Reference Dye 0.4 μL,10 μmol/L 上下游引物各 0.8 μL,cDNA 2 μL,dd H2O 6 μL。反应条件:95 ℃预变性 60 s;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,扩增 40 个循环,在 72 ℃延伸时采集荧光信号。
|
|
表 1 实时荧光定量 RT-PCR 的引物序列 Table 1 Primer sequences used for real-time RT-PCR |
1.6 数据处理
获取试验数据,得到循环数 (Ct) 值。利用 2–ΔΔCt 分析 mRNA 的相对表达水平[14, 15]。试验重复 3 次,利用 SPSS 19.0 软件分析试验结果,计算药物处理组 mRNA 相对表达的水平方差以及单因素 (ANOVA) 条件下的显著性。当 P < 0.05 时,看作有显著性差异。数值相对 β-Actin 进行比较,得到 mRNA 相对表达量。不同字母代表显著性差异,相同字母表示无显著性差异 (P < 0.05,n = 3)。星号代表空白组和处理组之间存在显著性差异。
2 结果与分析 2.1 异构体的拆分按 1.2.1 节的 HPLC 条件对氯菊酯进行拆分,4 个异构体均可实现基线分离,经 HPLC 测定其纯度均大于 97.5%。在上述色谱条件下,对同一供试样品,在 4 ℃下分别保存 0、3、6、9 和 12 h 后,用当日新配制的对照品溶液按外标法进行定量分析,4 个异构体的相对标准偏差均小于 2%,说明供试样品在 12 h 内稳定性良好,未发生消旋。气相色谱检测,氯菊酯的 4 个异构体 (1R-cis-(+)-PM、1S-cis-(-)-PM、1R-trans-(+)-PM 和 1S-trans-(-)-PM) 的质量浓度分别为 325.03、369.83、658.30 和 649.64 mg/L。
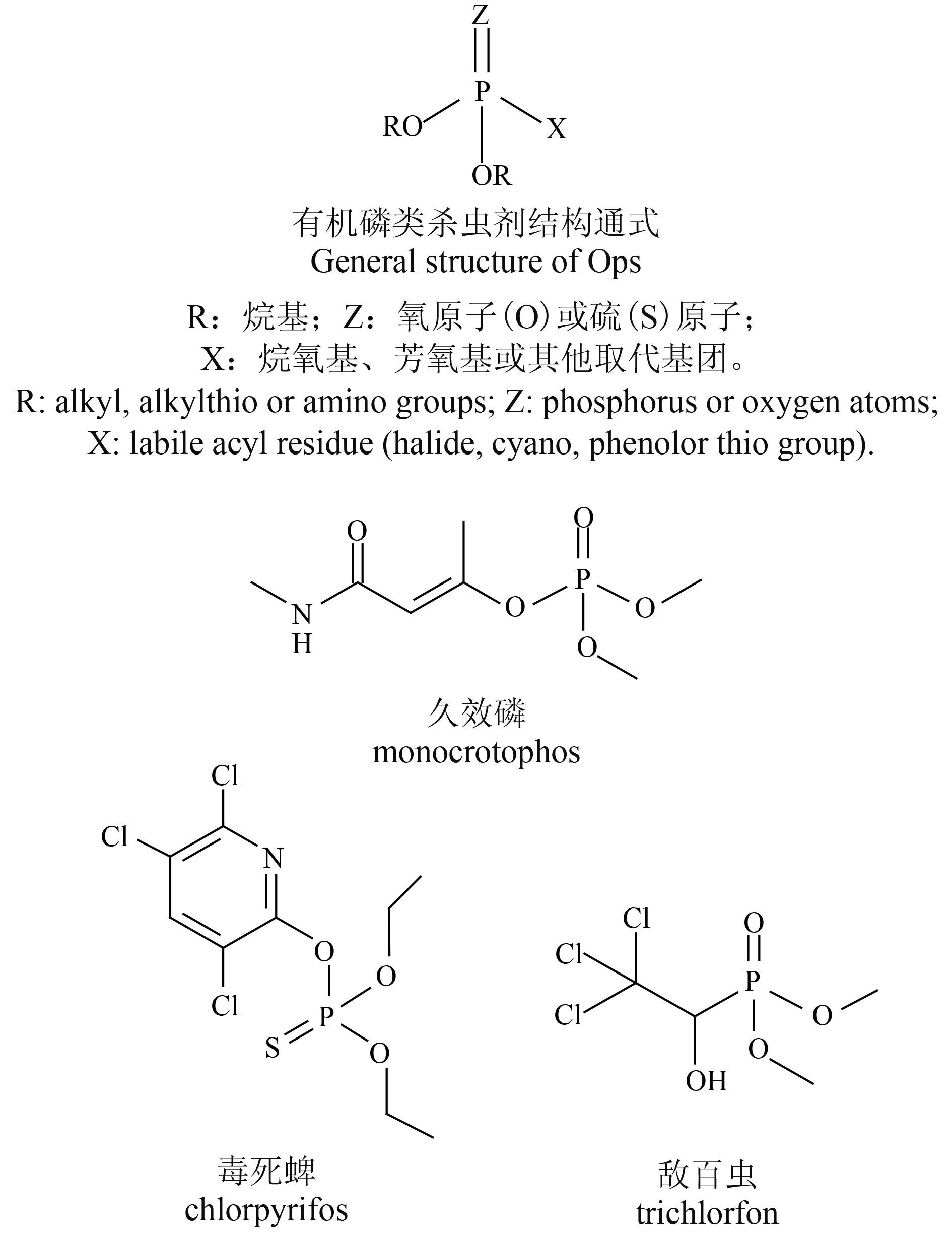
2.2 基因 GnRHI、GnRHII 和 GnRHR 的实时荧光定量 RT-PCR 结果GnRHI 和 GnRHII 为促性腺激素释放激素,可以促进卵泡刺激激素 (follicular stimulating hormone,FSH) 和黄体生成素 (luteinizing hormone,LH) 的合成和分泌。GnRHR 为促性腺激素释放激素受体,与 G 蛋白偶联后激活磷脂钙第二信使系统,能够与促性腺激素释放激素结合[16]。GnRHI、GnRHII 和 GnRHR 除了与促性腺激素释放激素 LH 和 FSH 的释放有关外,其还与调节胎盘、女性子宫和卵巢中一些复杂过程有关[17]。本研究结果 (图 1) 表明:当 JEG-3 细胞暴露于 1 × 10–6 mol/L 的氯菊酯中 24 h后,GnRHI、GnRHII 和 GnRHR mRNA 的相对表达水平均出现了一定升高,分别为对照组的 1.64、1.75 和 1.61 倍。在所选的暴露浓度下,氯菊酯异构体处理组中 GnRHI 和其受体 GnRHR 的 mRNA 水平变化呈现相同的趋势 (图 2A、2C)。经 trans-PM 处理后的 GnRHI 和 GnRHR 的 mRNA 水平呈显著上升趋势,而经 cis-PM 处理后这 2 个基因并未产生特异性变化。此外,1R-cis-PM,1R-trans-PM 和 1S-trans-PM 处理组的 GnRHII mRNA 水平有显著上升,但 1S-cis-PM 处理则无显著变化。值得注意的是,与暴露于 1R-cis-PM、1S-cis-PM 和 1S-trans-PM 处理组相比,暴露于 1R-trans-PM 处理组的基因 GnRH I、GnRH II 和 GnRHR 呈现出较强的变化趋势。
|
图 1 JEG-3 细胞在 1 × 10-6 mol/L 的氯菊酯及其异构体中处理 24 h 后GnRHI (A), GnRHII (B) 和 GnRHR (C) 基因的相对表达情况 Fig. 1 The relative expression of GnRHI (A), GnRHII (B) and GnRHR (C) mRNA in JEG-3 cells incubated with PM and its four isomers at the concentration of 1 × 10-6 mol/L for 24 h |
|
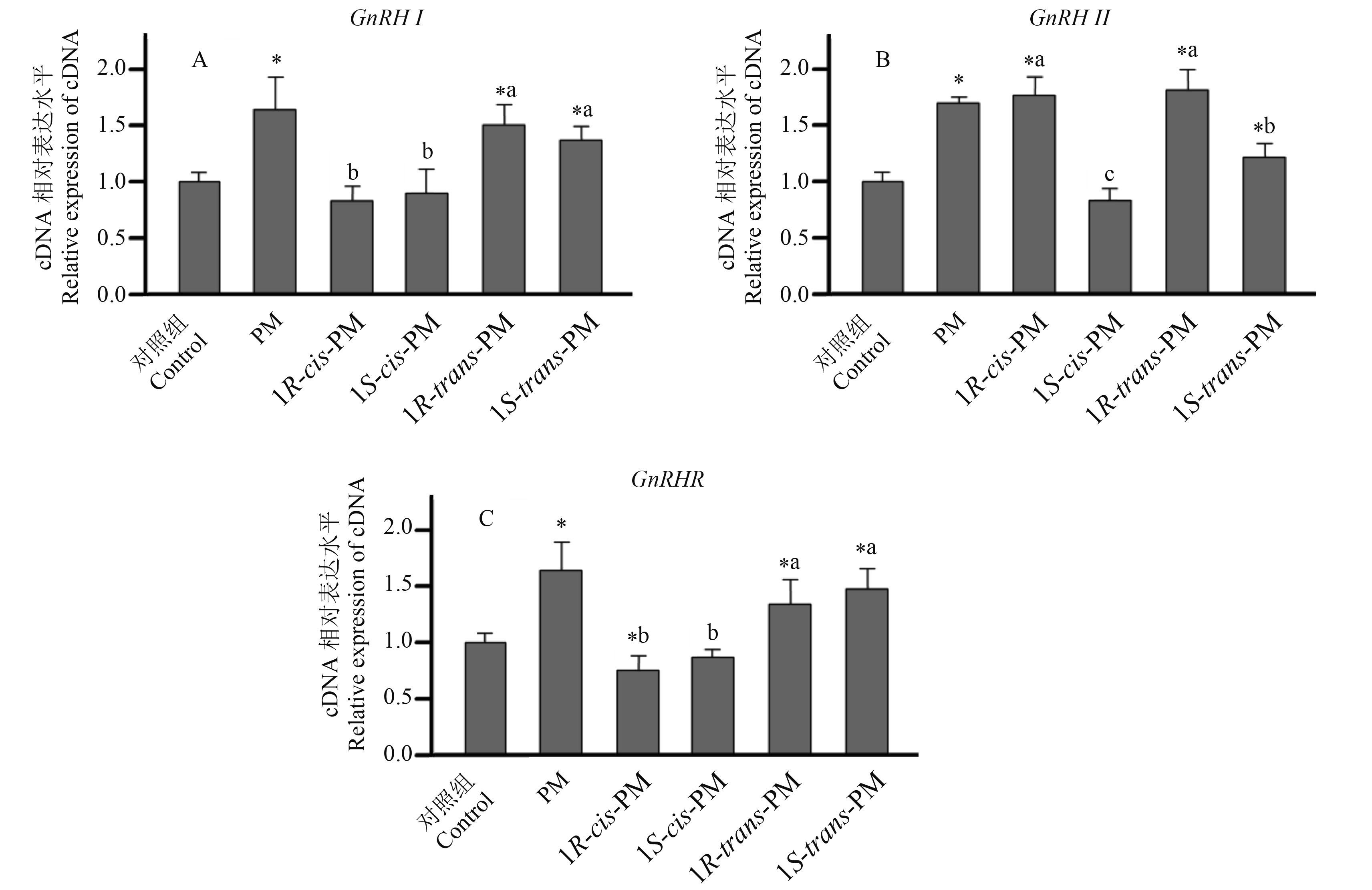
图 2 JEG-3 细胞在 1 × 10-6 mol/L 的氯菊酯及其异构体中处理 24 h 后 CYP11B2 (A)、CYP21 B2 (B)、3 β-HSD2 (C)、17 β-HSD1 (D) 和 17 β-HSD4 (E) 基因的相对表达情况 Fig. 2 The relative expression of CYP11B2 (A), CYP21B2 (B), 3β-HSD2 (C), 17β-HSD1 (D) and 17β-HSD4 (E) mRNA in JEG-3 cells incubated with PM and its four isomers at the concentration of 1 × 10-6 mol/L for 24 h |
2.3 JEG-3 细胞中类固醇合成相关基因的表达
因为 JEG-3 具有分泌类固醇激素的性能,故笔者检测了 8 个类固醇合成途径中的关键基因,分别是 CYP11A (胆固醇侧链裂解酶) [18],CYP11B2 (醛固酮合成酶) [19-20],CYP17 (类固醇 17a-羟基化酶或者 17,20 裂解酶),CYP19 (芳香酶) [21-22],CYP21B2 (类固醇 21-羟基化酶) [23-24],3β-HSD2 (3β-羟基类固醇脱氢酶),17β-HSD1 和 17β-HSD4 (17-β1 型和 17-β4 型羟基脱氢酶) 基因[20-24]。
根据药物处理后这些基因 mRNA 相对表达量的变化,将其分为 2 组,分别见图 2 和图 3。图 2 中,各处理组的 mRNA 表达水平显现出一致性,即同时上升或下降;无论 PM 组还是各异构体组,CYP11B2 和 17β-HSD1 均显著上升,而 CYP21B2 和 17β-HSD4 均有明显下降。与对照组相比,PM、1R-cis-PM、1S-cis-PM、1S-trans-PM 处理组的基因 CYP11B2 分别升高至对照的 2.9、2.0、1.5 和 3.2 倍。而 1R-trans-PM 处理组与对照组相比无显著性差异。此外,除 1R-trans-PM 处理组的 3β-HSD2 下调至约 0.71 倍外,氯菊酯和其他 3 个异构体处理组的基因 3β-HSD2 没有发生明显变化。变化最显著的基因是 CYP21B2,经氯菊酯、1R-cis-PM、1S-cis-PM、1R-trans-PM 和 1S-trans-PM 处理后,CYP21B2 分别下调至 0.61、0.52、0.34、0.71 和 0.47 倍 (图 2)。
|
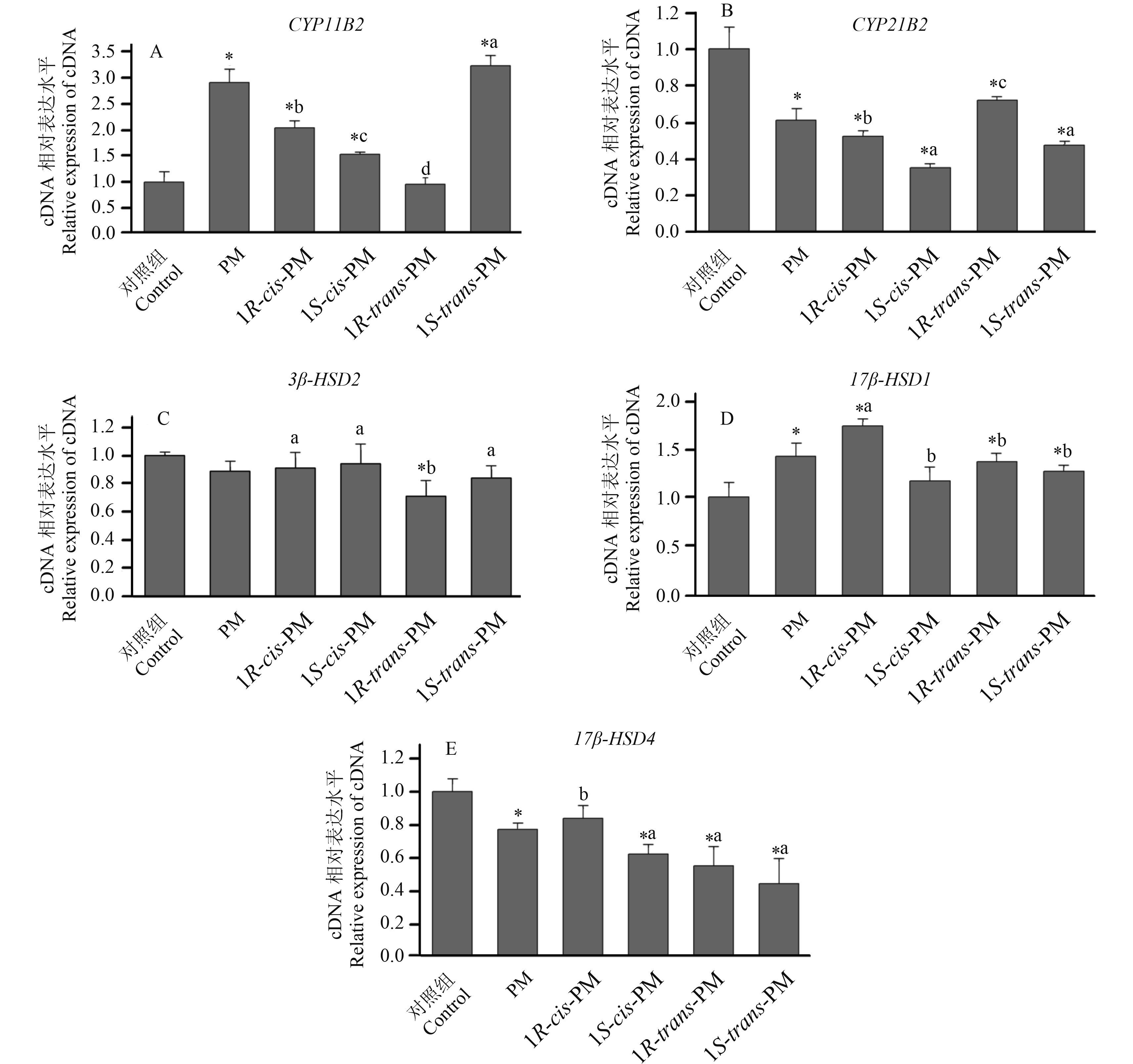
图 3 JEG-3 细胞在 1 × 10-6 mol/L 的氯菊酯及其异构体中处理 24 h后CYP11A (A) 、CYP17 (B) 和 CYP19 (C) 基因的相对表达情况 Fig. 3 The relative expression of CYP11A (A), CYP17 (B) and CYP19 (C) mRNA in JEG-3 cells incubated with PM and its four isomers at the concentration of 1 × 10-6 mol/L for 24 h |
药物处理后,基因 CYP11A、CYP17 和 CYP19 的 mRNA 表达变化见图 3。与对照组相比,PM、1R-cis-PM 和 1S-trans-PM 处理组的 CYP17 基因没有呈现显著性变化,而 1S-cis-PM 处理组的 CYP17 基因下调至 0.68 倍,1R-trans-PM 处理组则上调至 1.72 倍。PM 和 1S-trans-PM 处理组使 CYP19 基因上升至 1.47 和 1.25 倍,但是 1S-cis-PM 和 1R-trans-PM 处理组使该基因下调至 0.43 和 0.65 倍。1R-cis-PM 处理组基因 CYP19 没有出现显著变化。PM 处理组使 CYP11A 基因上调至 1.91 倍,1S-cis-PM 处理组使其下调至 0.77 倍。同时,其他 3 个 PM 异构体没有使 CYP11A 发生显著变化。
总的来说,氯菊酯的各个异构体对这 8 个类固醇合成关键基因存在显著的手性选择性。而且,cis-PM 和 trans-PM 处理组类固醇基因 mRNA 的相对表达量存在显著差异。
2.4 氯菊酯异构体在诱导 HLA-G 基因表达中的选择性HLA-G 属于人类非典型性主要组织相容性复合 I 类分子的初级产物,由于其主要是在绒毛外滋养层细胞 (EVCT) 中表达,因此其被认为与人类胚胎免疫耐受有关[25]。图 4 是 JEG-3 细胞在 1 × 10–6 mol/L 的氯菊酯及其异构体中处理 24 h 后基因 HLA-G 在 mRNA 水平的相对表达量。结果表明:1S-cis-PM 处理组的 HLA-G 基因未发生显著变化,而 PM、1R-cis-PM、1R-trans-PM 和 1S-trans-PM 处理组的 HLA-G 基因相对表达量分别升高至 1.77、1.34、1.51 和 1.21 倍。可见,在 4 个异构体中,1R-trans-PM 处理使 HLA-G 基因的 mRNA 相对表达量上调更显著。
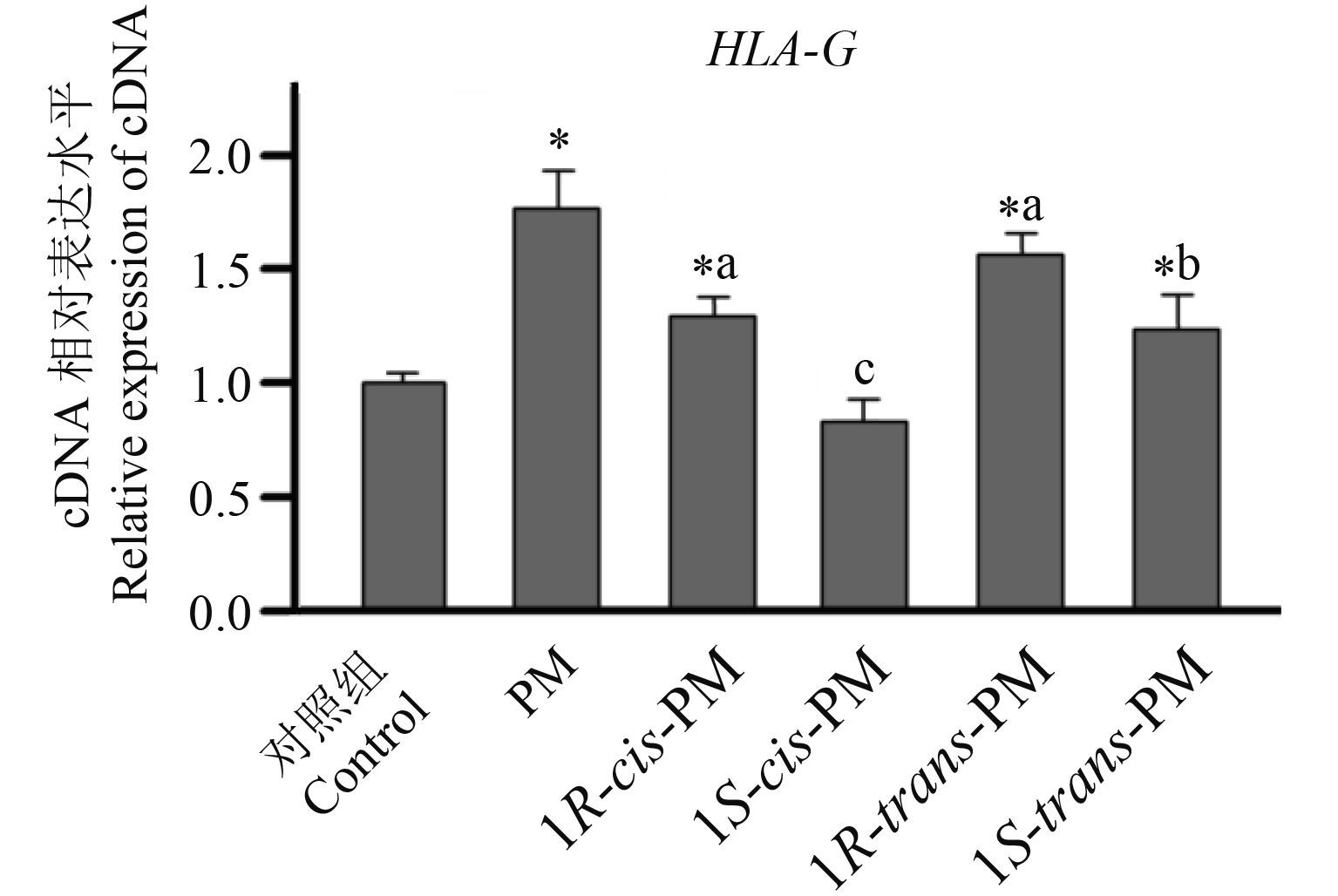
|
图 4 JEG-3 细胞在 1 × 10-6 mol/L 的氯菊酯及其异构体中处理 24 h 后 HLA-G 基因的相对表达情况 Fig. 4 The relative expression of HLA-G mRNA in JEG-3 cells incubated with PM and its four isomers at the concentration of 1 × 10-6 mol/L for 24 h |
3 结论与讨论
目前,世界范围内对人口与健康研究的重视程度越来越高,因此环境污染物对野生生物和人类的生殖、发育的危害是环境毒理学研究的热点。环境雌激素或 EDCs 会影响生物体正常的激素合成、分泌、转运、释放及其生物功能的正常运行,其中农药占了很大的比例。中国现在所使用的农药中有 40%是手性的,并且这个比例呈逐年递增的趋势[8]。研究表明,o'p-DDT 的雌激素效应具有对映体选择性差异[26]。本研究结果显示,氯菊酯对促性腺激素释放激素 (GnRH) 及其受体、类固醇生成基因和母胎交换重要分子基因 (HLA-G) mRNA 表达均有一定的影响。对于这些检测的目的基因,氯菊酯的 4 个异构体间存在选择性差异。有研究显示,1R-cis-PM 和 1R-trans-PM 相较于其他 2 个异构体,对大型蚤具有更强的生物毒性[27]。但本研究结果显示,1R-cis-PM 和 1S-trans-PM 处理对检测的大部分类固醇合成相关基因存在较强的干扰作用,而不是 1R-trans-PM,并且 cis-PM 和 trans-PM 异构体间存在显著差异。这与本研究组之前在 PC12 系中的试验结果——trans-PM 比 cis-PM 能引发更多氧化自由基 ROS 的产生,而使细胞增殖或者死亡的结果相一致[28]。总之,在手性化合物的研究中,需要从异构体层面出发研究其异构体的环境行为,而且多种因素应列入检测的范畴,如对非靶标生物细胞的毒性、生殖的影响、氧化应激、特别是对类固醇内分泌的影响,以期研发出更安全、对环境更友好的纯异构体手性化合物。
| [1] | YU R, LIU Q, LIU J S, et al. Concentrations of organophosphorus pesticides in fresh vegetables and related human health risk assessment in Changchun,Northeast China [J]. Food Control, 2016, 60 :353–360 . doi:10.1016/j.foodcont.2015.08.013 |
| [2] |
杨彩霞, 潘志彦, 赵美蓉, 等. 类雌激素农药对雌性哺乳动物的生殖毒理研究 [J]. 浙江工业大学学报, 2008,36 (2)
:122–128.
YANG C X, PAN Z Y, ZHAO M R, et al. Study on reproductive toxicity in female mammals of xenoestrogenic pesticides [J]. J Zhejiang Univ Tech, 2008, 36 (2) :122–128 . |
| [3] |
王汝平, 王军, 孙长青, 等. 有机磷农药类雌/抗雄激素效应研究进展 [J]. 海洋科学, 2014,38 (12)
:128–135.
WANG R P, WANG J, SUN C Q, et al. Research progress of estrogenic/anti-androgenic activity in-duced by organophosphorus pesticides [J]. Mar Sci, 2014, 38 (12) :128–135 . |
| [4] |
韩绍伦, 李剑, 王子健. 环境内分泌干扰化合物干扰胰岛素分泌潜在作用机理 [J]. 生态毒理学报, 2014,9 (2)
:181–189.
HAN S L, LI J, WANG Z J. Potential mechanisms of effects of environmental endocrine disrupting chemicals on disrupting insulin secretion [J]. Asian J Ecotoxicol, 2014, 9 (2) :181–189 . |
| [5] | TREVIÑO L S, WANG Q, WALKER C L. Hypothesis:activation of rapid signaling by environmental estrogens and epigenetic reprogramming in breast cancer [J]. Reprod Toxicol, 2015, 54 :136–140 . doi:10.1016/j.reprotox.2014.12.014 |
| [6] |
刘泽珣, 周辉凤, 高霞, 等. 6%高效氯氰菊酯·氯菊酯水乳剂的高效液相色谱分析 [J]. 农药, 2010,49 (4)
:264–265.
LIU Z X, ZHOU H F, GAO X, et al. Analysis of beta-cypermethrin·permethrin 6% EW by HPLC [J]. Agrochemicals, 2010, 49 (4) :264–265 . |
| [7] | GALERA M M, VIDAL J L M, FRENICH A G, et al. Determination of cypermethrin,fenvalerate and cis-and trans-permethrin in soil and groundwater by high-performance liquid chromatography using partial least-squares regression [J]. J Chromatogr A, 1996, 727 (1) :39–46 . doi:10.1016/0021-9673(95)01151-X |
| [8] | JIN Y X, CHEN R J, SUN L W, et al. Enantioselective induction of estrogen-responsive gene expression by permethrin enantiomers in embryo-larval zebrafish [J]. Chemosphere, 2009, 74 (9) :1238–1244 . doi:10.1016/j.chemosphere.2008.11.015 |
| [9] | BECHI N, SORDA G, SPAGNOLETTI A, et al. Toxicity assessment on trophoblast cells for some environment polluting chemicals and 17β-estradiol [J]. Toxicol Vitro, 2013, 27 (3) :995–1000 . doi:10.1016/j.tiv.2013.01.013 |
| [10] | HONKISZ E, ZIEBA-PRZYBYLSKA D, WOJTOWICZ A K. The effect of triclosan on hormone secretion and viability of human choriocarcinoma JEG-3 cells [J]. Reprod Toxicol, 2012, 34 (3) :385–392 . doi:10.1016/j.reprotox.2012.05.094 |
| [11] | MOISE J, DELKIS J, SCOMMEGNA A, et al. The effect of dehydroepiandrosterone sulfate on de novo and low-density lipoprotein-stimulated progesterone secretion by human chor ocarcinoma JEG-3 cells [J]. Am J Obstet Gynecol, 1986, 154 (5) :1080–1085 . doi:10.1016/0002-9378(86)90755-6 |
| [12] | WÓJTOWICZ A K, AUGUSTOWSKA K, GREGORASZCZUK E L. The short-and long-term effects of two isomers of DDT and their metabolite DDE on hormone secretion and survival of human choriocarcinoma JEG-3 cells [J]. Pharmacol Rep, 2007, 59 (2) :224–232 . |
| [13] | KARMAUS W, ZHU X B. Maternal concentration of polychlorinated biphenyls and dichlorodiphenyl dichlorethylene and birth weight in Michigan fish eaters:a cohort study [J]. Environ Health, 2004, 3 :1. doi:10.1186/1476-069X-3-1 |
| [14] |
李姗姗, 秦欢, 丁陈波, 等. 结核分枝杆菌Hsp16.3刺激小鼠巨噬细胞向M2分化 [J]. 中国免疫学杂志, 2015,31 (12)
:1595–1600.
LI S S, QIN H, DING C B, et al. Mycobacterium tuberculosis Hsp16.3 induces murine macrophages derived from M2 [J]. Chin J Immunol, 2015, 31 (12) :1595–1600 . |
| [15] |
曾晓春, 孔清, 伍伟锋. Th1-Th2-Th17细胞因子在小鼠慢性心肌炎中的表达 [J]. 中国免疫学杂志, 2015,31 (12)
:1601–1604.
ZENG X C, KONG Q, WU W F. Expressions of Th1-Th2-Th17 cytokines in mice chronic viral myocarditis [J]. Chin J Immunol, 2015, 31 (12) :1601–1604 . |
| [16] | CIECHANOWSKA M, ŁAPOT M, MALEWSKI T, et al. Expression of the GnRH and GnRH receptor (GnRH-R) genes in the hypothalamus and of the GnRH-R gene in the anterior pituitary gland of anestrous and luteal phase ewes [J]. Anim Reprod Sci, 2008, 108 (3-4) :345–355 . doi:10.1016/j.anireprosci.2007.09.002 |
| [17] | CHENG C K, LEUNG P C. Molecular biology of gonadotropin-releasing hormone (GnRH)-I,GnRH-Ⅱ,and their receptors in humans [J]. Endocr Rev, 2005, 26 (2) :283–306 . doi:10.1210/er.2003-0039 |
| [18] |
朱雄珊. 胎儿游离CYP11A-mRNA表达水平对子痫前期的预测价值 [J]. 临床医学工程, 2015,22 (12)
:1581–1583.
ZHU X S. Value of the expression level of fetal free CYP11A-mRNA in predicting Preeclampsia [J]. Clin Med Eng, 2015, 22 (12) :1581–1583 . |
| [19] |
杨静, 张泉, 李江津, 等. 中国汉族人群醛固酮合成酶CYP11B2基因多态性与原发性高血压相关性的荟萃分析 [J]. 中华高血压杂志, 2011,19 (7)
:673–677.
YANG J, ZHANG Q, LI J J, et al. Meta analysis on the association of CYP11B2 gene polymorphism and essential hypertension in Chinese Han population [J]. Chin J Hypertens, 2011, 19 (7) :673–677 . |
| [20] |
马宝新, 刘现亮, 李花, 等. 中国人醛固酮合成酶CYP11B2基因多态性与原发性高血压左室肥厚相关性的Meta分析 [J]. 华西医学, 2014,29 (2)
:239–242.
MA B X, LIU X L, LI H, et al. Meta-analysis on the association of CYP11B2 gene polymorphism and left ventricular hypertrophy in Chinese hypertensive patients [J]. West China Med J, 2014, 29 (2) :239–242 . |
| [21] | HU M C, CHIANG E F L, TONG S K, et al. Regulation of steroidogenesis in transgenic mice and zebrafish [J]. Mol Cell Endocrinol, 2001, 171 (1-2) :9–14 . doi:10.1016/S0303-7207(00)00385-3 |
| [22] | MÜLLER-VIEIRA U, ANGOTTI M, HARTMANN R W. The adrenocortical tumor cell line NCI-H295R as an in vitro screening system for the evaluation of CYP11B2(aldosterone synthase) and CYP11B1(steroid-11β-hydroxylase) inhibitors [J]. J Steroid Biochem Mol Biol, 2005, 96 (3-4) :259–270 . doi:10.1016/j.jsbmb.2005.04.032 |
| [23] | HILSCHEROVA K, JONES P D, GRACIA T, et al. Assessment of the effects of chemicals on the expression of ten steroidogenic genes in the H295R cell line using real-time PCR [J]. Toxicol Sci, 2004, 81 (1) :78–89 . doi:10.1093/toxsci/kfh191 |
| [24] |
陆颖冲, 张全, 王萃. 对溴磷及其对映体对人胎盘滋养层JEG-3细胞内分泌干扰的影响 [J]. 浙江工业大学学报, 2012,40 (2)
:152–156.
LU Y C, ZHANG Q, WANG C. Enantioseletive effect of endocrine disruption by leptophos in JEG-3 cells [J]. J Zhejiang Univ Tech, 2012, 40 (2) :152–156 . |
| [25] | JOHANSSON M K, SANDERSON J T, LUND B O. Effects of 3-MeSO2-DDE and some CYP inhibitors on glucocorticoid steroidogenesis in the H295R human adrenocortical carcinoma cell line [J]. Toxicol Vitro, 2002, 16 (2) :113–121 . doi:10.1016/S0887-2333(01)00111-4 |
| [26] | HOEKSTRA P F, BURNISON B K, NEHELI T, et al. Enantiomer-specific activity of o,p'-DDT with the human estrogen receptor [J]. Toxicol Lett, 2001, 125 (1-3) :75–81 . doi:10.1016/S0378-4274(01)00410-6 |
| [27] | LIU W P, GAN J J, QIN S J. Separation and aquatic toxicity of enantiomers of synthetic pyrethroid insecticides [J]. Chirality, 2005, 17 (S1) :S127–S133 . doi:10.1002/(ISSN)1520-636X |
| [28] | HU F, LI L, WANG C, et al. Enantioselective induction of oxidative stress by permethrin in rat adrenal pheochromocytoma (PC12) cells [J]. Environ Toxicol Chem, 2010, 29 (3) :683–690 . doi:10.1002/etc.v29:3 |
 2016, Vol. 18
2016, Vol. 18


