2. 陕西省微生物研究所, 西安 710043
2. Shaanxi Microbiology Institute, Xi'an 710043, China
有机磷类杀虫剂 (OPs) 是继有机氯类被禁用后应用最为广泛的一类药剂,通常以胃毒剂、触杀剂、熏蒸剂或内吸杀虫剂等多种形式用于虫害防治中[1],具有广谱、高效、残留期短、使用成本低等特点,已成为主要的农药种类,占到全球杀虫剂使用总量的 70% 以上,仅 2001 年,全美有机磷类杀虫剂用量即约为 3.3 万吨[2-4]。在中国,有机磷类杀虫剂的使用也最为广泛,平均每年仅农业生产用量即超过 10 万吨,是美国的 4 倍[5]。截至 2010 年,中国杀虫剂的年需求量达 12.95 万吨,其中有机磷类杀虫剂占到了 72%[6]。
长期使用有机磷类杀虫剂,不仅会造成相应的农产品残留污染,还可能通过食物链在多种生物体内蓄积,进而对高等动物及人类产生毒性作用[7-9]。同时,也可通过施药、挥发、漂移、地表径流或地下水渗漏等方式污染地表水及地下水,对水源地水域生态环境、饮用水安全及非靶标生物的生存构成严重威胁。有机磷类杀虫剂对水域的污染问题在全球范围内普遍存在,其污染程度受多区位因素影响,如:地质结构、施药量及频率、水域径流变化、气候变化等[10]。传统观念认为有机磷类杀虫剂残留期短、易降解,但已有研究表明,该类杀虫剂在一定条件下可随地球表面的再分配而到达高纬度地区,如南北极,对环境造成持久性的污染[11]。此外,常规的水处理技术,如过滤、澄清、软化、再碳化及氯化等均无法完全去除水体中残留的有机磷类杀虫剂,而且在目前污水处理最常用的技术——氯化处理过程中,此类杀虫剂磷硫键中的硫原子还可被氧原子部分取代,形成毒性比母体化合物更强的氧化物[2]。
有机磷类杀虫剂对水域的污染已成为威胁水生生态环境安全的巨大隐患。检测发现,中国九龙江河口区每年的农药使用量已超过 6 000 吨,其河口水域、沉积物及所在区域水生生物样本中均检出了有机磷类杀虫剂残留,河水中 17 种有机磷杀虫剂的平均含量为 227.2 ng/L[12],已对生态环境安全构成威胁[12-13]。此外,中国黄河、海河、淮河及辽河等水域也均检出了有机磷类杀虫剂残留[14]。由此可见,有机磷类杀虫剂在广泛推广应用的同时已在水域中残留、蓄积,造成了不同程度的水域环境污染,严重威胁水体质量及水生生态系统安全。
水生生态系统作为生态系统的重要组成部分,其变化影响着整个生态系统及人类的生存。水生生态系统包含了食物链中不同营养级的水生动物,它们对系统中毒性物质的耐受性主要取决于其自身的敏感性。而毒性物质作用方式的差异,决定了其对不同营养级生物毒性的不同。目前,水生生态系统中诸如溞类、鱼类、虾类、两栖类等许多物种已被作为水生生态毒理学研究的指示物种,用于研究污染物对动物的毒性效应及作用机制。本文拟就有机磷类杀虫剂的类型、理化性质及毒性机制方面的研究进展进行综述,探讨其暴露对多种非靶标水生动物的毒性效应,并尝试对其除干扰 AChE 产生神经毒性以外的其他毒性作用机制进行分析,以期为有机磷类杀虫剂对非靶标水生动物毒性机制的深入研究和完善奠定基础。
1 有机磷类杀虫剂的理化性质及毒性作用机制 1.1 有机磷类杀虫剂的理化性质概述有机磷是对所有有机磷类杀虫剂的统称,通常可简单分为三大类:脂肪族、苯及杂环衍生物。此类杀虫剂作为磷酸酯类或硫代磷酸酯类化合物,其中心磷原子是不等性 sp3 杂化态,呈四面体型 图式 1。按照其结构差异,可分为 6 个不同的亚类:1) 磷酸酯类 (phosphates),2) 膦酸酯类 (phosphonates),3) 硫代磷酸酯类 (phosphorothioates),4) 二硫代磷酸酯类 (phosphorodithioates),5) 硫赶磷酸酯类 (phosphorothiolates),6) 磷酰胺类 (phosphoramidates)。在中国,按照有机磷杀虫剂对大鼠的口服半致死剂量 (LD50 值,mg/kg),可将其毒性等级划分为 3 类:1) 高毒类 (LD50<10),如:氧乐果 (omethoate)、甲胺磷 (methamidophos)、久效磷 (monocrotophos) 及甲基对硫磷 (parathion-methyl) 等;2) 中毒类 (10 <LD50<100),如:乐果 (dimethoate)、毒死蜱 (chlorpyrifos)、敌敌畏 (dichlorvos)、乙硫磷 (ethion)、三唑磷 (triazophos)及二嗪磷 (diazinon)等;3) 低毒类 (100 <LD50<5 000),如:敌百虫 (trichlorfon)、辛硫磷 (phoxim)、杀虫畏 (tetrachlorvinphos) 及马拉硫磷 (malathion) 等。
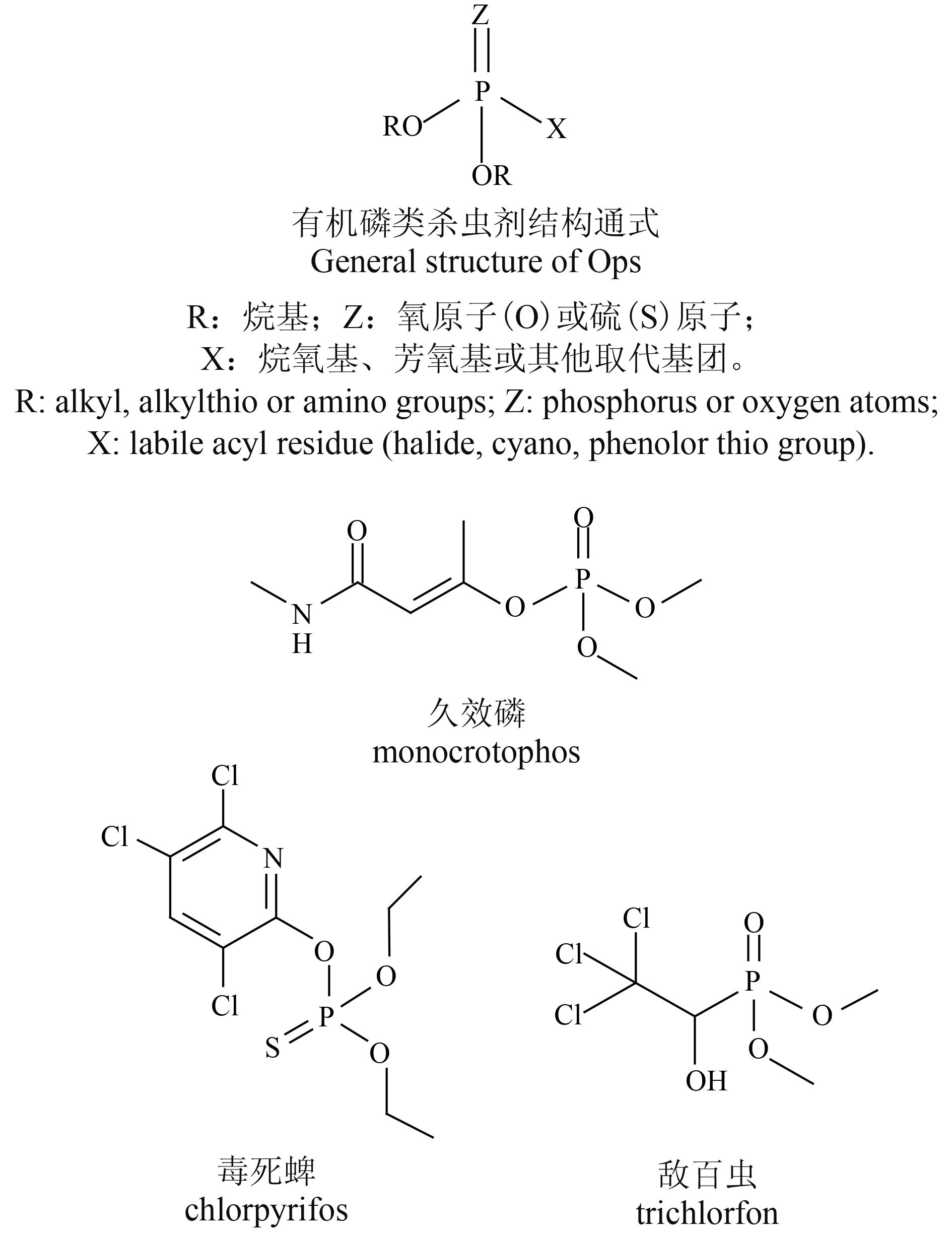
|
图式 1 有机磷类杀虫剂结构通式及典型化合物 Scheme1 General structure of organophosphate insecticides (OPs) and some typical compounds |
1.2 有机磷类杀虫剂对靶标生物的作用机制
对大多数动物而言,有机磷类杀虫剂对靶标的作用机制主要是抑制骨骼肌突触及肌肉神经接点的乙酰胆碱酯酶 (AChE) 活性,通过与其活性位点丝氨酸残基形成共价键而使之成为不易水解的磷酰化胆碱酯酶,失去水解乙酰胆碱 (ACh) 的能力,从而导致 ACh 在突触内蓄积,激活突触后膜的乙酰胆碱受体,使神经纤维长时间处于持续性兴奋状态,引起神经系统功能紊乱,诱发毒覃样和烟碱样作用及中枢神经系统中毒症状。由于不同种类的有机磷杀虫剂对 AChE 的抑制能力不同,故其毒性效应也有所差异[15]。
2 有机磷类杀虫剂对非靶标水生动物的毒性研究进展虽然 AChE 是有机磷类杀虫剂毒性作用的直接靶标,但于低剂量有机磷杀虫剂中暴露也可在不抑制 AChE 活性或不引起中毒症状的情况下造成神经毒性[16]。这意味着有机磷类杀虫剂还可作用于其他分子,通过非胆碱作用机制对机体产生毒性,因为仅基于胆碱酯酶的作用机制已不能解释其低剂量暴露对机体所产生的多种不良毒性效应。
2.1 对非靶标水生动物的毒性效应有机磷类杀虫剂在杀灭水体中靶标生物的同时也会对非靶标动物产生毒性,由于其作用机制不同以及水生动物自身对外界环境刺激耐受性和敏感度的差异,导致有机磷类杀虫剂对不同营养级水生动物的毒性效应也不同。因此,通过对水生生态系统中不同级别动物进行生态毒理学研究,将有助于探明有机磷类杀虫剂对水生生态环境的影响。先前的相关研究主要集中在有机磷类杀虫剂对不同水生动物安全浓度的确定及对其 AChE 活性的影响等方面,随着研究的不断深入,目前主要集中在其对机体正常机能产生干扰效应相关基因的表达及分子通路的研究,尤其是低剂量有机磷类杀虫剂暴露对非靶标动物毒性作用的分子机制等方面。
研究发现,有机磷类杀虫剂对不同水生动物幼体的形态发育具有毒性作用。例如,久效磷对马粪海胆 Hemicentrotus pulcherrimus 的毒性作用始于其原肠胚阶段,可抑制幼虫的腕长及体长生长[17]。将斑马鱼 Danio rerio 幼鱼暴露于 20 mg/L 的敌百虫中 3 d 后,可导致幼鱼出现心包水肿[18]。细鳞鲳 Piaractus mesopotamicus 暴露于 0.05 mg/L 敌百虫中 24 h,可导致其鳃水肿并充血[19];而罗氏沼虾 Macrobrachium rosenbergii 暴露于 0.4 mg/L 敌百虫中 24 h 后,除导致腮充血肿胀外,其鳃小片还出现了融合、坏死或增生现象[20]。将中国林蛙 Rana chensinensis 蝌蚪于低剂量敌百虫水体中持续暴露,其生长发育受到明显抑制,并可导致蝌蚪身体扭曲、尾部强直性弯曲等畸型的发生[21]。进一步研究显示,敌百虫可降低斑马鱼胚胎色素沉积,且其对斑马鱼胚胎孵化率和卵黄蛋白原吸收率的影响与暴露剂量和时间呈负相关[18]。于低剂量敌百虫中持续暴露还可引起异育银鲫 Carassius auratus gibelio 肝脏细胞受损,导致其线粒体结构被破坏、肿胀、空泡化、膜结构破损,粗面内质网膨胀以及核固缩等细胞凋亡特征[22]。将发育至第 7 天的水溞 Daphnia magna 于含不同亚致死剂量毒死蜱的水体中进行间隔暴露,当暴露浓度低于急性毒性阈值浓度时,机体可通过合成胆碱酯酶而恢复自身机能,但当体内药物累积超出阈值或间隔暴露中的清除期过短时,水溞则不能从毒死蜱的中毒状态得到恢复[23]。
有机磷类杀虫剂暴露还可对非靶标水生动物的种群发育产生毒性作用。暴露于甲基对氧磷 (paraoxon-methyl) (剂量小于 2.2 μg/L) 后水溞种群数量恢复试验表明,即使短暂的低剂量有机磷杀虫剂暴露也会对机体产生持久性毒性效应,导致处理组水溞的种群数量增长率明显低于对照组,其繁殖量不能完全恢复[24]。将美西螈 Ambystoma mexicanum 胚胎暴露于 10~30 mg/L 马拉硫磷后可导致胚胎死亡,同时马拉硫磷暴露还可导致其幼体发育延缓及畸形[25]。
2.2 对神经功能以及行为的影响有机磷类杀虫剂毒性作用的直接靶标是 AChE,此外还可作用于其他的靶分子,因此可将这些靶分子与 AChE 一起作为神经毒性的生物标志物。将金鱼 Carassius auratus 短时间暴露于 0.02~0.5 mg/L 的三唑磷后,发现其体内各组织中 AChE 活性均有所降低,而脑部尤为明显,且脑组织中生长激素 (growth hormone,GH)、促黄体激素 (luteinizing hormone,LH) 等激素的编码基因表达也发生了改变[26]。将鲤鱼 Cyprinus carpio 置于含 1.98 mg/L 马拉硫磷和 0.002 6 mg/L 三唑磷的水体中进行联合暴露,发现其体内 AChE 活性同样受到了抑制[27]。将光滑双脐螺 Biomphalaria glabrata 暴露于 2.5 和 5.0 mg/L 的谷硫磷 (azinphos-methyl) 中各 14 d 后,其体内 AChE 活性受到明显抑制,抑制率达 35%[28]。羧酸酯酶 (carboxylesterase,CarE) 作为有机磷类杀虫剂的交替靶标,可降低药剂对 AChE 的抑制作用,在机体对有机磷类杀虫剂的解毒过程中具有重要作用,常被用作为杀虫剂暴露对生物毒性的检测目标。将平角卷螺 Planorbarius corneus 暴露于 5 μg/L 的毒死蜱中 14 d 后,发现其机体内 AChE 和 CarE 的活性均受到了抑制,其中 AChE 是最敏感的毒性标志物[29],且该结果与谷硫磷胁迫下淡水腹足动物 Chilina gibbosa 的试验结果一致[30]。
低剂量有机磷类杀虫剂在对非靶标水生动物神经-内分泌系统功能形成干扰的同时,还能扰乱其正常行为。例如,久效磷对马粪海胆幼虫泳动行为的影响具有剂量-效应关系,能够扰乱幼虫自身向上的泳动行为,甚至造成泳动能力丧失[17]。通过免疫印迹检测发现,经久效磷暴露后海胆的血清素能神经细胞数量减少,轴突生长被显著抑制,同时,血清素能神经元形态发生异常,血清素受体细胞网络 (serotonin receptor cell network,SRCN) 中的口突横向纤维缺失,从而间接导致了其 SRCN 的紊乱[17]。将糠虾 Neomysis integer 暴露在 0.038 μg/L 的毒死蜱水体中 7 d,虾表现为极度活跃,趋向于向电流区域聚集,但其最大游泳速度大幅降低[31]。将发育早期的斑马鱼胚胎暴露于毒死蜱水体中,可对其行为形成显著影响,且该影响可一直持续至成鱼阶段。其中,低剂量 (10 ng/mL) 毒死蜱对斑马鱼空间区分能力的影响只体现在发育早期,而高剂量 (100 ng/mL) 毒死蜱对其空间区分能力的影响则具有显著的持续效应;毒死蜱对斑马鱼反应时间所产生的毒性效应因暴露剂量而异,低剂量暴露后斑马鱼反应明显变得迟钝,而高剂量处理组斑马鱼反应反而变快[32]。Scholz 等[33]的研究表明,二嗪磷会扰乱大马哈鱼 Oncorhyn-chus tshawytscha 的反捕和归巢行为:二嗪磷对大马哈鱼的游泳行为或由视觉引导的捕食行为均没有影响,但低剂量 (1.0 μg/L) 暴露会显著影响大马哈鱼由嗅觉介导的警戒行为,当其剂量达到 10 μg/L 时则会对大马哈鱼的归巢行为形成影响。表明此类有机磷杀虫剂在短时间、亚致死剂量暴露后可能会引起严重的行为障碍,这些障碍将对鱼类的存活率和生殖等产生负面影响。
2.3 对内分泌、生殖和发育的干扰有机磷类杀虫剂是众多环境内分泌干扰物 (environmental endocrine disruptors,EEDs) 中的一大类,其亚致死剂量暴露即可对非靶标水生动物的生殖、发育和内分泌形成干扰。据报道,谷硫磷暴露会导致光滑双脐螺产卵数量减少及孵化率降低,且其繁殖力与暴露剂量和时间呈负相关,高剂量暴露组甚至会造成繁殖能力完全丧失[28]。久效磷暴露可引起金鱼甲状腺滤泡细胞增生及肥大等变化,通过检测其血浆中甲状腺激素 (THs) 的含量,发现不同浓度久效磷暴露均可引起雄性金鱼血浆中 TT3 (total 3,3,5-triiodo-L-thyronine) 含量及其与 TT4 (total L-thyroxine) 比值的显著降低,而对雌性金鱼则表现为血浆中 FT3 (free T3) 含量显著降低[34]。进一步的研究表明,久效磷对脱碘酶基因表达具有组织特异性,而其对肝脏中 3 种脱碘酶基因 (d1、d2 和 d3) 表达的影响促进了雄鱼 THs 的代谢,最终导致其血浆中 TT3 水平降低,而血浆中 TT3 的负反馈调节作用进而促使垂体 tshβ mRNA 水平上调[34]。由此可见,久效磷具有潜在的甲状腺干扰效应,可通过影响下丘脑-垂体-甲状腺轴 (hypothalamic-pituitary-thyroid axis,HPT轴) 相关基因的表达,在下丘脑-垂体对甲状腺机能的调节、THs 在血液中的转运及其在外周组织中的脱碘转化等水平发挥干扰效应,从而造成鱼体内 THs 水平失衡[34]。另据报道,雄性孔雀鱼 Poecilia reticulata 在性成熟期间长时间接触久效磷,可导致其体内睾丸素含量降低,雌二醇升高,精子数量显著降低,同时,展现其第二性征的斑点面积缩小,颜色变浅,表明久效磷暴露过程中雄性孔雀鱼体内性激素水平发生了变化,该变化导致了其性征的变化,进而影响其生殖行为[35]。此外,久效磷暴露还可导致斑马鱼雌性及雌雄同体比例大幅增加[36]。在性别分化期,久效磷暴露组斑马鱼的性腺芳香化酶 cyp19a1a 基因表达提高,脑芳香化酶 cyp19a1b 基因转录增加,且随着暴露时间的延长,与卵巢分化相关的转录因子基因 foxl2 表达增加,而与精巢分化相关的转录因子基因 dmrt1 表达降低,说明久效磷可通过促进卵巢分化相关转录因子并抑制精巢分化相关转录因子的表达而引发雌性化效应[36]。因此,久效磷具有潜在的性别分化干扰作用,由其引起的性腺芳香化酶基因表达的上调可促使鱼体内睾酮向雌二醇转化,导致雌二醇水平上升,睾酮水平下降,使鱼体内雌雄激素水平失衡。而类固醇激素对性别分化的调节作用则可通过下丘脑-垂体-性腺轴 (hypothalamic-pituitary-gonadal axis,HPG轴) 的正反馈调节使得鱼体内雌激素再次升高,从而引发雌性化效应,干扰其性别分化[34-35-36]。
2.4 氧化应激效应及其导致的组织损伤有机磷类杀虫剂暴露可诱发机体产生氧化应激,扰乱相应的酶活性,影响氧化代谢等生理过程,从而使得机体内的代谢发生改变。当机体氧化程度超出自身抗氧化能力,致使其氧化和抗氧化作用失衡,倾向于过氧化状态时,将产生氧化中间产物,最终导致组织损伤及病变。涉及机体抗氧化防御系统的酶包括:超氧化物歧化酶 (superoxide dismutase,SOD)、过氧化氢酶 (catalase,CAT) 及谷胱甘肽转移酶 (glutathione S-transferase,GST) 等。
SOD 是机体应对氧化应激的第一层保护屏障,其活性变化可作为诱导氧化应激的生物标记。研究表明,0.5 mg/L 的敌百虫暴露可使异育银鲫血浆中 SOD 活性升高,而当敌百虫质量浓度高于 2 mg/L 时 SOD 活性反而下降[22]。甲基对硫磷暴露可诱发石头酯鲤 Brycon cephalus 不同组织中 SOD 活性升高,其中肌肉组织反应最为敏感,当甲基对硫磷质量浓度为 2 mg/L 时,其肌肉组织的 SOD 活性提高了 38%,肝和鳍则次之[37]。三唑磷暴露也可引起金鱼机体不同组织中 SOD 活性发生变化,且不同组织间酶活性变化存在差异性,除 0.02 mg/L 三唑磷可诱导脑组织中 SOD 活性升高 37% 外,0.1 和 0.5 mg/L 处理浓度则使得脑、脾脏、肾及肝组织中 SOD 活性降低了 8%~45%[26]。将罗非鱼暴露于0.005~0.015 mg/L 毒死蜱中 30 d 后,其性腺中 SOD 活性显著升高了 215.39%~446.15%,即使经过 15 d 的恢复处理后,0.015 mg/L 处理组 SOD 活性仍升高了 440.63%[38]。
CAT 作为抗氧化酶,其主要功能是保护机体抵御 H2O2 的损害,可将 H2O2 酶解为 O2 和 H2O,从而降低活性氧的毒性。研究表明,用谷硫磷处理淡水蜗牛 Chilina gibbosa 后,其体内 CAT 活性显著升高[30]。甲基对硫磷也可诱导石头酯鲤不同组织中 CAT 活性的升高[37]。然而,也有研究发现,0.1 和 0.5 mg/L 三唑磷暴露可使金鱼不同组织中 CAT 活性降低,其中肝、肾中酶活性降低最为显著[26]。此外,1 mg/L 的敌百虫可导致鲫鱼血浆中 CAT 活性升高,其他浓度处理组则 CAT 活性反而降低[22]。
GST 是生物体应对外源物质诱导形成氧化应激的主要解毒及抗氧化防御酶系,可通过催化还原型谷胱甘肽与有毒的输水亲电物质发生轭合反应,在外源物质对机体产生毒性之前将其排出体外。敌百虫暴露可导致斑马鱼肝脏组织中 GST 活性明显降低,而脑组织中 GST 活性的变化则不规律,对其余组织均无明显影响,表明斑马鱼肝脏组织对敌百虫反应最为敏感[18]。甲基对硫磷可诱使石头酯鲤的 GST 活性升高[37]。对于埃及蟾蜍 Bufo regularis,0.04 μg/L 二嗪磷暴露可使其 GST 活性显著增加,且其增加幅度在不同组织间存在差异,其中肝脏中 GST 活性变化最为明显,升高了 393%[39]。将南美蟾蜍 Rhinella arenarum 蝌蚪暴露于含 0.1 和 0.5 mg/L 毒死蜱的水体中 96 h 后,其体内 GST 活性均呈下降趋势[40]。将罗非鱼暴露于不同质量浓度 (0.005、0.01 和 0.015 mg/L) 毒死蜱中 15 d,其性腺组织中 GST 活性未受影响,暴露 30 d 后则 GST 活性下降,而经过 15 d 的恢复处理后,其 GST 活性可得到恢复[38]。
由此可见,即使在安全剂量下,有机磷类杀虫剂的持续暴露也可引起水生生物体内过量活性氧及自由基的形成。在机体可承受范围内,通过其自身的抗氧化系统可清除过量活性氧和自由基,但当暴露浓度超出临界值,机体的抗氧化系统受到破坏时,则会引起氧化应激反应。机体中的抗氧化酶可对有机磷类杀虫剂暴露后产生的脂质过氧化损伤起到保护作用,同时,类固醇激素水平的修复也可抑制氧化应激反应的产生。
2.5 导致基因损伤和遗传毒性有机磷类杀虫剂也可通过导致 DNA 损伤而产生遗传毒性。目前彗星电泳 (single cell gel electropho-resis,SCGE) 技术已被广泛用于单细胞水平下检测 DNA 的损伤,特别是环境污染物对生物体基因损伤的研究。而微核试验 (micronucleus,MN) 常被用于外源诱发剂对染色体遗传毒性的检测。通过微核试验和彗星电泳检测发现,亚致死剂量及安全浓度以下的毒死蜱对鲶鱼 Channa punctatus 具有遗传毒性,在 203.0 μg/L 毒死蜱水体中暴露 14 d 后,鲶鱼红细胞产生微核的现象最严重,暴露 5 d 则对 DNA 损伤最为严重,同时其淋巴细胞和鳃细胞呈缓慢非线性凋亡[41]。久效磷也可通过诱发染色体损伤进而导致遗传毒性,将文蛤 Meretrix ovum 暴露于久效磷水体后,其红细胞产生微核现象的显著性与暴露剂量成正相关[42]。用亚致死剂量的久效磷对鲶鱼进行暴露处理,通过检测其腮、肾和淋巴细胞表明,久效磷具有显著的遗传毒性,且暴露 4 d 时其对 DNA 的损伤最为严重,其中鳃细胞对久效磷反应最为敏感[43]。
2.6 对免疫功能的影响水域被有机磷类杀虫剂污染后,对其中的非靶标水生动物会形成胁迫,使其免疫活性下降,最终导致病原菌的侵染。现有研究认为,有机磷类杀虫剂高剂量、长时间胁迫下形成的免疫及细胞毒性作用除直接毒性外,还包括对细胞膜、蛋白及 DNA 的氧化损伤[44]。其中,溶酶体活性及吞噬作用的快速变化涉及调节激活、增殖及效应区信号转导通路的特异性阻断,以及膜蛋白对细胞离子浓度的调节[45]。血细胞在免疫防御中具有重要作用,采用甲基吡啶磷 (azamethiphos) 对蓝贝 Mytilus edulis 进行短时间暴露后,除引起神经毒性外,还会对其血细胞和机体免疫防御体系产生影响,经 0.1 mg/L 的甲基吡啶磷暴露 24 h 后,在蓝贝血细胞发生改变的同时,其血细胞的自噬能力也显著降低[45]。将罗氏沼虾暴露于 0.4 mg/L 的敌百虫中 6 h 后,发现其 SOD 基因的表达出现上调;24 h 后,机体免疫应答及免疫基因表达发生改变,如酚氧化酶原 (proPO)、葡聚糖结合蛋白 (LGBP)、细胞黏附蛋白 (PE)、巨球蛋白 (α-2M)、谷氨酰胺转移酶 (TG) 和铜锌超氧化物歧化酶 (Cu,Zn-SOD) 的表达均下降,从而引起机体的免疫缺陷并导致其对外界病原感染敏感性增加,但其具体分子作用通路尚待深入研究[46]。
3 低剂量有机磷类杀虫剂对水生动物的毒性机制及研究展望水环境是最易受污染的生态系统之一。不同营养级别的水生动物,包括溞类、甲壳类、鱼类及两栖类等,均可通过摄食、接触等多种途径摄入水体中的污染物。有机磷类杀虫剂种类多、应用广,目前在水产养殖中所使用的剂量即可对水生生物产生直接或间接的毒性,威胁其繁殖和生存,因此其毒性效应机制已成为生态和环境毒理学研究的热点[28]。除对 AChE 的抑制作用外,目前已经证明的有机磷类杀虫剂对水生动物的主要毒性机制还包括以下几方面:1) 通过干扰血清素递质含量及更新率,以及血清素合成酶、转运体、降解酶及受体的表达,扰乱血清素能神经系统,干扰神经内分泌系统功能,进而影响水生生物的正常行为。2) 通过影响小丘脑-垂体-甲状腺 (HPT)/性腺 (G) 轴相关基因的表达,造成机体激素水平失衡或扰乱内分泌系统,从而对生殖活动产生毒性。3) 通过影响机体的抗氧化防御体系,诱导机体产生氧化应激反应,改变体内抗氧化酶的活性,致使其抗氧化能力减弱,脂质过氧化反应增强,自由基产物过剩,从而加剧机体的氧化损伤,干扰组织器官的正常功能而产生毒性。由于在急性、亚急性有机磷类杀虫剂中毒,甚或极低剂量有机磷类杀虫剂暴露下都可产生氧化应激反应,因此对机体氧化应激的监测已被广泛用作有机磷类杀虫剂暴露的生物检测指标。4) 干扰神经细胞增殖与分化、扰乱轴突分布及树突生长,以及抑制神经营养因子前体转化的酶解过程和对线粒体的毒性[46]等其他机制。
关于有机磷类杀虫剂对水生动物的毒性机制,目前尚有许多问题亟待探明。例如:有机磷类杀虫剂对不同营养级非靶标水生动物的毒性效应是否一致,其毒性机制的差异有哪些,低剂量有机磷类杀虫剂在水生动物体内的蓄积机制是什么,其代谢通路及作用靶标是什么,等等。因此,1) 应确定有机磷类杀虫剂对不同水生生物的毒性,特别是对不同物种、不同生态环境及不同发育阶段非靶标水生动物的毒性;2) 应建立不同有机磷类杀虫剂个体对靶标生物的时间/剂量-作用关系,以确定有机磷类杀虫剂毒性效应及作用机制的多样性;3) 需明确体外试验中有机磷类杀虫剂对非胆碱靶标产生的多种毒性效应是否同样存在于生物体内,以及其毒性效应的持续性如何,尤其是在环境因素共同作用下此类杀虫剂的具体作用机制;4) 应明确有机磷类杀虫剂毒性效应与生物体自身对其感知及修复之间的作用通路 (如神经元功能作用的缺失等);5) 应深入研究有机磷类杀虫剂与机体中不同靶标分子间的相互作用关系,建立此类杀虫剂暴露后的合理恢复方案(如增强轴突转化的药物及抗氧化剂的运用等)。同时这对相关药物的研发、有机磷类杀虫剂水体污染及水源涵养地的生态风险评估及修复也甚为重要。
综上所述,有机磷类杀虫剂除通过磷酰化作用抑制 AChE 活性之外,也可对胆碱能系统中的其他组分产生影响,因此,关于此类杀虫剂对整个胆碱能系统的致毒机制还有待深入探究完善。同时,对有机磷类杀虫剂与神经元基本结构中的某些因素,如轴突运输蛋白、轴突线粒体功能及神经营养因子支架等之间相互作用的分析,可为其毒性作用机制研究提供依据。尤其值得关注的是,低剂量有机磷类杀虫剂暴露可在不引起 AChE 活性变化的情况下,导致某些激素水平的失衡甚至整个内分泌系统的紊乱;此外,此类杀虫剂对动物脑部发育过程中某些区域内树突生长及轴突分布的干扰作用,以及对某些神经递质相关基因表达的抑制作用等都将是未来需要深入研究的问题。
| [1] | MATSUMURA F. Toxicology of insecticides[M].2nd ed. New York: Plenum Press, 1985 . |
| [2] | KAMEL A, BYRNE C, VIGO C, et al. Oxidation of selected organophosphate pesticides during chlorination of simulated drinking water [J]. Water Res, 2009, 43 (2) :522–534 . doi:10.1016/j.watres.2008.10.038 |
| [3] | LAETZ C A, BALDWIN D H, COLLIER T K, et al. The synergistic toxicity of pesticide mixtures:implications for risk assessment and the conservation of endangered pacific salmon [J]. Environ Health Perspect, 2009, 117 (3) :348–353 . doi:10.1289/ehp.0800096 |
| [4] | LAETZ C A, BALDWIN D H, HEBERT V, et al. Interactive neurobehavioral toxicity of diazinon,malathion,and ethoprop to juvenile coho salmon [J]. Environ Sci Technol, 2013, 47 (6) :2925–2931 . doi:10.1021/es305058y |
| [5] | WANG P, TIAN Y, WANG X J, et al. Organophosphate pesticide exposure and perinatal outcomes in Shanghai,China [J]. Environ Int, 2012, 42 :100–104 . doi:10.1016/j.envint.2011.04.015 |
| [6] | LI H Z, MEHLER W T, LYDY M J, et al. Occurrence and distribution of sediment-associated insecticides in urban waterways in the Pearl River Delta,China [J]. Chemosphere, 2011, 82 (10) :1373–1379 . doi:10.1016/j.chemosphere.2010.11.074 |
| [7] | BALALI-MOOD M, BALALI-MOOD K, MOODI M, et al. Health aspects of organophosphorous pesticides in Asian countries [J]. Iran J Public Health, 2012, 41 (10) :1–14 . |
| [8] | YU R, LIU J S, WANG Q C, et al. Concentrations of organophosphorus pesticides in fresh vegetables and related human health risk assessment in Changchun,Northeast China [J]. Food Control, 2016, 60 :353–360 . doi:10.1016/j.foodcont.2015.08.013 |
| [9] | ZHANG Y, HAN S, LIANG D H, et al. Prenatal exposure to organophosphate pesticides and neurobehavioral development of neonates:a birth cohort study in Shenyang,China [J]. PLoS One, 2014, 9 (2) :e88491. doi:10.1371/journal.pone.0088491 |
| [10] | USEPA.Revised cumulative risk assessment:organophosphorus pesticides[R].Washington,DC:U.S.Environmental Protection Agency,2002. |
| [11] | MACDONALD R W, BARRIE L A, BIDLEMAN T F, et al. Contaminants in the Canadian Arctic:5 years of progress in understanding sources,occurrence and pathways [J]. Sci Total Environ, 2000, 254 (2-3) :93–234 . doi:10.1016/S0048-9697(00)00434-4 |
| [12] | ZHANG Z L, HONG H S, WANG X H, et al. Determination and load of organophosphorus and organochlorine pesticides at water from Jiulong River Estuary,China [J]. Mar Pollut Bull, 2002, 45 (1-12) :397–402 . doi:10.1016/S0025-326X(02)00094-2 |
| [13] | ZHENG S, CHEN B, QIU X Y, et al. Distribution and risk assessment of 82 pesticides in Jiulong River and estuary in South China [J]. Chemosphere, 2016, 144 :1177–1192 . doi:10.1016/j.chemosphere.2015.09.050 |
| [14] | GAO J J, LIU L H, LIU X R, et al. The occurrence and spatial distribution of organophosphorous pesticides in Chinese surface water [J]. Bull Environ Contaminat Toxicol, 2009, 82 (2) :223–229 . doi:10.1007/s00128-008-9618-z |
| [15] | HUSAIN K. Delayed neurotoxicity of organophosphorus compounds [J]. J Environ Immunol Toxicol, 2013, 1 :14–21 . doi:10.7178/jeit |
| [16] | TERRY Jr A V. Functional consequences of repeated organophosphate exposure:potential non-cholinergic mechanisms [J]. Pharmacol Therapeut, 2012, 134 (3) :355–365 . doi:10.1016/j.pharmthera.2012.03.001 |
| [17] | YAO D, RU S G, KATOW H. The neurotoxic effects of monocrotophos on the formation of the serotonergic nervous system and swimming activity in the larvae of the sea urchin Hemicentrotus pulcherrimus [J]. Environ Toxicol Pharmacol, 2010, 30 (2) :181–187 . doi:10.1016/j.etap.2010.06.001 |
| [18] | COELHO S, OLIVEIRA R, PEREIRA S, et al. Assessing lethal and sub-lethal effects of trichlorfon on different trophic levels [J]. Aquat Toxicol, 2011, 103 (3-4) :191–198 . doi:10.1016/j.aquatox.2011.03.003 |
| [19] | MATAQUEIRO M I, NAKAGHI L S O, DE SOUZA J P, et al. Histopathological changes in the gill,liver and kidney of pacu (Piaractus mesopotamicus,Holmberg,1887) exposed to various concentrations of trichlorfon [J]. J Appl Ichthyol, 2009, 25 (1) :124–127 . doi:10.1111/jai.2009.25.issue-1 |
| [20] | CHANG C C, LEE P P, HSU J P, et al. Survival,and biochemical,physiological,and histopathological responses of the giant freshwater prawn,Macrobrachium rosenbergii,to short-term trichlorfon exposure [J]. Aquaculture, 2006, 253 (1-4) :653–666 . doi:10.1016/j.aquaculture.2005.05.011 |
| [21] |
马瑜, 李勃, 张育辉. 敌百虫对中国林蛙蝌蚪生长发育的毒性效应 [J]. 生态毒理学报, 2014,9 (3)
:531–537.
MA Y, LI B, ZHANG Y H. Toxicity effect of trichlorfon on the growth and development of tadpoles Rana chensinensis [J]. Asian J Ecotoxicol, 2014, 9 (3) :531–537 . |
| [22] |
徐维娜.敌百虫对异育银鲫抗氧化应激系统的影响及抗坏血酸对鱼体的保护作用[D].南京:南京农业大学,2009:39-49.
XU W N.Effect of trichlorfon on anti-oxidative system and protection of ascorbic acid on Carassais auratus gibebio[D].Nanjing:Nanjing Agricultural University,2009:39-49. |
| [23] | NADDY R B, KLAINE S J. Effect of pulse frequency and interval on the toxicity of chlorpyrifos to Daphnia magna [J]. Chemosphere, 2001, 45 (4-5) :497–506 . doi:10.1016/S0045-6535(01)00019-4 |
| [24] | DUQUESNE S. Effects of an organophosphate on Daphnia magna at suborganismal and organismal levels:implications for population dynamics [J]. Ecotoxicol Environ Safety, 2006, 65 (2) :145–150 . doi:10.1016/j.ecoenv.2006.01.008 |
| [25] | ROBLES-MENDOZA C, GARCÍA-BASILIO C, CRAM-HEYDRICH S, et al. Organophosphorus pesticides effect on early stages of the axolotl Ambystoma mexicanum (Amphibia:Caudata) [J]. Chemosphere, 2009, 74 (5) :703–710 . doi:10.1016/j.chemosphere.2008.09.087 |
| [26] | LIU L, ZHU B, GONG Y X, et al. Neurotoxic effect of triazophos on goldfish (Carassius auratus) and tissue specific antioxidant responses [J]. Ecotoxicol Environ Safety, 2015, 116 :68–75 . doi:10.1016/j.ecoenv.2015.03.001 |
| [27] | WANG Y H, CHEN C, ZHAO X P, et al. Assessing joint toxicity of four organophosphate and carbamate insecticides in common carp (Cyprinus carpio) using acetylcholinesterase activity as an endpoint [J]. Pestic Biochem Physiol, 2015, 122 :81–85 . doi:10.1016/j.pestbp.2014.12.017 |
| [28] | KRISTOFF G, CACCIATORE L C, GUERRERO N R V, et al. Effects of the organophosphate insecticide azinphos-methyl on the reproduction and cholinesterase activity of Biomphalaria glabrata [J]. Chemosphere, 2011, 84 (5) :585–591 . doi:10.1016/j.chemosphere.2011.03.058 |
| [29] | RIVADENEIRA P R, AGRELO M, OTERO S, et al. Different effects of subchronic exposure to low concentrations of the organophosphate insecticide chlorpyrifos in a freshwater gastropod [J]. Ecotoxicol Environ Safety, 2013, 90 :82–88 . doi:10.1016/j.ecoenv.2012.12.013 |
| [30] | BIANCO K, YUSSEPPONE M S, OTERO S, et al. Cholinesterases and neurotoxicity as highly sensitive biomarkers for an organophosphate insecticide in a freshwater gastropod (Chilina gibbosa) with low sensitivity carboxylesterases [J]. Aquat Toxicol, 2013, 144-145 :26–35 . doi:10.1016/j.aquatox.2013.09.025 |
| [31] | ROAST S D, WIDDOWS J, JONES M B. Disruption of swimming in the hyperbenthic mysid Neomysis integer (Peracarida:Mysidacea) by the organophosphate pesticide chlorpyrifos [J]. Aquat Toxicol, 2000, 47 (3-4) :227–241 . doi:10.1016/S0166-445X(99)00016-8 |
| [32] | LEVIN E D, CHRYSANTHIS E, YACISIN K, et al. Chlorpyrifos exposure of developing zebrafish:effects on survival and long-term effects on response latency and spatial discrimination [J]. Neurotoxicol Teratol, 2003, 25 (1) :51–57 . doi:10.1016/S0892-0362(02)00322-7 |
| [33] | SCHOLZ N L, TRUELOVE N K, FRENCH B L, et al. Diazinon disrupts antipredator and homing behaviors in chinook salmon (Oncorhynchus tshawytscha) [J]. Can J Fish Aquat Sci, 2000, 57 (9) :1911–1918 . doi:10.1139/f00-147 |
| [34] | ZHANG X N, TIAN H, WANG W, et al. Exposure to monocrotophos pesticide causes disruption of the hypothalamic-pituitary-thyroid axis in adult male goldfish (Carassius auratus) [J]. General Comp Endocrinol, 2013, 193 :158–166 . doi:10.1016/j.ygcen.2013.08.003 |
| [35] | TIAN H, LI Y, WANG W, et al. Exposure to monocrotophos pesticide during sexual development causes the feminization/demasculinization of the reproductive traits and a reduction in the reproductive success of male guppies (Poecilia reticulata) [J]. Toxicol Appl Pharmacol, 2012, 263 (2) :163–170 . doi:10.1016/j.taap.2012.06.006 |
| [36] | ZHANG X N, GAO L, YANG K F, et al. Monocrotophos pesticide modulates the expression of sexual differentiation genes and causes phenotypic feminization in zebrafish (Danio rerio) [J]. Comp Biochem Physiol C Toxicol Pharmacol, 2013, 157 (1) :33–40 . doi:10.1016/j.cbpc.2012.09.004 |
| [37] | MONTEIRO D A, DE ALMEIDA J A, RANTIN F T, et al. Oxidative stress biomarkers in the freshwater characid fish,Brycon cephalus,exposed to organophosphorus insecticide Folisuper 600(methyl parathion) [J]. Comp Biochem Physiol C Toxicol Pharmacol, 2006, 143 (2) :141–149 . doi:10.1016/j.cbpc.2006.01.004 |
| [38] | ORUÇEÖ. Oxidative stress,steroid hormone concentrations and acetylcholinesterase activity in Oreochromis niloticus exposed to chlorpyrifos [J]. Pestic Biochem Physiol, 2010, 96 (3) :160–166 . doi:10.1016/j.pestbp.2009.11.005 |
| [39] | EZEMONYE L, TONGO I. Sublethal effects of endosulfan and diazinon pesticides on glutathione-S-transferase (GST) in various tissues of adult amphibians (Bufo regularis) [J]. Chemosphere, 2010, 81 (2) :214–217 . doi:10.1016/j.chemosphere.2010.06.039 |
| [40] | LIENDRO N, FERRARI A, MARDIROSIAN M, et al. Toxicity of the insecticide chlorpyrifos to the South American toad Rhinella arenarum at larval developmental stage [J]. Environ Toxicol Pharmacol, 2015, 39 (2) :525–535 . doi:10.1016/j.etap.2014.12.022 |
| [41] | ALI D, NAGPURE N S, KUMAR S, et al. Assessment of genotoxic and mutagenic effects of chlorpyrifos in freshwater fish Channa punctatus (Bloch) using micronucleus assay and alkaline single-cell gel electrophoresis [J]. Food Chem Toxicol, 2009, 47 (3) :650–656 . doi:10.1016/j.fct.2008.12.021 |
| [42] | REVANKAR P R, SHYAMA S K. Genotoxic effects of monocrotophos,an organophosphorous pesticide,on an estuarine bivalve,Meretrix ovum [J]. Food Chem Toxicol, 2009, 47 (7) :1618–1623 . doi:10.1016/j.fct.2009.04.010 |
| [43] | ALI D, KUMAR S. Long-term genotoxic effect of monocrotophos in different tissues of freshwater fish Channa punctatus (Bloch) using alkaline single cell gel electrophoresis [J]. Sci Total Environ, 2008, 405 (1-3) :345–350 . doi:10.1016/j.scitotenv.2008.05.037 |
| [44] | HANDY R D, GALLOWAY T S, DEPLEDGE M H. A proposal for the use of biomarkers for the assessment of chronic pollution and in regulatory toxicology [J]. Ecotoxixology, 2003, 12 :331–343 . doi:10.1023/A:1022527432252 |
| [45] | CANTY M N, HAGGER J A, MOORE R T, et al. Sublethal impact of short term exposure to the organophosphate pesticide azamethiphos in the marine mollusk Mytilus edulis [J]. Mar Pollut Bull, 2007, 54 (4) :396–402 . doi:10.1016/j.marpolbul.2006.11.013 |
| [46] | CHANG C C, RAHMAWATY A, CHANG Z W. Molecular and immunological responses of the giant freshwater prawn,Macrobrachium rosenbergii,to the organophosphorus insecticide,trichlorfon [J]. Aquat Toxicol, 2013, 130-131 :18–26 . doi:10.1016/j.aquatox.2012.12.024 |
 2016, Vol. 18
2016, Vol. 18


