韭菜Allium tuberosum Rottl.ex Spreng.,是多年生蔬菜中的常见品种,占地时间长,病虫害发生频繁,其中灰霉病和锈病是常见病害。三唑酮(图式 1)推荐用于韭菜叶斑病的防治[1],而腐霉利(图式 1)常用于灰霉病的防治[2-3]。中国尚未规定韭菜中三唑酮的最大残留限量(MRL),但规定了腐霉利的MRL值为0.2 mg/kg[4];欧盟规定韭菜中三唑酮和腐霉利的MRL值分别为0.1 mg/kg[5]和0.01 mg/kg[6]。为了有效回避潜在的食用风险,建立一种同时检测韭菜中三唑酮和腐霉利残留量的方法是必要的。
|
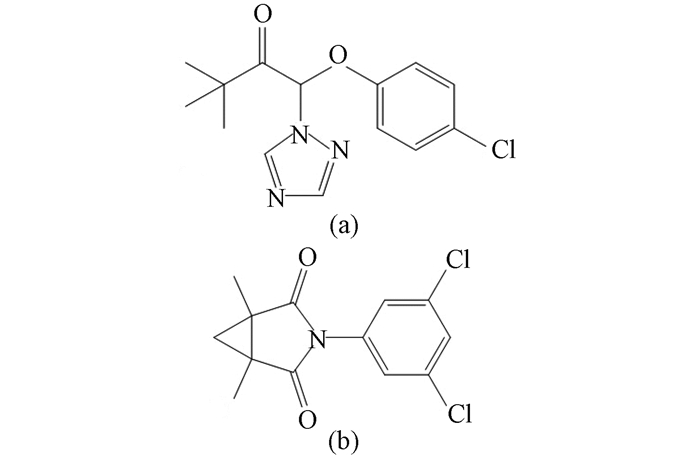
图式 1 三唑酮(a)和腐霉利(b)化学结构式 Scheme1 Structure of triadimefon(a)and procymidone(b) |
三唑酮和腐霉利常用的检测方法主要是气相色谱法[7-9]和气相色谱-质谱法[10-13],少量报道中使用高效液相色谱测定腐霉利[14-15],主要涉及果蔬、茶饮料、人参和食用油等基质中的残留,未见韭菜中三唑酮和腐霉利同时检测的报道。韭菜中的蒜氨酸在蒜氨酸酶作用下会水解产生一系列含有不同取代基的硫化酯、硫醚等硫化物[16-17],对检测结果可产生高背景干扰。鉴于此,本研究采用乙腈提取和石墨化碳黑/氨基混合型固相萃取柱净化,气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS/MS)检测,建立了韭菜中同时检测三唑酮和腐霉利残留量的方法。
1 材料与方法 1.1 仪器、试剂与材料7000三重串联四级杆气-质联用仪(美国,Agilent公司);EB-280-12电子顶载天平(千分之一天平,精确到0.001 g,日本岛津公司);T25 basic高速匀浆机(广州仪科实验技术有限公司);QL-901漩涡混合器(江苏海门麒麟医用仪器厂);RE52CS-1旋转蒸发仪(上海亚荣生化仪器厂);石墨化碳黑/氨基混合型固相萃取柱(500 mg/6 mL,Agilent Technologies);毛细管气相色谱柱SLB-5MS(美国Supelco公司)。
三唑酮(triadimefon)和腐霉利(procymidone)标准品,纯度≥ 99%(天津农业部环境质量监督检验测试中心);乙腈、丙酮和正己烷,均为色谱纯(美国Fisher公司);其余试剂均为市售分析纯。韭菜,购于海南市场。
1.2 试验方法 1.2.1 样品前处理准确称取鲜韭菜样品1 200 g,用食品料理机粉碎,混匀,于–18 ℃下保存,备用。
1)样品提取:按“NY/T 761—2008”标准方法[18]进行。2)样品净化:准确量取5 mL V(乙腈): V(甲苯)=3 : 1溶液预淋洗固相萃取柱,弃去淋洗液,用2 mL该溶液洗脱,重复两次;最后用20 mL该溶液洗脱;收集全部洗脱液,旋蒸至近干,氮气吹干,用正己烷定容至2 mL,待测。
1.2.2 气相色谱-串联质谱(GC-MS/MS)检测条件色谱条件:程序升温过程,初始温度为120 ℃,然后以30 ℃/min升温至240 ℃,再以5 ℃/min升温至260 ℃,最后以20 ℃/min升温至280 ℃;总运行时间:9.0 min;载气:氦气,纯度≥ 99.999%;恒流模式,流速为1.00 mL/min;进样口温度为260 ℃;进样量为1 μL;进样方式为不分流进样。
质谱条件:碰撞气流速为氦气1.50 mL/min,氮气2.25 mL/min;离子源为70 eV电子轰击源;扫描方式为正离子;离子源温度为230 ℃;溶剂延迟4.00 min;多反应监测模式。三唑酮和腐霉利的保留时间、定量离子对、定性离子对以及碰撞能量见表 1。
|
|
表 1 在多反应监测模式下待测农药的检测条件 Table 1 MS/MS conditions for tested pesticides under MRM mode |
1.2.3 标准溶液及基质标准溶液的配制
标准溶液的配制:三唑酮和腐霉利分别用正己烷溶解配制成100 mg/L标准储备液,于–18 ℃保存,备用。
基质标准溶液的配制:按1.2.1节的方法将空白样品(未有三唑酮和腐霉利检出的样品)配制成基质溶液,用基质溶液稀释标准储备液,配制成所需的基质匹配标准溶液,现用现配。
1.2.4 添加回收试验称取4组经测定不含三唑酮和腐霉利的空白韭菜样品,每组5个重复。在空白样品中分别添加三唑酮和腐霉利的混合标准溶液,添加水平分别为0.01、0.05、0.1和0.5 mg/kg,按照所建立的方法测定,计算添加回收率和相对标准偏差(RSD)。
2 结果与讨论 2.1 样品前处理条件优化 2.1.1 提取剂的选择考察了以乙腈、丙酮和正己烷为提取剂时对提取效果的影响。结果(图 1)表明:当添加水平为0.1 mg/kg时,以乙腈为提取剂时三唑酮和腐霉利的回收率均高于以正己烷和丙酮为提取剂的,故选用乙腈为提取剂。

|
图 1 提取剂对三唑酮和腐霉利回收率的影响(n=5) Fig. 1 Effect of extractant on the recoveries of triadimefon and procymidone(n=5) |
2.1.2 固相萃取柱的优化
韭菜基质比较复杂,富含糖、粗蛋白、粗脂肪、膳食纤维、维生素、钙、镁、锌、硒等成分,其中色素含量较高[19],干扰测定结果的准确性。农药残留检测中常用石墨化碳黑柱、氨基柱等固相萃取柱去除色素等杂质,本研究对石墨化碳黑柱、氨基柱及石墨化碳黑/氨基复合柱的净化效果进行了比较。结果表明:3种柱的去除色素效果相当,但以石墨化碳黑/氨基复合柱的回收率最高,故选用石墨化碳黑/氨基复合柱。
2.2 待测农药定量和定性离子的选择首先,在m/z 0~500之间分别对三唑酮和腐霉利的标准溶液(1.00 mg/L)进行全扫描,确定其保留时间(表 1)和质谱图(图 2)。在质谱图中,母离子选择标准为特征性、质量数和对称性均高,同时重现性好且不与柱流失碎片离子相同的一级碎片离子,三唑酮选择208和181为母离子,腐霉利选择283和96为母离子。利于离子轰击扫描对选择的母离子在10 eV碰撞能量下进行电离轰击,选择强度较大、灵敏度高的为子离子。选择不同的碰撞能量对每一组离子对进行扫描,选择丰度最高的一对子离子为定量离子对,选择丰度次高的一对子离子为定性离子对,优化后的多反应监测条件见表 1。图 3为三唑酮和腐霉利在添加水平为0.01 mg/L时和在表 1条件下得到的多反应监测总离子流图。从图中可以看出:所有谱峰峰形尖锐,对称性好,各谱峰间完全分离。

|
图 2 三唑酮和腐霉利标准品(1.00 mg/L)的质谱图 Fig. 2 Full-scan MS spectrum of triadimefon and procymidone in a standard sample(1.00 mg/L) |

|
图 3 三唑酮和腐霉利添加水平为0.01 mg/L时的多反应监测(MRM)色谱图 Fig. 3 MRM spectrum of triadimefon and procymidone with fortified concentration of 0.01 mg/L |
2.3 线性方程、定量限、回收率和精密度 2.3.1 线性方程
按1.2.3节的方法配制0.01~0.5 mg/kg内5个梯度浓度的混合标准溶液,按1.2.2的条件测定,分别以其定量离子峰面积(y)对其质量浓度(x)(mg/kg)绘制标准曲线。线性方程见表 2。结果表明:在0.01~0.5 mg/kg范围内,决定系数R2大于0.99,线性关系良好。
|
|
表 2 三唑酮和腐霉利的线性方程及决定系数 Table 2 Linear equations and determination coefficient for triadimefon and procymidone |
2.3.2 定量限
以3倍信噪比(S/N)计算得到韭菜中三唑酮和腐霉利的检出限为9×10-5 mg/kg;以10倍信噪比确定其定量限(LOQ)为3×10-4 mg/kg。通过实际添加回收试验,最终确定韭菜中三唑酮的LOQ为0.005 mg/kg,腐霉利的LOQ为0.001 mg/kg,平均回收率分别为85%和77%,相对标准偏差(RSD)分别为9.0%和6.3%(n=5)。本方法的LOQ可满足中国及欧盟等对韭菜中三唑酮和腐霉利最大残留限量的检测要求[4-6]。
2.3.3 回收率和精密度在0.01、0.05、0.1和0.5 mg/kg 4个添加水平下,三唑酮和腐霉利残留的平均回收率在84%~98%之间;RSD在2.0%~7.3%(n=5)之间,均满足定量分析要求[4-6](表 3)。
|
|
表 3 三唑酮和腐霉利的添加回收率及其相对标准偏差(n=5) Table 3 Average recoveries and relative standard deviations(RSD)of triadimefon and procymidone(n=5) |
2.4 实际样品的检测
按本研究建立的方法对市场购买的10份实际韭菜样品进行检测。结果表明:有1个样品检出三唑酮0.008 mg/kg,一个样品检出腐霉利0.011 mg/kg,但未超过中国制定的MRL值,可满足实际样品的检测需求。
3 结论本研究对“NY/T 761—2008”标准[18]进行了优化,并优化了串联质谱测定条件,采用基质匹配标准曲线外标法定量,建立了定性、定量测定韭菜中三唑酮和腐霉利残留量的气相色谱-串联质谱检测方法。结果表明:串联质谱法能很好地排除韭菜中复杂基质的干扰;还能提高分析的选择性和检测灵敏度,所建立的方法不仅能满足农药残留分析的要求,而且可以满足中国及欧盟等国规定的韭菜中三唑酮和腐霉利MRL值的检测要求。
| [1] | JORDAN M M, MAUDE R B, BURCHILL R T. Tests of fungicides for the control of leaf blotch diseases: Cladosporium allii of leek and C. alliicepae of onion [J]. Crop Prot, 1990, 9 (5) :367–370 . |
| [2] |
秦虎强, 史清华. 50% 腐霉利WP防治韭菜灰霉病 [J]. 农药, 1999,38 (7)
:24–25.
QIN H Q, SHI Q H. Test on control of Chinese chives Botrytis squamosa Walker with procymidone [J]. Pesticides, 1999, 38 (7) :24–25 . |
| [3] | CHEN L, LI X S, WANG Z Q, et al. Residue dynamics of procymidone in leeks and soil in greenhouses by smoke generator application [J]. Ecotox Environ Safe, 2010, 73 (1) :73–77 . |
| [4] |
食品中农药最大残留限量: GB 2763—2014[S]. 北京: 中国标准出版社, 2014.
Maximum residue limits for pesticides in food: GB 2763—2014[S]. Beijing: China Standard Press, 2014. |
| [5] | Amending Annexes Ⅱ, Ⅲ and Ⅳ to Regulation (EC) No 396/2005 of the European Parliament and of the Council as regards maximum residue levels for certain pesticides in or on certain products: Commission Regulation (EU) No 459/2010[S]. Rue Froissart: European Commission, 2010. |
| [6] | Amending Annexes Ⅱ, Ⅲ and Ⅴ to Regulation (EC) No 396/2005 of the European Parliament and of the Council as regards maximum residue levels for carbaryl, procymidone and profenofos in or on certain products: Commission Regulation (EU) No 1096/2014[S]. Rue Froissart: European Commission, 2014. |
| [7] |
徐国锋, 聂继云, 李静, 等. 苹果、香蕉和柑橘中腐霉利等4种防腐保鲜剂残留分析方法 [J]. 农药学学报, 2009,11 (3)
:351–356.
XU G F, NIE J Y, LI J, et al. Residue analysis of procymidone, imazalil, iprodione and prochloraz in apple, banana and citrus [J]. Chin J Pestic Sci, 2009, 11 (3) :351–356 . |
| [8] |
韩丙军, 汤建彪, 林靖凌, 等. 气相色谱法测定茶饮料中腐霉利、哒螨灵、高效氯氰菊酯残留 [J]. 江苏农业科学, 2012,40 (4)
:290–291.
HAN B J, TANG J B, LIN J L, et al. Determination of procymidone, pyridine and cypermethrin residues in tea beverages by gas chromatography [J]. Jiangsu Agric Sci, 2012, 40 (4) :290–291 . |
| [9] | WALORCZYK S. Gas chromatographic-tandem mass spectrometric analysis of pesticides residues in produce using concurrent solvent recondensation-large volume injection [J]. J Chromatogr A, 2012, 1222 :98–108 . |
| [10] | LI Y, KIM M R, LEE K B, et al. Determination of procymidone residues in ginseng by GC-ECD and GC-MS equipped with a solvent-free solid injector [J]. Food Control, 2007, 18 (4) :364–368 . |
| [11] |
郑龙, 周敏. 气相色谱-质谱联用法测定蔬菜中的腐霉利残留试验 [J]. 广东农业科学, 2009 (3)
:155–156.
ZHENG L, ZHOU M. Determination of procymidone in vegetables by gas chromatography-mass spectrometry [J]. Guangdong Agric Sci, 2009 (3) :155–156 . |
| [12] | WU G, BAO X X, ZHAO S H, et al. Analysis of multi-pesticide residues in the foods of animal origin by GC-MS coupled with accelerated solvent extraction and gel permeation chromatography cleanup [J]. Food Chem, 2011, 126 (2) :646–654 . |
| [13] | RESTREPO A R, ORTIZ A F G, OSSA D E H, et al. QuEChERS GC-MS validation and monitoring of pesticide residues in different foods in the tomato classification group [J]. Food Chem, 2014, 158 :153–161 . |
| [14] |
祁超, 张浩, 潘洪玉, 等. 腐霉利的高效液相色谱分析 [J]. 农药, 1998,37 (8)
:18–19.
QI C, ZHANG H, PAN H Y, et al. Determination of procymidone by RP-HPLC [J]. Pesticides, 1998, 37 (8) :18–19 . |
| [15] | DZUMAN Z, ZACHARIASOVA M, VEPRIKOVA Z, et al. Multi-analyte high performance liquid chromatography coupled to high resolution tandem mass spectrometry method for control of pesticide residues, mycotoxins, and pyrrolizidine alkaloids [J]. Anal Chim Acta, 2015, 863 :29–40 . |
| [16] |
陈黎, 王金芳, 杜鹏, 等. 韭菜中吡虫啉和啶虫脒残留的微波处理-逆固相分散法净化及液相色谱检测 [J]. 分析化学, 2008,36 (10)
:1364–1368.
CHEN L, WANG J F, Du P, et al. Determination of imidacloprid and acetamiprid in leek by reversed phase high performance liquid chromatography with microwave treatment and convenient reverse solid phase dispersion clean-up [J]. Chin J Anal Chem, 2008, 36 (10) :1364–1368 . |
| [17] | QU L J, ZHANG H, ZHU J H, et al. Rapid determination of organophosphorous pesticides in leeks by gas chromatography-triple quadrupole mass spectrometry [J]. Food Chem, 2010, 122 (1) :327–332 . |
| [18] |
蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定: NY/T 761—2008[S]. 北京: 中国农业出版社, 2008.
Pesticide mul-tiresidue screen methods for determination of organophosphorus pesticides, organochlorine pesticides, pyrethroid pesticides and carbamate pesticides in vegetables and fruits: NY/T 761—2008[S]. Beijing: China Agriculture Press, 2008. |
| [19] |
王俊魁, 杨帆, 赵丽华, 等. 沙葱与韭菜中营养成分分析比较 [J]. 营养学报, 2013,35 (1)
:86–88.
WANG J K, YANG F, ZHAO L H, et al. Analysis and comparison of nutritional components in Allium mongolicum Regel and Chinese chive (Allium tuberosum Rottler) [J]. Acta Nutrimenta Sinica, 2013, 35 (1) :86–88 . |
 2016, Vol. 18
2016, Vol. 18


