2. 上海海洋大学食品学院, 上海 201306
2. College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China
食用菌含有高蛋白以及人体所必需的多种氨基酸和微量元素,是兼有荤素两者之长的高档食品,深受广大消费者喜爱。但由于食用菌生产过程具有密封、潮湿和不见光等特点,病虫害一直是影响食用菌生产和品质的主要因素之一。目前在中国已报道的食用菌害虫包括双翅目、鳞翅目、蜱螨目、鞘翅目等11目44科90余种[1]。
啶虫脒是由日本曹达株式会于1996年开发并商品化的新型高效杀虫剂,属于烟碱类杀虫剂,对刺吸式口器害虫,如蚜虫、飞虱、叶蝉和粉虱以及对鞘翅目、双翅目和鳞翅目等有明显防治效果。有报道指出,食用菌中啶虫脒等烟碱类农药残留检出率在5.4%[2]。El Hassani等[3]研究发现,啶虫脒在环境中对有益昆虫有不利影响;Kocaman等[4]在体外试验中发现,啶虫脒对人淋巴细胞会诱发DNA损伤。因此,许多国家和地区制定了啶虫脒在农产品中的最大残留限量(MRL)值(0.01~5 mg/kg),涉及蔬菜,水果和食用菌等多种农产品[5-6]。
目前,对啶虫脒在蔬菜、水果和茶叶中的残留分析检测方法以气相色谱为主,也有用液相色谱检测的方法[7-13]。有关食用菌中农药残留与消解行为已有一些研究报道[14-19],但有关工厂化食用菌栽培中农药在土-菇-料系统中的残留变化和迁移研究尚未见报道。为此本研究在工厂化双孢蘑菇栽培环境下,研究了覆土、培养料和双孢蘑菇子实体中啶虫脒的残留消解以及覆土、培养料对子实体中农药的贡献率情况,以期为啶虫脒合理和安全使用提供理论依据。
1 材料与方法 1.1 供试药剂、试剂与仪器设备99.5%啶虫脒(acetamprid)标准品(上海市农药研究所提供);70%啶虫脒水分散粒剂(上海亚泰农资有限公司);乙腈和甲醇(均为色谱纯,德国Merck公司);氯化钠、无水硫酸镁(分析纯,纯度99%,上海埃彼化学试剂有限公司);乙二胺-N-丙基硅烷(PSA,粒径40~60 μm,广州亮化化工有限公司);Al2O3(粒径75~150 μm,中国医药集团上海化学试剂公司)。
ACQUITY UPLCTM超高效液相色谱仪,带二极管阵列检测器(UPLC-PDA,美国Waters公司);MX-S涡旋仪(美国赛洛捷克公司);D-37520冷冻离心机(Thermo公司);SK8300GT超声波清洗器(上海科导超声仪器有限公司);T25型IKA ULTRA-TURRAX分散机均质器(上海倍绣科学仪器有限公司);HWS-250电热恒温鼓风干燥箱(上海精宏实验设备有限公司);Ultra系列超纯水仪(上海首立实业有限公司);N-EVAP-12氮吹仪(美国Organomation公司);CM230 L手推式搅拌机(吴军机械厂);HR2096飞利浦食品搅拌机(飞利浦电子香港有限公司)。
1.2 田间试验设计参考《农药残留试验准则》[20],于上海市金山区联中食用菌专业合作社工厂化双孢菇栽培基地进行试验。试验用土为东北长白山附近深层草炭土。覆土按质量分数为80.2%的草炭土、17.3%的水、2%的碳酸钙、0.2%的石膏和0.3%的生石灰组成,于手推式搅拌机中混匀备用。培养料以小麦秸秆为主,按质量分数为52%的秸秆、39.3%的鸡粪、1.6%的棉籽壳、2.3%的棉籽饼和4.8%的石膏组成,经过一次发酵和二次发酵后备用。以57 cm×39 cm×23.5 cm的试验筐为单位,4个试验筐为1个小区,3次重复,采用拌药方式对覆土和培养料施药。另设不施药的空白对照(CK)。各小区间设隔离带,按照用药量由低到高的顺序排列。
药液的配制:分别称取70%啶虫脒水分散粒剂0.038、0.38、1.9和9.5 g,用于覆土中各小区施药;称取0.086、0.86、4.3和21.5 g,用于培养料中各小区施药。均用500 mL水溶解,3次重复,备用。
1.2.1 培养料和覆土中啶虫脒的残留消解及迁移试验采用一次施药多次采样方法,参考GB2763—2014[6]中规定的啶虫脒在蔬菜中的最大残留限量1 mg/kg,结合当前菇农实际使用情况,设定覆土和培养料中的啶虫脒有效成分用量分别为1(处理1)、10(处理2)、50(处理3)和250 mg/kg(处理4),另设不施药的空白对照(CK)。
覆土施药:称取80 kg覆土于搅拌机中,边搅拌边喷雾加入啶虫脒,混匀;将未加啶虫脒的培养料15 kg装入试验筐,上面覆盖已施入不同浓度啶虫脒的覆土6.65 kg。
培养料施药:称取180 kg培养料于搅拌机中,边搅拌边喷雾加入农药,混匀,取15 kg装入试验筐,上面覆盖不加啶虫脒的覆土6.65 kg。
于施药后2 h以及1、3、5、7、10、15、21、28、35、42、49 d,按五点采样法,采集每小区的覆土和培养料各300 g,去除培养料样品中混杂的覆土,于-20 ℃保存,备用。
1.2.2 双孢蘑菇子实体中啶虫脒残留变化试验覆土和培养料的处理同1.2.1节。待每潮双孢蘑菇子实体直径长至5 cm左右(即25、37、48 d)时采收500 g,去除根部,用搅拌机打碎,于-20 ℃保存,备用。
1.3 分析方法 1.3.1 样品提取与净化双孢蘑菇:准确称取10 g双孢蘑菇样品,置于50 mL塑料离心管中分别加入3 mL水和20 mL乙腈,涡旋提取2 min后超声提取30 min;依次加入4 g氯化钠和2 g无水硫酸镁,充分振荡后,于4 000 r/min下离心5 min;取上清液10 mL于试管中,用氮气吹干,加入2 mL乙腈超声提取10 s,涡旋10 s复溶;移入装有50 mg PSA和50 mg Al2O3的5 mL塑料离心管中,涡旋1 min,于10 000 r/min下离心2 min;取上层溶液1 mL加入1 mL水稀释混匀,过0.22 μm有机滤膜,待测。
覆土:称取5 g鲜土土样,置于50 mL离心管中(同时称取10 g覆土样品放入烘箱100 ℃烘干,计算其含水量,以换算成同一水平)。其他处理同双孢菇子实体处理,高浓度的样品稀释到5 mg/mL以下,待测。
培养料:称取培养料样品3 g,置于50 mL离心管中分别加入7 mL水和20 mL乙腈(同时称取10 g培养料样品放入烘箱100 ℃烘干,计算其含水量,以换算成同一水平)。除添加的氯化钠增至5 g外,其他处理同双孢蘑菇样品处理,高浓度的样品稀释到5 mg/mL以下,待测。
1.3.2 液相色谱检测条件Waters Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);等度洗脱,流动相为V(乙腈):V(水)=20 : 80,流速为0.3 mL/min,检测波长为246 nm,进样室温度30 ℃,柱温30 ℃;进样体积5 μL。在此条件下,啶虫脒的保留时间为4.5 min。
1.4 标准溶液的配制及标准曲线的绘制准确称取啶虫脒标准品0.01 g,用色谱纯甲醇溶解并定容至100 mL,得到1 000 mg/L的啶虫脒标准溶液,用V(乙腈):V(水)=50 : 50溶液稀释成质量浓度分别为0.02、0.05、0.1、0.5、1和5 mg/L的系列标准溶液,按照1.3.2节的条件测定,以质量浓度为横坐标(x),峰面积为纵坐标(y),绘制标准曲线。
1.5 添加回收试验在双孢蘑菇、培养料和覆土的空白样品中添加啶虫脒,添加水平分别为双孢蘑菇:0.02、0.5、3 mg/kg,培养料:0.02、20、3 mg/kg,覆土:0.2、20、3 mg/kg。每处理5个重复,静置2 h后按1.3节处理,计算回收率和相对标准偏差。
2 结果与分析 2.1 分析方法的线性关系、准确度和精密度结果表明:在0.02~5 mg/L范围内,啶虫脒的质量浓度与峰面积间呈良好的线性关系,线性方程为y=8 428x - 1 865.6,R2=0.999 8。以3倍信躁比(S/N)所对应的标准浓度确定三者的检出限均为0.01 mg/kg。在3个添加水平下,啶虫脒在双孢蘑菇、培养料和覆土中的回收率为81%~97%,相对标准偏差(RSD)为5.7%~9.6%(n=5),该方法的准确度和精确度符合农药残留分析要求。
2.2 啶虫脒在覆土和培养料中的消解动态啶虫脒在覆土和培养料中的残留消解趋势见图 1。对照的覆土和培养料中未检出啶虫脒的残留。施药各处理:1)在含啶虫脒1、10、50和250 mg/kg的覆土中啶虫脒的原始残留量(2 h采样)分别为0.95、9.3、47.3和233 mg/kg,随时间延长,其残留量逐渐降低,49 d分别降为0.36、3.8、16.3和95.1 mg/kg,其消解过程符合一级动力学指数方程,相关系数(r)分别为0.99、0.97、0.98和0.99,半衰期分别为35、33、33和37 d,平均半衰期为34 d(图 1a);2)在含啶虫脒1、10、50和250 mg/kg的培养料各处理中啶虫脒的原始残留量(2 h采样)分别为1.1、9.2、47.5和281 mg/kg,随时间延长,其残留量逐渐降低,消解过程符合一级动力学指数方程,49 d分别降为0.35、2.5、9.7和30.8 mg/kg,r分别为0.81、0.94、0.95和0.93,半衰期分别为27、25、24和17 d,平均半衰期为23 d(图 1b)。从中可以看出,啶虫脒在培养料和覆土中的残留降解速率相对较慢,半衰期均超过20 d。而且,其残留量随培养料和覆土中啶虫脒施用量的增加而增加,当啶虫脒有效成分用量为50 mg/kg时,第49天时,其在覆土和培养料中的残留量分别为16.3和9.7 mg/kg,当有效成分用量增加到250 mg/kg时,其残留量分别达到95.1和30.8 mg/kg。如果将覆土和培养料混合作有机肥,可能会导致再次污染。因此,覆土和培养料中农药有效成分用量需控制在50 mg/kg以下,覆土中的要更低一些。
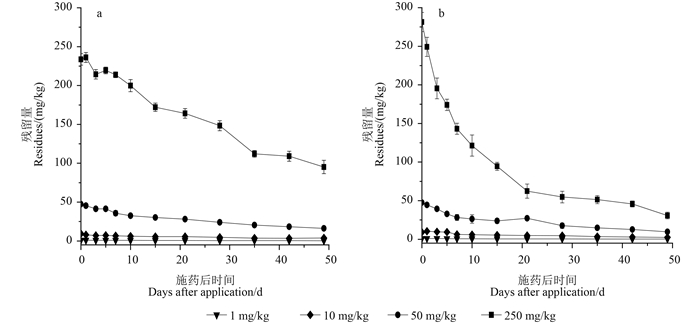
|
图 1 啶虫脒在覆土(a)和培养料(b)中的残留消解动态 Fig. 1 Dissipation of acetamiprid in cover-soil(a)and compost(b),respectively |
2.3 不同施药方式下覆土和培养料中啶虫脒的残留迁移
在培养料单独施药后,在覆土中未检测到啶虫脒,即培养料中的啶虫脒未向覆土中迁移。而覆土单独施药后,发现覆土中的啶虫脒可向下迁移到培养料内,致使培养料中啶虫脒残留量增加,且在21~28 d时达到高峰,随后残留量逐渐降低(表 1)。由于双孢蘑菇种植过程中需喷水,随着水的移动,覆土中农药可向培养料中迁移,由于前期覆土中农药含量较高,当迁移量大于培养料中的消解量时,则导致培养料中的残留量不断增加。在第21~28天时达到平衡,之后随着覆土中农药残留量降低,迁移量减少至小于培养料中的消解量时,消解占据主导地位,导致残留量逐渐降低。表明不同施药方式和用量均影响覆土和培养料中啶虫脒的残留迁移行为,进而影响残留量。
|
|
表 1 单独施用含药覆土时覆土和培养料中啶虫脒的残留量比较 Table 1 The comparison of acetamiprid residues in soil and compost after the application of acetamiprid in soil(mean±SD)(mg/kg) |
2.4 不同施药方式和施药剂量下双孢蘑菇中啶虫脒的残留规律
结果(表 2)表明:对照的双孢蘑菇中未检出啶虫脒残留;当啶虫脒有效成分用量为1 mg/kg时,覆土施药和培养料两种施药方式下双孢蘑菇中也均未检出啶虫脒的残留。随着覆土或培养料中啶虫脒的有效成分增加,双孢蘑菇中啶虫脒的残留量增加,且不同处理间差异达极显著水平(P<0.01);单独在覆土中施用啶虫脒(有效成分)250 mg/kg时,首潮双孢蘑菇(第25天采收)中的残留量高达2.6 mg/kg,而培养料施用相同浓度时,子实体中啶虫脒的残留也达到1.38 mg/kg;相同施药剂量、同一时期采收,覆土单独施药后双孢蘑菇中啶虫脒的残留量显著高于培养料单独施药后双孢蘑菇中啶虫脒的残留量(P<0.05)。但不同潮次间,除了覆土施药方式下10和50 mg/kg处理中的双孢蘑菇啶虫脒残留量第二潮(第37天采收)高于第一潮。其他潮次间,第一潮双孢蘑菇中啶虫脒的残留量高于第二潮双孢蘑菇中啶虫脒的残留量,第二潮高于第三潮(第48天采收),差异达极显著水平(P<0.01)。该结果表明,随施药剂量增加,双孢蘑菇中啶虫脒残留量增加,覆土施药方式下子实体中啶虫脒残的留量高于培养料施药,随着采收潮数增加,农药残留量显著降低。
|
|
表 2 不同施药剂量和施药方式下双孢蘑菇子实体中啶虫脒残留量 Table 2 Residue of acetamiprid in Agaricus bisporus(mean±SD) |
3 结论与讨论
本研究通过改良的QuEChERS前处理方法,建立了超高效液相色谱测定覆土、培养料和双孢蘑菇子实体中啶虫脒残留量的分析方法,在0.02~3 mg/kg添加水平下平均回收率为81%~97%,相对标准偏差为5.7%~9.6%,该方法简单、快速、成本较低,符合农药残留分析要求。
消解动态试验表明,培养料和覆土中啶虫脒的平均消解半衰期分别为23和34 d,啶虫脒在培养料中比在覆土中消解快,但均比其在茶园土壤(1.23~16.5 d)[9]和苹果园土壤(0.14~2.6 d)[10]中的半衰期长,消解速度慢,这与丁悦等[11]报道的结论相似。微生物降解是啶虫脒在土壤中消解的主要形式[21],其在灭菌土壤中的消解半衰期远大于其在未灭菌土壤中的消解半衰期。双孢蘑菇栽培环节覆土需要消毒,从而印证了上述结论。本研究还表明,由于培养料和覆土中啶虫脒施用量增加会引起其在覆土和培养料中残留量的增加,当药剂有效成分超过50 mg/kg时,农药在双孢蘑菇生产过程产生的废料中会含有较高水平的农药残留,释放到环境中会造成污染,进入循环农业也会造成次生污染。
施药方式对啶虫脒的迁移有显著影响。本研究表明,覆土中施用的啶虫脒可以迁移到培养料中,但培养料中的则不会迁移到覆土中。培养料中单独施用啶虫脒后,其在双孢蘑菇子实体中残留量显著低于覆土单独施用。因此,覆土中施用啶虫脒潜在的风险可能更大。但在工厂化双孢蘑菇生产中,由于规模化生产工艺的原因,覆土中添加农药是主要的施药方式。为了确保双孢蘑菇子实体安全和环境安全,必须严格控制农药的施用剂量。目前,食用菌生产栽培基质相关的标准远远满足不了当前食用菌生产的要求。NY5099—2002《无公害食品食用菌栽培基质安全技术要求》[22]和NY1935—2010《食用菌栽培基质质量安全要求》[23]中均只规定了采用何种培养料和覆土,对培养料和覆土中危害因子的指标没有建立定量的限值要求。因此,迫切需要修订双孢蘑菇培养料和覆土等栽培基质中的安全技术要求,一方面为执法提供技术依据,另一方面,从源头控制食用菌产品质量,保障农产品生产安全。
随覆土或培养料中啶虫脒的施药剂量增加,双孢蘑菇中啶虫脒的残留量随之增加,当施药量有效成分高于10 mg/kg时,子实体中啶虫脒残留量均在0.03 mg/kg以上,超过英国关于食用菌中0.01 mg/kg的限量要求[5];当施药量有效成分为250 mg/kg时,首潮双孢蘑菇(第25天采收)子实体中的残留量高达2.6 mg/kg;且相同施药方式、不同采收时期,除个别样品外,总体上第一潮菇中啶虫脒含量显著高于第二和第三潮菇。比较GB2763—2014[6]规定蔬菜中啶虫脒的MRL值0.5~1.0 mg/kg的要求,覆土或培养料中啶虫脒的施用剂量应小于50 mg/kg。中国食用菌在农药MRL标准制定等方面落后于发达国家,远不能适应对食用菌产品质量、产品安全等方面以及对外出口方面的需要[24-25]。虽然中国食用菌登记使用的农药不包含啶虫脒,但从农业部风险筛查的数据发现食用菌产品中吡虫啉、啶虫脒等烟碱类农药的残留检出率较高[2],因此开展前瞻性科学研究以探讨其安全性很有必要。本研究从安全角度出发,设定了1~250 mg/kg覆土(培养料)的较宽添加范围,为其残留登记和风险评估提供数据支撑。
| [1] |
何嘉, 张陶, 李正跃, 等. 我国食用菌害虫研究现状 [J]. 中国食用菌, 2005,24 (1)
:21–23.
HE J, ZHANG T, LI Z Y, et al. Research status of edible fungi pests in China [J]. Edible Fungi China, 2005, 24 (1) :21–23 . |
| [2] |
尚雪波, 韩晓磊, 张菊华, 等. 广东省食用菌病虫害调查及农残监测研究 [J]. 湖南农业科学, 2013 (8)
:28–29.
SHANG X B, HAN X L, ZHANG J H, et al. Guangdong Province mushroom pests investigation and monitoring of pesticide residues [J]. Hunan Agric Sci, 2013 (8) :28–29 . |
| [3] | L HASSANI A K, DACHER M, GARY V, et al. Effects of sublethal doses of acetamiprid and thiamethoxam on the behavior of the honeybee(Apis mellifera) [J]. Arch Environ Contam Toxicol, 2008, 54 (4) :653–661 . |
| [4] | OCAMAN A K, TOPAKTAŞ M. In vitro evaluation of the genotoxicity of acetamiprid in human peripheral blood lymphocytes [J]. Environ Mol Mutag, 2007, 48 (6) :483–490 . |
| [5] |
英国野生蘑菇中吡虫清的残留限量规定[DB/OL]//食品伙伴网.(2007-09-02)[2015-09-26].http://db.foodmate.net/pesticide/read_2613.html
The residue limits of Acetamiprid in wild mushrooms of English[DB/OL]//Food Mate Network.(2007-09-02)[2015-09-26].http://db.foodmate.net/pesticide/read_2613.html |
| [6] |
食品中农药最大残留限量: GB2763—2014[S].北京:中国标准出版社,2014.
Maximum residue limits for pesticides in food: GB2763—2014[S].Beijing: China Standard Press,2014. |
| [7] |
苏婷, 侯如燕, 赵秀霞, 等. 茶叶、茶鲜叶及茶汤中啶虫脒残留的检测 [J]. 食品与发酵工业, 2011,37 (10)
:174–177.
SU T, HOU R Y, ZHAO X X, et al. A method for determination of acetamiprid residue in tea,fresh tea and tea infusion with HPLC-UV [J]. Food Ferment Ind, 2011, 37 (10) :174–177 . |
| [8] |
李慧冬, 陈子雷, 王文博, 等. 啶虫脒在西兰花中的残留测定 [J]. 农药, 2007,46 (6)
:403–404.
LI H D, CHEN Z L, WANG W B, et al. Determination of acetamiprid residues in broccoli [J]. Agrochemicals, 2007, 46 (6) :403–404 . |
| [9] |
吴曼, 李添宝, 黄路, 等. 啶虫脒在茶叶和土壤中的残留和降解动态研究 [J]. 精细化工中间体, 2014,44 (1)
:67–72.
WU M, LI T B, HUANG L, et al. Residues and degradatiaon dynamics of acetamiprid in tea and soil [J]. Fine Chem Intermed, 2014, 44 (1) :67–72 . |
| [10] |
刘新刚, 董丰收, 杨爽, 等. 啶虫脒在苹果和土壤中的残留及消解动态 [J]. 农药, 2007,46 (10)
:693–695.
LIU X G, DONG F S, YANG S, et al. Residues and degradation of mospilan in apple and soil [J]. Agrochemicals, 2007, 46 (10) :693–695 . |
| [11] |
丁悦, 孙星, 汪佳蕾, 等. 露地和大棚条件下啶虫脒在黄瓜和土壤中的残留及消解动态 [J]. 农药学学报, 2014,16 (1)
:110–114.
DING Y, SUN X, WANG J L, et al. Residue and dissipation of acetamiprid in cucumber and soil under open field and greenhouse conditions [J]. Chin J Pestic Sci, 2014, 16 (1) :110–114 . |
| [12] | OBANA H, OKIHASHI M, AKUTSU K, et al. Determination of acetamiprid,imidacloprid,and nitenpyram residues in vegetables and fruits by high-performance liquid chromatography with diode-array detection [J]. J Agric Food Chem, 2002, 50 (16) :4464–4467 . |
| [13] | NAWAZ A, NIAZ A, ILYAS M, et al. Determination and extraction of acetamiprid residues in fruits and vegetables [J]. Int J Food Allied Sci, 2015, 1 (2) :63–66 . |
| [14] |
王会利, 陈长龙, 胡继业, 等. 百菌清和福美双在蘑菇上的残留研究 [J]. 农药学学报, 2006,8 (3)
:283–287.
WANG H L, CHEN C L, HU J Y, et al. Research on residues of chlorothalonil and thiram in mushroom [J]. Chin J Pestic Sci, 2006, 8 (3) :283–287 . |
| [15] |
宋卫国, 杨慧, 王伟民, 等. 吡虫啉在食用菌中的残留检测及安全性研究 [J]. 食用菌学报, 2012,19 (3)
:86–90.
SONG W G, YANG H, WANG W M, et al. Residues and safety studies of imidacloprid in edible fungi [J]. Acta Edulis Fungi, 2012, 19 (3) :86–90 . |
| [16] |
樊中臣, 施艳红, 花日茂, 等. 金针菇中6种拟除虫菊酯类农药多残留的测定 [J]. 食品科学, 2012,33 (6)
:199–201.
FAN Z C, SHI Y H, HUA R M, et al. Multiresidue determination of 6 pyrethroid pesticides in Flammulina velutipes [J]. Food Sci, 2012, 33 (6) :199–201 . |
| [17] | KASTANIAS M A, CHRYSAYI-TOKOUSBALIDES M, COWARD S, et al. Residue evaluation of the azole fungicides prochloraz and tebuconazole in the white mushroom Agaricus bisporus [J]. Bull Environ Contam Toxicol, 2006, 77 (1) :149–154 . |
| [18] | AHLAWAT O P, GUPTA P, KUMAR S, et al. Bioremediation of fungicides by spent mushroom substrate and its associated microflora [J]. Ind J Microbiol, 2010, 50 (4) :390–395 . |
| [19] | CHALLEN M P, ELLIOTT T J. The in vitro responses to a range of fungicides of two strains of the mushroom Agaricus bisporus and the pathogen Verticillium fungicola [J]. Mycopathologia, 1985, 90 (3) :161–164 . |
| [20] |
农药残留试验准则: NY/T 788—2004[S].北京:中国农业出版社,2004.
Guideline on pesticide residue trials: NY/T 788—2004[S].Beijing: China Agriculture Press,2004. |
| [21] |
母昌立, 余向阳, 刘贤进. 环境条件对土壤中啶虫脒降解的影响 [J]. 农药, 2011,50 (5)
:355–358.
MU C L, YU X Y, LIU X J. Effect of environmental conditions on the degradation of acetamiprid in soil [J]. Agrochemicals, 2011, 50 (5) :355–358 . |
| [22] |
无公害食品食用菌栽培基质安全技术要求: NY 5099—2002[S].北京:中国标准出版社,2002.
Free food mushroom cultvation matrix safety requirements: NY 5099—2002[S].Beijing: China Standard Press,2002. |
| [23] |
食用菌栽培基质质量安全要求: NY/T 1935—2010[S].北京:中国标准出版社,2010.
Quality and safety requirements of cultivar substrate for edible fungi: NY/T 1935—2010[S].Beijing: China Standard Press,2010. |
| [24] |
朱富春. 对食用菌病虫害综合防治的几点建议 [J]. 中国食用菌, 2008,27 (1)
:51–52.
ZHU F C. Several suggestions on the integrated control of insect pests in edible fungi [J]. Edible Fungi China, 2008, 27 (1) :51–52 . |
| [25] |
管道平, 胡清秀. 食用菌药残留限量与产品质量安全 [J]. 中国食用菌, 2008,27 (2)
:3–6.
GUAN D P, HU Q X. Residue limits of edible fungi and product quality safety [J]. Edible Fungi China, 2008, 27 (2) :3–6 . |
 2016, Vol. 18
2016, Vol. 18


