2. 康美新开河(吉林)药业有限公司, 吉林 通化 134200
2. Kangmei Xinkaihe (Jilin) Pharmaceutical Co., Ltd, Tonghua 134200, Jilin Province, China
人参 Panax ginseng C. A. Mey 是中国最具代表性的名贵传统中药材之一,其皂苷类等有效成分具有多种药理作用[1-3],但在种植过程中农药的过度和不合理使用易导致人参中农药残留超标[4]。申嗪霉素 (phenazino-1-carboxylic acid,化学结构式见图式1) 是上海交通大学和上海农乐生物制品股份有限公司联合开发的新型微生物源农药,有效成分为吩嗪-1-羧酸 (PCA),是由甜瓜根际假单胞菌株 M18生成的抑菌代谢产物,具有高效、低毒、安全和环境相容性好等特点[5-8],用于防治水稻纹枯病[9-11]、甜瓜蔓枯病[12]、油菜菌核病[13]、小麦赤霉病[14]和茄子黄萎病[15]等病害均具有良好的效果。关于申嗪霉素的研究目前多集中于其生产菌株的分离和鉴定[16-17]、PCA 的生物合成机理和基因调控[18-19]以及申嗪霉素发酵效价的提高[20-21]、降解菌的筛选和特性研究[22-23]等,此外,付馨慰等[24]采用液相色谱-电喷雾串联质谱测定了申嗪霉素在人参中的残留,而对于其在作物及环境中的残留消解动态报道较少[25-28],尚未见申嗪霉素在人参中残留动态及其在土壤中的降解及影响因素的研究报道。

|
图式 1 申嗪霉素的化学结构式 Scheme1 Chemical structure of phenazino-1-carboxylic acid |
本研究采用酸碱液-液萃取净化人参样品,建立了人参及土壤中申嗪霉素残留的高效液相色谱检测方法,同时研究了其在人参及田间土壤中的残留消解动态和最终残留量,并于室内模拟环境条件下初步探讨了土壤微生物、土壤类型、含水量和温度等因素对土壤中申嗪霉素降解的影响,旨在为申嗪霉素的安全合理使用及制定其在人参上的最大残留限量、了解其在土壤中的降解及影响因素,进一步探讨其在土壤中的降解机制等提供依据。
1 材料与方法 1.1 供试材料 1.1.1 人参和土壤供试鲜人参品种“二马牙”和土壤样品均采自吉林省集安市康美新开河 (吉林) 药业有限公司 GAP 人参种植基地,土壤类型为重壤土,有机质含量为7.65%,pH 值为4.86。
1.1.2 药剂及主要仪器申嗪霉素 (phenazino-1-carboxylic acid) 标准品 (纯度为99.9%) 和1% 申嗪霉素悬浮剂 (上海农乐生物制品股份有限公司);乙腈为色谱纯,二氯甲烷、丙酮和冰乙酸均为分析纯 (上海市国药集团化学试剂有限公司),用前经全玻璃蒸馏装置重蒸;无水硫酸钠 (杭州市高晶精细化工有限公司),经160 ℃ 烘5 h,用前于130 ℃ 烘2 h。
LC-2010C HT 岛津高效液相色谱仪,配紫外检测器 (上海市岛津国际贸易有限公司);FJ200-SH 型数显高速分散均质机 (上海标本模型厂);Laborota 4010 digital 旋转蒸发仪 (德国 Heidolph 集团);MTN-2800D 氮吹仪 (北京华瑞博远科技制造有限公司);LD4-2A 雷勃尔低速台式离心机 (北京雷勃尔离心机有限公司);DD02型中药粉碎机 (浙江温岭市大德中药机械有限公司)。
1.1.3 标准溶液配制及标准曲线绘制准确称取申嗪霉素标准品0.010 0 g (精确到0.000 1 g),用乙腈溶解,配成质量浓度为100 mg/L 的标准储备液,试验时再用乙腈逐级稀释成质量浓度分别为10、5、1、0.1、0.05、0.02、0.01和0.005 mg/L 的系列标准溶液。取各浓度标准溶液10.0 μL,从低浓度至高浓度依次分别进样检测,平行测定3次,以申嗪霉素标准溶液的质量浓度为横坐标 (x),峰面积为纵坐标 (y),建立线性回归方程,绘制标准曲线。
1.2 试验方法 1.2.1 田间试验试验于2013年8–9月在吉林省集安市康美新开河(吉林)药业有限公司GAP人参种植基地进行。按照《农药残留试验准则》[29]设计并进行1%申嗪霉素悬浮剂在人参叶片及其土壤中的田间消解动态以及在人参根中的最终残留量试验。消解动态试验采取一次施药多次采样的方法,最终残留量试验采取多次施药一次采样的方法 (试验设计见表 1),均以喷洒同体积清水为对照。每个处理和空白对照均重复3次,每小区面积约为14 m2,各小区间设保护行。
|
|
表 1 田间试验设计 Table 1 The design of field experiment |
采样及处理:1) 每小区随机选取5个点以上,采集生长正常、无病害的人参叶片和鲜根各1kg,取部分鲜根切片并置于50℃烘箱中烘烤10h,去掉细根,用中药粉碎机粉碎,制成干根样品。2) 用土钻采集表层0~15 cm的土壤1~2 kg,过20目筛 (粒径为0.85 mm),除去碎石、杂草和植物根茎等杂物,混匀后四分法留样500 g。样品均于 –20 ℃ 贮存,备用。
1.2.2 室内降解试验在室内模拟环境条件下,研究土壤微生物、土壤类型、温度及含水量4种因素对申嗪霉素降解的影响。1) 微生物试验设置灭菌 (121 ℃ 高压灭菌锅灭菌2次) 和非灭菌2组处理,同时2组处理均设非浸没 (水分含量为田间最大持水量的60%) 和浸没 (加水至超出土壤表面约3 cm) 2种条件;2) 土壤类型试验除吉林集安土壤外,选取湖北恩施、浙江桐乡和广东清远中药材种植基地的空白土壤样品,理化性质见表 2;3) 温度试验设10、20和30 ℃ 3组处理;4) 土壤含水量试验设自然风干土 (含水量5.6%)、田间最大持水量60% (含水量19.4%) 和田间最大持水量 (含水量32.3%) 3组处理。全部处理均设空白溶剂对照,处理和对照均3个重复,每样品瓶为一个重复。每瓶中准确称取20.00 g 土壤样品,除空白对照外均准确加入1 mL 20 mg/L 的申嗪霉素标准溶液,除特定含水量外均调节至田间最大持水量的60%,除特定温度外均放入20 ℃ 恒温培养箱中,避光培养。分别于2 h 及1、3、7、14、21、30、45、60 d 后取样测定申嗪霉素残留量。
|
|
表 2 试验土壤理化性质 Table 2 The physic-chemical properties of soils |
1.3 分析方法 1.3.1 土壤和人参样品前处理 1.3.1.1 土壤
参考占绣萍等[25]的方法:准确称取25.00 g 土壤样品 (精确至0.01 g),用60 mL V (丙酮):V (冰醋酸) = 29:1的混合溶液超声提取,于3 000 r/min 下离心10 min;静置后准确量取20 mL 上清液,氮气吹干后用乙腈定容至5 mL,过0.45 μm 滤膜,待测。
1.3.1.2 人参叶片和鲜根提取:准确称取人参样品 (叶片5.00 g,鲜根10.00 g,均精确至0.01 g),置于150 mL 磨口三角瓶中,加入60 mL 乙腈,于15 000 r/min 条件下匀浆1 min,并用20 mL 乙腈清洗刀头,清洗液也转入三角瓶中;加入1 g 助滤剂,盖紧塞,超声提取30 min;抽滤,用30 mL 乙腈分多次洗涤残渣,合并滤液;滤液过无水硫酸钠漏斗除水后,旋转浓缩至近干,待净化。
净化:将浓缩提取液用少许二氯甲烷转移至250 mL 分液漏斗中,加入50 mL 10% 的氯化钠水溶液和5 mL 1 mol/L 的氢氧化钠溶液,混匀后分别用50和40 mL 二氯甲烷分2次振荡萃取;弃去二氯甲烷相,碱性水相用1 mL 冰乙酸 (纯度 ≥ 99.5%) 调节 pH 值至3,再分别用50、40和30 mL二氯甲烷分3次振荡萃取;收集二氯甲烷相,经无水硫酸钠漏斗除水后,合并滤液,旋转蒸发浓缩至2 mL,氮气吹干,用乙腈定容至2 mL,过0.45 μm 滤膜,待测。
1.3.1.3 人参干根准确称取人参干根样品10.00 g (精确至0.01 g),置于150 mL 磨口三角瓶中,依次加入20 mL 纯水和60 mL 乙腈,于11 000 r/min 条件下匀浆1 min;并用20 mL 乙腈清洗刀头,一并转入三角瓶中;加入1 g 助滤剂,盖紧塞后超声提取30 min;抽滤,用30 mL 乙腈分多次洗涤残渣,合并滤液;滤液过无水硫酸钠漏斗除水后,旋转浓缩至近干,按1.3.1.2节的方法净化。
1.3.2 色谱分析条件DJ-001 C18 不锈钢色谱柱 (250 mm × 4.6 mm,5 μm);柱温20 ℃,检测波长250 nm,进样量10 μL。
1) 土壤:梯度洗脱,流速为0.8 mL/min,流动相为乙腈和0.2% 冰乙酸水溶液,0~15 min 乙腈体积分数为35%,15~25 min 时乙腈体积分数从35% 升至50%,保留时间为23.50 min;2) 人参叶片:等度洗脱,流速为0.8 mL/min,流动相为 V (乙腈):V (0.2% 冰乙酸水溶液) = 45:55,保留时间为13.40 min;3) 人参根:等度洗脱,流速为0.8 mL/min,流动相为 V(乙腈):V (0.2% 冰乙酸水溶液) = 44:56,保留时间为14.05 min。
1.3.3 添加回收试验向空白土壤、人参叶片和人参根样品中分加添加3个水平的申嗪霉素标准溶液。其中,土壤中的添加水平为0.003、0.06和0.60 mg/kg,叶片为0.002、0.02和0.40 mg/kg,鲜根和干根均为0.002、0.02和0.20 mg/kg。按1.3.1节的方法进行样品的前处理,按1.3.2节的条件测定。每个添加水平重复5次,计算平均回收率及相对标准偏差 (RSD)。
2 结果与分析 2.1 方法的灵敏度和准确度回归分析结果表明:在0.005~10 mg/L 范围内,申嗪霉素的质量浓度与对应的峰面积间呈良好的线性关系,线性回归方程为 y = 23 548x - 520.1,决定系数 R2 大于0.999。
在1.3.3节的添加水平下,申嗪霉素在土壤中的平均回收率在80%~85% 之间,RSD 为2.1%~4.5%;人参叶片中的平均回收率在91%~99% 之间,RSD 为2.2%~5.0%;鲜根中的平均回收率在89%~96% 之间,RSD 为2.7%~4.4%;干根中的平均回收率在88%~92% 之间,RSD 为3.1%~4.2%。以3倍和10倍信噪比 (S/N) 确定得到检测条件下申嗪霉素的最小检出量 (LOD) 为0.02 ng;土壤中申嗪霉素的最低检测浓度 (LOQ) 为0.003 mg/kg,人参叶片和根 (包括鲜根和干根) 中的 LOQ 均为0.002 mg/kg。典型色谱图见图 1。
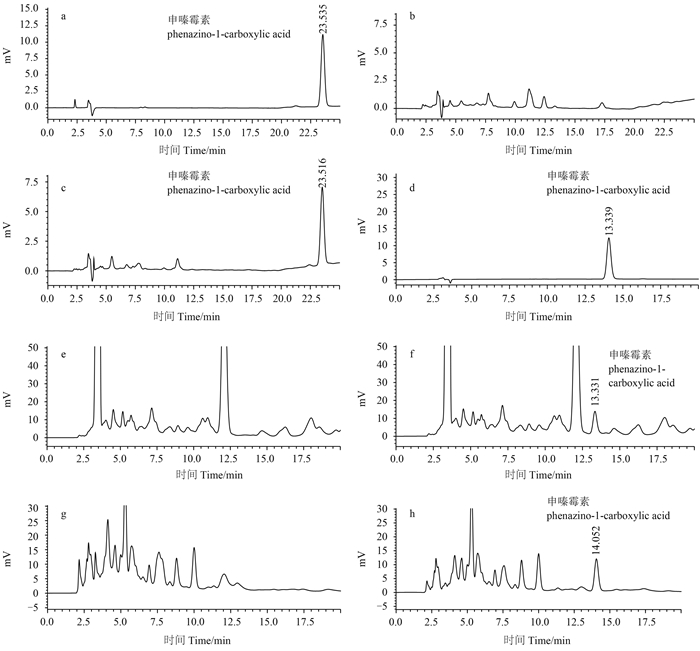
|
a. 申嗪霉素标准品 (1.0 mg/kg,土壤样品色谱分析条件);b. 空白土壤样品;c. 添加水平为0.6 mg/kg 的土壤样品;d. 申嗪霉素标准品 (1.0 mg/kg, 人参样品色谱分析条件);e. 空白人参叶片样品;f. 添加水平为0.4 mg/kg 的人参叶片样品;g. 空白人参根样品;h. 添加水平为0.2 mg/kg 的人参根样品。
a. Standard chromatogram of phenazino-1-carboxylic acid (1.0 mg/kg, chromatographic analysis of soil); b. Blank sample of soil; c. Soil sample fortified with phenazino-1-carboxylic acid (spiked level 0.6 mg/kg); d. Standard chromatogram of phenazino-1-carboxylic acid (1.0 mg/kg, chromatographic analysis of Panax ginseng); e. Blank sample of leaf; f. Leaf sample fortified with phenazino-1-carboxylic acid (spiked level 0.4 mg/kg); g. Blank sample of root; h. Root sample fortified with phenazino-1-carboxylic acid (spiked level 0.2 mg/kg). 图 1 申嗪霉素色谱图 Fig. 1 Chromatograms of phenazino-1-carboxylic acid |
2.2 申嗪霉素在人参叶片和田间土壤中的消解动态
结果 (表 3) 表明:申嗪霉素在人参叶片及其田间土壤中的残留消解动态均符合一级动力学方程。在人参叶片中的消解动态方程为 ct = 0.805 1e–0.209 1t (R2 = 0.916 9),消解半衰期为 (3.4 ± 0.9) d;在田间土壤中的消解动态方程为 ct = 0.044 6e–0.235 2t (R2 = 0.911 5),消解半衰期为 (3.0 ± 0.6) d。在田间环境条件下,申嗪霉素消解表现为前期较快,7 d 时消解率已达80% 左右,后期则相对平缓,且消解半衰期短,这与占绣萍等[25]、张耀中等[27]、赵莉等[28]的研究结果相一致。申嗪霉素在人参叶片中的消解较在土壤中慢,消解半衰期长,原因可能是:1) 人参采取山地设施栽培方式,受光照、风、雨等环境因素影响小,而土壤施药后直接暴露于雨水和光照之下,受环境因素影响可能更大;2) 土壤中有机质一方面可能促进了土壤微生物的活性[30],另一方面还可能产生结合残留而降低其残留量[30-31];3) 土壤中可能存在丰富的申嗪霉素降解菌,从而加速了其消解过程。
|
|
表 3 申嗪霉素在人参叶片和田间土壤中的残留消解动态 Table 3 Dissipation of phenazino-1-carboxylic acid in leaf and soil |
2.3 申嗪霉素在人参根中的最终残留量
测定结果表明:1% 申嗪霉素悬浮剂按1.8和2.7 kg/hm2 2种制剂用量进行田间施药,收获时距最后一次施药分别间隔7、14和21 d,申嗪霉素在收获期的人参鲜根和干根中的最终残留量均低于其最低检测浓度0.002 mg/kg,这与前人[25-27]的研究结果一致。究其原因,可能是由于本研究施药剂量较低,折合成有效成分用量仅为18~27 g/hm2;其次可能是吸收部位主要为上部茎叶,根部吸收相对较少,且申嗪霉素在植株内传导性差;另外,申嗪霉素是植物根际促生菌产生的抑菌代谢产物,在田间环境中较易消解,半衰期短,致使其最终残留量较低。
2.4 申嗪霉素在室内土壤中的降解及影响因素 2.4.1 微生物对申嗪霉素降解的影响结果 (表 4,图 2A) 表明:申嗪霉素在灭菌和未灭菌土壤中的降解均符合一级动力学方程,半衰期分别为10.4 d (未灭菌)、17.0 d (未灭菌、浸没)、79.2 d (灭菌)及85.6 d (灭菌且浸没),且未灭菌处理与灭菌处理间存在显著性差异 (P<0.05)。与田间相比,室内环境条件下主要为土壤微生物的降解作用,因此土壤一旦灭菌,申嗪霉素的降解即非常缓慢,半衰期延长,60 d 时非浸没和浸没2组灭菌土壤中申嗪霉素的降解率分别仅为38.2% 和39.9%;氧气的充分供应有利于微生物对申嗪霉素的降解,这可能是因为在充足的氧气条件下,微生物的代谢活性高,好氧细菌种群数量居多,以及氧化反应增强等,从而加快了其对申嗪霉素的分解。
|
|
表 4 室内模拟环境条件下申嗪霉素在土壤中的残留降解动态 Table 4 Decline dynamics of phenazine-1-carboxylic acid in soil within indoor environment |
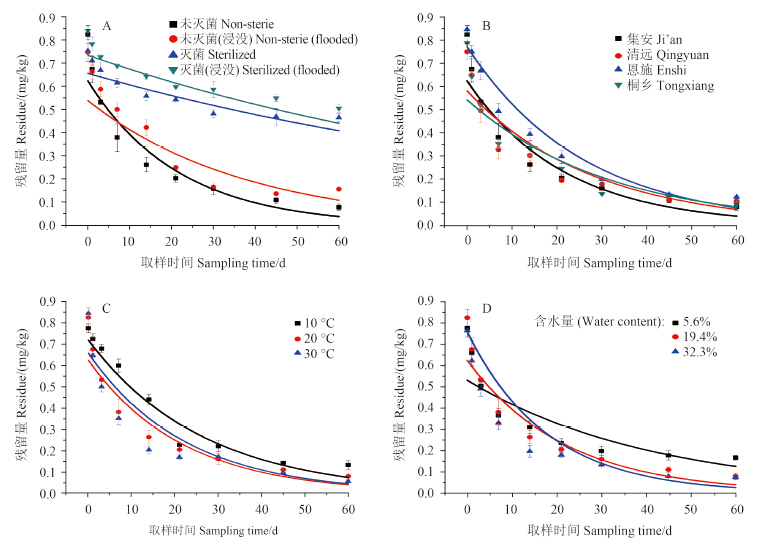
|
图 2 室内模拟环境条件下申嗪霉素在土壤中的降解动态曲线 Fig. 2 Decline curves of phenazine-1-carboxylic acid in soil within indoor environment |
2.4.2 土壤类型对申嗪霉素降解的影响
申嗪霉素在4种不同土壤中的半衰期依次为10.4 d (集安)、12.1 d (清远)、12.8 d (桐乡) 和14.9 d (恩施),降解动态均符合一级动力学方程 (表 4,图 2B)。结果表明,申嗪霉素在不同地区土壤中的降解速率与土壤有机质含量呈正相关,这与田间试验的结果一致。试验所选土壤的性质差异主要体现在有机质含量和土壤 pH 值上,推测其可能是影响不同类型土壤中申嗪霉素降解的主要因素。
2.4.3 温度对申嗪霉素降解的影响结果 (表 4,图 2C) 表明:不同温度下申嗪霉素在土壤中的残留降解动态均符合一级动力学方程,半衰期分别为16.5 d (10 ℃)、10.4 d (20 ℃) 和8.2 d (30 ℃)。其中,申嗪霉素在10 ℃ 处理中的半衰期与20和30 ℃ 处理间存在显著性差异 (P<0.05),而20与30 ℃ 处理间差异不显著 (P>0.05)。温度与申嗪霉素的降解速率总体成正比,在试验温度范围内,申嗪霉素降解速率随温度的升高而加快,这可能是由于20~30 ℃ 的环境温度与土壤中微生物的最适温度接近,从而提高了微生物的活性所致。据研究报道,申嗪霉素降解菌的最适培养和作用温度在23~28 ℃ [22-23],本研究结果与之一致。
2.4.4 土壤含水量对申嗪霉素降解的影响在不同土壤含水量 (图 2D)下,申嗪霉素的残留降解动态均符合一级动力学方程,其半衰期分别为15.6 d (5.6%)、10.4 d (19.4%) 和8.7 d (32.3%)。5.6% 处理的半衰期与后两者间存在显著性差异 (P<0.05),可能是由于风干土中微生物活性较低,抑制了其对农药的代谢降解;后两者间半衰期差异不显著 (P>0.05),说明在保证微生物生存环境所需水分的前提下,土壤含水量不影响申嗪霉素的降解。
3 结论本研究采用了酸碱液-液萃取净化人参样品、离心净化田间土壤样品,经 HPLC-UVD 测定样品中的申嗪霉素残留量,操作简便、净化效果好,回收率等指标均满足农药残留分析的要求。目前国内外均尚未制定申嗪霉素在人参及其他作物中的 MRL 值。田间试验中,1% 申嗪霉素悬浮剂以2.7 kg/hm2 制剂用量施药后,在人参叶片及土壤中的消解半衰期分别为3.4和3.0 d,消解迅速,7 d 时的残留量分别为0.22和0.01 mg/kg,消解率均大于75%;以推荐高制剂量1.8 kg/hm2 和1.5倍推荐高制剂量2.7 kg/hm2 用药,距最后一次施药间隔7、14和21 d 收获的人参鲜根和干根中申嗪霉素的最终残留量均低于0.002 mg/kg,表明其通过根从田间土壤中吸收的量较小,且该农药在人参植株中向下传导的作用较弱,同时鉴于申嗪霉素属低毒农药,因此建议1% 申嗪霉素悬浮剂以有效成分用量18 g/hm2 推荐高剂量施药3次,施药间隔期为7 d,采收期距最后一次施药后7 d 及以上,是比较安全的。
申嗪霉素在室内土壤中的降解与土壤微生物、有机质含量、含水量和温度等因素有关,其中以土壤微生物对其降解的影响最大,有机质含量高、温度升高和含水量增加在一定范围内可促进土壤中申嗪霉素的降解,但也可能是通过直接或间接影响土壤微生物的数量及活性而发挥作用的。
| [1] | LIAN X Y, ZHANG Z Z, STRINGER J L. Protective effects of ginseng components in a rodent model of neurodegeneration [J]. Ann Neurol, 2005, 57 (5) :642–648 . |
| [2] | QU D F, YU H J, LIU Z, et al. Ginsenoside Rg1 enhances immune response induced by recombinant Toxoplasma gondii SAG1 antigen [J]. Vet Parasitol, 2011, 179 (1-3) :28–34 . |
| [3] | MIN J K, KIM J H, CHO Y L, et al. 20(S)-Ginsenoside Rg3 prevents endothelial cell apoptosis via inhibition of a mitochondrial caspase pathway [J]. Biochem Biophys Res Commun, 2006, 349 (3) :987–994 . |
| [4] | CHEN J C. The pollution of heavy metals and chemical in Chinese medicine [J]. Chin J Chin Mater Med, 2000, 7 (8) :902–911 . |
| [5] |
许煜泉. 绿色微生物源抗菌剂申嗪霉素 (M18) [J]. 精细与专用化学品, 2004,12 (20)
:8–9.
XU Y Q. Green microorganism based antimicrobial: shenqinmycin (M18) [J]. Fine Spec Chem, 2004, 12 (20) :8–9 . |
| [6] |
许煜泉, 唐玮宁, 郑有丽, 等. 筛选假单胞菌株 M18防治大棚黄瓜枯萎病害 [J]. 上海交通大学学报, 1999,33 (2)
:210–213.
XU Y Q, TANG W N, ZHENG Y L, et al. Screening of pseudomonas M18 and its biological control of cucumber wilt disease under commercial greenhouse [J]. J Shanghai Jiaotong Univ, 1999, 33 (2) :210–213 . |
| [7] |
沈丽娟. 高效、广谱、安全生物杀菌剂: 申嗪霉素 [J]. 世界农药, 2011,33 (3)
:58.
SHEN L J. Highly efficient, broad spectrum, safe biopesticide: Shenqinmycin [J]. World Pestic, 2011, 33 (3) :58. |
| [8] |
方运玲, 孙爽, 申阅, 等. 微生物源农药申嗪霉素的研制与应用 [J]. 农药学学报, 2014,16 (4)
:387–393.
FANG Y L, SUN S, SHEN Y, et al. Progress on the development and application of biopesticide Shenqinmycin [J]. Chin J Pestic Sci, 2014, 16 (4) :387–393 . |
| [9] |
温广月, 张穗, 张红艳, 等. 新型微生物源农药申嗪霉素对水稻纹枯病菌的毒力测定及田间药效 [J]. 植物保护, 2008,34 (4)
:143–145.
WEN G Y, ZHANG S, ZHANG H Y, et al. Toxicity tests and filed control effects of novel microbial pesticide Shenqinmycin against Rhizoctonia solani [J]. Plant Prot, 2008, 34 (4) :143–145 . |
| [10] |
张红艳, 赵胜荣, 许煜泉, 等. 申嗪霉素与增效剂复配对水稻纹枯病菌防治的增效作用 [J]. 上海交通大学学报(农业科学版), 2007,25 (6)
:556–560.
ZHANG H Y, ZHAO S R, XU Y Q, et al. Synergistic effect of the complex between Shenqinmycin and synergistic on rice sheath blight (Rhizoctonia solani) disease [J]. J Shanghai Jiaotong Univ (Agric Sci), 2007, 25 (6) :556–560 . |
| [11] |
陈海霞, 杜兴彬, 张穗, 等. 申嗪霉素对水稻纹枯病的田间防效分析 [J]. 上海农业学报, 2012,28 (2)
:69–71.
CHEN H X, DU X B, ZHANG S, et al. Field efficacy of Shenqinmycin on rice sheath blight (Rhizoctonia solani) [J]. Acta Agric Shanghai, 2012, 28 (2) :69–71 . |
| [12] |
祝新德, 冯镇泰, 许煜泉, 等. 荧光假单胞菌株 M18防治甜瓜蔓枯病害 [J]. 上海交通大学学报, 2001,35 (7)
:1062–1065.
ZHU X D, FENG Z T, XU Y Q, et al. Biocontroling of melon gummy stem blight (Mycosphaeralla melonis) using Pseudomonas fluorecens M18 [J]. J Shanghai Jiaotong Univ, 2001, 35 (7) :1062–1065 . |
| [13] |
郑文君, 徐曙, 周明国. 申嗪霉素对油菜菌核病菌生物学活性的初步研究 [J]. 农药学学报, 2011,13 (1)
:28–32.
ZHENG W J, XU S, ZHOU M G. Preliminary study on biological activity of Shenqinmycin against Sclerotinia sclerotiorum [J]. Chin J Pestic Sci, 2011, 13 (1) :28–32 . |
| [14] |
赵影, 张影, 赵凤梅, 等. 1% 申嗪霉素悬浮剂防治小麦赤霉病药效试验初报 [J]. 安徽农学通报, 2012,18 (24)
:87–88.
ZHAO Y, ZHANG Y, ZHAO F M, et al. Efficacy of phenazine-1-carboxylic acid 1% SC on FusaHum graminearum Sehw [J]. Anhui Agri Sci Bull, 2012, 18 (24) :87–88 . |
| [15] |
张丹, 张万民, 马辉, 等. 1% 申嗪霉素 SC 防治茄子黄萎病田间药效试验 [J]. 北方园艺, 2012 (9)
:149–150.
ZHANG D, ZHANG W M, MA H, et al. Field efficacy of phenazine-1-carboxylic acid 1% SC on Verticillium wilt of eggplant [J]. Northern Horticult, 2012 (9) :149–150 . |
| [16] | HU H B, XU Y Q, CHEN F, et al. Isolation and characterization of a new fluorescent strain that produces both phenazine-1-carboxylic acid and pyoluteorin [J]. J Microbiol Biotechnol, 2005, 15 (1) :86–90 . |
| [17] |
周莲, 蒋海霞, 金凯明, 等. 高产申嗪霉素和吩嗪-1-酰胺的水稻根际铜绿假单胞菌 PA1201分离、鉴定与应用潜力 [J]. 微生物学报, 2015,55 (4)
:401–411.
ZHOU L, JIANG H X, JING K M, et al. Isolation, identification and characterization of rice rhizobacterium Pseudomonas aeruginosa PA1201 producing high level of biopesticide Shenqinmycin and phenazine-1-carboxamide [J]. Acta Microbiologica Sinica, 2015, 55 (4) :401–411 . |
| [18] |
张锋华, 许煜泉, 张雪洪. 农用杀菌剂吩嗪-1-羧酸的生物合成与基因调控 [J]. 农药研究与应用, 2006,10 (5)
:4–7.
ZHANG F H, XU Y Q, ZHANG X H. Biosynthesis and genetic regulation of the microbial pesticide phenazine-1-carboxylic acid [J]. Agrochem Res Appl, 2006, 10 (5) :4–7 . |
| [19] | 王国昊, 魏雪, 李赛男, 等. 假单胞菌株 M18psrA 突变株的构建及其对吩嗪-1-羧酸和藤黄绿菌素合成的调控 [J]. 微生物学通报, 2012,39 (3) :291–299. |
| [20] |
张锋华, 许煜泉, 张雪洪. 采用响应面分析法优化吩嗪-1-羧酸的发酵条件 [J]. 现代农药, 2007,6 (2)
:15–18.
ZHANG F H, XU Y Q, ZHANG X H. Process optimization phenazine-1-carboxylic acid fermentation by response surface analysis [J]. Mod Agrochem, 2007, 6 (2) :15–18 . |
| [21] | DU X L, LI Y Q, ZHOU W P, et al. Phenazine-1-carboxylic acid production in a chromosomally non-scar triple-deleted mutant Pseudomonas aeruginosa using statistical experimental designs to optimize yield [J]. Appl Microbiol Biotechnol, 2013, 97 (17) :7767–7778 . |
| [22] |
陈快快, 胡洪波, 王威, 等. 鞘氨醇单胞菌 DP58降解吩嗪-1-羧酸的特性研究 [J]. 高校化学工程学报, 2008,22 (5)
:818–832.
CHEN K K, HU H B, WANG W, et al. Degradation characteristics of phenazine-1-carboxylic acid by Sphingomonas sp. D58 [J]. J Chem Eng Chin Univ, 2008, 22 (5) :818–832 . |
| [23] |
金颖, 胡洪波, 张雪洪, 等. 吩嗪-1-羧酸降解菌的筛选及其特性研究 [J]. 农业环境科学学报, 2006,25 (5)
:1260–1265.
JIN Y, HU H B, ZHANG X H, et al. Screening for phenazine-1-carboxylic acid degrading bacteria [J]. J Agro-Environ Sci, 2006, 25 (5) :1260–1265 . |
| [24] |
付馨慰, 黄超群, 蒋沁婷, 等. 液相色谱-串联质谱法测定人参中申嗪霉素的残留 [J]. 分析测试学报, 2014,33 (10)
:1204–1208.
FU X W, HUANG C Q, JIANG Q T, et al. Determination of phenazine-1-carboxylic acid residue in ginseng by liquid chromatography-tandem mass spectrometry [J]. J Instrumental Anal, 2014, 33 (10) :1204–1208 . |
| [25] |
占绣萍, 赵莉, 樊晓青, 等. 申嗪霉素在稻田环境中的 HPLC 残留分析方法研究 [J]. 现代农药, 2009,8 (2)
:39–41.
ZHAN X P, ZHAO L, FAN X Q, et al. Study on analysis of M18 residue in paddy water and soil by HPLC [J]. Mod Agrochem, 2009, 8 (2) :39–41 . |
| [26] |
占绣萍, 平新亮. 申嗪霉素1% 悬浮剂在水稻及稻田环境中的残留动态研究 [J]. 农药科学与管理, 2010,31 (11)
:29–33.
ZHAN X P, PING X L. Study on the residual dynamic of phenazine-1-carboxylic acid in rice and field environment [J]. Pestic Sci Admin, 2010, 31 (11) :29–33 . |
| [27] |
张耀中, 周力, 李向阳, 等. 申嗪霉素在辣椒及土壤中残留动态的研究 [J]. 化学分析计量, 2006,15 (6)
:48–50.
ZHANG Y Z, ZHOU L, LI X Y, et al. Study on residue dynamics of phenazino-1-carboxylic acid in capsicum and soil [J]. Chem Anal Meter, 2006, 15 (6) :48–50 . |
| [28] |
赵莉, 沈秋光, 杨挺. 申嗪霉素在辣椒和土壤中的残留动态 [J]. 农药, 2008,47 (4)
:277–278.
ZHAO L, SHEN Q G, YANG T. Study on residue and degradation of shenqinmycin in capsicum and soil [J]. Agrochemicals, 2008, 47 (4) :277–278 . |
| [29] |
农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004.
Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
| [30] | BOSSIO D A, SCOW K M, GUNAPALA N, et al. Determinants of soil microbial communities: Effects of agriculture management, season, and soil type on phospholipids fatty acid profiles [J]. Microb Ecol, 1998, 36 (1) :1–12 . |
| [31] | GEVAO B, SEMPLE K T, JONES K C. Bound pesticide residues in soils: a review [J]. Environ Pollut, 2000, 108 (1) :3–14 . |
 2016, Vol. 18
2016, Vol. 18


