2. 军事医学科学院毒物药物研究所, 北京 100850;
3. 中国科学院东北地理与农业生态研究所, 长春 130102;
4. 中国科学院近代物理研究所, 兰州 730000
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Science, Beijing 100850, China;
3. Northeast Institute of Geography and Agricultural Ecology, Chinese Academy of Sciences, Changchun 130102, China;
4. Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China
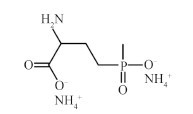
草铵膦 [(glufosinate-ammonium,图式1),化学名称为4-(羟基 (甲基) 膦酰基)-DL-高丙氨酸],是由德国赫斯特公司 (现为拜耳公司下属企业) 于20世纪80年代创制的有机磷类广谱触杀型非选择性除草剂,最早于1984年在日本获得登记。草铵膦也是世界第二大转基因作物耐受除草剂[1],其特点是活性高、吸收好、杀草谱广、低毒、持效期长、环境兼容性好[2-3],已在日本、韩国、东南亚、欧洲、美洲等国家普遍应用。“灭生性除草剂 + 抗除草剂转基因作物” 的农业生产模式已逐渐成为农业生产发展的主流[4]。在草铵膦产量日益增长的同时,其安全性也引起了广泛关注。
|
图式 1 草铵膦化学结构式 Scheme1 Stucture of glufosinate-ammonium |
目前,对草铵膦的研究主要集中于其在环境中的降解、转移以及对农作物的影响等。草铵膦在土壤中活性较低、降解较快,一般降解为4-甲基膦酸亚基-2-氧代丁酸 (PPO) 和3-甲基膦酸亚基 (MPP),其降解及转移与土壤的黏度成分有关[5],气候、水分和光照等条件亦会影响其降解[6]。草铵膦在杂草体内的作用靶点是谷氨酰铵合成酶 (GS),其作用机制是对 GS 不可逆的抑制及破坏其相关代谢过程,从而导致细胞内氨积累、氨基酸合成及光合作用受抑制、叶绿素被破坏等,进而引起植物死亡[7]。有关草铵膦在动物体内代谢动力学的研究表明,草铵膦被吸收后在大鼠全身大部分脏器均有分布,以尿液排出为主[8]。
草铵膦易溶于水 (溶解度为1 379 g/L),并且在 pH 5~9的水体中不会光解[9],因而在一些研究中草铵膦已被归为持久性污染物,其半衰期为3~42 d[10]。草铵膦会抑制树蟾体内乙酰胆碱酯酶和丁酰胆碱酯酶的活性[11];草铵膦染毒会诱导蟾蜍蝌蚪血液红细胞微核率升高[9]。还有研究表明,草铵膦会造成人的DNA氧化性损伤[12];在使用草铵膦的地区,通过饮食和饮水可对人体和动物造成危害[13-15]。
随着草铵膦的广泛应用,其残留物对人体健康的影响越来越受到人们的重视,开展其水生生物毒性的相关研究可以评价其对水体的安全性。斑马鱼 Danio rerio 是目前理想的生物模型[16-17]。本研究采用草铵膦感染早期斑马鱼胚胎,通过形态学、分子生物学以及组织学等手段,观察评价了草铵膦对胚胎生长发育的影响。
1 材料与方法 1.1 仪器与试剂5415R 型台式离心机 (Eppendorf 公司);数码照相机 DXM1200、倒置显微镜 E600及 EclipseNet 图像分析软件 (Nikon 公司)。
10% 草铵膦 (glufosinate-ammonium) 水溶液 (由Solarbio公司从德国拜耳进口分装);阿尔新蓝 (Alcian blue 8GX,Solarbio);DIG 抗体显色剂 (BM purple,Roche);抗地高辛抗体 (DIG,Roche);Trizol RNA 提取试剂盒 (Gibco);反转录试剂盒 (Promega);SYBR Green I PCR 反应混合液 (TaKaRa);肝素和酵母 tRNA (Solarbio)。
阿尔新蓝染液:由0.1 g 阿尔新蓝、20 mL 醋酸和80 mL 95% 乙醇组成。
20 × 氯化钠柠檬酸钠缓冲液 (SSC):氯化钠17.52 g,柠檬酸钠8.84 g,蒸馏水80 mL;用氢氧化钠调 pH 值至6.0,定容至100 mL,高压灭菌,4 ℃ 或者室温保存。
1.2 供试动物斑马鱼 Danio rerio (AB 系) 由日本酪农学园大学赠送,饲养于北京爱生公司生产的斑马鱼养殖系统中,保持饲养水温28.5 ℃ 、光照时间为14 h/d。试验前一天傍晚,随机选取3条雌鱼和6条雄鱼放在同一斑马鱼专用孵化缸中混养,于第2日8:00开灯,待其自然交配后,挑选发育正常的受精卵置于直径为3 cm 的六孔板中,在受精后2 h 进行草铵膦染毒。每个浓度10个胚胎,3次重复。染毒后移入孵化箱,于28.5 ℃ 下培养。分别于受精后24、48或120 h 取样观察,记录死亡和畸形胚胎个数。
1.3 试验处理根据预试验结果,最终确定了6个草铵膦染毒浓度处理,分别为:空白对照、0.001 μg/L (微量浓度组)、1.0 μg/L (低浓度组)、1.3 μg/L (有畸形但未出现死亡的浓度)、1.6 μg/L(开始出现死亡个体的浓度) 和2.0 μg/L (全部死亡组,即高浓度组)。
1.4 软骨染色参考 Dong 等的方法[16]。1)胚胎的固定:取受精后120 h 的幼鱼10条,用4% 的中性缓冲多聚甲醛 (PFA) 于4 ℃ 下固定并过夜;2)染色:用阿尔新蓝染液染色6 h;3)清洗:用75% 和50% 的酒精以及蒸馏水各清洗3 h;4)祛黑色素:依次用0.05% 的胰酶-饱和四硼酸盐 (tetraborate) 和1% 氢氧化钾-30% 双氧水各处理1 h;5)观察及保存:在70% 甘油中观察及保存。
1.5 原位杂交及定位Vasa (AB0055147.1) 探针的制备采用981~1 400 pb 和1 658~2 795 bp 两个 Vasa 片段,引物分别是 zVasaS1:5′-TGGCTTGTGCTCAGACC TGGA-3′;zVasaR1:5′-AAAGCCCATGTCC AGCATTCTG-3′ 和 zVasaS2:5′-AGATCTCAAC CACAAGCATCCAT-3′;zVasaR2:5′-GTCACC AGTATCCGTCTTTATT-3′。HSP90a (NM131328.1) 探针的制备采用68~509 pb HSP90a的片段,引物分别为5′-CCGCAGGTGGAGAAGAGGA-3′ 和5′-GACA GTGAACGATCCGCCA-3′。将扩增后的基因片段插入 pGEM 质粒中,经过筛选、扩增、测序、酶切和纯化后,在 DIG 标识的 dNTP 和 T7或者 SP6 Ploymerase (Roche) 存在的情况下,合成各自的探针。
原位杂交按 Dong 等[16] 的方法进行。取受精后24 h 的胚胎,于4 ℃ 下用4% 的 PFA 固定12 h;用蛋白酶 K (1.0 × 10-6 mol/L) 于室温下消化30 min;加入原位杂交液 (50% 甲酰胺,5 × SSC,2 g/L tRNA,200 μg/mL 肝素),于64 ℃ 恒温箱中培养1 h (预杂交);用含有斑马鱼 Vasa 基因探针的原位杂交缓冲液更换过夜;分别用2 × SSC、0.2 × SSC 在64 ℃ 加热器中各清洗30 min,再用顺丁烯二酸缓冲液 (0.1 mol/L 顺丁烯二酸,0.15 mol/L 氯化钠,0.1% 吐温-20,pH 7.5) 清洗20 min,然后用封闭液 (blocking buffer:2% blocking reagent,0.1 mol/L 顺丁烯二酸,0.15 mol/L 氯化钠,0.1% 吐温-20,pH 7.5) 在室温下清洗1 h;置于4 000倍稀释的抗地高辛抗体 (DIG) 中,于4 ℃ 冰箱中反应过夜;加入清洗液 (0.1 mol/L Tris-HCl,pH 9.5,0.1 mol/L 氯化钠,0.05 mol/L 氯化镁,0.1% 吐温-20) 静置20 min,用 BM purple AP 染色,观察基因表达部位、范围与强度等,对特定基因的表达进行定位,并运用 CCD 摄像系统进行解析。
1.6 RNA 的提取及定量 PCR (QRT-PCR) 技术总 RNA 的提取使用 Trizol RNA 提取试剂盒。取受精后24 h 的胚胎,分成3组,即3次重复,每个重复30粒鱼卵,匀浆后,加入氯仿于4 ℃、12 000 r/min 下离心10 min;离心后用移液枪移取上层水相 (含有RNA) 到新管中,用异丙醇沉淀 RNA,经80% 乙醇冲洗2遍后用无核酸酶水溶解,采用多功能酶标仪测定 OD260 和 OD280 值,并计算 OD260/OD280 的比值,求出 RNA 产量。转录采用反转录酶2 μL、5 × Buffer 4 μL、5 mmoL/L dNTP 4 μL、反转录抑制剂1 μL、特异下游引物1 μL和总 RNA 1 μg,最后加无核酸酶水至20 μL;于42 ℃ 60 min→95 ℃ 5 min→冰水中冷却5 min,备用。
SYBR Green I QRT-PCR 方法的建立:在25 μL反应体系中,加入 SYBR Green I PCR 反应混合液12.5 μL,Vasa 上、下游引物各0.5 μL,cDNA 2 μL (1 ng),水9.5 μL;于95 ℃ 10 min→95 ℃ 15 s→60 ℃ 1 min,40个循环。内参基因为 β-Actin,采用2-ΔΔCT 方法计算基因表达的相对变化。
1.7 统计方法数据用 SPSS 统计软件在单因素方差分析方法中进行多重比较。结果以平均值±标准误差表示,差异显著性水平设置为 P < 0.05。
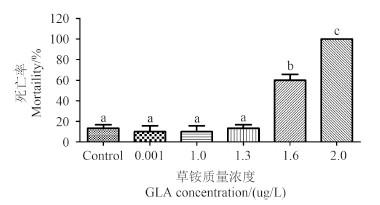
2 结果与分析 2.1 草铵膦对斑马鱼胚胎及仔鱼的致死作用用草铵膦染毒受精后2 h 的斑马鱼胚胎,于受精后第120小时取样观察发现,随草铵膦处理浓度升高,各处理间死亡率存在差异。其中对照组、0.001、1.0、1.3、1.6和2 μg/L 浓度组的死亡率分别为13.3% 、10% 、10% 、13.3% 、60% 和100% (图 1),且1.6和2.0 μg/L 处理间存在显著差异,这两组与其他处理间也存在显著差异。
|
不同字母表示处理间差异显著,P < 0.05。
Different letters indicate significant difference, P < 0.05. 图 1 草铵膦对斑马鱼胚胎及仔鱼的致死作用 Fig. 1 The effect of GLA on mortality of zebrafish embryos and larvae |
2.2 草铵膦对斑马鱼胚胎和仔鱼形态的影响
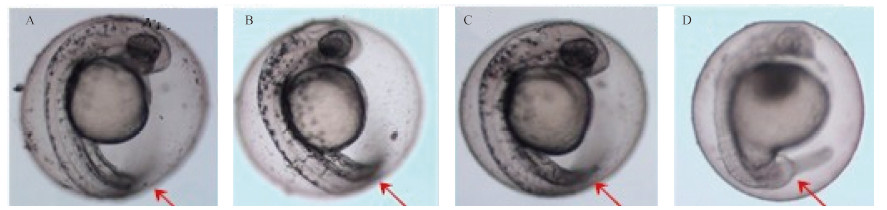
草铵膦可引起斑马鱼胚胎黑色素沉着障碍和仔鱼尾部弯曲 (图 2)。在受精后2 h 用草铵膦进行染毒,于受精后120 h记录。对照组、0.001、1.0、1.3和1.6 μg/L 浓度组畸形率分别为0、0、0、70% 和40%;2 μg/L 浓度组全部死亡 (图 3)。
|
A、B、C、D分别为对照组、0.001、1.0和1.3 μg/L 染毒处理。箭头表示胚胎尾部。
A: Control; B: 0.001 μg/L GLA; C: 1.0 μg/L GLA; D: 1.3 μg/L GLA. Arrow indicates tail. 图 2 草铵膦对斑马鱼胚胎形态的影响 Fig. 2 The effect of GLA on morphology of zebrafish embryos |
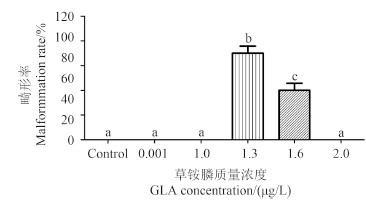
|
图 3 草铵膦对斑马鱼仔鱼的致畸作用 Fig. 3 The effect of GLA on malformation rate of zebrafish larvae |
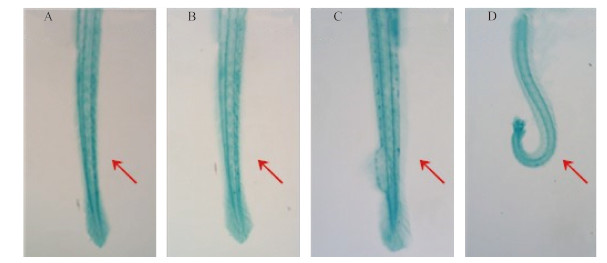
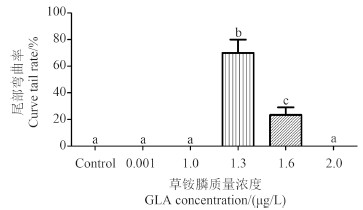
草铵膦可诱导斑马鱼仔鱼尾部弯曲 (图 4)。用草铵膦染毒受精后2 h 的斑马鱼胚胎,于受精后120 h 取样观察发现,对照组、0.001和1.0 μg/L 浓度组尾部弯曲率均为0;1.3 μg/L 浓度组尾部弯曲率平均为70%;1.6 μg/L 浓度组尾部弯曲率平均为23.3%;2.0 μg/L 浓度组全部死亡 (图 5)。
|
A、B、C、D 分别为对照组及0.001、1.0和1.3 μg/L 染毒处理。箭头表示鱼尾部。
A: Control; B: 0.001 μg/L GLA; C: 1.0 μg/L GLA; D: 1.3 μg/L GLA. Arrow indicates tail. 图 4 草铵膦对斑马鱼仔鱼尾部形态的影响 Fig. 4 The effect of GLA on tail morphology of zebraifsh larvae |
|
不同字母表示处理间差异显著,P < 0.05.
Different letters indicate significant difference, P < 0.05. 图 5 草铵膦对斑马鱼仔鱼尾部弯曲率的影响 Fig. 5 The effect of GLA on the tail curving rate of zebrafish larvae |
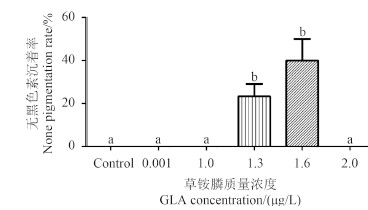
高浓度草铵膦可阻碍斑马鱼胚胎的黑色素沉着 (图 2D)。用草铵膦染毒受精后2 h 的斑马鱼胚胎,于受精后48 h 取样观察 (图 6) 发现:对照组、0.001和1.0 μg/L 浓度组无黑色素沉着;1.3 μg/L 浓度组无黑色素沉着率平均为23.3%;1.6 μg/L 浓度组无黑色素沉着率平均为40%;2.0 μg/L 浓度组全部死亡。
|
不同字母表示处理间差异显著,P < 0.05。
Different letters indicate significant difference, P < 0.05. 图 6 草铵膦对斑马鱼胚胎黑色素沉着的影响 Fig. 6 The effect of GLA on the none pigmentation rate of zebrafish embryos |
2.3 草铵膦对斑马鱼 Vasa 基因表达的影响
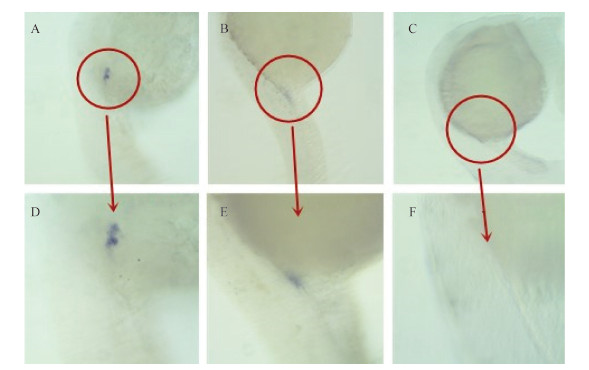
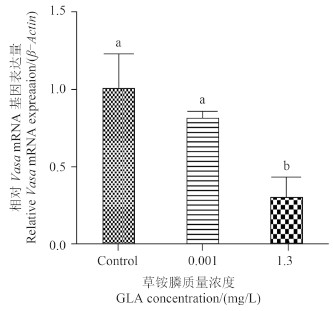
Vasa 基因是斑马鱼原始生殖细胞相关基因,本研究采用1.3 μg/L (有畸形但未出现死亡的浓度) 和0.001 μg/L (微量浓度),在受精后2 h 染毒,于受精后24 h 取样,每个处理取10枚鱼卵固定,进行原位杂交,图 7 中紫色为 Vasa 基因。与对照组相比,0.001 μg/L 低浓度组没有明显的 Vasa 基因表达被抑制现象 (图 7),但1.3 μg/L 浓度组有明显的 Vasa 基因表达被抑制现象。进一步应用 QRT-PCR 进行了定量测定。0、0.001和1.3 μg/L 3个处理从受精后2 h 染毒至受精后24 h,收集鱼卵提取总 RNA 转录 cDNA,以 β-Actin 为内参基因,发现经0.001和1.3 μg/L 草铵膦处理后,在受精后24 h 可引起 Vasa 基因表达分别下调1.2和3.8倍 (图 8)。表明草铵膦具有潜在的生殖毒性。
|
A 为对照组,B 为0.001 μg/L 浓度组,C 为1.3 μg/L 浓度组,D、E、F 分别为 A、B、C 的10倍放大照片。箭头表示 Vasa 基因表达部位。
A: Control; B: 0.001 μg/L GLA; C: 1.3 μg/L GLA; D, E, F are their 10 times photographs respectively. Arrow: the area of Vasa expression. 图 7 草铵膦对斑马鱼胚胎 Vasa 基因表达的影响 Fig. 7 The effect of GLA on Vasa mRNA expression of zebrafish embryos |
|
不同字母表示处理间差异显著,P < 0.05。
Different letters indicate significant difference, P < 0.05. 图 8 QRT-PCR 检测草铵膦对斑马鱼胚胎 Vasa 基因表达的影响 Fig. 8 The effect of GLA on the expression of Vasa gene in embryos of zebrafish as determined by QRT-PCR |
3 结论与讨论
目前,尚未见关于草铵膦对斑马鱼毒性的研究报道。本研究用不同浓度草铵膦染毒受精后2 h的斑马鱼胚胎,检测了草铵膦的致死毒性、致畸作用和潜在的生殖毒性,并评价了其毒性作用。结果显示,草铵膦致死浓度范围窄,于受精后2 h染毒,当其质量浓度为1.3 μg/L 时,斑马鱼无死亡,而当其质量浓度升高到2.0 μg/L时,斑马鱼全部死亡。另有研究显示,草铵膦能特异性诱发小鼠神经上皮细胞凋亡[18],并且细胞凋亡发生在小鼠神经上皮细胞中的脑泡细胞和神经管中,而不是间质细胞[19]。还有研究发现,产前和产后的小鼠经低浓度草铵膦暴露会造成神经损伤并诱导自闭症的产生[20]。这些都表明草铵膦对小鼠具有神经毒性。
在草铵膦的致畸作用方面尚缺少相关报道,在小鼠试验中没有发现其致畸作用[21],这与本试验中草铵膦可引起斑马鱼尾部弯曲和抑制黑色素沉着的结果不符,原因可能是由于供试动物和试验方法不同。本试验还发现,尾部弯曲和抑制黑色素沉着不一定同时发生在同一条鱼身上,其中有一部分鱼只出现尾部弯曲现象而黑色素沉积正常,而另外一部分鱼无黑色素沉积但尾部正常。
在生殖毒性方面,已明确草铵膦会引起小鼠胚胎着床障碍[21]。本研究中用草铵膦1.3 μg/L 于受精后2 h 染毒,24 h 取样通过原位杂交和 QRT-PCR 技术,可监测到斑马鱼 Vasa 基因表达受到抑制,该结论与文献报道相符,从而印证了草铵膦对斑马鱼胚胎具有生殖毒性。
综上所述,草铵膦对斑马鱼具有较强的致死毒性和致畸作用,同时还具有潜在的生殖毒性。
| [1] |
凌进. 草铵膦、百草枯、草甘膦对非耕地杂草的防效比较 [J]. 农药, 2014,53 (8)
:613–615.
LING J. Comparison of control effect on non-arable land weeds of glufosinate-ammonium, paraquat and glyphosate [J]. Agrochemicals, 2014, 53 (8) :613–615 . |
| [2] | EBERT E, LEIST K H, MAYER D. Summary of safety evaluation toxicity studies of glufosinate ammonium [J]. Food Chem Toxicol, 1990, 28 (5) :339–349 . |
| [3] |
吴文进, 余永志. 不同浓度草铵膦水剂防除非耕地杂草药效试验初报 [J]. 中国园艺文摘, 2013 (10)
:47–48.
WU W J, YU Y Z. Testing control effect on non-arable land weeds with different concentration solution of glufosinate ammonium [J]. Chin Horticult Abstr, 2013 (10) :47–48 . |
| [4] |
梁丽娜, 郭平毅, 李奇峰. 中国除草剂产业现状、面临的问题及发展趋势 [J]. 中国农学通报, 2005,21 (10)
:321–323.
LIANG L N, GUO P Y, LI Q F. China herbicides industry present situation, question and development trend [J]. Chinese Agric Sci Bull, 2005, 21 (10) :321–323 . |
| [5] | DALLUGE J J, NELSON B C, THOMAS J B, et al. Selection of column and gradient elution system for the separation of catechins in green tea using high-performance liquid chromatography [J]. J Chromatogr A, 1998, 793 (2) :265–274 . |
| [6] | COETZER E, ALKHATIB K, LOUGHIN T M. Glufosinate efficacy, absorption, and translocation in amaranth as affected by relative humidity and temperature [J]. Weed Sci, 2001, 49 (1) :8–13 . |
| [7] | NOLTE S A, YOUNG B G, MUNGUR R, et al. The glutamate dehydrogenase gene gdhA increased the resistance of tobacco to glufosinate [J]. Weed Res, 2004, 44 (4) :335–339 . |
| [8] |
李小翠. 草铵膦在大鼠体内毒物代谢动力学研究[D]. 武汉: 华中科技大学, 2012: 9-10.
LI X C. Toxicokinetics of glufosinate-ammonium in rats[D]. Wuhan: Huazhong University of Science and Technology, 2012: 9-10. |
| [9] | LAJMANOVICH R C, CABAGNA-ZENKLUSEN M C, ATTADEMO A M, et al. Induction of micronuclei and nuclear abnormalities in tadpoles of the common toad (Rhinella arenarum) treated with the herbicides Liberty® and glufosinate-ammonium [J]. Mutat Res/Genet Toxicol Environ Mutagen, 2014, 769 :7–12 . |
| [10] | UK Ministry of Agriculture Fisheries and Food (MAFF). Evaluation No. 33, HOE 399866(Glufosinate-ammonium)[Z]. London, 1990. |
| [11] | PELTZER P M, JUNGES C M, ATTADEMO A M, et al. Cholinesterase activities and behavioral changes in Hypsiboas pulchellus (Anura: Hylidae) tadpoles exposed to glufosinate ammonium herbicide [J]. Ecotoxicol, 2013, 22 (7) :1165–1173 . |
| [12] | KOUREAS M, TSEZOU A, TSAKALOF A, et al. Increased levels of oxidative DNA damage in pesticide sprayers in Thessaly Region (Greece). Implications of pesticide exposure [J]. Sci Total Environ, 2014, 496 :358–364 . |
| [13] | HOFFMAN L, HARDEJ D. Ethylene bisdithiocarbamate pesticides cause cytotoxicity in transformed and normal human colon cells [J]. Environ Toxicol Pharmacol, 2012, 34 (2) :556–573 . |
| [14] | PARO R, TIBONI G M, BUCCIONE R, et al. The fungicide mancozeb induces toxic effects on mammalian granulosa cells [J]. Toxicol Appl Pharmacol, 2012, 260 (2) :155–161 . |
| [15] | SRIVASTAVA A K, ALI W, SINGH R, et al. Mancozeb-induced genotoxicity and apoptosis in cultured human lymphocytes [J]. Life Sci, 2012, 90 (21-22) :815–824 . |
| [16] | DONG W, TERAOKA H, YAMAZAKI K, et al. 2,3,7,8-tetrachlorodibenzo-p-dioxin toxicity in the zebrafish embryo: local circulation failure in the dorsal midbrain is associated with increased apoptosis [J]. Toxicol Sci, 2002, 69 (1) :191–201 . |
| [17] |
于永利, 杨景峰, 巴雅斯胡, 等. 高残留农药福美双对斑马鱼胚胎脊索的特异性影响 [J]. 环境科学研究, 2011,24 (11)
:1297–1304.
YU Y L, YANG J F, BA Y, et al. Specific effects of the highly-persistent pesticide thiuram on notochord development in zebrafish embryos [J]. Res Environ Sci, 2011, 24 (11) :1297–1304 . |
| [18] | TYAGI S, GEORGE J, SINGH R, et al. Neoplastic alterations induced in mammalian skin following mancozeb exposure using in vivo and in vitro models [J]. OMICS: J Integrat Biol, 2011, 15 (3) :155–167 . |
| [19] | WATANABE T. Apoptosis induced by glufosinate ammonium in the neuroepithelium of developing mouse embryos in culture [J]. Neurosci Lett, 1997, 222 (1) :17–20 . |
| [20] | LAUGERAY A, HERZINE A, PERCHE O, et al. Pre-and postnatal exposure to low dose glufosinate ammonium induces autism-like phenotypes in mice [J]. Front Behav Neurosci, 2014, 8 :390. |
| [21] | SCHLTE-HERMANN R, WOGAN G N, BERRY S, et al. Analysis of reproductive toxicity and classification of glufosinate-ammonium [J]. Regul Toxicol Pharmacol, 2006, 44 (s1) :1–76 . |
 2016, Vol. 18
2016, Vol. 18


