2. 山东省泰安市农业科学研究院 植物保护研究所, 山东 泰安 271018
2. Insitute of Plant Protection, Tai'an Academy of Agricultural Sciences, Tai'an 271018, Shandong Province, China
耿氏硬草 Pseudosclerochloa kengiana (Ohwi) Tzvel. 为一年生或越年生禾本科硬草属杂草,主要分布在中国稻麦两熟地区[1]。自 20 世纪 90 年代开始,耿氏硬草在稻茬麦田发生基数不断增加,逐渐成为杂草群落的优势种群,严重影响小麦的产量和品质[2]。长期以来,以精鰁唑禾草灵为代表的芳氧苯氧基丙酸酯类 (APP) 除草剂是防除麦田禾本科杂草的主要药剂,其作用靶标是乙酰辅酶 A 羧化酶 (acetyl-CoA carboxylase,ACCase)[3]。
ACCase 在 ATP 的参与下将乙酰辅酶 A 羧化为丙二酸单酰辅酶 A,该反应既是脂肪酸合成反应中的第一步反应,也是关键步骤,同时也是限速步骤[4]。目前针对该靶标的除草剂共有 3 大类:芳氧苯氧基丙酸酯类 (aryloxyphenoxypropionate,APP)、环己烯酮类 (cyclohexanedione,CHD) 和新苯基吡唑啉类 (phenylpyraxoline,DEN)。ACCase 类除草剂自 20 世纪 70 年代末被开发以来,已在全球范围内用来控制禾本科杂草,但其作用位点单一,易产生抗性。自从 1986 年澳大利亚发现第一例抗 ACCase 类除草剂的硬直黑麦草 Lolium rigidum[5]以来,截至目前全球 38 个国家已有 47 种杂草对 ACCase 类除草剂产生了抗性[6]。中国正式报道的对 ACCase 类除草剂已产生抗性的杂草有 8 种,分别是看麦娘 Alopecurus aequalis、日本看麦娘 Alopecurus japonicus、菵草 Beckmannia syzigachne、棒头草 Polypogon fugax、千金子 Leptochloa chinensis、马唐 Digitaria sanguinalis、稗草 Echinochloa crus-galli var. crus-galli 和耿氏硬草[6]。
杂草对除草剂抗药性机制主要包括 2 个方面:靶标抗性 (target site resistance,TSR) 和非靶标抗性 (non-target site resistance,NTSR)。靶标抗性是由除草剂作用靶标的某个位点氨基酸突变而导致的对除草剂敏感度下降或者靶标酶的过量表达引起的;非靶标抗性是由杂草对除草剂的代谢作用增强或吸收转运的减少导致到达作用靶标部位的除草剂减少引起的。多数杂草对 ACCase 类除草剂产生抗药性的主要原因是由于 ACCase 羧基转移酶 (carboxyltransferase,CT) 区域的基因发生突变,进而导致 ACCase 对除草剂的敏感性降低[7]。2001 年 Zagnitiko 等[8]研究证实,硬直黑麦草 ACCase CT 区域的一个 Ile-Leu 被替换导致其对禾草灵和烯禾啶的抗性。目前,已报道的可导致杂草抗药性产生的 ACCase 基因突变位点共 7 个:1781 位异亮氨酸 (Ile1781) 被亮氨酸 (Leu)、缬氨酸 (Val) 或苏氨酸 (Thr) 所取代;1999 位色氨酸 (Trp1999) 被半胱氨酸 (Cys)、亮氨酸或丝氨酸 (Ser) 所取代;2027 位色氨酸 (Trp2027) 被半胱氨酸所取代;2041 位异亮氨酸 (Ile2041) 被天冬酰胺 (Asn) 或缬氨酸所取代;2078 位天冬氨酸 (Asp2078) 被甘氨酸 (Gly) 所取代;2088 位半胱氨酸 (Cys2088) 被精氨酸 (Arg) 所取代;2096 位甘氨酸 (Gly2096) 被丙氨酸 (Ala) 或丝氨酸所取代[9-11]。通常,Trp1999、Trp2027、Ile2041 和 Gly2096 位点的氨基酸突变会导致对一种或多种 APP 类除草剂产生抗性,而不会对 CHD 或 DEN 类除草剂产生抗性;而 Ile1781、Asp2078 和 Cys2088 位氨基酸的突变则会对所有的 ACCase 类除草剂产生抗性[9, 12]。
中国已于 2010 年在山东省和江苏省的多个小麦田发现了抗 ACCase 类除草剂的耿氏硬草[6]。目前国内外有关耿氏硬草对 ACCase 类除草剂抗性的研究报道很少。2015 年本文作者首次报道了耿氏硬草对 ACCase 类除草剂产生抗药性是由 ACCase 基因 1999 位色氨酸突变所致[11]。近几年来,许多农民反映精鰁唑禾草、炔草酯等 ACCase 类除草剂对麦田耿氏硬草的防效显著下降,以田间推荐剂量喷施该药剂已经无法有效防除耿氏硬草。随着抗药性杂草种群密度和发生面积的增加,杂草防除效果显著下降,作物产量损失随之增加。
本研究采用剂量-反应曲线法测定了潜在抗性耿氏硬草种群对不同 ACCase 类除草剂的抗性水平,并通过扩增和比对抗性和敏感种群间 ACCase 基因 CT 区序列,从分子水平初步阐明其靶标抗性机制,为制定耿氏硬草防除策略和延缓其抗药性种群的发展提供科学依据。
1 材料与方法 1.1 供试材料杂草:潜在抗性耿氏硬草种群 (SD-32) 种子于 2013 年 6 月采自山东省济宁市鱼台县清河镇鹿洼村麦田,该麦田已连续十几年使用精鰁唑禾草灵;敏感性耿氏硬草种群 (SD-6) 种子采自同一地区的非麦田 (从未使用过除草剂)。
除草剂:69 g/L 精鰁唑禾草灵 (fenoxaprop-p-ethyl) 水乳剂,拜耳作物科学 (中国) 有限公司;15% 炔草酯 (clodinafop-propargyl) 可湿性粉剂和5% 唑啉草酯 (pinoxaden) 乳油,瑞士先正达作物保护有限公司;240 g/L 烯草酮 (clethodim) 乳油,北京明德立达农业科技有限公司;12.5% 烯禾啶 (sethoxydim) 乳油,日本曹达株式会社。
主要仪器:RXZ 型人工气候箱,宁波江南仪器厂;GA110 型万分之一电子天平,德国赛多利斯公司;ASS-4 型自动控制农药喷洒系统,国家农业信息化工程技术中心研制,北京盛恒天宝科技有限公司生产;5424R 型台式高速冷冻离心机,德国 Eppendorf 公司;恒温水浴锅,上海亚荣生化仪器厂;T100 梯度 PCR 仪,美国 Bio-Rad 公司;ChampGel 6000 紫外凝胶成像系统,北京赛智创业科技有限公司;DYY-6C 电泳仪,北京六一仪器厂;3730 全自动 DNA 测序仪,美国 ABI 公司。
1.2 耿氏硬草对 5 种 ACCase 类除草剂的敏感性测定采用剂量-反应曲线法测定 SD-32 和 SD-6 种群对精鰁唑禾草灵、炔草酯、烯禾啶、烯草酮和唑啉草酯 5 种 ACCase 类除草剂的敏感性。选择饱满一致的耿氏硬草种子,用 30% 次氯酸钠溶液进行表面消毒 20 min,灭菌水冲洗 3~5 次。消毒后的种子于无菌条件下播种在 0.6% 琼脂培养基平板上,置于人工气候箱内培养 (光照(L/D):12 h/12 h;温度:白天 15 ℃,晚上 10 ℃)。将萌发露白的种子播种于装有壤土的塑料盆钵 (直径 12 cm),置于可控日光温室 (夜间温度 18~22 ℃,白天温度 20~33 ℃,自然光照,相对湿度 57%~68%)。待幼苗长至 1 叶 1 心期,间苗,每盆保留 15 株长势基本一致的植株。于 3 叶 1 心期 (约出苗后 28 d) 进行茎叶喷雾处理,喷雾采用 ASS-4 型自动定量喷雾系统,喷液量为 450 L/hm2,喷雾压力为 0.275 MPa。根据预试验,各除草剂处理剂量见表 1。试验重复 2 次,每处理 3 次重复,设清水对照。喷药后将塑料盆钵移回可控日光温室培养,培养条件同上。喷药 21 d 后,剪取耿氏硬草植株的地上部分,放入恒温干燥箱内 75 ℃ 烘干 72 h,称量干重,按 (1) 式计算干重比值。根据双逻辑非线性回归模型 (2)[13]计算抑制杂草生长 50% 所需的除草剂剂量,并按公式 (3) 计算抗性倍数。
|
|
表 1 耿氏硬草对 ACCase 类除草剂的敏感性测定中所用除草剂的剂量 Table 1 The herbicide doses used for determining the sensitivity to ACCase-inhibiting herbicides in P. kengiana |

|
(1) |
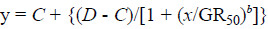
|
(2) |

|
(3) |
公式 (2) 中,y 为特定除草剂用量下杂草的地上部干重的比值;C 为剂量反应下限;D 为剂量反应上限;x 为除草剂用量;GR50 为抑制 50% 生长量时的除草剂剂量;b 为斜率。
1.3 耿氏硬草抗性和敏感种群 ACCase 基因差异 1.3.1 基因组 DNA 提取耿氏硬草生长至 3 叶 1 心期后,分别剪取抗性和敏感种群单株的幼嫩叶片,迅速用液氮处理后置于 –80 ℃ 冰箱保存。采用 CTAB 法[14]提取 DNA。
1.3.2 ACCase CT 区域基因的 PCR 扩增根据 NCBI 的 GenBank 数据库提供的大穗看麦娘 Alopecurus myosuroides 质体型 ACCase 基因序列 (AJ310767) 设计了 1 对引物,用于扩增包含已报道赋予抗性 7 个突变位点的 ACCase CT 区序列。引物序列为 FP:5′-ACTCTGGTGCTCGGATTGG-3′,RF:5′-CCCTGGAGTCTTGCTTTCAGAT-3′,由生工生物工程 (上海) 股份有限公司合成。
PCR 反应总体积为 25 μL,包括:17 μL ddH2O,0.5 μL Tap plus DNA 聚合酶 (2.5 U/μL,TIANGEN 公司),2.5 μL 10 × Tap plus Buffer (含 Mg2+),2 μL dNTP Mixture (2.5 mmol/L),1 μL 正向引物 FP (10 μmol/L),1 μL 反向引物 RP (10 μmol/L),1 μL 基因组 DNA 为模板。PCR 反应条件:94 ℃ 预变性 5 min;94 ℃ 变性 50 s,58 ℃ 退火 50 s,72 ℃ 延伸 1 min 30 s,35 个循环;72 ℃ 再延伸 10 min。
1.3.3 PCR 产物测序PCR 反应结束后,取 3 μL 扩增产物于 1% 琼脂糖凝胶中电泳检测。将有特异性目的条带的 PCR 样品送生工生物工程 (上海) 股份有限公司测序,测序引物为扩增引物 FP 和 RF,双向测序。用 Chromas 2.4.1 软件对测序结果进行分析。
1.3.4 PCR 产物克隆、测序将目的条带进行回收,连接到 pEASY-T1 载体上,然后转到大肠杆菌感受态细胞 Trans1-T1 中,涂布于含有 Ampicilin 和 X-gal/IPTG 的 LB 固体培养基上培养过夜。挑取白色菌落到含 Ampicilin 的 LB 培养液中振荡培养,取菌液为模板进行 PCR 鉴定,得到的阳性克隆送生工生物工程 (上海) 股份有限公司测序验证。将测序结果在 NCBI 上进行 BLAST 比对,用 DNAMAN 5.2.2 软件对扩增出的抗性和敏感种群耿氏硬草 ACCase 基因进行比对分析。
1.4 数据分析试验数据采用 SPSS 20.0 软件的 ANOVA 方法进行差异性分析,用 SigmaPlot 12.5 软件的双逻辑非线性回归模型计算 GR50 值。
2 结果与分析 2.1 耿氏硬草对 5 种 ACCase 类除草剂的敏感性由图 1 可以看出,耿氏硬草抗性种群和敏感种群对同一 ACCase 类除草剂的剂量-反应曲线存在明显差异。5 种 ACCase 类除草剂在田间推荐剂量下,敏感种群 SD-6 的干重比值均低于 20%,而潜在抗性种群 SD-32 的干重比值均大于 80%。从表 2 得知,种群 SD-32 对精鰁唑禾草灵、炔草酯、烯禾啶、烯草酮和唑啉草酯的 GR50 值均高于敏感种群 SD-6,抗性倍数分别为 16.5、7.5、15.0、4.4 和 5.7。表明 SD-32 种群对精鰁唑禾草灵产生了高水平抗性,同时对炔草酯、烯禾啶、烯草酮和唑啉草酯也产生了不同程度的抗性。

|
图 1 类除草剂对耿氏硬草抗性和敏感种群的剂量-反应曲线 Fig. 1 The dose-response relationship curves of ACCase-inhibiting herbicides between the resistant and susceptible P. kengiana populations |
|
|
表 2 耿氏硬草种群对 ACCase 类除草剂的抗性水平 Table 2 The resistance level of P. kengiana populations to ACCase-inhibiting herbicides |
2.2 耿氏硬草抗性、敏感种群 ACCase 基因差异
以提取的基因组 DNA 为模板,按上述 PCR 反应条件进行扩增,得到一条大小约为 1 200 bp 的基因片段,与预期目的片段 1 291 bp 的大小一致。将目的片段进行克隆、测序。在 NCBI 上进行 BLAST 比较,发现扩增到的 SD-32 和 SD-6 种群的 ACCase 基因序列与大穗看麦娘质体型 ACCase 基因 (GenBank No. AJ310767) 序列的同源性约 96%,而与大穗看麦娘胞质型 ACCase 基因 (GenBank No. AJ632096) 序列的同源性仅 78% 左右,确认所扩增的序列为耿氏硬草质体型 ACCase 基因序列。
对扩增出的抗性、敏感耿氏硬草 ACCase 基因 CT 区域核苷酸序列用 DNAMAN 软件进行比对,发现与敏感种群 SD-6 相比,SD-32 种群 ACCase 基因 CT 区域 6233 位 (以大穗看麦娘 ACCase 基因编码为标准) 碱基 A 突变为 G,导致 2078 位氨基酸由天冬氨酸突变为甘氨酸,即 Asp-2078-Gly。
为明确抗性种群 SD-32 发生 Asp-2078-Gly 突变的频率,本研究在 SD-32 种群中随机选取 100 个单株分别进行基因组 DNA 提取、PCR 扩增和产物直接测序。结果发现,所有单株 ACCase 基因第 6233 位碱基均发生了突变,由碱基 A 突变为 G。
3 讨论截至目前,中国共报道了 8 种抗 ACCase 类除草剂的杂草[6]。杨彩宏等[15]报道,中国油菜田日本看麦娘在连续应用高效氟吡甲禾灵约 10 a 后对该药产生了显著的抗性。张锁荣[16]研究发现,连续施用精鰁唑禾草灵 3 a 的麦田菵草产生了抗药性,并且随着连续施药年限的延长,菵草的抗性水平不断提高。根据 Gressel 分成的 3 个风险等级,ACCase 类除草剂属于抗性风险中的高风险级别[17]。Devine[18]提出,一般连续施用该类除草剂 6~10 a,杂草就会产生抗性。本研究中,耿氏硬草种群 SD-32 的采集地块连续施用精鰁唑禾草灵的历史超过 10 a。剂量-反应曲线法测定发现,SD-32 种群对精鰁唑禾草灵产生了较高水平的抗性。
基因突变可导致杂草抗药性的产生,在有关抗 ACCase 类除草剂的杂草报道中,发现 ACCase 基因 CT 区域的 7 个氨基酸位点突变与抗性相关[7]。Nikolskaya 等[19]将小麦质体 ACCase CT 亚基的编码基因片段与酵母 ACCase 基因重组,证实了质体 ACCase 与除草剂互作的区域是 CT 亚基之内一段大约 400 个氨基酸残基的区域。本研究通过对抗性、敏感耿氏硬草种群质体型 ACCase 基因 CT 区域进行扩增、测序和比对后发现,SD-32 种群植株的 ACCase 第 2078 位氨基酸发生了突变,Asp2078 被 Gly 取代。前人研究证实,这种突变是导致日本看麦娘、看麦娘、硬直黑麦草、野燕麦 Avena fatua 等对 ACCase 类除草剂产生抗药性的分子基础[20-23]。Beckie 等[9]报道,特定的氨基酸位点突变赋予杂草对 ACCase 类除草剂不同的交互抗性模式。本研究发现,抗性种群 SD-32 对炔草酯、烯草酮、烯禾啶和唑啉草酯产生了交互抗性。此结果与 Yu 等[23]发现 Asp-2078-Gly 赋予了硬直黑麦草对禾草灵、炔草酯、烯草酮和唑啉草酯产生抗性的结论一致。Petit 等[24]也报道,在大穗看麦娘中 ACCase 基因 2078 位氨基酸的突变导致了其对精鰁唑禾草灵、炔草酯和唑啉草酯产生高水平的抗性。因此,Asp2078 位点突变可能是耿氏硬草种群 SD-32 对 ACCase 类除草剂产生抗药性的重要原因之一。本次试验没有对除草剂代谢等非靶标机制进行研究,因此不能排除其对抗性产生的贡献,这有待进一步研究。
过度频繁地在同一地区或对于同一防治对象使用同一种除草剂或具有相同作用方式的同一类除草剂,会造成抗性杂草在该地区迅速传播,使得杂草抗性问题日益突出与严重。本研究 PCR 产物直接测序发现随机选取的 100 个 SD-32 种群植株 ACCase 基因都发生了 Asp-2078-Gly 突变。当杂草种群抗药性杂草密度加大和除草剂防效明显下降时,农民往往盲目加大除草剂用量和次数,试图获得理想防效。然而这种方式不仅造成除草剂选择压进一步加大,抗药性杂草进一步恶化,还加大了农作物药害风险和环境污染风险。Collavo 等[25]报道,不同作用机理的除草剂轮换使用及混用,可有效治理抗性杂草和延缓抗性杂草的产生。本课题组研究发现,啶磺草胺、异丙隆等除草剂在大田推荐剂量下能够有效防除抗性耿氏硬草种群 SD-32 (数据未写入)。因此在防除小麦田抗 ACCase 类除草剂耿氏硬草时,可选用这两种除草剂与 ACCase 类除草剂进行合理轮用、混用,以有效防除抗性耿氏硬草,并延缓抗性杂草的进一步发展。
| [1] |
王兆龙, 朱国家. 硬草主要生物学特性及防除途径的研究 [J]. 植物保护学报, 1993,20 (4)
:363–368.
WANG Z L, ZHU G J. Biological characteristics of stiffgrass and its control [J]. Acta Phytophy Sin, 1993, 20 (4) :363–368 . |
| [2] |
于新民, 薛良鹏, 刘春祥. 江苏沿海地区麦田杂草群落演替及控制措施 [J]. 杂草科学, 2007 (3)
:29–30.
X M, XUE L P, LIU C X. Weed communities succession in wheat fields in coastal area of Jiangsu Province and their control strategy [J]. Weed Sci, 2007 (3) :29–30 . |
| [3] |
夏向东, 马洪菊, 许孟涵, 等. 杂草对芳氧苯氧丙酸类(APPs)除草剂的抗性分子机理研究进展 [J]. 农药学学报, 2013,15 (6)
:609–614.
XIA X D, MA H J, XU M H, et al. Research progress on molecular mechanism of resistant weeds to aryloxyphenoxypropionate herbicides [J]. Chin J Pestic Sci, 2013, 15 (6) :609–614 . |
| [4] | KONISHI T, SHINOHARA K, YAMADA K, et al. Acetyl-CoA carboxylase in higher plants: most plants other than gramineae have both the prokaryotic and the eukaryotic forms of this enzyme [J]. Plant Cell Physiol, 1996, 37 (2) :117–122 . |
| [5] | HEAP I, KNIGHT R. The occurrence of herbicide cross-resistance in a population of annual ryegrass, Lolium rigidum, resistant to diclofop-methyl [J]. Crop Pasture Sci, 1986, 37 (2) :149–156 . |
| [6] | HEAP I. The international survey of herbicide resistant weeds[DB/OL]. [2015-10-20]. http://weedscience.org |
| [7] | DéLYE C. Weed resistance to acetyl coenzyme A carboxylase inhibitors: an update [J]. Weed Sci, 2005, 53 (5) :728–746 . |
| [8] | ZAGNITKO O, JELENSKA J, TEVZADZE G, et al. An isoleucine/leucine residue in the carboxyltransferase domain of acetyl-CoA carboxylase is critical for interaction with aryloxyphenoxypropionate and cyclohexanedione inhibitors [J]. Proc Natl Acad Sci USA, 2001, 98 (12) :6617–6622 . |
| [9] | BECKIE H J, TARDIF F J. Herbicide cross resistance in weeds [J]. Crop Prot, 2012, 35 :15–28 . |
| [10] | KAUNDUN S S, HUTCHINGS S J, DALE R P, et al. Role of a novel I1781T mutation and other mechanisms in conferring resistance to acetyl-CoA carboxylase inhibiting herbicides in a black-grass population [J]. PLoS One, 2013, 8 (7) :e69568. |
| [11] | YUAN G H, LIU W T, BI Y L, et al. Molecular basis for resistance to ACCase-inhibiting herbicides in Pseudosclerochloa kengiana populations [J]. Pestic Biochem Phys, 2015, 119 :9–15 . |
| [12] | POWLES S B, YU Q. Evolution in action: plants resistant to herbicides [J]. Annu Rev Plant Biol, 2010, 61 :317–347 . |
| [13] | SEEFELDT S S, JENSEN J E, FUERST E P. Log-logistic analysis of herbicide dose-response relationships [J]. Weed Technol, 1995, 9 (2) :218–227 . |
| [14] |
李荣华, 夏岩石, 刘顺枝, 等. 改进的CTAB提取植物DNA方法 [J]. 实验室研究与探索, 2009,28 (9)
:14–16.
LI R H, XIA Y S, LIU S Z, et al. CTAB-improved method of DNA extraction in plant [J]. Res Explor Lab, 2009, 28 (9) :14–16 . |
| [15] |
杨彩宏, 董立尧, 李俊, 等. 油菜田日本看麦娘对高效氟吡甲禾灵抗药性的研究 [J]. 中国农业科学, 2007,40 (12)
:2759–2765.
YANG C H, DONG L Y, LI J, et al. Study on resistance of Alopecurus japonicus Steud populations to haloxyfop-R-methyl in oilseed rape fields [J]. Scientia Agric Sinica, 2007, 40 (12) :2759–2765 . |
| [16] |
张锁荣. 苏南地区稻麦连作田菵草对精鰁唑禾草灵的抗药性及控制方法研究[D]. 南京:南京农业大学, 2007.
ZHANG S R. Study on the resistance of Beckmannia syzigachne Steud. to fenoxaprop-p-ethyl and control methods in rice and wheat succession cropping field in southern area in Jiangsu Province[D]. Nanjing: Nanjing Agricultural University, 2007. |
| [17] | GRESSEL J, SEGEL L, RANSOM J K. Managing the delay of evolution of herbicide resistance in parasitic weeds [J]. Int J Pest Manage, 1996, 42 (2) :113–129 . |
| [18] | DEVINE M D. Mechanisms of resistance to acetyl-coenzyme A carboxylase inhibitors: a review [J]. Pestic Sci, 1997, 51 (3) :259–264 . |
| [19] | NIKOLSKAYA T, ZAGNITKO O, TEVZADZE G, et al. Herbicide sensitivity determinant of wheat plastid acetyl-CoA carboxylase is located in a 400-amino acid fragment of the carboxyltransferase domain [J]. Proc Natl Acad Sci USA, 1999, 96 (25) :14647–14651 . |
| [20] |
毕亚玲, 吴翠霞, 郭文磊, 等. 抗精鰁唑禾草灵的日本看麦娘ACCase基因突变 [J]. 植物保护学报, 2015,42 (3)
:447–452.
BI Y L, WU C X, GUO W L, et al. Mutation in the acetyl-CoA carboxylase confers resistance to fenoxaprop-p-ethyl in Alopecurus japonicus populations [J]. Acta Phytophy Sin, 2015, 42 (3) :447–452 . |
| [21] | GUO W L, YUAN G H, LIU W T, et al. Multiple resistance to ACCase and AHAS-inhibiting herbicides in shortawn foxtail (Alopecurus aequalis Sobol.) from China [J]. Pestic Biochem Phys, 2015, 124 :66–72 . |
| [22] | CRUZ-HIPOLITO H, OSUNA M D, DOMíNGUEZ-VALENZUELA J A, et al. Mechanism of resistance to ACCase-inhibiting herbicides in wild oat (Avena fatua) from Latin America [J]. J Agr Food Chem, 2011, 59 (13) :7261–7267 . |
| [23] | YU Q, COLLAVO A, ZHENG M Q, et al. Diversity of acetyl-coenzyme A carboxylase mutations in resistant Lolium populations: evaluation using clethodim [J]. Plant Physiol, 2007, 145 (2) :547–558 . |
| [24] | PETIT C, BAY G, PERNIN F, et al. Prevalence of cross- or multiple resistance to the acetyl-coenzyme A carboxylase inhibitors fenoxaprop, clodinafop and pinoxaden in black-grass (Alopecurus myosuroides Huds.) in France [J]. Pest Manag Sci, 2010, 66 (2) :168–177 . |
| [25] | COLLAVO A, STREK H, BEFFA R, et al. Management of an ACCase-inhibitor-resistant Lolium rigidum population based on the use of ALS inhibitors: weed population evolution observed over a 7 year field-scale investigation [J]. Pest Manag Sci, 2013, 69 (2) :200–208 . |
 2016, Vol. 18
2016, Vol. 18


