由植物病原真菌引起的病害约占植物病害的70%~80%。据估算,在全球范围内植物真菌病害每年可导致水稻、小麦、玉米、马铃薯和黄豆减产1.25亿t。如果能控制其传播,每年可多养活6亿人[1]。因此植物真菌病害的防治显得尤为重要。
链霉菌Streptomyces能够产生大量具有广谱抑菌活性的抗真菌抗生素和分解真菌细胞壁的酶,应用于农业的抗生素等生物活性物质60%以上来源于链霉菌属,因此链霉菌被广泛认为是一种重要的工业微生物[2],在植物真菌病害的生物防治中具有巨大的开发潜力。真菌细胞壁主要由几丁质、β-1,3-葡聚糖和甘露糖等组成,因此具有几丁质酶活性和β-1,3-葡聚糖酶活性的物质成为近年来抑菌活性药物开发的热点。
本实验室从土壤中分离筛选到一株利迪链霉菌AS 4.2501,经过诱变筛选得到菌株E12[3],初步试验发现该菌株18 h的发酵液对立枯丝核菌、灰葡萄孢等病原真菌有很好的抑制作用。笔者对利迪链霉菌E12的发酵液及其粗提物的抑菌特性进行了探究,旨在为其进一步开发和应用提供依据。
1 材料与方法 1.1 菌种和培养基菌种:利迪链霉菌(S.lydicus)E12,本实验室保存。立枯丝核菌(Rhizoctonia solani)ACCC No.30089和灰葡萄孢(Botrytis cinerea)ACCC No.36448,购自中国农业微生物菌种保藏管理中心。
固体斜面培养基:淀粉20 g/L,葡萄糖5 g/L,蛋白胨2 g/L,MgSO4 0.5 g/L,NaCl 0.5 g/L,玉米浆2 g/L,琼脂20 g/L,自然pH,121 ℃蒸气灭菌20 min;种子培养基:可溶性淀粉30 g,葡萄糖5 g,酵母粉4 g,蛋白胨2 g,K2HPO4 1.5 g,NaCl 0.5 g,MgSO4 0.5 g,自来水配制定容至1 L,自然pH,121 ℃蒸气灭菌20 min;发酵培养基:可溶性淀粉40 g,葡萄糖5 g,蛋白胨2 g,K2HPO4 1 g,NaCl 0.5 g,MgSO4 0.5 g,自来水配制定容至1 L,自然pH,121 ℃蒸气灭菌20 min。PDA培养基:称取200 g洗净去皮的马铃薯,切成小块放入水中煮至酥而不烂,用6层纱布过滤,收集滤液,加入20 g葡萄糖,18 g琼脂,用自来水定容至1.0 L,121 ℃蒸气灭菌20 min。
1.2 利迪链霉菌E12发酵液的制备铲取约0.5 cm2的斜面种子接种到装有50 mL种子培养基的250 mL摇瓶中,于28 ℃、220 r/min条件下培养48 h,得到一级种子;取10 mL一级种子接种于装有100 mL种子培养基的250 mL摇瓶中,于28 ℃、220 r/min条件下摇床培养24 h,得到二级种子;取300 mL二级种子,于4 500 r/min下离心10 min去掉上清液,用300 mL无菌水重悬菌体,接种于装有2.7 L发酵培养基的5.0 L发酵罐内,加入3.0 mL消泡剂(主成分为硅油),于通气量为2.0 vvm、自然pH、28 ℃、500 r/min条件下培养。每隔6 h收集发酵液,测定其抑菌活性,并记录发酵液的pH值;每隔3 h收集发酵液,测定可溶性淀粉的含量。
1.3 利迪链霉菌E12发酵液抑菌活性及残留淀粉含量的测定 1.3.1 抑菌活性的测定1)采用琼脂稀释法[4]:用移液管吸取11.4 mL PDA培养基与0.6 mL发酵液混匀,注入直径9 cm的培养皿中,冷却至凝固;以相同体积的溶剂作为空白对照。用灭菌的直径为6 mm的吸头沿已在PDA培养基上培养了48 h的立枯丝核菌菌落边缘打取圆形菌丝块,接种于上述已凝固的PDA培养基中央,于28 ℃下培养48 h,测量菌落直径,按公式(1)计算抑菌率。2次重复。

2)采用琼脂扩散法[5]:当以立枯丝核菌作为指示菌时,打取直径为6.0 mm的立枯丝核菌菌丝块,接种于PDA培养皿中央,将发酵液滴加到菌丝块周围约2 cm处,于28 ℃下培养2 d观察是否有抑菌圈出现;当以灰葡萄孢作为指示菌时,将灰葡萄孢的孢子悬浮液与熔化的PDA培养基混匀倒入培养皿中,待其凝固后将发酵液滴加到PDA培养皿上,于28 ℃下培养2 d观察是否有抑菌圈出现。
1.3.2 可溶性淀粉含量的测定采用碘显色法[6]:取不同时间点的发酵上清液,分别加入碘-碘化钾溶液,显色后于600 nm处测定吸光度;配制1.0 mg/mL的可溶性淀粉溶液,加入碘-碘化钾溶液,显色后于600 nm处测定吸光度作为对照。若吸光度大于1,则适当稀释溶液使吸光度在0.2~0.8之间。按公式(2)计算发酵液中可溶性淀粉的浓度。

分别用淀粉和葡萄糖等量代替原始发酵培养基中的混合碳源,其他组分保持不变,分别得到以淀粉和葡萄糖作为惟一碳源的两种发酵培养基,用于利迪链霉菌E12的发酵试验。分别取18和24 h的发酵液,按琼脂稀释法[4]测定其抑菌活性。
1.5 利迪链霉菌E12发酵液抑菌活性粗提物的分离与鉴定 1.5.1 粗提物的分离取发酵上清液以4 mL/min的流速装填至加有预处理好的Diaion HP-20大孔吸附树脂的层析柱中;吸附完毕后,先用1倍柱体积的50%甲醇水溶液冲洗层析柱,除去色素及未吸附的杂质,再用1倍柱体积的50%乙醇水溶液替换柱中的甲醇水溶液,最后用2倍柱体积的50%乙醇水溶液以2 mL/min的速率洗脱活性物质;收集洗脱液,于45 ℃减压浓缩,析出白色絮状沉淀物。于4 ℃静置过夜,于4 500 r/min下离心10 min,采用琼脂稀释法[4]检测沉淀和上清液的抑菌活性。确定活性后将沉淀冻干,作为抑菌活性粗提物,于4 ℃下保存,备用。
1.5.2 粗提物的鉴定为了确定粗提物中具β-1,3-葡聚糖酶活性物质的分子质量,首先将粗提物进行聚丙烯酰胺凝胶(SDS-PAGE)电泳,然后对胶上蛋白进行复性处理,并用复性的SDS-PAGE胶与含β-1,3-葡聚糖的琼脂糖凝胶反应,找到分解β-1,3-葡聚糖的条带并检查该条带的抑菌活性。
1.5.2.1 粗提物分子质量的确定分别配制厚度为1.0 mm的12%的分离胶和5%的堆积胶,加入Tris-甘氨酸电泳缓冲液和20 μL粗提物样品上样,用电泳缓冲液封口。电泳仪初始电压设为恒压80 V,待样品进入分离胶后,将电压调至120 V保持至电泳结束(溴酚蓝标记带至胶块底部),得到SDS-PAGE。
先用含25%异丙醇的磷酸盐缓冲液反复浸洗SDS-PAGE胶块,再用不含异丙醇的磷酸盐缓冲液反复冲洗至胶块上面的异丙醇味道完全消失。擦干SDS-PAGE胶表面的水分,覆盖在琼脂糖凝胶(含0.1% β-1,3-葡聚糖)上,驱出气泡,置于60 ℃下保持1.0 h;取出SDS-PAGE胶,用考马斯亮蓝染液染色20 min后脱色;将琼脂糖凝胶放入0.1%刚果红染液中染色30 min,再用1.0 mol/L的NaCl溶液脱色30 min后用5%的冰醋酸对胶块进行显色[7]。若琼脂糖凝胶上出现透明光圈,表明该处的葡聚糖被分解,即与之对应的SDS-PAGE胶上的条带具有β-1,3-葡聚糖酶活性,通过与Marker进行对比得到该条带的分子质量。
1.5.2.2 具β-1,3-葡聚糖酶活性条带抑菌活性的测定采用琼脂扩散法[5]并稍作改进:将SDS-PAGE胶上具β-1,3-葡聚糖酶活性的条带用小刀切下来,编号为2号条带,同时将与该条带紧邻的上下方条带切下来编号为1、3号条带。将直径6.0 mm的立枯丝核菌菌丝块接种于PDA平皿中央,取上述1、2、3号条带分别置于菌丝块周围,于28 ℃下正面培养24 h待条带中的物质扩散到PDA培养基中后,再翻转倒置反面培养1 d,观察各条带的抑菌情况。若条带周围没有立枯丝核菌菌丝生长,表明该条带具有抑菌活性。
2 结果与分析 2.1 利迪链霉菌E12的发酵特性及其抑菌活性对利迪链霉菌E12在5.0 L发酵罐上不控制pH值进行发酵,得到了其抑菌活性随发酵时间的变化曲线,并实时监测了pH值的变化,结果如图 1。
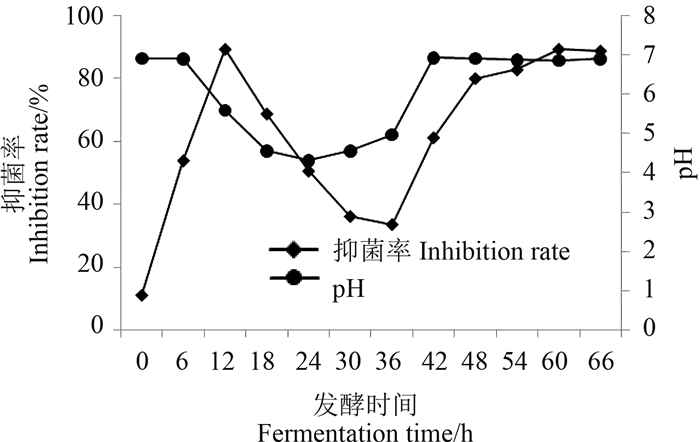 | 图 1 利迪链霉菌E12的发酵特性 Fig. 1 The fermentation character of S. lydicus E12 |
发酵液的pH值在培养6 h时开始下降,18~24 h时降至最低点,为4.31,而与之对应的利迪链霉菌E12的抑菌活性也在18 h时最强,抑菌率为90.2%,说明抑菌活性物质是在酸性环境中产生的。而在酸性条件下淀粉酶活性较高,淀粉水解较快,为了判断前期的抑菌活性物质是否与淀粉的初步酶解存在关联,测定了发酵液中残留的可溶性淀粉含量。结果(图 2)表明:发酵前6 h胞外淀粉含量在40 g/L左右(发酵培养基中淀粉的初始浓度为40 g/L),说明在利迪链霉菌E12产酸前基本上不消耗淀粉;从6 h开始,发酵液中淀粉的浓度开始降低,并于18 h时基本消耗完毕。
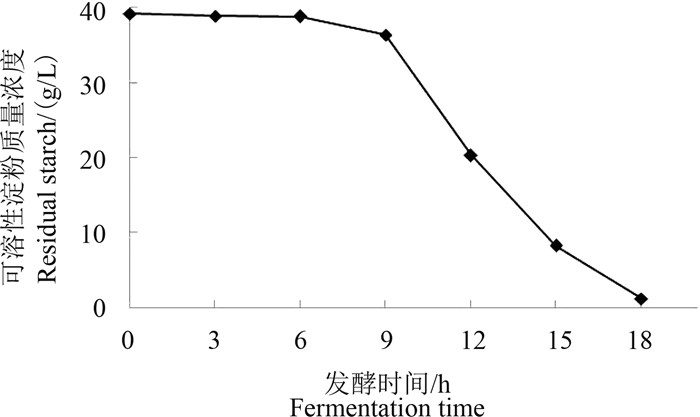 | 图 2 发酵培养基中可溶性淀粉的浓度 Fig. 2 The concentration of the residual starch in the fermentation medium |
淀粉的消耗情况与利迪链霉菌E12发酵过程中发酵液的pH值变化以及抑菌活性变化吻合,由此推断,作为碳源的淀粉与利迪链霉菌抑菌活性物质的产生存在紧密联系。通过琼脂扩散法同时测定其对立枯丝核菌和灰葡萄孢的抑制活性发现,利迪链霉菌E12前期的发酵液对灰葡萄孢具有很强的抑制活性(图 3)。
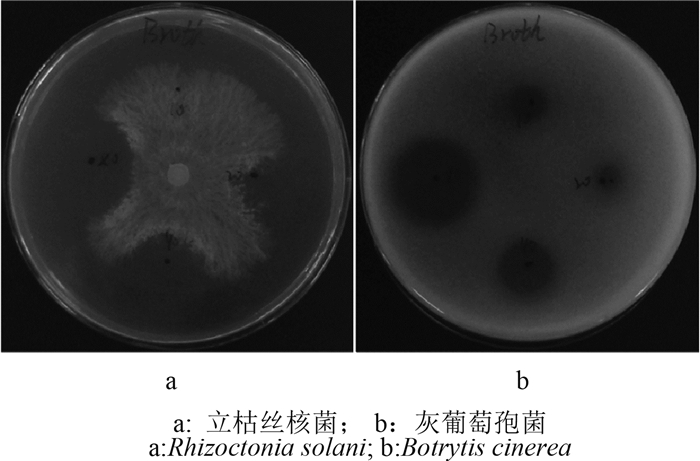 | 图 3 利迪链霉菌E12发酵液的抑菌活性 Fig. 3 The antifungal activity of the fermentation broth |
根据2.1节的结果推断,淀粉的水解可能与抑菌活性物质的产生有关,因此分别以淀粉和葡萄糖作为惟一碳源的发酵培养基进行发酵。结果(图 4)表明:当发酵培养基中碳源仅含有淀粉时,发酵液在18和24 h均具有抑菌活性,当培养基中碳源仅含有葡萄糖时,发酵液在18和24 h不再具有抑菌活性,说明淀粉与抑菌活性物质的产生关系紧密。
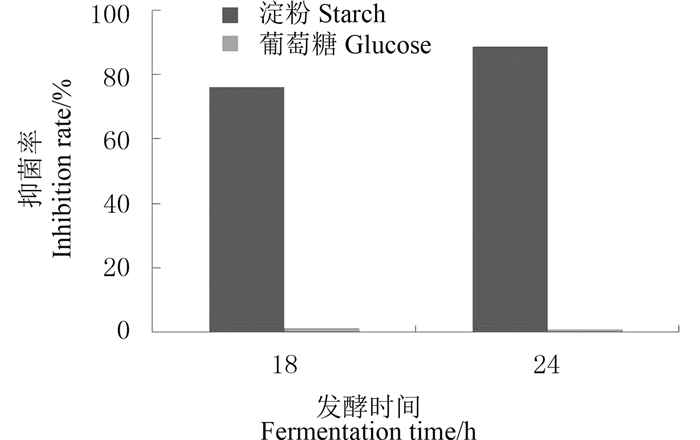 | 图 4 淀粉和葡萄糖对利迪链霉菌E12抑菌活性的影响 Fig. 4 Effects of starch and glucose on the antifungal activity of S. lydicus E12 (n=2) |
发酵液经吸附柱层析后浓缩得到的沉淀物具有较高的抑菌活性,抑菌率为91.5%,而上清液无抑菌活性。说明抑菌活性物质全部集中在该沉淀物中,损失很小。同时经过了柱层析和类似于浓缩结晶的分离操作,大大提高了抑菌活性物的纯度。
2.3.2 粗提物分子质量的确定结果(图 5)表明:在SDS-PAGE胶(图 5a)上只出现了大小在3 kDa左右的1条带,该条带同时具有抑菌活性(图 5c),表明抑菌活性物质的分子质量约为3 kDa;由于发酵18 h即收集发酵液,而此时正是菌体大量繁殖的时期,尚未开始产生次级代谢产物[8]。为保证菌体快速增长,需要分解利用大量的营养物质,因此菌体各种酶的含量和活性均较高。
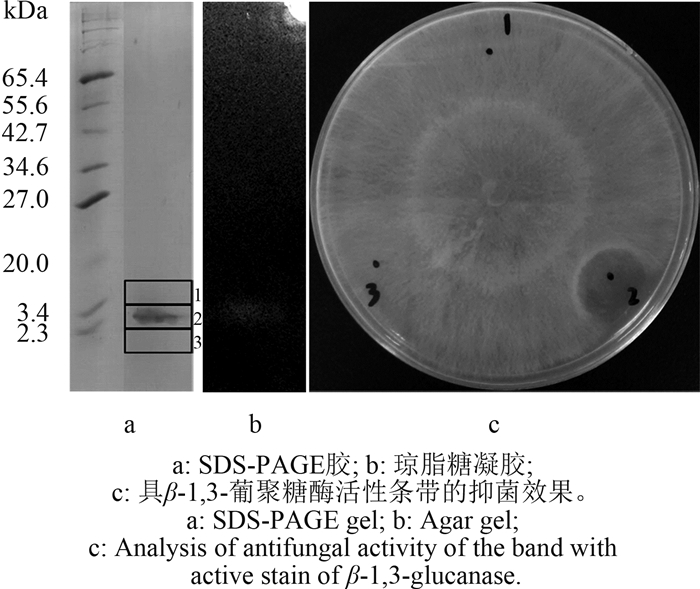 | 图 5 粗提物的电泳产物分解葡聚糖活性和抑菌活性的检测 Fig. 5 Analysis of the crude extract in polyacrylamide gels |
已报道的与利迪链霉菌抑菌活性有关的酶多为β-1,3-葡聚糖酶和几丁质酶,其中对β-1,3-葡聚糖酶研究较多[9],β-1,3-葡聚糖酶可以特异性地分解真菌细胞壁的组成成分葡聚糖,使细胞壁变薄或失去完整性,造成细胞壁暴露,最后由于渗透压差导致细胞渗漏而死亡[10],因此同时测定了粗提物中β-1,3-葡聚糖酶活性。结果发现,在琼脂糖凝胶上与SDS-PAGE胶条带对应的位置出现透明条带,说明产生的抑菌活性物质很可能是一种β-1,3-葡聚糖酶,其抗菌机理可能为破坏病原真菌的细胞壁,但其结构需要纯化后加以验证。链霉菌虽然能够产生大量的抑菌活性物质,但是利迪链霉菌产生的抑菌活性物质除了几丁质酶[11]和那他霉素[12]外鲜有报道,对该物质进一步的分离纯化及结构鉴定,有望开发出高效、低毒、环境友好的蛋白农药,为防治植物真菌病害提供良好的新农药。
本研究表明,利迪链霉菌能够产生抑制立枯丝核菌和灰葡萄孢生长的活性物质,淀粉与利迪链霉菌抑菌活性物质的产生密切相关,从利迪链霉菌E12的发酵液中得到的抑菌活性粗提物具有β-1,3-葡聚糖酶的活性。
| [1] | FISHER M C, HENK D A, BRIGGS C J, et al. Emerging fungal threats to animal, plant and ecosystem health[J]. Nature, 2012, 484(7393):186-194. |
| [2] | ILIC S B, KONSTANTINOVIC S S, TODOROVIC Z B, et al. Characterization and antimicrobial activity of the bioactive metabolites in streptomycete isolates[J]. Microbiology, 2007, 76(4):421-428. |
| [3] | 梁英权. 氨基酸添加和响应面优化促利迪链霉菌抗真菌物产生研究[D]. 天津:天津大学, 2013.LIANG Y Q. Study on amino acids addition and response surface methodology for improving antifungal substance production of Streptomyces lydicus[D]. Tianjin:Tianjin University, 2013. |
| [4] | BARRY A L. Procedure for testing antimicrobial agents in agar media:theoretical considerations[M]//LORIAN V. Antibiotics in laboratory medicine. Baltimore:The Williams & Wilkins Co., 1986:1-26. |
| [5] | MOTTA A S, BRANDELLI A. Characterization of an antibacterial peptide produced by Brevibacterium linens[J]. J Appl Microbiol, 2002, 92(1):63-70. |
| [6] | 张峻松, 贾春晓, 毛多斌, 等. 碘显色法测定烟草中的淀粉含量[J]. 烟草科技/烟草化学, 2004(5):24-28.ZHANG J S, JIA C X, MAO D B, et al. Determination of starch in tobacco with iodine colorimetry[J]. Tobacco Sci Technol/Tobacco Chem, 2004(5):24-28. |
| [7] | BéGUIN P. Detection of cellulase activity in polyacrylamide gels using Congo red-stained agar replicas[J]. Anal Biochem, 1983, 131(2):333-336. |
| [8] | SáNCHEZ S, CHáVEZ A, FORERO A, et al. Carbon source regulation of antibiotic production[J]. J Antibiot, 2010, 63(8):442-459. |
| [9] | LIU J, BALASUBRAMANIAN M K. 1, 3-beta-glucan synthase:a useful target for antifungal drugs[J]. Curr Drug Targets Infect Disord, 2001, 1(2):159-169. |
| [10] | GEORGOPAPADAKOU N H. Update on antifungals targeted to the cell wall:focus on beta-1, 3-glucan synthase inhibitors[J]. Expert Opin Investig Drugs, 2001, 10(2):269-280. |
| [11] | YUAN W M, CRAWFORD D L. Characterization of Streptomyces lydicus WYEC108 as a potential biocontrol agent against fungal root and seed rots[J]. Appl Environ Microbiol, 1995, 61(8):3119-3128. |
| [12] | 隋勤, 刘伟成, 卢彩鸽, 等. 利迪链霉菌A02抗真菌活性产物的分离和结构鉴定[J]. 生物工程学报, 2009, 25(6):840-846.SUI Q, LIU W C, LU C G, et al. Extraction and structural identification of the antifungal metabolite of Streptomyces lydicus A02[J]. Chin J Biotechnol, 2009, 25(6):840-846. |
 2016, Vol. 18
2016, Vol. 18

