2. 扬州大学 环境科学与工程学院, 江苏 扬州 225009
2. College of Environmental Science and Engineering, Yangzhou University, Yangzhou 225009, Jiangsu Province, China
溴氰菊酯(deltamethrin,图式 1),化学名称α-氰基苯氧基苄基(1R,3R)-3-(2,2-二溴乙烯基)-2,2-二甲基环丙烷羧酸酯,是一种中等毒性的、高效拟除虫菊酯类杀虫剂,主要用于棉花、蔬菜和果树等害虫及卫生害虫的防治[1],具有杀虫谱广、活性高和对哺乳动物低毒等特点[2]。我国GB2763—2014中规定,溴氰菊酯在叶菜、谷类及其制品中的最大残留限量(MRL)值为0.5 mg/kg,油菜籽和棉籽等油料作物中为0.1 mg/kg,茶叶中为10 mg/kg [3]。
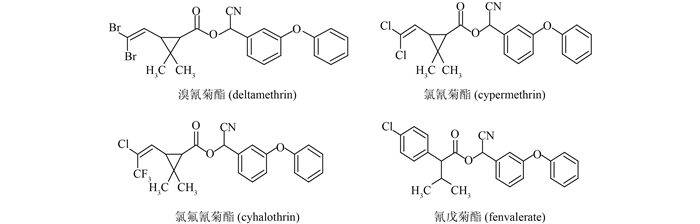 | 图式 1 溴氰菊酯、氯氰菊酯、氯氟氰菊酯和氰戊菊酯的结构式 Scheme 1 Structures of deltamethrin, cypermethrin, cyhalothrin and fenvalerate |
目前检测溴氰菊酯残留量的方法主要有气相色谱法[4, 5, 6]、高效液相色谱法[7, 8]、气-质联用法[9]、液-质联用法[10]、间接竞争酶联免疫吸附分析法[11, 12]和荧光光度法[13]等。其中对于含色素等共提取物较多的样品,多需经过活性炭、Florisil硅土或氧化铝柱层析[4, 5]等对提取液进行净化处理,存在操作步骤繁琐、费时费力等不足,难以满足大量样品现场快速检测的需要。酶联免疫吸附分析(ELISA)具有特异性强、灵敏度高、简单快捷、样品容量大、样品前处理简单和分析成本低等特点,在大量样本和现场样本快速筛选检测中优势明显[14]。Queffelec等[15]、Kong等[16]通过制备抗溴氰菊酯单克隆抗体,建立了间接竞争ELISA法,但测定过程需进行两次免疫反应。张帮红等[11]、Lee等[17]及张献忠[18]等通过在溴氰菊酯全分子上衍生,合成含末端氨基或末端羧基的半抗原,与载体蛋白共价偶联后免疫动物制备抗体,建立了间接竞争ELISA法,但与其他含二苯醚结构的拟除虫菊酯类农药存在较明显的交叉反应。本研究利用作者所在实验室合成的突出溴氰菊酯特异性结构的人工抗原及酶标半抗原,以人工抗原免疫动物获得对溴氰菊酯具有特异性亲和力的抗体,建立包被抗体-酶标半抗原直接竞争ELISA法(DC-ELISA),考察了抗溴氰菊酯抗体与氯氰菊酯、氯氟氰菊酯和氰戊菊酯(图式 1)的交叉反应情况,以期用于小白菜中溴氰菊酯残留量的快速测定。
1 材料与方法 1.1 试剂和仪器98%溴氰菊酯(deltamethrin)标准品,法国罗素尤克福公司;99.9%氯氰菊酯(cypermethrin)标准品,南开大学;95%氯氟氰菊酯(cyhalothrin),江苏扬农集团;99.2%氰戊菊酯(fenvalerate)标准品,同济大学测试中心-上海测试技术中心;溴氰菊酯半抗原N-(2,2-二溴乙烯基)-3,3-二甲基环丙烷氨基丙酸,本实验室合成;洗涤液为灭菌蒸馏水;包被液为0.01 mol/L、pH 7.2的磷酸盐缓冲液(PB);反应液为0.02 mol/L、pH 6.8、含0.125 mol/L氯化钠的PBS;显色液A为0.2 mmol过氧化脲溶于1 L柠檬酸-磷酸盐缓冲液(5.2 g柠檬酸、8.4 g磷酸氢二钠溶于蒸馏水并定容至1 L),显色液B为0.1 g 3,3’,5,5’-四甲基联苯胺溶于10 mL二甲基甲酰胺,用前将100 µL的B液加到10 mL的A液中混匀;终止液为2 mol/L的硫酸水溶液;甲醇为色谱纯;无水硫酸钠和正己烷均为分析纯。
Waters 2487高效液相色谱仪,美国Waters公司;Biofuge primo R台式高速冷冻离心机,德国Heraeus公司;Model 680酶标仪,美国BIO-RAD公司;8孔酶标条,江苏海门爱苯德实验器材有限公司。
1.2 试验方法 1.2.1 抗溴氰菊酯特异性抗体的制备和酶标半抗原的合成将半抗原采用活性酯法[19]分别与血清蛋白和辣根过氧化物酶共价偶联,制备人工抗原和酶标半抗原;以人工抗原免疫新西兰大白兔,获得对溴氰菊酯具有特异性亲和力的抗体。抗原合成路线见图式 2。
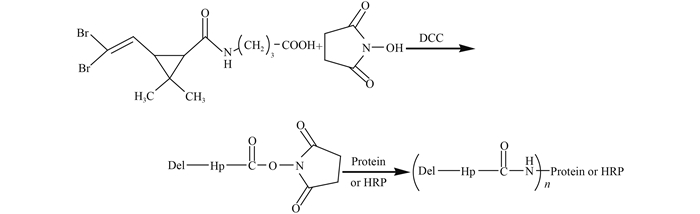 | 图式 2 溴氰菊酯抗原合成路线 Scheme 2 Synthetic route of deltamethrin antigen |
准确称取10 mg溴氰菊酯标准品,用1 mL二甲基甲酰胺(DMF)溶解,再用甲醇稀释并定容至10 mL,配制成1 000 mg/L的储备液。用0.02 mol/L、pH 6.8的PBS [含10%甲醇(V/V)]将储备液稀释成质量浓度分别为10、10/3、1.0、1.0/3和0.10 mg/L的系列标准溶液,备用。
1.2.3 直接ELISA法最适酶标半抗原-包被抗体工作浓度初筛用0.02 mol/L、pH 6.8的PB将抗溴氰菊酯抗体稀释成质量浓度分别为1.5、2.0、2.5和3.0 mg/L的溶液,横向包被酶标条;酶标半抗原稀释4.0×104、6.0×104、8.0×104和10×105倍后分别加入酶标板的不同行中,于37 ℃下反应1 h;倾去反应液,用无菌蒸馏水洗除游离物,拍干,加入显色液(100 µL/孔),于37 ℃避光反应15 min;加入50 µL/孔终止液终止反应,测定OD450值,筛选抗体和酶标半抗原工作浓度。选择抗体和酶标半抗原用量少、酶促显色反应后OD450值在1.0左右的组合,作为进一步建立直接竞争ELISA法的酶标半抗原-包被抗体工作浓度。
1.2.4 直接竞争ELISA法条件优化用0.02 mol/L、系列pH值(5.8、6.0、6.5、6.8、7.0、7.2、7.5和8.0)的PB稀释抗体至2 mg/L,包被酶标板;用0.02 mol/L、pH 7.2的PB将酶标半抗原稀释8.0×104倍,按包被抗体直接ELISA步骤[19, 20],测定不同包被pH值条件下酶促反应的OD450值,筛选包被介质的最优pH值。
用0.02 mol/L、pH 7.2的PB稀释抗体至2 mg/L,包被酶标板;分别用0.02 mol/L、系列pH值(6.4、6.8、7.2、7.6、8.0)的PB将酶标半抗原稀释8.0×104倍,按包被抗体直接ELISA步骤,测定不同pH值条件下酶标半抗原和抗体的结合能力,筛选反应介质的最优pH值。
用0.02 mol/L、pH 7.2的PB稀释抗体至2 mg/L,包被酶标板;用0.02 mol/L、系列氯化钠浓度(0、0.125、0.25、0.5、1、2 mol/L)、pH 6.8的PBS将酶标半抗原稀释8.0×104倍,按包被抗体直接ELISA步骤,测定不同盐浓度下酶标半抗原和抗体的结合能力,筛选反应介质的最优盐浓度。
用0.02 mol/L、pH 7.2的PB稀释抗体至2 mg/L,包被酶标板;用0.02 mol/L、pH 6.8 PB分别稀释配制体积分数为0%、5%、10%、15%、20%、25%、30%的系列丙酮溶液、系列甲醇溶液和系列乙腈溶液。分别用含不同体积分数有机溶剂的0.02 mol/L、pH 6.8 PB将酶标半抗原稀释8.0×104倍,按包被抗体直接ELISA步骤,测定不同有机溶剂含量下酶标半抗原和抗体的结合能力,考察有机溶剂对酶标半抗原与抗体结合反应的影响。
1.2.5 最适酶标半抗原工作浓度的进一步筛选用0.02 mol/L、pH 6.8和氯化钠含量为0.125 mol/L的PBS将酶标半抗原稀释成不同倍数(1.5×105、2.0×105、2.5×105、3.0×105),其他步骤同1.2.3节。选择OD450值在1.0左右、抗体和酶标半抗原用量最少的组合,作为酶标半抗原-包被抗体的最适工作浓度。
1.2.6 溴氰菊酯直接竞争ELISA标准抑制曲线的建立在1.2.4和1.2.5节确定的最适条件下进行直接竞争免疫反应,测定不同浓度的溴氰菊酯对抗体与酶标半抗原结合反应的抑制率(I)。具体操作步骤如下:
用0.02 mol/L、pH 7.2的PB将抗体稀释至最适浓度(2 mg/L),包被酶标板,以0.02 mol/L 、pH 7.2的PB包被酶标板作为空白对照,于4 ℃下包被过夜;倾去包被液,用灭菌水洗板1次,加封闭液封闭1.5 h;倾去包被液,于4 ℃下保存,备用。
准确量取按1.2.2节制备的系列浓度的溴氰菊酯标准溶液,分别与两倍最适浓度(稀释1.0×105倍)的酶标半抗原溶液等体积混合,加入到已包被了抗体并封闭过的酶标板内(100 µL/孔),于37 ℃下反应1 h;倾去反应液,用无菌蒸馏水洗除游离物,拍干;加入显色液(100 µL/孔),于37 ℃下避光反应15 min;加入50 µL/孔终止液终止反应,测定OD450值。按公式(1)计算抑制率(I)。绘制I对溴氰菊酯浓度(ρ)的抑制曲线,建立回归方程I=B ρ+A并进行相关分析,分别求出IC50和IC10。在实际样品测定时,根据样品的抑制率及回归方程即可求出样品中溴氰菊酯的含量,以IC10为最低检测浓度。
同样条件下,建立常用拟除虫酯类农药氯氰菊酯、氯氟氰菊酯和氰戊菊酯的I-ρ的抑制曲线,求出各自的IC50,分别作为对照,然后根据公式(2)求出交叉反应率(CR)。
将小白菜剪碎匀浆后,称取10 g于50 mL离心管中,用甲醇溶解并定容至15 mL,振荡10 min;于70 ℃水浴中超声提取5 min,冷却至室温;于6 000 r/min下离心20 min;取上清液10 mL,于45 ℃下减压旋蒸10 min除去甲醇,用0.02 mol/L、pH 6.8、含体积分数为10%甲醇的PBS定容至5 mL;准确量取溴氰菊酯系列工作溶液(30、10、10/3、1.0、1.0/3 mg/L),分别与2倍最适浓度(稀释1.0×105倍)的酶标半抗原溶液等体积混合,按1.2.6节的操作步骤,建立DC-ELISA工作曲线。
1.2.8 添加回收试验在小白菜中分别添加5.0、1.0和0.2 mg/kg 3个水平的溴氰菊酯标准溶液,每个水平重复5次。按1.2.7节的方法提取后,与2倍最适浓度(稀释1.0×105倍)的酶标半抗原溶液等体积混合,采用DC-ELISA法测定,计算抑制率(I)。依据同步建立的DC-ELISA工作曲线,计算平均添加回收率。
1.2.9 色谱分析样品的提取、净化及分析提取[21]:准确称取10 g样品,按1.2.7节的操作步骤提取;取上清液10 mL,减压旋蒸除去甲醇后置于100 mL分液漏斗中,加入10 mL丙酮、10 mL石油醚和34 mL 2%的硫酸钠水溶液,充分振摇,静置分层。将下层溶液再用2×7 mL石油醚萃取,合并3次萃取液,用无水硫酸钠脱水,减压旋蒸至近干。用V(石油醚): V(丙酮)=1:1的溶液定容至5 mL,备用。
净化[22]:在30 mm×300 mm玻璃层析柱中,从下往上依次加入高1.25 cm的无水硫酸钠、3.75 cm的中性氧化铝、0.1 g活性碳和2.5 cm的无水硫酸钠。先用50 mL石油醚淋洗并弃去淋洗液,待石油醚下降至无水硫酸钠层时,加入2.5 mL样品提取液,用87 mL石油醚洗脱。收集洗脱液,于38 ℃下旋转浓缩至近干,用甲醇定容至1 mL,待测定。
1.2.10 HPLC检测条件化学键合C18色谱柱(4.6 mm×250 mm,5 μm);流动相为V(甲醇): V(水)=8:2的混合溶液,流速0.8 mL/min;检测波长236 nm;进样体积20 μL;峰面积法定量。
2 结果与分析 2.1 直接ELISA法条件筛选结果 2.1.1 抗体与酶标半抗原工作浓度结果(图 1)表明:在反应介质pH值为6.8的PB条件下,抗体和酶标半抗原的工作浓度确定为:抗体2 mg/L,酶标半抗原稀释8.0×104倍。
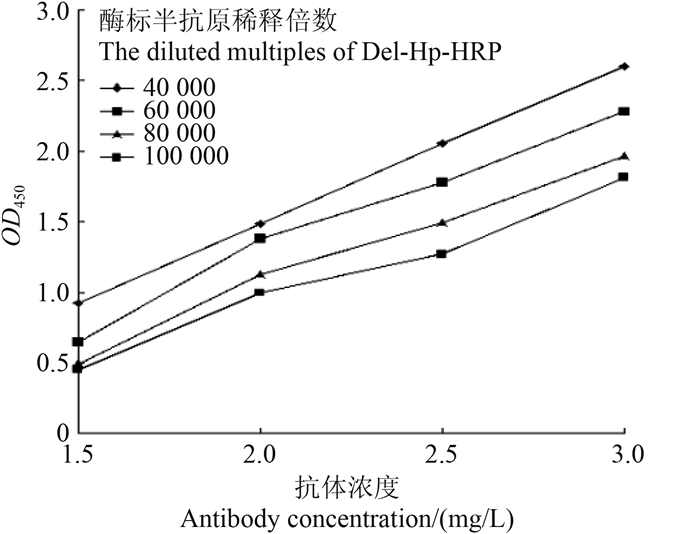 | 图 1 抗体与酶标半抗原工作浓度筛选结果(n = 5) Fig. 1 The optimization of the working concentration of antibody and Del-Hp-HRP (n = 5) |
从图 2可以看出:在包被介质中性偏弱碱条件下OD450值较大,故选择pH值为7.2的PB作为抗体的包被介质。
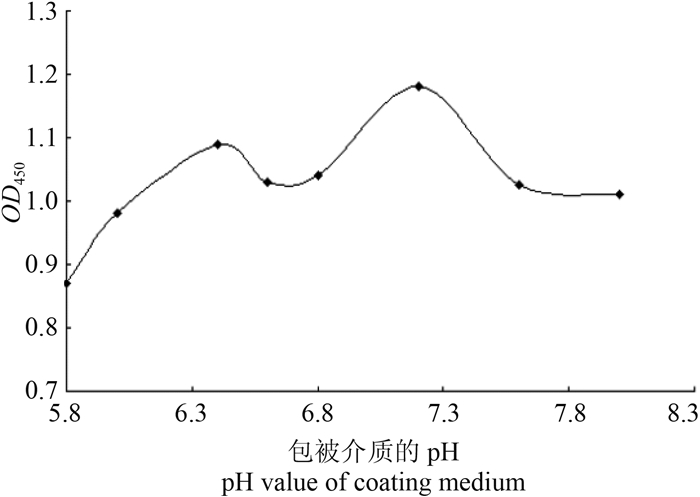 | 图 2 抗体包被介质pH值筛选结果(n = 5) Fig. 2 The optimization of the pH value of antibody coating medium (n = 5) |
从图 3可以看出:当反应介质的pH值为6.4时,溴氰菊酯对抗体-酶标半抗原结合反应的抑制率最高,但此条件下对照的OD450值偏小。当pH值为6.8时对照的OD450值合适且溴氰菊酯对抗体-酶标半抗原结合反应抑制率也较高。故选择反应介质的pH值为6.8。
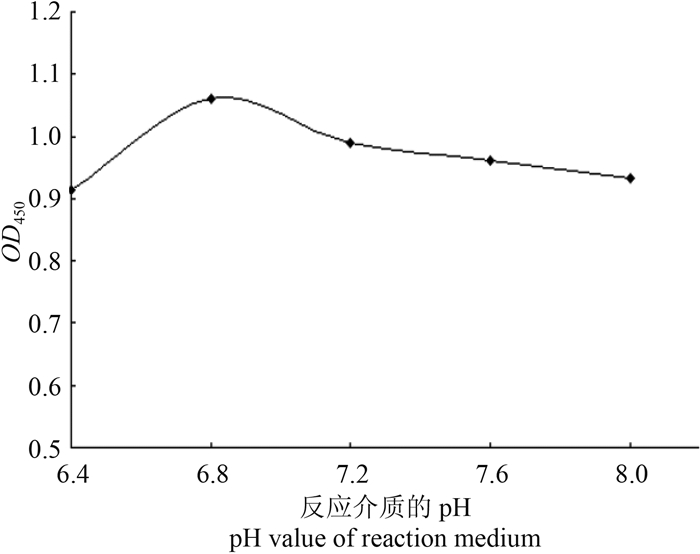 | 图 3 反应介质的pH筛选结果 Fig. 3 The optimization of the pH value of the reaction medium |
由图 4可以看出:当盐浓度为0.125 mol/L时,OD450值最大,说明合适的盐离子浓度对抗体和酶标半抗原的结合有促进作用。最终选择反应介质的盐浓度为0.125 mol/L。
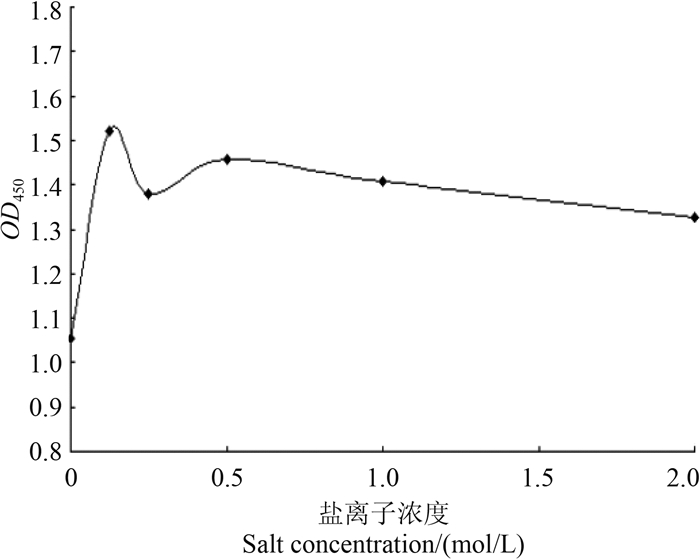 | 图 4 盐离子浓度对抗体与酶标半抗原结合反应的影响(n = 5) Fig. 4 The effect of salt concentrations on the combination of antibody and Del-Hp-HRP (n = 5) |
有机溶剂含量对抗原抗体结合反应的影响见图 5。从中可以看出:当甲醇含量≤ 5%时,对抗原抗体结合无影响;乙腈和丙酮含量≤ 5%时,对酶标半抗原与抗体结合反应的抑制率≤ 10%。
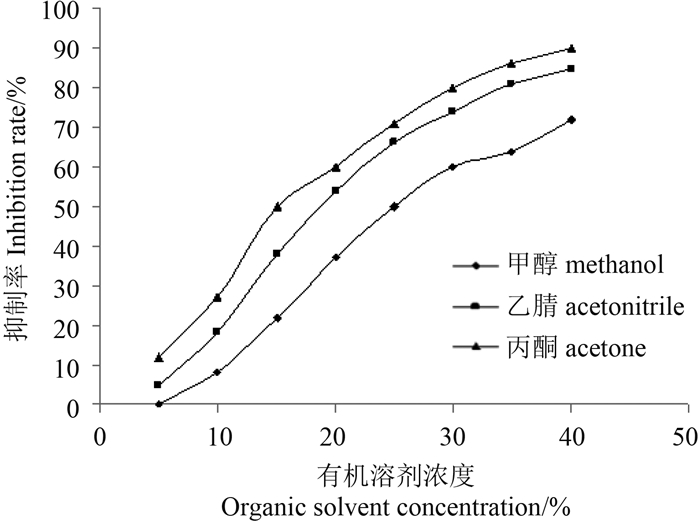 | 图 5 有机溶剂含量对Del DC-ELISA的影响(n = 5) Fig. 5 Effect of organic solvents on Del DC-ELISA (n = 5) |
从图 6可以看出:当包被抗体浓度为2.0 mg/L、酶标半抗原稀释2.0×105倍时,两者用量最少,且最终酶促显色反应的OD450 ≈ 1.0,因此确定该浓度为下一步直接竞争ELISA法的包被抗体和酶标半抗原最适工作浓度。
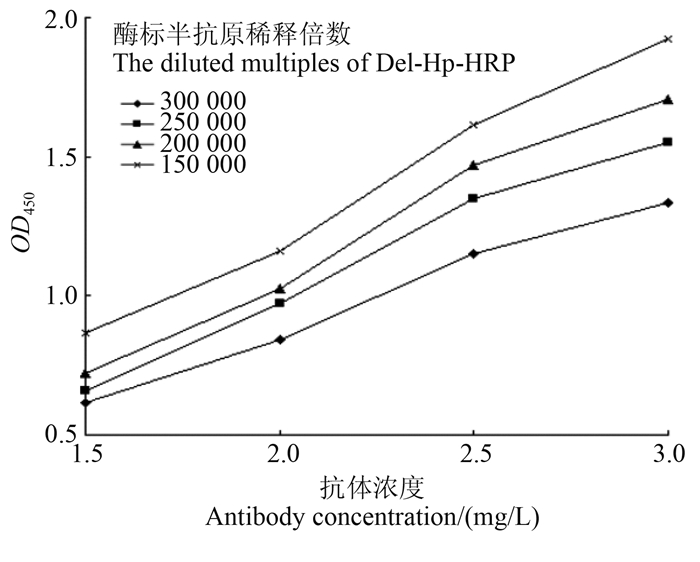 | 图 6 抗体和酶标半抗原最适工作浓度筛选结果 Fig. 6 The optimization of the working concentration of antibody and deltamethrin-Hp-HRP |
以5次重复测定的抑制率平均值为纵坐标(y),溴氰菊酯浓度的对数为横坐标(x)绘制标准曲线,结果见图 7。由图 7可以看出:在10~0.10 mg/L范围内,溴氰菊酯浓度对数与抑制率间呈线性关系,回归方程为y=0.393x+0.411 4,R2=0.968 3,IC50=1.68 mg/L,相应的相对标准偏差(RSD)为2.1%(n=5);IC10=0.16 mg/L。
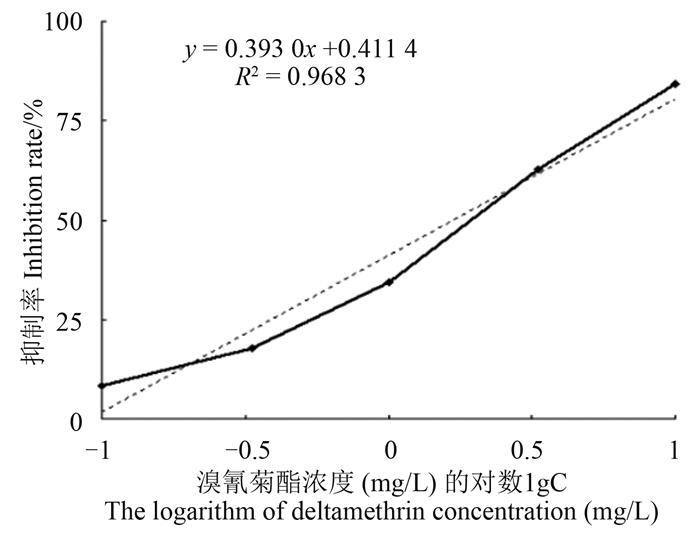 | 图 7 溴氰菊酯直接竞争ELISA标准曲线(n = 5) Fig. 7 Standard curve of direct competitive ELISA for deltamethrin (n = 5) |
其他常用拟除虫菊酯类农药氯氰菊酯、氯氟氰菊酯和氰戊菊酯的IC50和交叉反应率见表 1,表明溴氰菊酯抗体对溴氰菊酯具有很高的特异性。
|
| 表 1 抗溴氰菊酯抗体与常用拟除虫菊酯类农药的交叉反应 Table 1 Cross reaction of anti-deltamethrin antibody with common used pyrethroid pesticides |
从图 8可以看出:用空白样品提取稀释液作溶剂配制的溴氰菊酯工作溶液,在30~1.0/3 mg/L范围内对抗体-酶标半抗原结合的抑制率与溴氰菊酯浓度的对数间呈线性相关,回归方程为y=0.445 7x+0.251 7,R2=0.976,IC50=3.61 mg/L(RSD=5.8%),IC10=0.23 mg/L。表明DC-ELISA法的灵敏度符合小白菜中溴氰菊酯残留检测的要求。
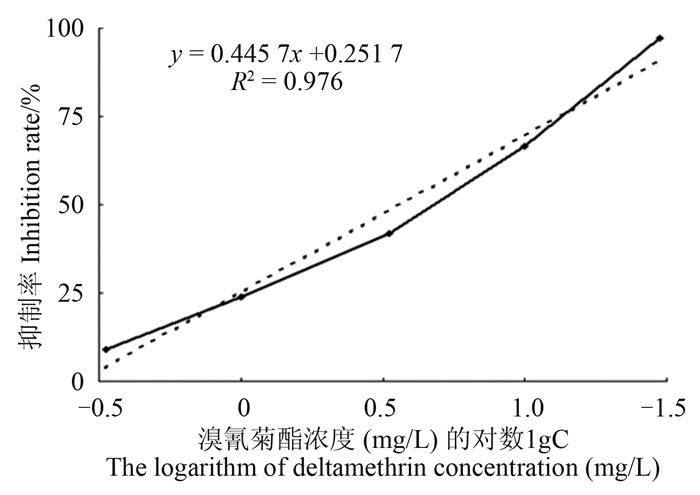 | 图 8 小白菜中溴氰菊酯直接竞争ELISA工作曲线(n = 5) Fig. 8 Working curve of direct competitive ELISA for deltamethrin in Chinese cabbage (n = 5) |
在5.0、1.0和0.2 mg/kg 3个添加水平下,DC-ELISA法测定的平均回收率分别为97%、106%和95%,相对标准偏差分别为8.5%、8.1%和8.1%。该结果说明DC-ELISA法的准确度和精确度符合溴氰菊酯残留检测的要求[22]。
2.5 小白菜中溴氰菊酯残留量的HPLC测定结果样品按文献[21, 22]的方法进行提取和净化,尚不能完全除去其中的杂质(共提取物),但所剩杂质在HPLC-UVD法检测中能与溴氰菊酯有效分离,空白样品中未见溴氰菊酯的色谱峰。在0.2 mg/kg添加水平下,HPLC-UVD法测定的小白菜中溴氰菊酯的平均回收率为107%,但提取、净化和浓缩费时、繁琐,难以满足大量样品快速检测的需求,相关谱图见图 9。
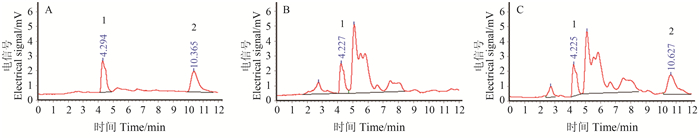 |
1. 溶剂 Solvent;2. 溴氰菊酯 deltamethrin。 A. 标准品 Standard (1.0 mg/L);B. 空白样品 Blank sample;C. 添加样品 Spiked sample (0.2 mg/kg)。 图 9 溴氰菊酯高效液相色谱图 Fig. 9 HPLC chromatogram of deltamethrin |
本研究成功建立了对溴氰菊酯具特异性的包被抗体直接竞争ELISA法,可用于测定小白菜中溴氰菊酯残留量,与现有报道的间接竞争ELISA法相比,直接竞争ELISA法只有一步免疫反应,省去了与二抗反应的步骤,方法更加简便快捷,系统误差小,特异性强。溴氰菊酯经典的检测手段是GC-EDC和GC-MS,具有较高的灵敏度和准确性,但需要经过石墨化碳黑、Florisil硅土柱层析等繁杂的净化过程。与之相比,本研究建立的直接竞争ELISA法省去了层析净化步骤,减少了有机溶剂用量,更适用于大量样品的现场快速检测。
目前农业上常用的拟除虫菊酯类杀虫剂大多具有羧酸-α-氰基-3-苯氧基苄酯结构,且占据分子结构的主要部分。以拟除虫菊酯农药全分子的衍生物(无论从哪个部位衍生)作半抗原制备抗原抗体,所建立的ELISA法灵敏度较高,但却很难避免与此类农药不同品种间的交叉反应,因而特异性不强。以拟除虫菊酯农药特异性的菊酸衍生物作半抗原制备抗原抗体,所建立的ELISA法灵敏度会明显降低,但特异性显著提高。对于常用拟除虫菊酯类农药,半抗原设计在提高灵敏度和增强特异性两方面目前仍然是一个两难的选择,这是由此类农药的结构特征所决定的,最终半抗原的设计取决于应用的目的。本研究针对溴氰菊酯分子中特异性结构部分合成半抗原和免疫原,提高了抗体对溴氰菊酯的特异性识别能力,与常用拟除虫菊酯类农药的交叉反应率低,可用于溴氰菊酯残留的特异性检测。虽然其检测灵敏度低于现有以溴氰菊酯全分子衍生物作半抗原的研究报道,但方法的检测限(IC10为0.16 mg/L)可满足对溴氰菊酯残留检测的要求[3]。与酶标抗体相比,酶标半抗原稳定性好,可长时间保存(作者所在实验室1997年制备的克百威酶标半抗原至今仍然保持良好的免疫学活性),有利于试剂盒的制备和应用。在实际应用中,可采用直接竞争ELISA法对大量样品进行快速定性筛查,必要时再对筛查呈阳性的样品采用色谱或色-质联用法进行确证。
需要引起重视的是,免疫反应是一种生物反应,一定程度上可能受到有机溶剂等因素的影响。在应用直接竞争ELISA法对实际样品进行检测时,由于样品提取液、抗体和酶标半抗原是在同一体系中进行反应的,因此在保证目标分析物充分溶解的同时,应尽量避免样品提取液中有机溶剂含量过高,以免对免疫反应产生影响。
| [1] | 赵欣昕, 刑红, 刘耄. 溴氰菊酯的高效液相色谱分析[J]. 农药, 1997, 36(7):26-27.ZHAO X X, XING H, LIU M. Determination of deltamethrin by high performance liquid chromatography[J]. Pesticides, 1997, 36(7):26-27. |
| [2] | 汤富彬, 钟冬莲, 徐玉祥, 等. 气相色谱法同时测定竹笋中毒死蜱、五氯硝基苯、氰戊菊酯和溴氰菊酯农药残留量[J]. 食品工业科技, 2012, 33(7):362-363.TANG F B, ZHONG D L, XU Y X, et al. Simultaneous determination of chlorpyrifos, quintozene, fenvalerate and deltamethrin in bamboo shoots by gas chromatography[J]. Sci Technol Food Ind, 2012, 33(7):362-363. |
| [3] | 食品中农药最大残留限量:GB 2763-2014[S]. 北京:中国标准出版社, 2014.Maximum residue limits for pesticides in food:GB 2763-2014[S]. Beijing:China Standards Press, 2014. |
| [4] | 黄冬梅, 沈晓盛, 王媛. 贝类产品中溴氰菊酯残留量的测定[J]. 中国卫生检验杂志, 2008, 18(2):270-271.HUANG D M, SHEN X S, WANG Y. Study on analytical method for deltamethrin in cultured shellfish[J]. Chin J Health Lab Technol, 2008, 18(2):270-271. |
| [5] | 叶菁. 浓缩果汁中氰戊菊酯和溴氰菊酯农药残留测定方法研究[J]. 干旱环境监测, 2008, 22(2):117-119.YE J. Study on determination of fenvalerate and deltamethrin pesticide residues in concentrated juice[J]. Arid Environ Monit, 2008, 22(2):117-119. |
| [6] | 高天兵, 张曙明, 田金改. 三七、白芍及西洋参中氯氰菊酯、氰戊菊酯和溴氰菊酯的残留量测定[J]. 药物分析杂志, 1999, 19(5):313-316.GAO T B, ZHANG S M, TIAN J G. Determination of residual amount of cypermethrin, fenvalerate and deltamethrin in Chinese herbal medicines by capillary gas chromatography(CGC-ECD)[J]. Chin J Pharm Anal, 1999, 19(5):313-316. |
| [7] | 王恒, 吴富忠, 黄丽君, 等. 反相高效液相色谱法测定饮用水中溴氰菊酯残留[J]. 中国卫生检验杂志, 2008, 18(10):2017-2018.WANG H, WU F Z, HUANG L J, et al. Determination of decamethrin residues in drinking water with reverse phase high performance liquid chromatography[J]. Chin J Health Lab Technol, 2008, 18(10):2017-2018. |
| [8] | 罗晓燕, 周洪伟, 林玉娜. 水中溴氰菊酯残留量的反相高效液相色谱测定法[J]. 环境与健康杂志, 2008, 25(12):1902-1903.LUO X Y, ZHOU H W, LIN Y N. Determination of deltamethrin residue in water by rephase high performance liquid chromatogrophy[J]. J Environ Health, 2008, 25(12):1902-1903. |
| [9] | 沈崇钰, 沈伟健, 蒋原, 等. 气相色谱-负化学源质谱联用法测定菊酯类农药[J]. 分析化学, 2006, 34(S1):36-39.SHEN C Y, SHEN W J, JIANG Y, et al. Determination of pyrethroid pesticide residues by gas chromatography-negative chemical ionization mass spectrometry and its application[J]. Chin J Anal Chem, 2006, 34(S1):36-39. |
| [10] | 李永夫, 高华鹏, 张健玲, 等. 超高效液相色谱-串联质谱法测定鳗鱼中呋线威和溴氰菊酯残留[J]. 分析化学, 2008, 36(6):755-759.LI Y F, GAO H P, ZHANG J L, et al. Simultaneous determination of residual furathiocarb and deltamethrin in eel by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chin J Anal Chem, 2008, 36(6):755-759. |
| [11] | 张帮红, 施海燕, 王鸣华. 溴氰菊酯酶联免疫吸附分析方法研究[J]. 农药学学报, 2009, 11(2):261-268.ZHANG B H, SHI H Y, WANG M H. Enzyme-linked immunosorbent assay for deltamethrin[J]. J Pestic Sci, 2009, 11(2):261-268. |
| [12] | 张婧, 魏朝俊, 王春娜, 等. 溴氰菊酯残留酶联免疫分析方法的建立[J]. 农业环境科学学报, 2009, 28(5):1065-1069.ZHANG J, WEI C J, WANG C N, et al. Development of enzyme immunoassays for deltamethrin[J]. J Agro Environ Sci, 2009, 28(5):1065-1069. |
| [13] | 李满秀, 高首勤. 蔬菜中溴氰菊酯农药残留的β-CD包结荧光光度法测定[J]. 化学研究与应用, 2011, 23(6):788-791.LI M X, GAO S Q. Determination of the remains of deltamethrin pesticide on vegetable with β-cyclodextrin inclusion spectrofluorimetry[J]. Chem Res Appl, 2011, 23(6):788-791. |
| [14] | 曾俊源, 崔巧丽, 刘曙照. 直接竞争酶联免疫吸附分析法测定桃中氰戊菊酯的残留量[J]. 农药学学报, 2014, 16(1):61-65.ZENG J Y, CUI Q L, LIU S Z. Determination of fenvalerate residue in peach by direct competitive enzyme-linked immunosorbent assay[J]. Chin J Pestic Sci, 2014, 16(1):61-65. |
| [15] | QUEFFELEC A-L, NODET P, HAELTERS J-P, et al. Hapten synthesis for a monoclonal antibody based ELISA for deltamethrin[J]. J Agric Food Chem, 1998, 46(4):1670-1676. |
| [16] | KONG Y, ZHANG Q, ZHANG W, et al. Development of a monoclonal antibody-based enzyme immunoassay for the pyrethroid insecticide deltamethrin[J]. J Agric Food Chem, 2010, 58(14):8189-8195. |
| [17] | LEE H-J, SHAN G M, WATANABE T, et al. Enzyme-linked immunosorbent assay for the pyrethroid deltamethrin[J]. J Agric Food Chem, 2002, 50(20):5526-5532. |
| [18] | 张献忠, 李培武, 张文, 等. 溴氰菊酯人工抗原及多克隆抗体制备[J]. 农药, 2008, 47(8):573-576.ZHANG X Z, LI P W, ZHANG W, et al. Preparation of deltamethrin artificial antigen and its polyclonal antibody[J]. Agrochemicals, 2008, 47(8):573-576. |
| [19] | 王翠翠. 溴氰菊酯免疫分析化学研究[D]. 扬州:扬州大学, 2010.WANG C C. Studies on immunochemistry for analysis of deltamethrin[D]. Yangzhou:Yangzhou University, 2010. |
| [20] | 尤海琴, 刘浪, 刘曙照. 直接竞争酶联免疫吸附分析法测定氰戊菊酯[J]. 分析化学, 2009, 37(4):577-580.YOU H Q, LIU L, LIU S Z. Direct competitive enzyme-linked immunoassay for fenvalerate analysis[J]. Chin J Anal Chem, 2009, 37(4):577-580. |
| [21] | 植物性食品中有机氯和拟除虫菊酯类农药多种残留的测定:GB/T 5009. 146-2008[S]. 北京:中国标准出版社, 2008.Determination of organochlorines and pyrethroid pesticide multiresidues in vegetable foods:GB/T 5009. 146-2008[S]. Beijing:China Standards Press, 2008. |
| [22] | 植物性食品中氯氰菊酯、氰戊菊酯和溴氰菊酯残留量的测定:GB/T 5009. 110-2003[S]. 北京:中国标准出版社, 2004.Determination of cypermethrin, fenvalerate and deltamethrin residues in vegetable foods:GB/T5009. 110-2003[S]. Beijing:China Standards Press, 2004. |
 2016, Vol. 18
2016, Vol. 18


