2. 山东中农联合生物科技股份有限公司, 济南 250000
2. Shandong Sino-Agri United Biotechnology Co., Ltd., Ji'nan 250000, China
由辣椒疫霉Phytophthora capsici侵染辣椒韧皮部引起的辣椒疫病是一种毁灭性的土传病害,在世界各辣椒种植区普遍发生[1],在中国江苏、陕西、甘肃和新疆等地区广泛发生,可危害辣椒的各个生长期,主要危害其根、茎、叶、花和果实,条件适宜时,短期内即可暴发成灾,造成辣椒减产甚至绝收[2]。目前化学药剂防治仍是防治辣椒疫病的主要手段,其中已广泛应用的有甲霜灵和精甲霜灵等苯基酰胺类杀菌剂,但由于该类药剂对病原菌的作用位点单一,加之长期大量使用,使抗这类化合物的菌系群体快速上升,导致防治效果下降[3, 4]。因此,亟待开发作用机制独特的新型杀菌剂。
氟醚菌酰胺(LH-2010A,N -(3-氯-5-(三氟甲基)吡啶-2-甲基)-2,3,5,6-四氟-4-甲氧基苯甲酰胺)是山东农业大学和山东中农联合生物科技股份有限公司联合创制合成的一种新型含氟苯甲酰胺类杀菌剂[5],结构式见(Ⅰ),已获得中国农药临时登记(LS20150222)。研究表明:氟醚菌酰胺具有高效、广谱的抑菌活性,且对辣椒疫霉具有较强的抑制作用[6]。为了明确其对辣椒疫霉的作用机制,本研究分别测定了氟醚菌酰胺对辣椒疫霉菌丝生长、游动孢子释放、菌丝生长量和菌丝超显微结构的影响,同时研究了其对辣椒疫霉能量代谢、呼吸代谢及呼吸代谢途径、细胞膜通透性、可溶性蛋白和DNA含量的影响,旨在为氟醚菌酰胺作用靶标的研究及进一步的应用开发提供理论依据。

96.2%氟醚菌酰胺原药(LH-2010A,山东中农联合生物科技股份有限公司);98%嘧菌酯原药(azoxystrobin,涿州拜奥威生物科技有限公司);70.4%霜霉威原药(propamocarb,拜耳作物科学(中国)有限公司)。供试原药均以二甲基亚砜(DMSO)为溶剂配制成质量浓度为105 μg/mL的母液。
辣椒疫霉P.capsici,中国农业科学院植物保护研究所保存,经转接、纯化培养后供试。
马铃薯葡萄糖琼脂(PDA)培养基[7]:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,分装灭菌后用于辣椒疫霉培养。
马铃薯葡萄糖液体(PDB)培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,分装灭菌待用。牛血清白蛋白(BSA)和考马斯亮蓝G-250(美国Amresco公司)。
DDS-307型电导率仪(上海雷磁仪器厂);MJX智能型霉菌培养箱(宁波江南仪器厂);Hitachi S4800冷场发射扫描电子显微镜及S-7500日立透射电子显微镜(日本日立公司);Oxygraph液相氧电极(Hansatech);MLS-3781L高压灭菌锅(北京百立隆生物技术有限公司);IS-RDS3恒温振荡器(北京中科捷瑞生物科技有限公司);TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司);Eppendorf 5804R冷冻离心机(深圳市赛亚泰科仪器设备有限公司)。
1.2 试验方法 1.2.1 氟醚菌酰胺对辣椒疫霉菌丝生长的影响采用菌丝生长速率法[8]测定。将一定量的氟醚菌酰胺或嘧菌酯母液加入PDA培养基,分别制成质量浓度为3.125、6.25、12.5、25、50和100 μg/mL的系列含药培养基,待其凝固后,接入辣椒疫霉菌饼。每个浓度重复3次,设置空白对照。置于25 ℃霉菌培养箱培养4 d,采用十字交叉法测量菌落直径,求其平均值,按(1)式计算菌丝生长抑制率。采用机率值分析法计算供试药剂对病原菌菌丝生长的毒力回归方程和EC50值。
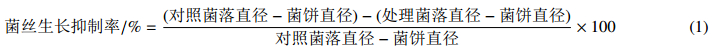
采用凹玻片法[9]。取一定量的辣椒疫霉孢子囊悬浮液[10]与等量的氟醚菌酰胺或嘧菌酯母液混合于凹玻片上,制成系列浓度的药液,每处理重复3次,设置空白对照。于4 ℃冰箱中保湿培养30 min后,置于25 ℃光照条件下培养2 h,在显微镜下观察游动孢子释放情况,按(2)式计算释放抑制率及EC50值。

参考文献[11]方法,在经灭菌并冷却的PDB培养液中,分别加入一定量的氟醚菌酰胺和嘧菌酯母液,制成质量浓度分别为6.25、12.5、25、50、100 μg/mL和3.125、6.25、12.5、25、50 μg/mL的系列含药培养液。接入复壮的辣椒疫霉菌饼,在25 ℃恒温振荡器(120 r/min)中培养10 d,滤除培养液,用镊子取出琼脂块,每个菌丝球用灭菌蒸馏水冲洗3次,置于60 ℃烘箱中烘24 h,称取滤纸和菌丝球的总质量。按(3)式计算菌丝生长量抑制率。每个处理重复3次,设置空白对照。

将氟醚菌酰胺母液加入PDA培养基,制成质量浓度为12.5、25、50和100 μg/mL的含药培养基,待其凝固后接入辣椒疫霉菌饼,置于25 ℃霉菌培养箱培养3 d。用洁净的刀片分别在对照和含药培养基上取小块直角梯形的菌块,按以下步骤处理:用4%的戊二醛固定液固定→ 0.1 mol/L的磷酸缓冲液(pH 7.0)冲洗→1%锇酸固定→ 0.1 mol/L的磷酸缓冲液(pH 7.0)冲洗→ 30%、50%、70%、80%、90%、100%丙酮系列脱水→置换→干燥→喷金,在Hitachi S4 800冷场发射扫描电子显微镜下观察药剂对辣椒疫霉菌丝形态的影响。
1.2.4.2 透射电镜下观察菌丝变化将氟醚菌酰胺母液与PDB培养液混合均匀,其终浓度同扫描电镜观察试验。取少量菌丝置于含药培养液中,于25 ℃恒温振荡器中120 r/min下培养24 h,取出菌球,依次用4%的戊二醛溶液固定→0.1 mol/L的磷酸缓冲液(pH 7.0)冲洗→1%锇酸固定→0.1 mol/L的磷酸缓冲液(pH 7.0)冲洗→30%、50%、70%、80%、90%、100%丙酮系列脱水→环氧树脂SPURR包埋→聚合→Leica Uc6i型切片机超薄切片→醋酸双氧铀和柠檬酸铅染色,在S-7 500日立透射电子显微镜下观察药剂对辣椒疫霉细胞结构的影响。
1.2.5 ATP对氟醚菌酰胺活性的影响采用菌丝生长速率法[8]测定。配制含系列质量浓度氟醚菌酰胺和ATP盐的PDA培养基,接入辣椒疫霉菌饼。每个处理重复3次,设置空白对照。放入25 ℃霉菌培养箱中培养4 d,采用十字交叉法量取菌落直径,计算平均值,按(1)式计算抑制率。采用机率值分析法求出毒力回归方程和抑制中浓度(EC50值)。
1.2.6 氟醚菌酰胺对辣椒疫霉菌丝呼吸代谢的影响采用氧电极法[12]测定。在Oxygraph液相氧电极反应室中,加入0.9 mL磷酸盐缓冲液(0.1 mol/L,pH 7.2)、0.1 mL 2%的葡萄糖溶液和0.1 g菌丝,搅拌5 min后开始测定悬浮液中的溶氧量(整个搅拌过程中需确保系统处于密封状态)。5 min后加入供试母液,使氟醚菌酰胺的终浓度分别为6.25、12.5、25、50和100 μg/mL,嘧菌酯的终浓度分别为1.562 5、3.125、6.25、12.5和25 μg/mL。利用氧电极测定溶液中含氧量的变化,求出菌丝体的呼吸速率(O2,μmol/(g·min))。根据加入药剂前后菌丝体的呼吸速率,按公式(4)计算药剂对辣椒疫霉菌丝体呼吸的抑制率。

式中:IR表示供试药剂对菌丝体呼吸的抑制率;R0表示对照组菌丝体呼吸速率;R1表示处理组菌丝体呼吸速率。
1.2.7 氟醚菌酰胺对辣椒疫霉呼吸代谢途径的测定在1.2.6节的基础上,在反应室中分别加入3种典型的呼吸抑制剂——丙二酸、碘乙酸和磷酸钠,添加质量浓度均为50 μg/mL,氟醚菌酰胺和嘧菌酯的终浓度分别为100和25 μg/mL。根据3种典型抑制剂的加入与否,利用氧电极测定溶液中含氧量的变化,并求出菌丝体的呼吸速率,按(5)式计算典型抑制剂对供试药剂的叠加率。

式中:RR表示典型抑制剂与供试药剂的叠加率;R1表示加入供试药剂后菌丝体的呼吸速率(O2,μmol/(g·min));R1'表示加入供试药剂和典型抑制剂后菌丝体的呼吸速率(O2,μmol/(g·min))。
1.2.8 氟醚菌酰胺对辣椒疫霉细胞膜通透性的影响采用电导率法[13]测定。使用灭菌蒸馏水稀释氟醚菌酰胺和霜霉威母液,使其终浓度分别为6.25、12.5、25、50和100 μg/mL。将在PDB培养液中培养4 d的辣椒疫霉菌丝用灭菌蒸馏水冲洗3次,抽滤。分别称取0.2 g菌丝置于上述系列浓度的药液中。以菌丝加灭菌蒸馏水为空白对照,每个处理设置3次重复。于28 ℃恒温振荡器中120 r/min下处理不同时间,用DDS-307型电导率仪测定各处理菌丝在0、10、40、160、220、340和400 min时的电导率,最后进行死处理(煮沸)并测定其电导率。按(6)式计算相对渗率。

式中:Ct表示某时刻的电导率值;C0表示初始(0 min)电导率值;C死处理表示死处理后的电导率值。
1.2.9 氟醚菌酰胺对辣椒疫霉可溶性蛋白的影响采用Bradford的考马斯亮蓝G-250比色法[14]。辣椒疫霉菌饼在含有系列浓度药剂的PDB培养液中,于28 ℃恒温振荡器中120 r/min下培养12 d。按文献[11]所述方法提取可溶性蛋白,并制作标准曲线和进行样品的测定[14]。用紫外分光光度计测定OD595值[11],按式(7)计算样品中的蛋白质含量。

X:在标准曲线上查得的蛋白质含量(μg)
1.2.10 氟醚菌酰胺对辣椒疫霉DNA含量的影响将适量氟醚菌酰胺母液加入PDA培养基中配成系列浓度的含药培养基,设置空白对照。待培养基凝固后,贴上提前灭菌的玻璃纸,接种复壮的辣椒疫霉菌饼,于培养箱中25 ℃培养5 d后,刮取1 g菌体,加入液氮冰冻,采取CTAB(十六烷基三甲基溴化铵)法[15]提取菌丝体的DNA。根据紫外可见分光光度计[16]测得的OD值,检测DNA的纯度和浓度,如果OD260/OD280值在1.8~2.0之间,则证明提取的DNA纯度符合试验要求。
2 结果与分析 2.1 氟醚菌酰胺对辣椒疫霉菌丝生长的抑制作用结果(表 1)表明:氟醚菌酰胺对辣椒疫霉菌丝生长的抑制率随其质量浓度的提高而逐渐增大,EC50值为7.14 μg/mL;而对照嘧菌酯对辣椒疫霉的EC50值为25.63 μg/mL。表明与嘧菌酯相比,氟醚菌酰胺能更有效地抑制辣椒疫霉菌丝的生长。
|
| 表 1 氟醚菌酰胺对辣椒疫霉不同发育阶段的影响 Table 1 The effect of LH-2010A against P. capsici at different development stages |
从表 1可以看出,氟醚菌酰胺和嘧菌酯的质量浓度与对游动孢子释放的抑制作用呈正线性关系,EC50值分别为16.34和1.73 μg/mL。表明氟醚菌酰胺对游动孢子释放具有一定的抑制作用,但活性低于嘧菌酯。
2.3 氟醚菌酰胺对辣椒疫霉菌丝生长量的影响结果(表 1)表明:药剂处理后辣椒疫霉菌丝生长量均受到不同程度的抑制,且与浓度呈正相关。两种药剂的EC50值分别为5.12和4.89 μg/mL。可以看出,氟醚菌酰胺对辣椒疫霉菌丝生长量有一定的抑制作用。
2.4 氟醚菌酰胺对辣椒疫霉菌丝形态的影响在扫描电镜下观察(图 1)发现:正常生长状态下的菌丝分支正常且粗细均匀;而在含有25 μg/mL氟醚菌酰胺的PDA培养基上生长的辣椒疫霉菌丝分枝增多变短,菌丝发生扭曲变形;当药剂质量浓度达100 μg/mL时,菌丝发生严重的扭曲变形,且出现了菌丝体密度增加。
 |
A. 空白对照;B. 氟醚菌酰胺 25 μg/mL;C、D. 氟醚菌酰胺 100 μg/mL。 A. Control; B. LH-2010A 25 μg/mL; C, D. LH-2010A 100 μg/mL. 图 1 扫描电镜观察辣椒疫霉菌丝的变化(A~C 1 000×;D 3 000×) Fig. 1 Scanning electron micrographs of the hyphae from the colony of P. capsici (A-C 1 000 ×;D 3 000×) |
在透射电镜下观察发现:正常状态下的辣椒疫霉菌丝体细胞中细胞壁、质膜、液泡和脂质体等细胞学的超微结构清晰,分布有序(图 2,A);而在含有25 μg/mL氟醚菌酰胺培养液中生长的菌丝,细胞壁明显增厚,并且脂质体的数量增多(图 2,B);在100 μg/mL氟醚菌酰胺培养液中生长的菌丝,细胞壁增厚现象愈加明显,脂质体比对照处理显著增多(图 2,C和D)。
 |
A. 空白对照;B. 氟醚菌酰胺 25 μg/mL;C、D. 氟醚菌酰胺 100 μg/mL。 液泡 (V);质膜 (PM);细胞壁 (CW);脂质体 (L)。 A. Control; B. LH-2010A 25 μg/mL; C,D. LH-2010A 100 μg/mL. Vacuole (V) ; Plasma membrane (PM); Cell wall (CW); Liposome (L). 图 2 透射电镜观察辣椒疫霉细胞超微结构的变化(A~D 2 μm) Fig. 2 Transimission electron micrographs of P. capsici (A-D 2 μm) |
结果(表 2)表明:在无ATP存在时,随着氟醚菌酰胺处理质量浓度升高其对辣椒疫霉菌丝的抑制率明显增大;当有1或5 μg/mL的ATP存在时,均会导致氟醚菌酰胺对辣椒疫霉菌丝的抑制率降低,且ATP质量浓度越大,氟醚菌酰胺对病原菌的抑制率越低。表明ATP可明显降低氟醚菌酰胺对辣椒疫霉菌丝的抑制作用。
|
| 表 2 添加ATP后对氟醚菌酰胺对辣椒疫霉菌丝抑制作用的影响 Table 2 The effect of ATP on the toxicity of LH-2010A against mycelial growth |
结果见图 3。氟醚菌酰胺对辣椒疫霉菌丝的呼吸代谢具有抑制作用,且抑制作用随其质量浓度的提高而加强。氟醚菌酰胺质量浓度在6.25~100 μg/mL范围内,抑制率的变化范围为19.36%~52.76%。对照药剂嘧菌酯在25 μg/mL下对菌丝体呼吸作用的抑制率为69.52%。
 | 图 3 氟醚菌酰胺对辣椒疫霉菌丝呼吸代谢的抑制作用 Fig. 3 Respiratory inhibition of LH-2010A to the mycelia of P. capsici |
结果见表 3。氟醚菌酰胺与碘乙酸和磷酸钠的叠加率分别为30.44%和41.73%,而与丙二酸的叠加率最小,为13.61%。丙二酸、碘乙酸和磷酸钠分别是三羧酸循环途径、糖酵解途径和磷酸戊糖途径的典型抑制剂,当处理药剂与典型抑制剂的叠加率越小时,表明该药剂对此典型抑制剂所作用的呼吸代谢途径有越强的抑制作用。此结果说明氟醚菌酰胺对三羧酸循环途径的抑制作用最为明显。嘧菌酯是呼吸作用抑制剂,已有研究表明,其对病原菌三羧酸循环途径具有较强的抑制作用[17],而本研究中嘧菌酯与丙二酸的叠加率(16.82%)也最小,表明嘧菌酯能够抑制病原菌的三羧酸循环途径,与已有报道[17]结论一致。
|
| 表 3 典型抑制剂和氟醚菌酰胺、嘧菌酯对辣椒疫霉菌丝呼吸速率的抑制率及叠加率 Table 3 Inhibition rate and superpose rate of P. capsici mycelia respiration in presence of representative inhibitors, LH-2010A or azoxystrobin |
已有研究表明,霜霉威的主要作用方式是抑制病原菌细胞膜成分磷脂和脂肪酸的生物合成[18],故选用霜霉威为对照药剂,采用电导率法研究了氟醚菌酰胺对辣椒疫霉细胞膜通透性的影响。结果(图 4)显示:氟醚菌酰胺各浓度处理的相对渗率值均随时间的推移呈上升趋势。其中:100 μg/mL的氟醚菌酰胺在不同时间所引起的相对渗率值分别为45.69%、48.90%、54.22%、56.71%、65.33%和70.18%,与50 μg/mL霜霉威引起的相对渗率值(分别为46.88%、49.26%、56.65%、59.38%、65.12%和74.97%)相当。初步表明,氟醚菌酰胺与霜霉威作用方式一致,因增加了细胞膜的通透性,从而导致更多的电解质渗漏。
 | 图 4 不同药剂处理对辣椒疫霉细胞膜通透性的影响 Fig. 4 Effect of different fungicides on membrane permeability of P. capsici |
如表 4所示,氟醚菌酰胺对辣椒疫霉可溶性蛋白含量的影响与药剂浓度成正相关。当氟醚菌酰胺质量浓度为12.5和25 μg/mL时,供试菌丝体的可溶性蛋白含量与对照相比在5%水平上差异不显著,抑制率分别为2.27%和4.54%;当药剂质量浓度为50和100 μg/mL时,对供试菌丝体的可溶性蛋白含量有一定的抑制作用,抑制率分别为10.22%和18.55%。
|
| 表 4 氟醚菌酰胺对辣椒疫霉可溶性蛋白质的影响 Table 4 The effect of LH-2010A on dissoluble protein of P. capsici |
结果(表 5)表明,氟醚菌酰胺各浓度处理后辣椒疫霉DNA含量比空白对照均有所下降,但差异均不显著,说明氟醚菌酰胺可能对辣椒疫霉DNA的合成无影响。
|
| 表 5 氟醚菌酰胺对辣椒疫霉DNA含量的影响 Table 5 Effects of LH-2010A on DNA content of P. capsici mycelium |
笔者系统研究了氟醚菌酰胺对辣椒疫霉菌丝生长、游动孢子释放和菌丝生长量的影响,以及其对辣椒疫霉菌丝超微结构、细胞膜通透性、呼吸代谢途径、可溶性蛋白和DNA含量的影响。研究结果表明:氟醚菌酰胺能有效抑制辣椒疫霉菌丝生长,同时对游动孢子释放也有一定的抑制作用;可增加菌丝细胞膜的通透性;通过对呼吸代谢途径的测定,推断三羧酸循环途径是其作用位点之一;然而,氟醚菌酰胺对辣椒疫霉生物大分子合成的影响较小。研究结果初步表明,氟醚菌酰胺主要通过影响辣椒疫霉细胞膜通透性以及三羧酸循环途径而起到抑菌作用。具体的作用机制还有待进一步研究。
| [1] | LEONIAN L H. Stem and fruit blight of peppers caused by Phytophthora capsici sp. nov.[J]. Phytopathology,1922,12(9):401-408. |
| [2] | 鲁占魁,樊仲庆,黄刚. 我国辣椒疫病的发生及防治研究[J]. 宁夏农林科技,1995(2):22-25.LU Z K, FAN Z Q, HUANG G. Pepper Phytophthora blight occurrence and prevention research in China[J]. Ningxia J Agric Fore Sci Tech,1995(2):22-25. |
| [3] | GROVES C T, RISTAINO J B. Commercial fungicide formulations induce in vitro oospore formation and phenotypic change in mating type in Phytophthora infestans[J]. Phytopathology, 2000, 90(11):1201-1208. |
| [4] | FRENCH-MONAR R D, JONES J B, ROBERTS P D. Characterization of Phytophthora capsici associated with roots of weeds on florida vegetable farms[J]. Plant Dis, 2006, 90(3):345-350. |
| [5] | 张化霜, 翟明涛, 王开运, 等. 新化合物氟醚菌酰胺的抑菌活性及其对棉花立枯丝核菌的作用方式研究[J]. 农药学学报, 2013, 15(4):405-411.ZHANG H S, ZHAI M T, WANG K Y, et al. Study on fungicidal activity and mode of action of a novel fungicidal agent, LH-2010A against Rhoizoctonia solani[J]. Chin J Pestic Sci, 2013, 15(4):405-411. |
| [6] | 翟明涛, 张化霜, 王红艳, 等. 氟醚菌酰胺和5种常用杀菌剂对辣椒疫霉菌不同子实体的毒力比较[J]. 农药, 2013, 52(10):765-767.ZHAI M T, ZHANG H S, WANG H Y, et al. Comparison of the toxicity of LH-2010A with several conventional fungicides against Phytophthora capsici's different fruiting bodies[J]. Agrochemicals, 2013, 52(10):765-767. |
| [7] | 李立凤, 李小梅, 张景涛. 辣椒疫霉菌生长和产孢条件的研究[J]. 东北农业大学学报, 2010, 41(10):139-142.LI L F, LI X M, ZHANG J T. Study on growth and sporulation conditions of Phytophthora capsici[J]. J Northeast Agric Univ, 2010, 41(10):139-142. |
| [8] | 黄雄英, 袁会珠, 任新国, 等. 烯酰吗啉对番茄晚疫病菌的抑制活性[J]. 植物保护, 2006, 32(6):45-47.HUANG X Y, YUAN H Z, REN X G, et al. Studies on the activity of dimethomorph against Phytophthora infestans[J]. Plant Prot, 2006, 32(6):45-47. |
| [9] | MITANI S, ARAKI S, YAMAGUCHI T, et al. Antifungal activity of the novel fungicide cyazofamid against Phytophthora infestans and other plant pathogenic fungi in vitro[J]. Pestic Biochem Physiol, 2001, 70(2):92-99. |
| [10] | 秦维彩. 丁吡吗啉对辣椒疫霉菌的作用方式及作用机理探讨[D]. 合肥:安徽农业大学, 2010.QIN W C. The inhibitive activity of pyrimorph against Phytophthora capasici and its mechanism[D]. Hefei:Anhui Agricultural University, 2010. |
| [11] | 黄雄英, 袁会珠, 覃兆海, 等. 丁吡吗啉对致病疫霉的作用机制初探[J]. 农药学学报, 2007, 9(4):376-382.HUANG X Y, YUAN H Z, QIN Z H, et al. Preliminary studies on the mode of action of pyrimorph against Phytophthora infestans[J]. Chin J Pestic Sci, 2007, 9(4):376-382. |
| [12] | 陈亚非, 黄凯玲, 高健华, 等. α-溴代肉桂醛及烷烯基酸酯类对鲜草菇呼吸代谢的抑制[J]. 食品科学, 1994(9):9-12.CHEN Y F, HUANG K L, GAO J H, et al. Inhibition of α-bromo cinnamaklehyde and alkenoic acid esters on the respiratory metabolism against Straw mushroom[J]. Food Sci, 1994(9):9-12. |
| [13] | 丁中, 刘峰, 慕立义. 应用电导仪测定番茄灰霉病菌对多菌灵抗药性的初步研究[J]. 农药学学报, 2003, 5(3):94-96.DING Z, LIU F, MU L Y. A preliminary study on detecting resistance of Botrytis cinerea to carbendazim with conductometer[J]. Chin J Pestic Sci, 2003, 5(3):94-96. |
| [14] | BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1):248-254. |
| [15] | 安鑫龙, 董金皋, 韩建民. 玉米大斑病菌的RAPD分析Ⅰ:应用CTAB法提取玉米大斑病菌DNA[J]. 河北农业大学学报, 2001, 24(1):38-41.AN X L, DONG J G, HAN J M. RAPD analysis of Exserohilum turcicumⅠ. CTAB method of isolating DNA from Exserohilum turcicum for RAPD[J]. J Agric Univ Hebei, 2001, 24(1):38-41. |
| [16] | 朱杰华. 中国马铃薯晚疫病菌群体遗传结构研究[D]. 保定:河北农业大学, 2004.ZHU J H. Research on the genetic structure of potato late blight pathogen(Phytophthora infestans) population in China[D]. Baoding:Agricultural University of Hebei, 2004. |
| [17] | SAUTER H, STEGLICH W, ANKE T. Strobilurins:Evolution of a new class of active substances[J]. Angew Chem Int Ed, 1999, 38(10):1328-1349. |
| [18] | SCHMUCK G, MIHAIL F. Effects of the carbamates fenoxycarb, propamocarb and propoxur on energy supply, glucose utilization and SH-groups in neurons[J]. Arch Toxicol, 2004, 78(6):330-337. |
 2016, Vol. 18
2016, Vol. 18


