2. 中国热带农业科学院 环境与植物保护研究所, 海口 571101
2. Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, China
对硫磷(O,O-二乙基-O-(4-硝基苯基)硫代磷酸酯)为有机磷广谱杀虫剂,是一种作用于乙酰胆碱酯酶的神经毒剂,通过多种途径的暴露可对人类健康产生危害[1, 2]。尽管其在许多国家和地区已被明令限制或禁止使用,但在环境和作物中仍可检测到该药的残留[3, 4]。对硫磷的监测是国际食品贸易中的重要项目,中国农业部规定马铃薯和原粮中对硫磷的最大残留限量(MRL)标准分别为0.05和0.10 µg/mL,对蔬菜和水果的MRL值已低至0.01 µg/mL。目前对硫磷的检测方法主要是仪器分析法[5]和免疫分析法。与仪器分析法相比,免疫分析方法因具有快速简便、灵敏度高及选择性强等优点,已成为农药残留检测备受关注的技术手段,如酶联免疫吸附法(ELISA)[6, 7]、金标试纸条[8]、石英晶体微天平生物传感器[9, 10]、微悬臂生物传感器[11]等。这些免疫分析方法多是基于传统的单克隆抗体而建立的,而基于第三代抗体——基因工程抗体的免疫快速检测技术是当前小分子环境污染物检测领域的研究热点[12]。
单链抗体(single-chain variable fragment antibody,scFv)是重组抗体中包含抗体重链可变区(VH)和轻链可变区(VL)的最小功能结构单位,可通过一段柔性连接肽(Linker)相互串联。与传统单克隆抗体相比,单链抗体在一定程度上保持了亲本抗体对抗原的特异性结合能力,并可进一步通过亲和力成熟改善其特异性;从某种程度上,抗体可变区序列的获得,使具有良好性能的单克隆抗体得以长期保存和大量制备[13, 14, 15]。迄今为止,已有原核系统、昆虫细胞、哺乳细胞以及体外翻译系统等多种表达体系在不断拓展,并成功应用于功能性重组抗体的表达研究[16, 17, 18]。据统计,小分子有毒有害物质的单链抗体的表达主要借助于安全、简单、快速的大肠杆菌原核表达系统[19, 20, 21],通过N端信号肽引导表达至周质空间形成可溶产物,但与亲本单克隆抗体相比,其生物学功能可能存在差异[22]。有研究结果表明,与原核表达相比,昆虫表达体系可获得与亲本抗体天然构象更贴近的蛋白产物,进而展现与亲本更相近的特异性[23, 24]。据分析,该现象可能与杆状病毒介导的昆虫表达系统可以进行多种转录后修饰有关,这使得其在蛋白折叠、生物活性方面展现比原核表达系统更好的优势[18]。
目前,抗对硫磷单链抗体的制备主要集中在大肠杆菌表达系统。徐振林等[25]报道了一株可同时检测多种有机磷农药的宽谱单链抗体,表现了与亲本相似的生物活性,但对其他有机磷农药交叉率高,不适合特异性检测对硫磷。尽管Garrett等[21, 26]获得的单链抗体可特异性识别对硫磷,但亲和力低于亲本单抗50倍,检测灵敏度不能满足MRL要求;虽然有学者在其基础上通过制备多价重组抗体来提高抗体的生物活性,但尚未有方法建立[27, 28]。本研究从性能良好的对硫磷特异性单抗细胞株出发,扩增了抗体的可变区片段,并对组装后的单链抗体在昆虫细胞中进行表达,最终获得了与单克隆抗体性能相当的单链抗体片段,为基因工程抗体免疫分析方法用于对硫磷痕量检测提供了新的材料来源。
1 材料与方法 1.1 材料及主要仪器抗对硫磷的鼠源单克隆抗体稳定杂交瘤细胞株(PA-4C6)由浙江大学农药与环境毒理学研究所实验室制备,亚型为IgG1,kappa。UNIQ-10柱式Trizol总RNA抽提试剂盒、Poly(A)mRNA纯化试剂盒及M-MuLV第一链cDNA合成试剂盒(上海生工生物工程有限公司);FastPfu Fly DNA聚合酶、EasyPure胶回收试剂盒、Blunt zero克隆载体及Escherichia coli Trans1-T1感受态细胞(北京全式金生物技术有限公司);质粒提取试剂盒(Axygen公司);限制性内切酶、T4连接酶(美国NEB公司);Cellfectin Invitrogen转染试剂、Gibco培养基、Bac-to-Bac杆状病毒表达系统及昆虫Sf9细胞(Thermo Fisher Scientific公司)。对硫磷等农药标准品(浙江省农药检定管理所);MaxiSorp™96孔聚丙乙烯微孔板(丹麦Nunc公司);3,3',5,5'-四甲基联苯胺(TMB)(美国Sigma-Aldrich公司)。
XT5107生化培养箱(杭州雪中炭恒温技术有限公司);Chemi Doc MP成像系统、PowerPac Basic电泳仪及Mini-PROTEAN Tetra垂直电泳槽(Bio-Rad公司,美国);SpectraMax i3多功能酶标仪(Molecular devices公司,美国)。
1.2 试验方法 1.2.1 抗体重链(VH)、轻链(VL)可变区基因扩增和鉴定将处于对数生长期的抗对硫磷杂交瘤细胞PA-4C6(5×106 个),在0.5 mL Trizol试剂作用下破碎溶解并提取总RNA,借助Poly(A)尾纯化获得mRNA,并进一步以mRNA为模板,Oligo(dT)18为引物,在M-MuLV反转录酶作用下合成第一链cDNA,产物于–80 ℃下贮存,备用。具体方法参照RNA提取、mRNA纯化及cDNA合成相应试剂盒操作说明。
VH、VL基因片段扩增:吸取第一链cDNA反应物2 µL于管中,依次加入5×PCR Buffer 10 µL,上下游简并引物(表 1)各0.2 µmol/L,dNTPs 0.25 mmol/L,高保真Pfu酶2.5 U,用无菌纯水定容至50 µL,混匀并低速离心后进行PCR扩增反应。反应条件为:95 ℃预变性2 min;95 ℃变性10 s,48 ℃退火20 s,72 ℃延伸30 s,完成35个循环;72 ℃延伸5 min,获得扩增产物。产物经1%琼脂糖凝胶电泳分离,GelRed染色验证后割胶回收目的条带。随后,将纯化的可变区基因按物质的量之比7:1克隆至Blunt Zero载体,25 ℃连接10 min后加入至100 µL刚刚解冻的Trans1-T1感受态细胞中,冰浴30 min;42 ℃热激30 s后迅速转移至冰上急冷2 min;于管中直接加入400 µL LB培养基,37 ℃ 200 r/min条件下培养1 h。4 000 r/min下离心去掉部分上清液,重悬至100 µL后涂布在含氨苄(Amp)和卡那(Kan)抗性的LB平板,37 ℃下培养过夜。次日挑取单克隆,在相同抗性的LB液体培养基中培养6~ 9 h,采用SDS碱裂解法结合DNA制备膜的方法提取质粒。PCR法和测序鉴定阳性重组子,M13通用上游引物为5'-GTAAAACGACGGCCAG-3',下游引物为5'-CAGGAAACAGCTATGAC-3'。
|
| 表 1 抗体可变区VH、VL及scFv全长片段扩增引物序列 Table 1 Primer sequences for the amplification of the variable fragments and the full length scFv |
单链抗体的构建采用重叠延伸法(SOE-PCR)[25],采用含连接肽(Linker)、酶切入点的引物对(表 1),PCR反应分别扩增用于连接的轻重链基因,产物经琼脂糖凝胶电泳分离后割胶回收,纯化后于–20 ℃贮存,备用。其次,取轻重链基因纯化产物各50 ng,加入5 ×PCR Buffer 5 µL、2.5 mmol/L dNTPs 2.5 µL和高保真Pfu酶0.5 µL,用无菌纯水混匀至25 µL;于95 ℃预变性1 min,95 ℃变性1 min,57 ℃退火1 min,72 ℃延伸1 min,反应20个循环后获得重叠链。随后进行扩增反应,重叠链产物管内依次加入含酶切位点的重链上游和轻链下游引物各0.5 µL、5 ×PCR Buffer 5 µL、2.5 mmol/L dNTPs 2.5 µL和高保真Pfu酶0.5 µL,用无菌纯水混匀至25 µL;于95 ℃预变性1 min,95 ℃变性1 min,61 ℃退火1 min,72 ℃延伸1 min,反应30个循环;72 ℃后延伸5 min。产物克隆方法同1.2.1节,经琼脂糖凝胶电泳分离后割胶回收单链抗体片段,连接克隆载体Blunt Zero并转化至Trans1-T1感受态细胞获得Amp和Kan抗性阳性质粒,经PCR法和测序鉴定scFv-4C6组装成功。
1.2.3 Bacmid-scFv-4C6重组杆粒的产生和验证分别取1µg scFv-4C6阳性质粒和pFastBac 1表达载体质粒,加入限制性内切酶EcoRI、NotI各1 µL和10 ×NEBuffer 5 µL,用无菌纯水定容至50 µL,充分混匀后于37 ℃下酶切过夜。次日,用1%琼脂糖凝胶验证酶切效果,分别割胶回收含粘性末端的目的片段和表达载体,并按物质的量之比为7:1混合为9.5 µL,在0.5 µL T4 DNA连接酶作用下于16 ℃下反应过夜,将目的片段与表达载体连接。连接产物进一步转化至Trans1-T1感受态细胞,涂布于Amp抗性平板上,并经EcoRI和NotI双酶切及测序,验证目的片段成功插入表达载体并生成pFast-scFv-4C6。
取鉴定正确的重组质粒10 µL,于42 ℃热激90 s,使目的片段转座至宿主菌DH10Bac感受态细胞中,制备重组杆粒Bacmid-scFv-4C6。37 ℃下培养4 h后,转化成功的转座子将在培养48 h后在包含50 µg/mL Kan、7 µg/mL庆大霉素(Gen)、10 µg/mL四环素(Tet)、100 µg/mL半乳糖苷(X-gal)及40 µg/mL异丙基硫代半乳糖苷(IPTG)的LB平板上形成独立的白色菌落,将划线验证后的白色转座子接种于液体LB培养基(含50 µg/mL Kan,7 µg/mL Gen,10 µg/mL Tet),于37 ℃、200 r/min下培养过夜后,参照PureLink HiPure(Invitrogen)质粒提取试剂盒说明,制备纯化的重组杆粒DNA,于–20 ℃保存备用。重组DNA的鉴定采用PCR法,pUC/M13上游引物为5'-CCCAGTCACGACGTTGTAAAACG-3',下游引物为5'-AGCGGATAACAATTTCACACAGG-3'。
1.2.4 重组杆粒转染Sf9昆虫细胞及表达条件优化阳性重组杆粒用于昆虫细胞Sf9的转染。将健康且繁殖能力强的细胞(9×105/孔)提前铺于6孔细胞培养板内,27 ℃下接触1 h以上。将1 µg杆粒稀释至100 µL未补充Grace培养基中(不含抗生素和血糖),同时将6 µL已恢复到室温的Cellfectin试剂加于另一管100 µL未补充Grace培养基,将两者轻柔混合,室温下孵育30 min,加入0.8 mL未补充Grace培养基混匀。将已贴壁细胞用2 mL未补充Grace培养基清洗,加入DNA/脂肪混合体后于27 ℃培养5 h,弃去并更换2 mL新鲜Sf-900™ Ⅱ SFM培养基,继续培养直到能够看到病毒感染现象(大约72 h)。于500 ×g下离心,收集包含重组病毒的培养基上清液,即获得P1代病毒株,连续感染传代,并通过病毒斑点试验[29]确定滴度。
将6×105个/孔Sf9细胞铺于24孔板中,在300 µL新鲜Sf-900™Ⅱ SFM培养基中加入上述重组病毒株,于27 ℃下恒温培养。考察两组参数感染复数(multiplicity of infection,MOI)(1、2、3、4、5)和感染时间(24、48、72、96 h)对蛋白表达的影响,设未转染细胞为阴性对照。弃去培养基,将收获的细胞溶于1×SDS-PAGE Buffer 400 µL,样品煮沸4 min后用于免疫印迹法(Western blotting,WB)分析,鉴定蛋白表达情况。
1.2.5 可溶性scFv-4C6亲和性和特异性测定采用间接竞争ELISA法(ic-ELISA)测定可溶性scFv-4C6对对硫磷的识别能力,以及对其他有机磷农药的交叉识别情况,参照文献[15]方法操作。最终,以TMB为底物通过酶的催化作用发生显色反应,15 min后加入50 µL/孔2 mol/L的硫酸终止反应,以OD450值的高低衡量抗体结合的多少。以分析物质量浓度的对数值为横坐标,结合抑制率为纵坐标,由S形曲线拟合后的线性方程计算抗体对分析物的识别灵敏度IC50(ng/mL)。由(1)式计算交叉反应率(cross-reactivity,CR)。
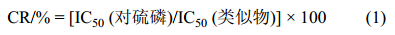
以抗对硫磷杂交瘤细胞的cDNA为模板扩增VH和VL基因片段,并进一步构建如图 1A所示的抗对硫磷单链抗体scFv-4C6。1%琼脂糖电泳结果(图 1B)表明,采用亚型特异性简并引物成功扩增了VH和VL片段,大小分别为390 bp和348 bp。经BLAST比对发现,测序获得的核苷酸序列无早熟序列出现,抗体可变区部分完整,表明抗体可变区序列成功扩增。
 | 图 1 抗对硫磷单链抗体scFv-4C6构建方式(A)及抗体片段扩增 (可变区, B; 单链抗体, C) Fig. 1 The construction mode of scFv-4C6 against parathion (A) by assembling the amplified VH and VL fragments (B) to the full length scFv fragment (C) |
图 1C显示,VH和VL片段经过重叠延伸法拼接、PCR扩增后获得scFv片段,大小为809 bp,与预期值相符。测序结果表明,scFv的核苷酸序列与图 1A设计相符,VH和VL片段通过编码((Gly)4Ser)3的核苷酸序列成功拼接,并在VH上游引入了酶切位点EcoRI的碱基序列、起始密码子ATG、6×His标签的编码序列,在VL片段下游引入了终止密码子TAA、酶切位点NotI的碱基序列。综上说明,scFv-4C6片段成功组装,可用于下一步表达载体的构建。
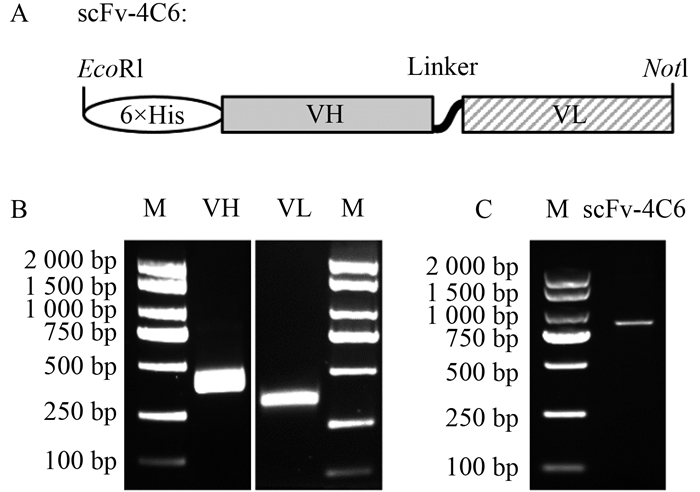
2.2 Bacmid-scFv-4C6重组杆粒的产生和验证将构建成功的scFv-4C6片段连接到表达载体pFastBac 1的EcoRI和NotI酶切位点之间,获得pFast-scFv-4C6重组质粒。经双酶切验证,如图 2A所示,构建的pFast-scFv-4C6重组质粒在500 ~ 1000 bp之间释放出与预期大小相符的外源基因片段。对该质粒的测序结果显示,目的片段正确插入表达载体的EcoRI和NotI酶切位点之间,且序列信息完整。以上结果表明,pFast-scFv-4C6重组质粒构建成功。
 | 图 2 pFast-scFv-4C6重组载体双酶切鉴定(A)及重组杆粒Bacmid-scFv-4C6的PCR验证(B) Fig. 2 The identification of recombinant expression vector pFast-scFv-4C6 by double digestion (A) and recombinant bacmid-scFv-4C6 verified by PCR (B) |
以携带外源目的片段的pFast-scFv-4C6重组质粒为供体质粒,转染包含杆状病毒质粒(杆粒)的DH10Bac感受态细胞,在辅助质粒提供的转化蛋白处发生重组,获得Bacmid-scFv-4C6。经蓝白斑筛选,对划线验证的白色单菌落进行培养并提取质粒,经过PCR验证(图 2B),表明重组后的扩增产物与目的片段相比增加2300 bp,说明成功转化获得了Bacmid-scFv-4C6杆粒。
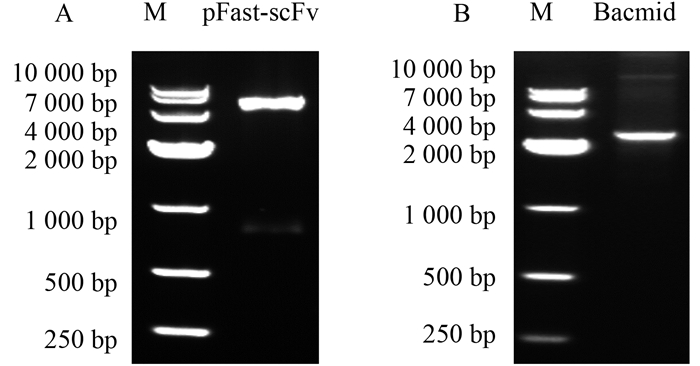
2.3 Sf9昆虫细胞表达PA-scFv及表达条件优化预先将Sf9昆虫细胞经过一段时间无血清培养,使其处于良好的对数生长状态(图 3)。将成功转化的不含氯化钠和酚污染的超纯杆粒DNA侵染Sf9细胞,转染72 h后细胞发生明显病变,体积变大并停止生长。待部分细胞有脱离培养瓶的迹象时收集培养上清,为P1代病毒株。以P1代病毒株为病毒来源,再次侵染Sf9细胞,转染48 h后分别收集细胞和培养基上清(P2代病毒株)。细胞经WB鉴定,如图 4A所示,捕获一条28.3 kD的单一条带,与PA-scFv理论氨基酸序列大小相符,说明外源scFv-4C6在昆虫细胞表达体系中成功表达。
 | 图 3 Sf9昆虫细胞转染scFv-4C6杆粒前(A)后(B)的形态变化 Fig. 3 Morphological change of Sf9 cell before (A) and 72 h after (B) transfection with bacmid-scFv-4C6 |
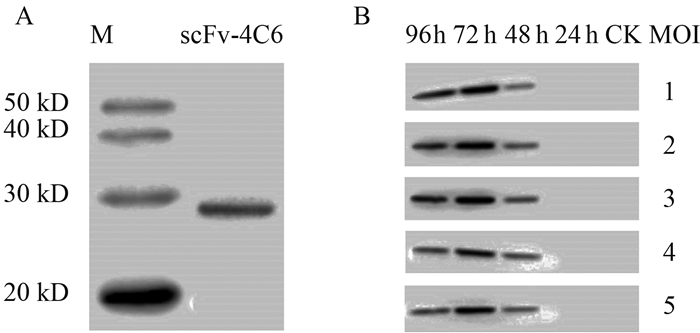 | 图 4 免疫印迹法验证scFv-4C6的表达(A)及不同转染时间和MOI值条件的影响(B) Fig. 4 Immunoblot analysis of scFv-4C6 expression (A) and the effect of different times post-infection and MOI values (B) |
将滴度为3 ×107 pfu/mL的P2代病毒株转染Sf9细胞,以确定转染时间和病毒数量对scFv-4C6蛋白表达的影响。结果如图 4B所示:未经过转染的细胞并未发现本底杂蛋白干扰,且蛋白在转染后24 h仍无目的蛋白的表达;在转染后48 h,目的蛋白开始表达,病毒株数量较低(MOI 1~3)时表达量反而略高。但是,转染时间对表达量的影响要明显大于病毒数量的影响,表达量在转染后72 h达到顶峰,随着时间延长至96 h,表达量出现明显减弱的迹象。这可能与细胞发生裂解有关,胞内蛋白已经释放至上清。考虑到病毒株的合理使用以及蛋白的表达效率,选取MOI为1、表达时间为72 h的最优条件,进行大体积培养,以验证重组蛋白的生物活性。
2.4 可溶性PA-scFv的生物活性验证转染72 h后离心收集细胞,经裂解浓缩后获得目的蛋白,进一步通过ic-ELISA方法评价其生物活性。结果如图 5所示:表达的scFv-4C6可以成功捕获溶液中游离的对硫磷小分子,并随着对硫磷质量浓度的递增,明显抑制了重组抗体与固相抗原的结合。不仅如此,scFv-4C6与其亲本对硫磷的单克隆抗体mAb-4C6表现了相似的识别灵敏度,活性抑制率达到50%所需的对硫磷浓度IC50值分别为7.9 ng/mL和8.5 ng/mL;线性检测范围分别为2.3~26.9 ng/mL和2.7~26.6 ng/mL。
 | 图 5 对硫磷单链抗体与亲本抗体灵敏度的比较(n=3) Fig. 5 Ic-ELISAs for parathion detection developed by scFv-4C6 and mAb-4C6 (n=3) |
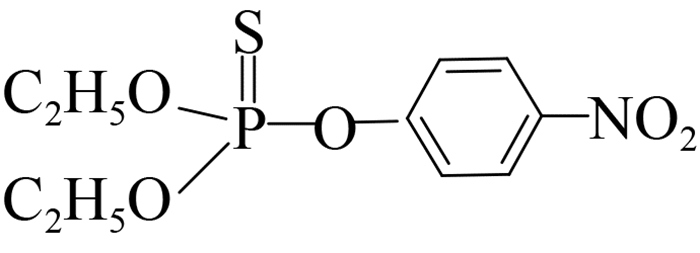
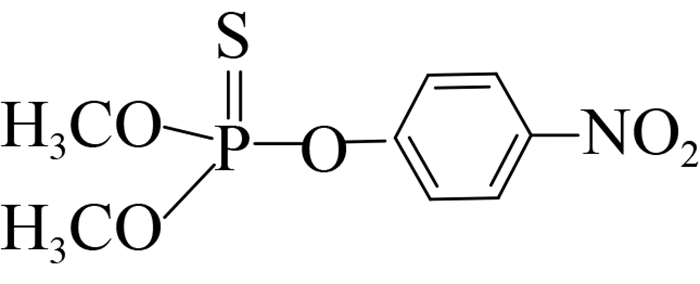
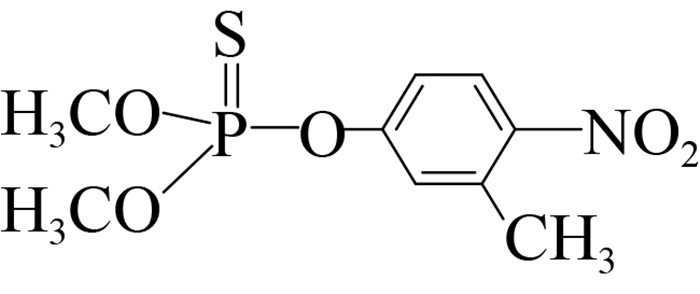
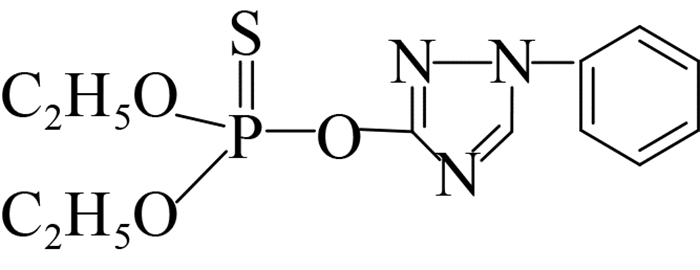
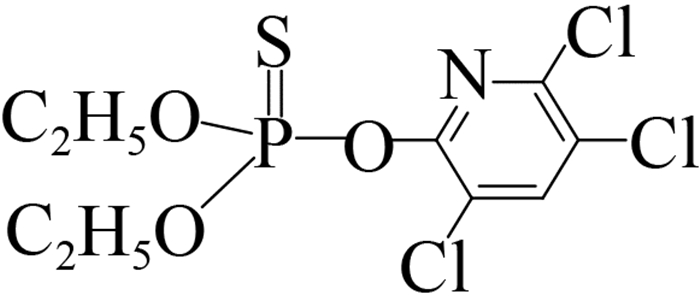
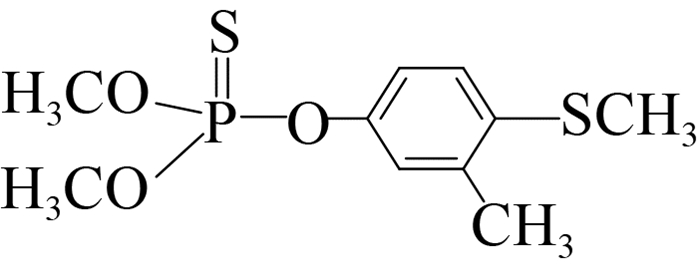
此外,可溶性scFv-4C6展现出与亲本抗体相似的特异性识别谱(表 2),可特异性识别对硫磷,对甲基对硫磷和杀螟硫磷存在12%和1.8%的交叉识别率,对三唑磷、毒死蜱、倍硫磷、辛硫磷和水胺硫磷不识别。由化合物分子结构间的差异可以看出,这种交叉识别主要来自于有机磷农药的对硝基苯基部分,而甲基对硫磷和杀螟硫磷的甲氧基结构以及后者苯环间位上的甲基结构对免疫反应识别都起到了干扰作用,因此也说明对硫磷上的对硝基苯基和乙氧基结构共同组成了关键的抗原决定簇(抗体识别表位)。
|
| 表 2 对硫磷单链抗体与亲本抗体交叉反应率的比较 Table 2 Cross-reactivity (CR) determined for parathion and analogues by scFv-4C6 and mAb-4C6 |
以上免疫反应结果表明,抗对硫磷scFv目的片段在昆虫细胞体系中得到了成功表达,其分子识别活性与传统的单克隆抗体相当。
2.5 多种对硫磷scFv的氨基酸序列分析和比对根据测序获得的核苷酸序列推导获得的单链抗体的氨基酸序列,并进一步对抗体可变区的高变区进行划分。如图 6所示:PA-4C6为本研究获得的抗对硫磷scFv-4C6抗体的氨基酸序列,可特异性识别对硫磷。Garrett等[21]报道了与PA-4C6有相似识别谱的抗对硫磷单链抗体序列(PA-Garrett),但灵敏度较低;Xu等[25]表达了有机磷农药宽谱单链抗体(PA-Xu ZL),虽然建立的直接竞争ELISA法对对硫磷有较好识别能力,但对辛硫磷、蝇毒磷和三唑磷等多种有机磷农药有较高的交叉识别性。
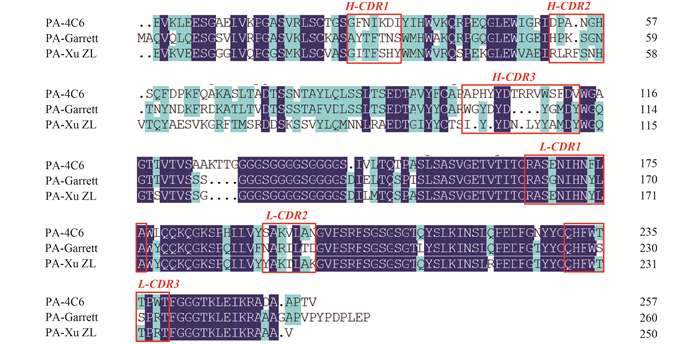 | 图 6 抗对硫磷(PA)单链抗体的氨基酸序列比对 Fig. 6 Multiple alignment of deduced amino acid sequences of scFvs against parathion (PA) |
通过对3组氨基酸序列进行比对发现,重链可变区的差异很可能是形成3组单链抗体识别选择性差异的主要影响因素。3组氨基酸序列在轻链高变区(L-CDR)仅有几个氨基酸的差异,但在重链高变区H-CDR3区的氨基酸数量上差异最为明显;PA-4C6与PA-Garrett的区别更多体现在重链高变区(CDR),而与宽谱单链抗体PA-Xu ZL在CDR2和CDR3之间的FR3骨架区氨基酸也表现较大差异。
3 结论与讨论具有良好性能的杂交瘤细胞株是获得单克隆抗体可变区的重要来源,与非免疫来源的文库筛选法相比,可更快捷地获得特异性较好的可变区片段[19]。本研究从能分泌抗对硫磷单克隆抗体的杂交瘤细胞株出发,采用亚型特异性的引物成功扩增抗体的轻重链可变区片段,并通过15个氨基酸的柔性连接肽拼接,获得重组的单链抗体片段。进一步将获得的scFv基因构建到昆虫杆状病毒体系,转染Sf9昆虫细胞进行可溶性表达,建立了基于单链抗体的对硫磷间接竞争ELISA检测方法。
本研究结果表明,该重组表达的单链抗体对对硫磷的灵敏度(IC50)为7.9 ng/mL,特异性较高,只对甲基对硫磷和杀螟硫磷有12%和1.8%的交叉识别率,且与亲本单克隆抗体的识别性能相似。这可能与昆虫表达体系能够形成比较贴近亲本抗体天然构象的蛋白产物有关,进而展现了抗对硫磷单链抗体与亲本单抗相近的亲合力和特异性,该结论与其他学者报道一致[23]。分析现有抗对硫磷单链抗体的氨基酸序列,重链可变区对抗体性能的影响大于轻链可变区,且以重链CDR3区的差异最大。虽然有学者报道了重链CDR3区对小分子抗体识别特异性的重要影响[30, 31],但轻链可变区对抗体性能的影响以及单链抗体发挥作用的关键氨基酸是否在CDR3区,可进一步通过同源建模和分子对接的手段展开研究,并通过突变的手段进行验证。综上所述,本研究通过基因工程手段获得了和亲本单抗性能相当的抗对硫磷单链抗体片段,为对硫磷基因工程抗体免疫分析方法的建立提供了新的应用材料。
| [1] | KARAMI S, ANDREOTTI G, KOUTROS S, et al. Pesticide exposure and inherited variants in vitamin d pathway genes in relation to prostate cancer[J]. Cancer Epidem Biomar, 2013, 22(9):1557-1566. |
| [2] | MOSTAFALOU S, ABDOLLAHI M. Pesticides and human chronic diseases:Evidences, mechanisms, and perspectives[J]. Toxicol Appl Pharm, 2013, 268(2):157-177. |
| [3] | VELASCO A, HERNÁNDEZ S, RAMÍREZ M, et al. Detection of residual organochlorine and organophosphorus pesticides in agricultural soil in Rio Verde region of San Luis Potosi, Mexico[J]. J Environ Sci Heal B, 2014, 49(7):498-504. |
| [4] | YU R, LIU Q, LIU J S, et al. Concentrations of organophosphorus pesticides in fresh vegetables and related human health risk assessment in Changchun, Northeast China[J]. Food Control, 2016, 60:353-360. |
| [5] | VELKOSKA-MARKOVSKA L, PETANOVSKA-ILIEVSKA B. Optimization and development of a SPE-HPLC-DAD method for the determination of atrazine, malathion, fenitrothion, and parathion pesticide residues in apple juice[J]. Maced J Chem Chem En, 2013, 32(2):299-308. |
| [6] | YAN X, SHI H Y, WANG M H. Development of an enzyme-linked immunosorbent assay for the simultaneous determination of parathion and imidacloprid[J]. Anal Methods-UK, 2012, 4(12):4053-4057. |
| [7] | 邓浩, 孔德彬, 杨金易, 等. 对硫磷化学发光酶联免疫吸附分析方法的建立和评价[J]. 分析化学, 2013, 41(2):247-252.DENG H, KONG D B, YANG J Y, et al. Development of an indirect competitive chemiluminescence enzyme-linked immunoassay for parathion[J]. Chin J Anal Chem, 2013, 41(2):247-252. |
| [8] | LIU Y H, XIE R, GUO Y R, et al. Comparison of homologous and heterologous formats in nanocolloidal gold-based immunoassays for parathion residue determination[J]. J Environ Sci Health B, 2012, 47(5):475-483. |
| [9] | FUNARI R, DELLA VENTURA B, SCHIAVO L, et al. Detection of parathion pesticide by quartz crystal microbalance functionalized with UV-activated antibodies[J]. Anal Chem, 2013, 85(13):6392-6397. |
| [10] | FUNARI R, DELLA VENTURA B, CARRIERI R, et al. Detection of parathion and patulin by quartz-crystal microbalance functionalized by the photonics immobilization technique[J]. Biosens Bioelectron, 2015, 67:224-229. |
| [11] | XUE C G, NAN T G, WU S Q, et al. Detection of ethyl parathion using microcantilever biosensor[J]. Asian J Chem, 2012, 24(9):3951-3953. |
| [12] | MARKUS V, JANNE L, URPO L. Directed antibody-engineering techniques and their applications in food immunoassays[J]. Trac Trends Analc Chem, 2011, 30(2):219-226. |
| [13] | LI X, LI P W, ZHANG Q, et al. Molecular characterization of monoclonal antibodies against aflatoxins:a possible explanation for the highest sensitivity[J]. Anal Chem, 2012, 84(12):5229-5235. |
| [14] | WYATT G M, GARRETT S D, LEE H A, et al. Alteration of the binding characteristics of a recombinant scFv anti-parathion antibody-1. Mutagenesis targeted at the VH CDR3 domain[J]. Food Agric Immunol, 1999, 11(3):207-218. |
| [15] | KARSUNKE X Y Z, WANG H F, WEBER E, et al. Development of single-chain variable fragment(scFv) antibodies against hapten benzo[α]pyrene:a binding study[J]. Anal Bioanal Chem, 2012, 402(1):499-507. |
| [16] | SCHIRRMANN T, AL-HALABI L, DÜBEL S, et al. Production systems for recombinant antibodies[J]. Front Biosci, 2008, 13:4576-4594. |
| [17] | STECH M, MERK H, SCHENK J A, et al. Production of functional antibody fragments in a vesicle-based eukaryotic cell-free translation system[J]. J Biotech, 2013, 164(2):220-231. |
| [18] | VERMA R, BOLETI E, GEORGE A J T. Antibody engineering:comparison of bacterial, yeast, insect and mammalian expression systems[J]. J Immunol Methods, 1998, 216(1-2):165-181. |
| [19] | LI X, LI P W, LEI J W, et al. A simple strategy to obtain ultra-sensitive single-chain fragment variable antibodies for aflatoxin detection[J]. RSC Adv, 2013, 3(44):22367-22372. |
| [20] | ZHANG X, LIU Y, ZHANG C Z, et al. Rapid isolation of single-chain antibodies from a human synthetic phage display library for detection of Bacillus thuringiensis(Bt) Cry1B toxin[J]. Ecotox Environ Safe, 2012, 81:84-90. |
| [21] | GARRETT S D, APPLEFORD D J A, WYATT G M, et al. Production of a recombinant anti-parathion antibody(scFv); Stability in methanolic food extracts and comparison to an anti-parathion monoclonal antibody[J]. J Agric Food Chem, 1997, 45(10):4183-4189. |
| [22] | MORENO M J, PLANA E, MANCLÚS J J, et al. Comparative study of monoclonal and recombinant antibody-based immunoassays for fungicide analysis in fruit juices[J]. Food Anal Method, 2014, 7(2):481-489. |
| [23] | LEMEULLE C, CHARDÈS T, MONTAVON C, et al. Anti-digoxin scFv fragments expressed in bacteria and in insect cells have different antigen binding properties[J]. FEBS Lett, 1998, 423(2):159-166. |
| [24] | 徐重新, 张霄, 张存政, 等. 抗Bt(Cry1B)毒素单链抗体在sf9昆虫细胞中的表达及活性测定[J]. 江苏农业学报, 2013, 29(5):985-991.XU C X, ZHANG X, ZHANG C Z, et al. Expression and characterization of anti-Bt(Cry1B) toxin scFv antibody in sf9 insect cells[J]. Jiangsu J Agric Sci, 2013, 29(5):985-991. |
| [25] | XU Z L, DONG J X, WANG H, et al. Production and characterization of a single-chain variable fragment linked alkaline phosphatase fusion protein for detection of O,O-diethyl organophosphorus pesticides in a one-step enzyme-linked immunosorbent assay[J]. J Agric Food Chem, 2012, 60(20):5076-5083. |
| [26] | HORÁČEK J, GARRETT S D, SKLÁDAL P, et al. Characterization of the interactions between immobilized parathion and the corresponding recombinant scFv antibody using a piezoelectric biosensor[J]. Food Agric Immunol, 1998, 10(4):363-374. |
| [27] | 乔亚奇, 潘家荣, 王磊, 等. 抗对硫磷基因工程新型抗体的制备及鉴定[J]. 微生物学报, 2010, 50(5):670-675.QIAO Y Q, PAN J R, WANG L, et al. Construction and identification of genetically engineered tetravalent antibodies against parathion[J]. Acta Microbiologica Sinica, 2010, 50(5):670-675. |
| [28] | 张付凯, 乔亚奇, 王磊, 等. 抗对硫磷基因工程四价抗体在大肠杆菌中高效表达与鉴定[J]. 核农学报, 2012, 26(1):118-122.ZHANG F K, QIAO Y Q, WANG L, et al. High level expression of genetically engineered tetravalent antibodies against parathion in E. coli and its identification[J]. J Nucl Agric Sci, 2012, 26(1):118-122.(in Chinese) |
| [29] | YAP W N. Development of novel galactosylation method for the expression of recombinant human transferrin in insect cell culture[D]. Malaysia:Universiti Teknologi Malaysia, 2006. |
| [30] | JANG Y J, STOLLAR B D. Anti-DNA antibodies:aspects of structure and pathogenicity[J]. Cell Mol Life Sci, 2003, 60(2):309-320. |
| [31] | LIN Y, LI B, WANG M, et al. Improved affinity of a chicken single-chain antibody to avian infectious bronchitis virus by site-directed mutagenesis of complementarity-determining region H3[J]. African J Biotechnol, 2011, 10(79):18294-18303. |
 2016, Vol. 18
2016, Vol. 18