2. 华北水利水电大学 环境与市政工程学院, 郑州 450045
2. North China University of Water Resources and Electric Power, Institute of Environmental and Municipal Engineering, Zhengzhou 450045, China
甜菜夜蛾Spodoptera exigua Hübner,属鳞翅目夜蛾科,是一种重要的世界性农业害虫,在五大洲均有为害记录[1]。20世纪80年代以前,甜菜夜蛾在中国间歇性发生,为害较轻,之后逐年加重,在高温期为害更为严重,已成为中国一种重要的农业害虫[2]。甜菜夜蛾对常用杀虫剂产生抗性是其危害加重的重要原因[3]。灭多威是最早(1986年)报道的对甜菜夜蛾产生抗药性的农药[4]。之后的研究发现:泰安甜菜夜蛾幼虫对氯氰菊酯和毒死蜱的抗药性分别达1 535.9和164.1倍[5];福建甜菜夜蛾敏感品系对氯氰菊酯和毒死蜱的抗药性分别达3 090.4和1 981.4倍,对丙嗅磷的抗药性为734.3倍,对灭多威的抗药性为153.8倍[6]。
昆虫对杀虫剂的抗药性是一种复杂的遗传现象。利用解毒酶降解杀虫剂是昆虫产生抗药性的方式之一[7],而昆虫脂肪体中的细胞色素P450在物质转换和有毒物质的解毒过程中起着重要作用,与昆虫的抗药性密切相关[8],如棉铃虫CYP9A12对拟除虫菊酯类杀虫剂具有代谢作用[9],甜菜夜蛾对氯虫苯甲酰胺抗药性与CPY9A9、CPY4G37和CPY6B有关[10];但甜菜夜蛾对毒死蜱、灭多威和氯氰菊酯的抗药性与P450家族基因的关系尚未见报道,但已有研究发现,甜菜夜蛾细胞色素P450(CYP9A11)在杀虫剂的代谢组织-脂肪体和中肠中特异表达[11, 12],基于此,本研究以甜菜夜蛾CYP9A11和已产生抗药性的3种常用杀虫剂(毒死蜱、灭多威和氯氰菊酯,结构式见图式 1)为研究对象,分析它们之间结合机理。
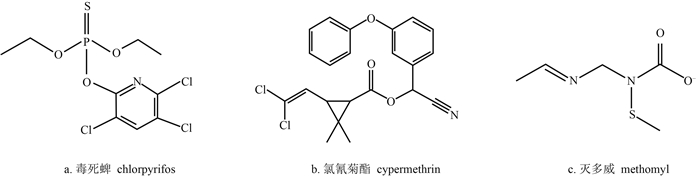 | 图式 1 3种杀虫剂的分子结构 Scheme 1 Molecular structure of three pesticides |
小分子与生物大分子间的非共价作用(静电作用、范德华力和氢键等)的协同作用和加合作用可形成一定方向性和选择性的强作用力,这种强作用力是分子组装和识别的基础,对其特性进行研究有助于了解分子间的相互作用以及相互识别过程[13];分子对接技术是通过预测生物大分子和小分子的结合位点、结合能以及关键氨基酸残基等分析二者之间的结合模式[14]。本研究采用AutoDock分子对接技术及分子力学泊松-波尔兹曼表面积法(molecular mechanics Poisson-Boltzmann surface area,MM-PBSA)结合自由能计算法,研究了甜菜夜蛾CYP9A11与毒死蜱、氯氰菊酯和灭多威3种杀虫剂的作用方式,确定其作用力类型、结合的关键位点及自由能,旨在为阐明甜菜夜蛾与3种杀虫剂的结合机理提供理论依据。
1 材料与方法 1.1 甜菜夜蛾CYP9A11三维模型和3种农药结构的获取从蛋白数据库(www.ncbi.nlm.nih.gov)中下载甜菜夜蛾CYP9A11序列。以CYP9A11为研究对象,运用Discovery studio(DS)2.5中同源建模程序构建其三维结构模型:主要包括从蛋白质晶体数据库(www.rcsb.org)中搜索同源蛋白、将目标蛋白序列与模板蛋白序列对比、建立模型及对模型的优化和评估等。
运用ChemBioOffice 10.0中的ChemBioDraw模块,构建灭多威、毒死蜱和氯氰菊酯的初始结构,再运用ChemBio 3D模块构建其空间结构,并进行能量最小化优化。
1.2 甜菜夜蛾CYP9A11与杀虫剂的分子对接运用分子对接软件AutoDock 4.2对CYP9A11与3种杀虫剂进行分子对接,选择经验自由能函数和拉马克遗传算法(LGA)分别计算CYP9A11与3种杀虫剂的可能构象,对接过程中CYP9A11保持刚性结构,农药设为全柔性结构(所有可旋转键自由旋转),保留对接复合物的10个构象,最后选取自由能最低的构象进行分析[15]。
1.3 对接复合物的统计分析运用Ligplot+软件分析对接复合物的分子作用网,统计CYP9A11与3种杀虫剂产生氢键和疏水作用力的氨基酸残基。
1.4 对接复合物的结合自由能计算采用MM-PBSA法计算对接复合物的结合自由能(binding free energy,ΔGbind)[16]。ΔGbind与受体和配体的亲和力呈负相关性,MM-PBSA法将对接体系自由能(G)分解为溶剂化能(Gsolv)、真空分子内能(EMM)和构象变化引起的熵变(TSMM),计算公式如下:
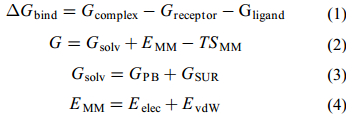
自由能由气相和液相两部分组成。液相部分自由能为溶剂化能Gsolv,包括极性溶剂化能GPB和非极性溶剂化能GSUR(公式3),可由DS 2.5软件的Calculate Energy模块计算而得,其中Implicit Solvent Model参数设置为Poisson-Boltzmann surface area(PBSA),其他参数为默认设置。气相部分的自由能为分子力学能EMM和熵变能TSMM(公式2),其中TSMM值的变化对自由能影响小,计算中忽略,EMM主要包括分子静电相互作用能Eelec和范德华力能EvdW(公式4)。Implicit Solvent Model参数设置为None,其他参数为默认值。
2 结果与讨论 2.1 甜菜夜蛾CYP9A11的同源建模和3种杀虫剂分子结构的建立经同源性搜索,发现4个与目的蛋白序列相似性较高的模板,晶体库登录号及相似度分别为1TQN(51.77%)、2Q9F(32.89%)、2IJ2(35.44%)和2VE3(45.21%),以这4个晶体结构为模板构建模型。结果显示:模型Verify Score为45.11高于Verify Expected High Score值(38.70),Ramachandran Plot图(图 1)显示氨基酸均在最适区域,可见模型质量较高,经动力学优化后保存模型。
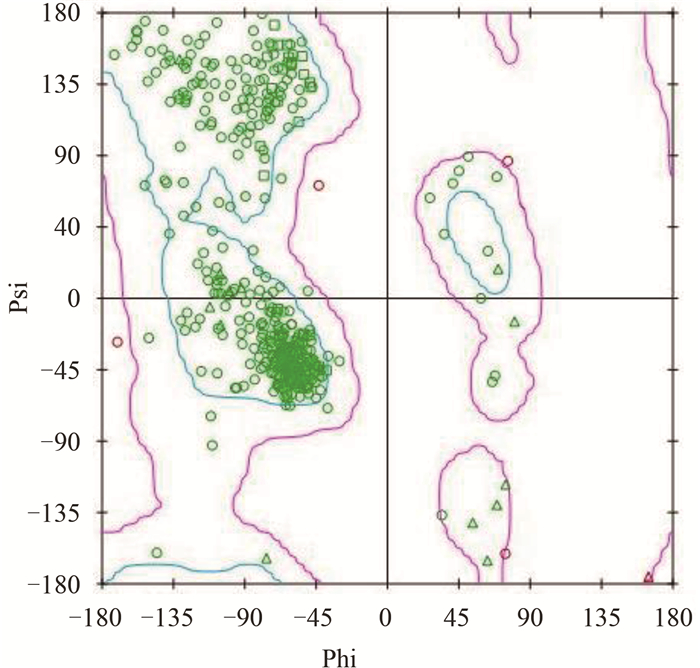 | 图 1 CYP9A11三维结构的Ramachandran Plot图 Fig. 1 Ramachandran Plot of three-dimensional structure of CYP9A11 |
由于目前尚无资料显示甜菜夜蛾CYP9A11可能的活性位点,所以在用AutoDock 4.2程序进行分子对接时,设置Grid Box分子对接格点包含整个模型。3个对接体系分子对接格点分别为100 ×126 ×102(毒死蜱)、108 ×126 ×104(氯氰菊酯)和106 ×122 ×102(灭多威),格点间距为3.75 nm,结合模式如图 2所示。3种杀虫剂对接后均处于受体的腔体口袋内。
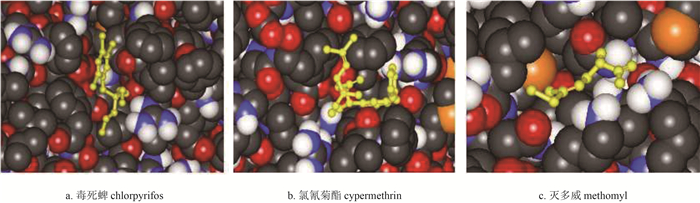 |
注:球棒状为杀虫剂结构。 Ball and stick show the structure of pesticide. 图 2 CYP9A11与3种杀虫剂的对接 Fig. 2 Docking between CYP9A11 and three pesticides |
运用DS 2.5软件分析CYP9A11与3种杀虫剂形成的对接复合物中的氢键(图 3虚线)。结果表明:在毒死蜱与CYP9A11的对接复合物中有2个氢键,灭多威与CYP9A11的对接复合物中有5个氢键,而在氯氰菊酯与CYP9A11的对接复合物中无氢键;在CYP9A11中有4个氨基酸残基参与了上述7个氢键的形成(表 1),其中Leu216和Arg217是CYP9A11与毒死蜱形成氢键的重要氨基酸残基,CYP9A11中的Lys94和Gln21与灭多威形成氢键。氢键具有稳定性、方向性和饱和性,分子间生成氢键可以降低物质的能量,增强化合物稳定性[17],所以氢键可能是这两种复合物形成的重要作用力;值得注意的是:氯氰菊酯与CYP9A11的对接复合物中并无氢键形成,但复合物也具有较高的结合自由能(表 2),可见配体与受体的结合是多种力作用的结果,如结合腔内的疏水作用力等[18]。
 | 图 3 CYP9A11与两种杀虫剂的氢键二维图 Fig. 3 2D map of hydrogen bonds between CYP9A11 and two pesticides |
|
| 表 1 CYP9A11与2种杀虫剂的氢键分析 Table 1 Hydrogen bonds analysis between CYP9A11 and two pesticides |
受体和配体结合的稳定程度取决于结合自由能的大小,自由能越低,复合物稳定程度越高[19]。CYP9A11与3种杀虫剂对接复合物的结合自由能(ΔGbind)计算结果见表 2。CYP9A11与毒死蜱、氯氰菊酯和灭多威的ΔGbind分别为-3659.80、-473.44和-470.92 kJ/mol,可见3种配体均与受体稳定结合[20]。
|
| 表 2 CYP9A11 中与 3 种杀虫剂对接复合物的结合自由能 (kJ/mol) Table 2 Binding free energy of docking compounds of CYP9A11 and three pesticides (kJ/mol) |
通过对比结合自由能和田间试验中甜菜夜蛾的抗药性[6],发现两者之间未呈现正相关性:田间试验发现,甜菜夜蛾对氯氰菊酯的抗药性最强;而本研究发现,CYP9A11与氯氰菊酯和灭多威的结合自由能较高,表明所形成的复合物稳定性较低,这可能是由于不同昆虫与氯氰菊酯抗药性相关的CYP酶是不相同的,如小菜蛾与氯氰菊酯抗药性相关的是CYP6家族[21],棉铃虫对氯氰菊酯抗药性相关的是CYP6[22]家族和CYP9家族[9],推测甜菜夜蛾与氯氰菊酯抗药性也可能是多个CYP家族共同作用的结果,CYP9A11起部分作用,所以与氯氰菊酯的结合自由能较高。越来越多的研究也表明,昆虫产生抗药性是多个P450基因共同作用的结果[22, 23];而灭多威为氨基甲酸酯类杀虫剂,与此类杀虫剂抗性相关的是昆虫P450 CYP4家族[24],所以与CYP9A11的结合自由能也较高。此外,由于分子模拟是在理想状态下进行的,而大田试验会受到诸多气象因子和生物因子的影响,故两者结果在定量方面有差异,同时也可能是由于P450与杀虫剂的结合只是甜菜夜蛾产生抗药性的一个步骤,两者并无正相关性。
通过对结合自由能各组分的能量进行拆解(表 2)发现:毒死蜱与CYP9A11的结合复合物中ΔEvdW和ΔEelec为负值,表明范德华力和静电作用力是促进二者结合的作用力;ΔGPB为正值,表明极性溶剂化能抑制二者的结合。在3种作用力中,范德华力对结合自由能的贡献值最大,是配体与受体结合的主要驱动力,这与文献报道[25, 26]一致。氯氰菊酯与CYP9A11结合的复合物中,ΔEvdW和ΔEelec为正值,表明范德华力和静电作用力对复合物的生成有抑制作用;ΔGPB为负值,表明极性溶剂化能对复合物的形成有促进作用,与毒死蜱不同的是,极性溶剂化能对结合自由能的贡献最大,是氯氰菊酯与CYP9A11结合的主要驱动力。灭多威与P450结合的复合物中ΔGPB为负值,对结合自由能的贡献最大,是二者结合的主要驱动力,ΔEvdW和ΔEelec为正值,对复合物的形成有抑制作用。在3种复合物中ΔGSUR均为接近于0的负值,说明非极性溶剂化能对配体与受体的结合具有轻微的促进作用。本研究表明,CYP9A11与3种杀虫剂的结合机理不同。
2.5 复合物的疏水作用分析通过Ligplot+软件运算所得的CYP9A11与3种杀虫剂相互作用的二维图见图 4。图 4和表 3显示:CYP9A11中有8个氨基酸残基与毒死蜱形成了疏水作用力,7个氨基酸残基与氯氰菊酯形成了疏水作用力,3个氨基酸残基与灭多威形成了疏水作用力,其中phe53、Ile223和phe427可与毒死蜱和氯氰菊酯均形成疏水作用力。
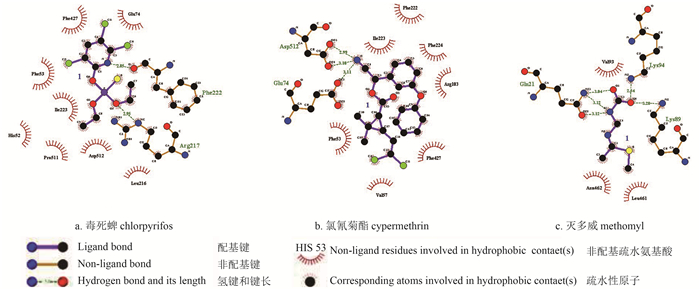 | 图 4 CYP9A11 与 3 种杀虫剂分子间的氢键和疏水相互作用分析 Fig. 4 Hydrogen bond and hydrophobic interactions between CYP9A11 and three pesticides |
|
| 表 3 CYP9A11中与3种杀虫剂产生疏水作用的氨基酸残基 Table 3 Hydrophobic amino acid residues of CYP9A11 that interacted with three pesticides |
本研究以3种杀虫剂毒死蜱、氯氰菊酯和灭多威为配体,以甜菜夜蛾细胞色素酶P450 CYP9A11为受体,运用同源建模的方法构建了CYP9A11的三维模型,并与3种杀虫剂进行分子对接和MM-PBSA结合自由能计算。结果表明:CYP9A11与毒死蜱结合的复合物中有两个氢键,CYP9A11中有8个氨基酸残基与毒死蜱之间形成了疏水作用力,结合自由能为-3 659.80 kJ/mol,其中范德华力为二者结合的主要驱动力;CYP9A11中有7个氨基酸残基与氯氰菊酯之间形成了疏水作用力,结合自由能为-473.44 kJ/mol,其中极性溶剂化能是二者结合的主要驱动力;CYP9A11与灭多威结合的复合物中有5个氢键,CYP9A11中有3个氨基酸残基与灭多威之间形成了疏水作用力,结合自由能为-470.92 kJ/mol,其中极性溶剂化能是二者结合的主要驱动力。这些结果为阐明CYP9A11与3种杀虫剂的结合模式以及甜菜夜蛾抗药性机理的研究提供了重要参考。
| [1] | 章士美, 赵泳祥. 中国农林昆虫地理分布[M]. 北京:中国农业出版社, 1996:260-261.ZHANG S M, ZHAO Y X. The geographical distribution of agriculture and forest insects in China[M]. Beijing:China Agriculture Press, 1996:260-261. |
| [2] | 何玉仙, 杨秀娟, 翁启勇, 等. 甜菜夜蛾的抗药性研究及其治理[J]. 世界农业, 1999(6):41-43.HE Y X, YANG X J, WONG Q Y, et al. Study and management of pesticide resistance in Spodoptera exigua[J]. Word Agric, 1999(6):41-43. |
| [3] | 张悦丽, 高兴祥. 甜菜夜蛾生物防治研究进展[J]. 农药, 2004, 43(5):209-211.ZHANG Y L, GAO X X. Research progress on biological control of beet armyworm[J]. Chin J Pestic, 2004, 43(5):209-211. |
| [4] | CHAUFAUX J, FERRON P. Sensibilité differente de deux populations de Spodoptera exigua Hüb.(Lépid., Noctuidae) aux baculovirus et aux pyréthrinoïdes de synthèse[J]. Agronomie, 1986, 6:99-104. |
| [5] | 王开运, 姜兴印, 仪美芹, 等. 甜菜夜蛾的抗药性变化及治理对策的研究[J]. 农药, 2001, 40(6):29-32.WANG K Y, JIANG X Y, YI M Q, et al. Studies on resistance change and management strategy of Spodoptera exigua[J]. Pesticides, 2001, 40(6):29-32. |
| [6] | 兰亦全, 赵士熙. 甜菜夜蛾抗药性监测及机理[J]. 福建农林大学学报(自然科学版), 2004, 33(1):26-29.LAN Y Q, ZHAO S X. Monitoring of insecticide resistance and its mechanism of Spodoptera exigua Hübner in Fuzhou, Fujian Province, China[J]. J Fujian Agric For Univ(Nat Sci Ed), 2004, 33(1):26-29. |
| [7] | SCOTT J G. Insecticide resistance in insects[M]//Pimentel P. Handbook of Pest Management in Agriculture. Boca Raton:CRC Press, 1991, 2:663. |
| [8] | 邱立红, 张文吉. 多功能氧化酶系(MFO)与棉铃虫抗药性关系初步研究[J]. 农药学学报, 1999, 1(2):54-60.QIU L H, ZHANG W J. Preliminary study on relationship between mixed-function oxidases and the resistance of Helicoverpa armigera to fenvalerate[J]. Chin J Pestic Sci, 1999, 1(2):54-60. |
| [9] | 张爽, 杨亦桦, 武淑文, 等. 棉铃虫P450基因CYP9A12酵母表达产物对拟除虫菊酯的代谢作用[J]. 昆虫学报, 2008, 51(12)1255-1259.ZHANG S, YANG Y H, WU S W, et al. Metabolism of pyrethroids by Helicoverpa armigera cytochrome P450 gene CYP9A12 heterologously expressed in Saccharomyces cerevisiae[J]. Acta Entomologica Sinica, 2008, 51(12):1255-1259. |
| [10] | 王学贵, 余慧灵, 梁沛, 等. 氯虫苯甲酰胺诱导甜菜夜蛾细胞色素P450基因上调表达[J]. 昆虫学报, 2015, 58(3):281-287.WANG X G, YU H L, LIANG P, et al. Chlorantraniliprole induces up-regulated expression of cytochrome P450 genes in Spodoptera exigua(Lepidoptera:Noctuidae)[J]. Acta Entomologica Sinica, 2015, 58(3):281-287. |
| [11] | SHEN Y H, CHENG D J, ZHA X F, et al. The gene expression profile of the fat-body of silkworm, Bombyx mori Ⅰ. Gene expression profile of the fat-body of the 5th instar Bombyx mori larvae[J]. Acta Sericologica Sinica, 2004, 30(1):24-27. |
| [12] | ZHAO C Q, FENG X Y, TANG T, et al. Isolation and expression analysis of CYP9A11 and cytochrome P450 reductase gene in the beet armyworm(Lepidoptera:Noctuidae)[J]. J Insect Sci, 2015, 15(1):122, doi:10.1093/jisesa/iev100. |
| [13] | GILSON M K, GIVEN J A, BUSH B L, et al. The statistical-thermodynamic basis for computation of binding affinities:a critical review[J]. Biophys J, 1997, 72(3):1047-1069. |
| [14] | REINIKAINEN T L, RUOHONEN L, NEVANEN T, et al. Investiigation of the function of mutated cellulose-binding, domains of Trichoderma reesei cellobiohydrolase[J]. Proteins:Structure, Function and Genetics, 1992, 14(4):475-482. |
| [15] | MORRIS G M, HUEY R, LINDSTROM W, et al. AutoDock4 and AutoDockTools4:automated docking with selective receptor flexibility[J]. J Comput Chem, 2009, 30(16):2785-2791. |
| [16] | ZHANG Y, PAN D B, SHEN Y L, et al. Understanding the molecular mechanism of the broad and potent neutralization of HIV-1 by antibody VRC01 from the perspective of molecular dynamics simulation and binding free energy calculations[J]. J Mol Model, 2012, 18(9):4517-4527. |
| [17] | 王海燕, 曾艳丽, 孟令鹏, 等. 有关氢键理论研究的现状及前景[J]. 河北师范大学学报(自然科学版), 2005, 29(2):177-181.WANG H Y, ZENG Y L, MENG L P, et al. The present studies and prospect on hydrogen bond[J]. J Hebei Normal Univ(Nat Sci Ed), 2005, 29(2):177-181. |
| [18] | 李红亮, 张林雅, 庄树林, 等. 中华蜜蜂普通气味结合蛋白ASP2的气味结合功能模式分析[J]. 中国农业科学, 2013, 46(1):154-161.LI H L, ZHANG Y Y, ZHUANG S L, et al. Interpretation of odorant binding function and mode of general odorant binding protein ASP2 in Chinese Honeybee(Apis cerana cerana)[J]. Scientia Agricultura Sinica, 2013, 46(1):154-161. |
| [19] | GUANG C E, SHANG J G, JIANG B. Transport of traditional Chinese pimple milk-derived angiotensin-converting enzyme(ACE) inhibitory peptides across a Caco-2 cell monolayer and their molecular recognition with ACE[J]. J Food Agric Environ, 2012, 10(3&4):40-44. |
| [20] | 时术华, 张少龙, 张庆刚. MDM2与抑制剂PDIQ作用机制的结合自由能计算研究[J]. 原子与分子物理学报, 2014, 31(4):618-623.SHI S H, ZHANG S L, ZHANG Q G. Binding free energy insight into interaction mechanism of inhibitor PDIQ with MDM2[J]. J Atom Mol Phys, 2014, 31(4):618-623. |
| [21] | BAUTISTA M A M, TANAKA T, MIYATA T. Identification of permethrin-inducible cytochrome P450s from the diamondback moth, Plutella xylostella(L.) and the possibility of involvement in permethrin resistance[J]. Pestic Biochem Physiol, 2007, 87(1):85-93. |
| [22] | YANG Y, CHEN S, WU S, et al. Constitutive overexpression of multiple cytochrome P450 genes associated with pyrethroid resistance in Helicoverpa armigera[J]. J Econ Entomol, 2006, 99(5):1784-1789. |
| [23] | FEYEREISEN R. Insect CYP genes and P450 enzymes[M]//Gilbert L I. Insect molecular biology and biochemistry. Oxford:Elsevier, 2012:236-316. |
| [24] | SCBARF M E, PARIMI S, MEINKE L J, et al. Expression and induction of three family 4 cytochrome P450(CYP4) genes identified from insecticide-resistant and susceptible western corn rootworms, Diabrotica virgifera[J]. Insect Mol Biol, 2001, 10(2):139-146. |
| [25] | CHONG L T, DUAN Y, WANG L, et al. Molecular dynamics and free-energy calculations applied to affinity maturation in antibody 48G7[J]. Proc Natl Acad Sci USA, 1999, 96(25):14330-14335. |
| [26] | NOVOTNY J, BRUCCOLERI R E, DAVIS M, et al. Empirical free energy calculations:a blind test and further improvements to the method[J]. J Mol Biol, 1997, 268(2):401-411. |
 2016, Vol. 18
2016, Vol. 18


