2. 重庆大学 生物工程学院, 重庆 400044
2. College of Bioengineering, Chongqing University, Chongqing 400044, China
农药在保证农业稳产、高产,满足人们对农副产品的需求等方面发挥着不可替代的作用,但同时,因不规范使用而导致的农作物、土壤、水和大气中农药残留量超标问题,对生态环境、农产品安全及人畜健康产生了较大的隐患,因此加强农药残留检测的必要性已越来越受到人们的重视。
目前关于农药残留检测的研究主要集中在前处理技术和快速灵敏检测技术开发两方面。有效的前处理技术能够很好地富集待测成分,去除杂质,以保证后续检测的准确性。目前较为普及的农药残留检测方法主要有色谱法[1]、免疫法[2]及传感器法[3, 4]等,其中色谱方法存在仪器设备昂贵、检测时间长、操作复杂等缺点,难以达到小型化、实时、快速的现场检测要求;免疫学方法需要制备特异性抗体,实验周期长,且其生物活性因受多种因素影响而易于失活,不适合工业化生产;采用传感器方法检测农药残留时大多利用生物分子(如抗体、酶等)作为识别元件,存在分析结果不稳定、重现性差和使用寿命短等问题。
在农药残留实际测定中,复杂样品基质中可能含有数百种自然存在的干扰物质,并且其浓度常常比待测农药要高出很多倍。而传统的分离富集方法不能有效地选择性分离富集目标化合物,因而会影响后续分析方法的灵敏度。由于分子印迹聚合物(molecular imprinted polymers,MIPs)对模板分子具有极强的特异选择性,使其在前处理方面具有了很高的应用价值[5],主要体现在用于分离技术和固相萃取技术两方面,特别是分子印迹固相萃取技术,由于其既弥补了传统方法选择性差、专一性不强等缺点,又保留了原有的操作简单、省时省力等优点,因而得到了广泛的应用。通过MIPs对农药残留检测样品进行前处理,可实现对待测组分的高效富集,将其与仪器(色谱或色谱-质谱联用)检测技术相结合,则可大大提高检测方法的准确度和精密度,降低仪器的检出限。而近年来发展起来的以MIPs为识别元件,结合不同种类转换器[6, 7, 8, 9]制得的分子印迹传感器(molecular imprinted polymer sensors)既具有生物传感器的专一识别性,同时又具有化学传感器的机械稳定性及热稳定性[10],因而在农药残留检测领域显示出了广阔的应用前景。本文拟从原理和方法两方面就分子印迹传感技术与电化学、光学以及质量敏感技术联用在农药残留检测领域的研究应用进展进行综述,以期为该技术在相关领域更好地实现产业转化提供参考。
1 分子印迹聚合物传感器的原理及主要合成方法以分子印迹聚合物(MIPs)作为敏感材料的传感器被称为MIPs传感器,其工作原理是:模板分子经扩散进入敏感层,与MIPs上的印迹位点发生特异性结合,经过换能器将敏感识别膜上感知到的信号转换成可记录的信号(如电位变化、电流变化、荧光强度变化、频率变化和吸光度变化等),从而完成传感器的传感过程(如图 1所示)。分子印迹传感器的实质是将分子印迹技术所特有的高选择性与各种传感技术相结合,将待分析的模板分子、用作识别器件的分子印迹传感膜以及换能器之间通过化学、生物或物理作用联系在一起,从而实现对目标化合物的快速、高效检测。由于其中的模板分子与印迹孔穴之间通常存在氢键、疏水作用及静电引力等分子间作用力,所以多数目标化合物都能被用作模板分子来制备相应的分子印迹传感器。通过分子印迹传感技术专一性地检测目前农业生产中广泛使用的有机氯类、有机磷类、拟除虫菊酯类及氨基甲酸酯类杀虫剂,各类除草剂以及植物生长调节剂等主要种类的农药,在近年来已有较多报道[11, 12]。
 | 图 1 分子印迹传感器的传感原理 Fig. 1 The principle of molecular imprinted sensor |
MIPs的合成方法有很多种,如本体聚合法、原位聚合法、悬浮聚合法、沉淀聚合法、表面聚合法以及分子印迹膜法等等[13]。目前运用于传感器制备方面的主要有本体聚合法[14]、印迹膜法[15]和原位聚合法[16]。
早期的相关研究多采用本体聚合法,所制备的印迹材料呈块状,使用时再研磨成细末,然后涂于转换器表面(如光纤、电极、石英晶体等)。采用该方法得到的MIPs产物纯度高,制备工序简单,但通常存在后处理过程繁杂等缺点,且研磨过程中不可避免地会产生一些不规则粒子和大量的过细粒子,这些过细粒子需经过沉降除去,因此费时费力,并使得产量大大降低。此外,由于印迹点在合成过程中被包埋于聚合物内部,因而使得其利用率低,表现为吸附量较低。印迹膜法是在转换器表面直接聚合一层分子印迹膜,检测时通过测定印迹材料物化参数的变化幅度来判断所结合的农药分子的量,该方法结合了分子印迹技术和膜分离技术的优点,具有操作简便、耗能低、反应时间短以及干净无污染等特点,同时还具有很高的稳定性和机械强度,对目标分子也具有较高的渗透选择性和特异性识别能力。原位聚合法通过在色谱柱中注入反应物,直接聚合成具有连续性及均一性的棒状色谱固定相,可特异性吸附农药分子,主要适用于色谱分析。
2 分子印迹聚合物传感器在农药残留检测领域的应用由于MIPs自身的特性,使得MIPs传感器具有良好的选择性、稳定性及灵敏度,耐酸、碱及压力,并可多次重复使用,因此在传感器领域备受关注。
2.1 MIPs电化学传感器此类传感器主要由电信号转换装置和分子印迹敏感材料组成,将MIPs引入到电化学检测系统中,当其与待测农药分子结合后,会导致电极的电信号发生改变,信号转换装置再将这种改变转化为可处理的电信号,从而实现对待测物的检测。
胡文英等[17]将叶蝉散(isoprocarb)MIPs自组装至玻碳电极上,制得可用于叶蝉散残留量检测的MIPs电化学传感器。试验表明,采用差分脉冲伏安法,以铁氰化钾和氯化钾的混合溶液作为底液,该分子印迹传感器的线性范围为0~3.3×10-4 mol/L。利用所制得的MIPs电化学传感器测定水果中残留的叶蝉散,检出限为5.43×10-11 mol/L,灵敏度和识别性均较高。Uygun等[18]将吡咯与毒死蜱(chlorpyrifos)共同作为模板分子,在铅笔石墨电极上通过电化学聚合法制备了毒死蜱分子印迹膜,制得一种可检测毒死蜱残留的新型阻抗传感器。在所选条件下,该传感器的线性范围为5.70×10-8~8.56×10-7 mol/L,检出限为1.28×10-8 mol/L,具有一次性、低消耗以及高选择性和高灵敏度等特点。Toro等[19]通过分子建模的方法从甲基丙烯酸(MAA)、2-乙烯基吡啶(2-VP)和丙烯酰胺(AM)中筛选出2-VP作为环嗪酮(hexazinone)MIPs的功能单体,将该MIPs修饰至碳糊电极表面,采用微分脉冲吸附阴极溶出伏安法(DPAdCSV)进行检测,得该传感器的线性范围为1.9×10-11~1.1×10-10 mol/L,检测限为2.6×10-12 mol/L,且对河水样品的检测效果良好。
Li等[11]曾提出一种基于电子放大的、可大幅提高分子印迹传感器灵敏度的方法,其原理如图 2所示。以农业生产中经常喷洒的植物激素3-吲哚乙酸(IAA)作为模板分子,经过3-吲哚乙酸与硫醇化3-吲哚乙酸(IAA-S)的竞争性反应后,IAA-S被银纳米粒子标记,然后再经铜催化,以减少聚集在银纳米粒子表面的沉积物;铜经电化学反应被溶解,待阳极溶出后通过线扫描伏安法测定。结果表明,当IAA浓度为9.0×10-10~6.0×10-7 mol/L时,峰值电流与IAA浓度的对数呈正相关性,其检测限可达2.31×10-10 mol/L,显著提升了灵敏度。Fu等[20]研究建立了采用多重标记模板分子以提高分子印迹电化学传感器灵敏度的方法,通过被修饰有大量二茂铁甲酸的树枝状大分子标记的赤霉素与样品中的赤霉素分子之间的竞争反应来进行定量测定。该方法由于实现了二茂铁甲酸的多重标记,故其可测量的电信号得到了明显放大,灵敏度显著提高,线性范围为2.0×10-9~1.0×10-7 mol/L,检出限达9.3×10-10 mol/L。
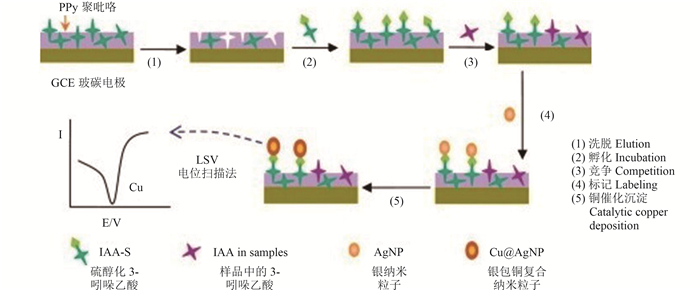 | 图 2 3-吲哚乙酸的分子印迹电化学传感器机理图[11] Fig. 2 Schematic diagram of the preparation principle of the IAA molecularly imprinted electrochemical sensor[11] |
Zhao等[12]将分子印迹聚合物-离子水-石墨烯(MIPs-IL-EGN)复合材料膜组装在玻碳电极上,制备了可检测甲基对硫磷(parathion-methyl)残留的电化学传感器,该MIPs以MAA为功能单体,二甲基丙烯酸乙二醇酯(EGDMA)为交联剂,以偶氮二异丁氰为引发剂,通过自由基引发集合。该传感器的线性范围为1.0×10-8~7.0×10-6 mol/L,检测限可达6.0×10-9 mol/L,并展示出了较好的选择性和稳定性,可用于实际样品检测,且回收率在97%~110%之间。Li等[21]将用酶标记的农药引入到分子印迹电化学发光传感器(MIP-ECL)中,通过异丙隆(isoproturon,IPU)和被葡萄糖氧化酶标记的异丙隆(GOD-IPU)之间的竞争反应来提高传感器的灵敏度,其原理如图 3所示。竞争反应结束后剩余的GOD-IPU会产生过氧化氢,其与鲁米洛反应发出ECL信号,竞争反应中GOD-IPU被取代越多,ECL信号强度就越弱。该传感器的灵敏度大幅提高,线性范围为9.0×10-11~5.1×10-9 mol/L,检测限可达3.78×10-12 mol/L。
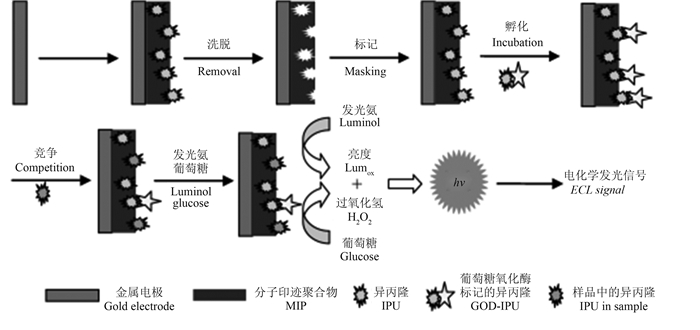 | 图 3 分子印迹电化学发光 (MIP-ECL) 传感器的合成及用于检测异丙隆的原理[21] Fig. 3 The procedure to construct MIP-ECL sensor and determine IPU[21] |
在MIPs电化学传感器的研究中,为了增强稳定性和提高灵敏度,碳纳米管、石墨烯、纳米金属等多种材料或其复合材料正陆续被运用到传感器合成中,相信集中多种功能材料的优势必将为此类传感器的高效优质生产及实现商业化奠定基础。
2.2 MIPs光学传感器 2.2.1 MIPs光化学传感器常见的MIPs光化学传感器主要有两种:MIPs荧光化学传感器和MIPs化学发光传感器。其中,MIPs荧光化学传感器的原理是当MIPs荧光膜与待测物质结合时,其荧光信号会发生改变,根据荧光信号的改变量可测得待测物的含量。化学发光法(chemiluminescent,CL)主要是通过在化学反应过程中某些物质(反应物、中间体或者荧光物质)吸收反应释放的能量后因发生能级跃迁而产生的化学发光现象,从而完成对待测物的检测。CL仪器设备简单且灵敏度高,但本身的选择性较差,将MIPs引入CL中则可使其在保持原有优点的同时兼具良好的选择性,因而可用于复杂样品的分析。
Liu等[22]以高效氯氟氰菊酯(lambda-cyhalothrin)为模板分子,MAA为功能单体,EGDMA为交联剂,通过沉淀聚合的方式使模板分子在钒酸钇(YVO4)-Eu3+纳米粒子表面聚合,制得一种可以特异性检测高效氯氟氰菊酯的新型传感器。其中的镧系元素铕(Eu)是一种发光元素,Eu3+与待测物结合后其荧光光谱会发生改变,从而使得纳米粒子表面的MIPs可以特异性识别模板分子。该荧光传感器的线性范围为2.0~10.0和10.0~90.0 μmol/L,检测限可达1.76 μmol/L,并且适用于实际样品中的高效氯氟氰菊酯残留量检测。Sun等[23]通过接枝的方式将以甲基对硫磷为模板的MIPs成功聚合到核-壳结构的量子点CdSe@SiO2表面,当MIPs重新吸附模板分子时其荧光强度会急剧降低,从而根据荧光强度的猝灭量可测得MIPs吸附的模板分子的量。该荧光传感器的线性范围为0.013~2.63 mg/kg,检出限为0.004 mg/kg,远低于传统MIPs的检测限,在实际蔬菜样品中甲基对硫磷残留检测方面展现了良好的适用性。
Ge等[24]首先制备了CdTe量子点并采用沉淀聚合法制备了以溴氰菊酯(deltamethrin)为模板分子,AM为功能单体,EGDMA为交联剂的MIPs,之后采用层层自组装的方法,先在形状类似96孔微孔板底部的载玻板上用CdTe量子点改性,然后再进一步采用MIPs改性,得到了可检测溴氰菊酯残留的化学发光传感器。该传感器的线性范围为1.05×10-7~9.20×10-5 mol/L,检出限为3.56×10-8 mol/L,在实际样品检测中表现出色。Xie等[25]通过沉淀聚合法制备了甲基噻吩磺隆(thifensulfuron- methyl,TFM)的MIPs,其以AM为功能单体,EGDMA为交联剂。该MIPs可以特异性吸附TFM,而被吸附的TFM可显著提高发光氨和过氧化氢之间的化学发光作用。基于此原理,他们设计了一种新型MIPs光化学传感器,可用于检测TFM残留。当TFM浓度在1.0×10-9~5.0×10-5 mol/L范围内时,药剂浓度对数与化学发光强度的对数呈正比例关系,检出限为8.3×10-10 mol/L。试验证明,该传感器可逆且可重复利用,并提高了化学发光分析的选择性和灵敏度。Zhao等[26]以草甘膦(glyphosate)为模板,通过沉淀聚合法制备得到尺寸小但比表面积很大的MIPs微球,将该微球置于玻璃片上进行改性,并将玻璃片放置在器皿底部作为识别器,制得高选择性和高流量的化学发光传感器,其原理如图 4所示。该传感器可在10 min内连续完成96组独立的检测,检测限为2.72×10-7 mol/L,相对标准偏差为4.68%,充分展示了MIPs光化学传感器在农药残留快速检测方面的广阔应用前景。
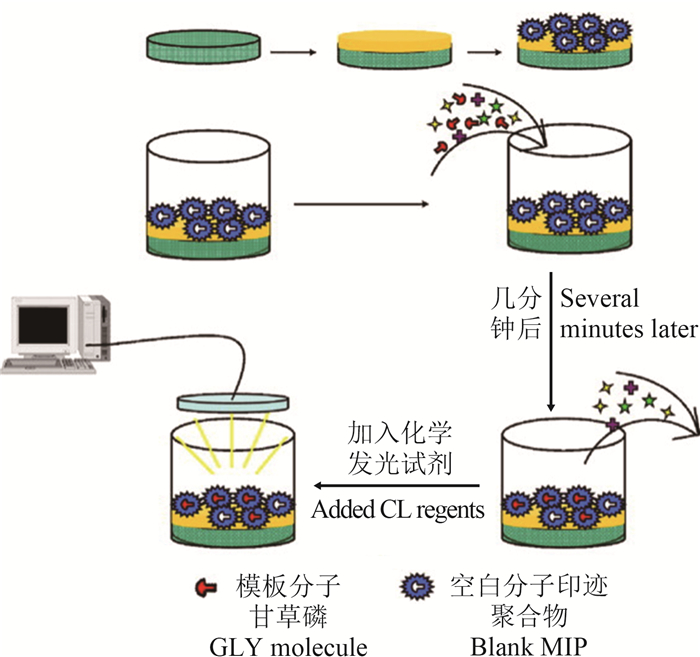 | 图 4 草甘膦的 MIPs 化学发光传感器原理图[26] Fig. 4 The schematic representation of the chemiluminescence-molecular imprinting sensor for the selective recognition of glyphosate[26] |
表面等离子共振(surface plasmon resonance,SPR)是用于表征表面折射系数改变情况的光学技术。当一束偏振光在一定的角度范围内入射到棱镜端面时,在棱镜与金属薄膜(Au或Ag)的界面将产生表面等离子波。结合分子印迹技术,先在传感芯片表面固定一层分子印迹识别膜,当待测样品流过芯片表面时,若样品中含有能够被芯片表面分子印迹膜识别的分子,将使得金属薄膜表面折射率发生变化,最终导致SPR角发生变化,通过检测该角度的变化而获得被测物的浓度、亲和力及特异性等信息。此类传感器可称为分子印迹SPR传感器。
Zhang等[27]采用聚氯乙烯分子印迹(PVC-MIP)共聚膜法制备了适用于SPR分析仪的分子印迹芯片,其SPR角度扫描结果表明,厚度在200 nm以下的芯片具有较好的SPR吸收特性。他们还对0.1、0.2、0.5和1 μg/mL系列质量浓度的氯磺隆(chlorsulfuron)进行了SPR定点检测,发现在这4个浓度下,氯磺隆的折射率响应信号满足线性关系,其相关系数r=0.996 4。试验中对低浓度的氯磺隆反复进行了检测,检测限为50 ng/mL,满足农药残留检测的要求。Yao等[28]提出了通过磁性分子印迹纳米粒子放大SPR响应来提高分子印迹SPR传感器检测灵敏度的方法,该磁性分子印迹纳米粒子通过自组装的方式,在弱碱水溶液中使模板分子毒死稗和多巴胺聚合在Fe3O4纳米粒子表面制得。该传感器的线性范围为0.001~10 μmol/L,检测限为0.76 nmol/L。该方法明显提高了分子印迹SPR传感器的灵敏度,同时该纳米粒子对毒死蜱还有着非常高的识别度。
分子印迹光子晶体凝胶(molecularly imprinted photonic polymer,MIPP)传感器是以光子晶体技术和分子印迹技术为基础发展起来的传感器,具有自表达能力及无需标记、快速响应和高度普适等优点,并且可直接把对目标分子特异性识别的化学信号转化为可读的光信号,从而实现肉眼识别。Wu等[29]以莠去津(atrazine)为模板分子制备了MIPP传感器,并探究了其响应情况。结果发现:当磷酸缓冲液中莠去津浓度在10-12~10-6 mol/L范围内时,随着目标物浓度的升高,薄膜颜色从蓝色逐渐转变成红色,据此可对待测液中目标物的浓度进行半定量分析。采用与莠去津具有相似分子结构的莠灭净(ametryn)和扑草净(prometryn)为竞争吸附物,考察了该印迹凝胶的特异性吸附性能,发现其衍射峰的位置几乎不变,证实其具备高度特异性。该传感器对莠去津的检测限可达10-16 mol/L,响应时间约为20 s。
在MIPs光学传感器研究领域,荧光化学传感器和化学发光传感器在目前的研究应用中比较常见。为了增强传感器的灵敏度,拓展多种待测物同时检测的实际应用,设计合成新型荧光单体和采用MIPs的传感器阵列进行检测将成为研究的热点。
2.3 MIPs质量敏感型传感器石英晶体微天平(QCM)是一种质量敏感原件,待测物质量增加会使其谐振频率降低,通过检测该频率的变化即可确定QCM表面所吸附的待测物的质量。QCM与MIPs结合就构成了可检测特定分子质量的QCM-MIPs传感器。
Ozkutuk等[30]通过金属螯合作用,在QCM表面合成了以对氧磷(paraoxon)为模板分子的分子印迹膜,从而制得可检测对氧磷残留量的传感器。该传感器的检测限和亲和常数分别为0.06 μmol/L和2.25×104 L/mol,同时证明该传感器对于结构类似的对硫磷的选择性和灵敏度也很高。Yaqub等[31]采用自组装的方式,通过原位聚合法直接在QCM的金属电极上制备MIPs,得到了可特异性检测莠去津残留的QCM-MIPs传感器。该传感器的检测限可达0.97 μmol/L,同时在特异性吸附试验中显示了超过9倍的选择性吸附能力。Gao等[32]将自组装制备的丙溴磷(profenofos)分子印迹膜通过表面引发自由基聚合的方法固定在已经过巯基十一烷酸预处理过的传感器芯片上,制得可特异性检测丙溴磷的QCM-MIPs传感器。检测结果表明,当丙溴磷质量浓度在1.0×10-8~1.0×10-5 mg/mL及1.0×10-5~1.0×10-3 mg/mL范围内时,该传感器均显示出了极好的线性关系,检测限为2.0×10-7 mg/mL。将其用于检测自来水中的丙溴磷,表现出了良好的回收率和可重复性。
在MIPs质量敏感型传感器的研究中,如何设计和改进成膜方法,以获得质量稳定、性能优越的分子印迹膜,对扩大此类传感器的应用领域具有重要意义。此外,为了实现便携化和实时检测,仪器的微型化和智能化也必将越来越被研究者所关注。
3 结语由于残留检测中农药样品通常浓度低、组分复杂而且易发生变化,因此对检测技术的要求也比较高。MIPs具有机械和化学稳定性良好、专一性强、价格低廉等优点,因而在农药残留检测领域受到了广泛的关注。但该技术目前仍存在一些问题,如可供选择的功能单体还比较少,在水溶液或极性溶剂中进行制备和识别仍有难度,传感器灵敏度尚不及生物受体,检测对象基质单一,等等。因此,制备灵敏度更高及可同时用于水相、有机相或更复杂基质中农药残留检测的MIPs将是未来的研究重点。当前备受关注的酶热传感器等生物量热传感器具有通用性强,不受光、电化学物质等干扰因素的影响,能够满足实际样品检测的要求,操作简便,适用于现场检测等优点,但目前生物量热传感器在用于农药残留检测中仍存在酶稳定性差、酶活性易受影响,以及不易回收重复利用等缺点。若将生物量热技术引入到分子印迹传感器中,将二者有效结合,必然会大幅提高分子印迹传感器的检测性能。可以预见,随着印迹技术的发展,分子印迹传感器必将成为农药残留检测领域强有力的手段,在对残留农药的实时、现场、快速检测中发挥重要作用。
| [1] | 王波, 李贤良, 张雷, 等. 气相色谱法测定火锅底料中的多种有机氯农药和拟除虫菊酯农药残留[J]. 分析化学, 2010, 38(10):1433-1438. WANG B, LI X L, ZHANG L, et al. Simultaneous determination of organochlorine and pyrethroid pesticide residues in hotpot condiment by gas chromatography[J]. Chin J Analyt Chem, 2010, 38(10):1433-1438. |
| [2] | WATANABE E, BABA K, EUN H, et al. Application of a commercial immunoassay to the direct determination of insecticide imidacloprid in fruit juices[J]. Food Chem, 2007, 102(3):745-750. |
| [3] | MARCH C, MANCLúS J J, JIMÉNEZ Y, et al. A piezoelectric immunosensor for the determination of pesticide residues and metabolites in fruit juices[J]. Talanta, 2009, 78(3):827-833. |
| [4] | LONG F, SHI H C, HE M, et al. Sensitive and rapid detection of 2, 4-dicholorophenoxyacetic acid in water samples by using evanescent wave all-fiber immunosensor[J]. Biosen Bioelectr, 2008, 23(9):1361-1366. |
| [5] | HOGENDOORN E, VAN ZOONEN P. Recent and future developments of liquid chromatography in pesticide trace analysis[J]. J Chromatogr A, 2000, 892(1-2):435-453. |
| [6] | BAKKER E, QIN Y. Electrochemical sensors[J]. Anal Chem, 2006, 78(12):3965-3984. |
| [7] | WOLFBEIS O S. Fiber-optic chemical sensors and biosensors[J]. Anal Chem, 2006, 78(12):3859-3874. |
| [8] | 张连明, 李建平, 潘宏程. 基于门控制电催化效应的分子印迹传感器[J]. 分析化学, 2012, 40(7):1025-1030. ZHANG L M, LI J P, PAN H C. A molecularly imprinting sensor based on gate controlled electro-catalyzation[J]. Chin J Anal Chem, 2012, 40(7):1025-1030. |
| [9] | 易娜, 张教强, 史长明, 等. 分子印迹传感器的研究进展[J]. 材料开发与应用, 2013(1):117-124. YI N, ZHANG J Q, SHI C M, et al. Research progress of sensor based molecularly imprinted polymers[J]. Develop Appl Mater, 2013(1):117-124. |
| [10] | BLANCO-LÓPEZ M C, LOBO-CASTAÑÓN M J, MIRANDA-ORDIERES A J, et al. Electrochemical sensors based on molecularly imprinted polymers[J]. TrAC Trend Anal Chem, 2004, 23(1):36-48. |
| [11] | LI J P, YIN W L, TAN Y J, et al. A sensitive electrochemical molecularly imprinted sensor based on catalytic amplification by silver nanoparticles for 3-indoleacetic acid determination[J]. Sensor Actuat B:Chem, 2014, 197:109-115. |
| [12] | ZHAO L J, ZHAO F Q, ZENG B Z. Electrochemical determination of methyl parathion using a molecularly imprinted polymer-ionic liquid-graphene composite film coated electrode[J]. Sensor Actuat B:Chem, 2013, 176:818-824. |
| [13] | DAI J D, PAN J M, XU L C, et al. Preparation of molecularly imprinted nanoparticles with superparamagnetic susceptibility through atom transfer radical emulsion polymerization for the selective recognition of tetracycline from aqueous medium[J]. J Hazard Mater, 2012, 205-206:179-188. |
| [14] | LUO C H, LIU M Q, MO Y C, et al. Thickness-shear mode acoustic sensor for atrazine using molecularly imprinted polymer as recognition element[J]. Anal Chim Acta, 2001, 428(1):143-148. |
| [15] | MARX S, ZALTSMAN A, TURYAN I, et al. Parathion sensor based on molecularly imprinted sol-gel films[J]. Anal Chem, 2004, 76(1):120-126. |
| [16] | ULUDAĞ Y, PILETSKY S A, TURNER A P F, et al. Piezoelectric sensors based on molecular imprinted polymers for detection of low molecular mass analytes[J]. FEBS J, 2007, 274(21):5471-5480. |
| [17] | 胡文英, 黄建辉. 叶蝉散分子印迹电化学传感器制备及其性能研究[J]. 山西大学学报(自然科学版), 2014, 37(3):415-419. HU W Y, HUANG J H. Preparation and performance characterization study on asoprocarb molecular imprinting electrochemical sensor[J]. J Shanxi Univ(Nat Sci Ed), 2014, 37(3):415-419. |
| [18] | UYGUN Z O, DILGIN Y. A novel impedimetric sensor based on molecularly imprinted polypyrrole modified pencil graphite electrode for trace level determination of chlorpyrifos[J]. Sensor Actuat B:Chem, 2013, 188:78-84. |
| [19] | TORO M J U, MARESTONI L D, SOTOMAYOR M D P T. A new biomimetic sensor based on molecularly imprinted polymers for highly sensitive and selective determination of hexazinone herbicide[J]. Sensor Actuat B:Chem, 2015, 208:299-306. |
| [20] | FU C, LI J P. A molecular-imprinted sensor for trace detection of gibberellin based on ferrocenecarboxylic acid multiply marked dendrimer[J]. Chin J Anal Chem, 2014, 42(3):315-319. |
| [21] | LI S H, TAO H L, LI J P. Molecularly imprinted electrochemical luminescence sensor based on enzymatic amplification for ultratrace isoproturon determination[J]. Electroanalysis, 2012, 24(7):1664-1670. |
| [22] | LIU C B, SONG Z L, PAN J M, et al. A simple and sensitive surface molecularly imprinted polymers based fluorescence sensor for detection of λ-cyhalothrin[J]. Talanta, 2014, 125:14-23. |
| [23] | SUN Q, YAO Q Q, SUN Z L, et al. Determination of parathion-methyl in vegetables by fluorescent-labeled molecular imprinted polymer[J]. Chin J Chem, 2011, 29(10):2134-2140. |
| [24] | GE S G, ZHANG C C, YU F, et al. Layer-by-layer self-assembly CdTe quantum dots and molecularly imprinted polymers modified chemiluminescence sensor for deltamethrin detection[J]. Sensor Actuat B:Chem, 2011, 156(1):222-227. |
| [25] | XIE C G, GAO S, ZHOU H K, et al. Chemiluminescence sensor for sulfonylurea herbicide using molecular imprinted microspheres as recognition element[J]. Luminescence, 2011, 26(4):271-279. |
| [26] | ZHAO P N, YAN M C, ZHANG C C, et al. Determination of glyphosate in foodstuff by one novel chemiluminescence-molecular imprinting sensor[J]. Spectrochim Acta A:Mol Biomol Spectrosc, 2011, 78(5):1482-1486. |
| [27] | ZHANG L L, CUI D F, CAI H Y, et al. Recognition of chlorsulfuron based on SPR sensors with the molecular imprinted polymer[J]. Micronanoelect Technol, 2011, 48(4):254-257. |
 2016, Vol. 18
2016, Vol. 18


