三唑类杀菌剂是一类由咪唑环、羟基(酮基)及取代苄基等构成的广谱、内吸性杀菌剂,多数三唑类杀菌剂具有一个手性中心,属于手性农药,其结构通式见图式 1[1,2]。
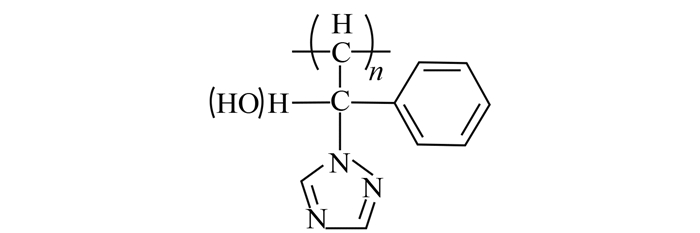 | 图式 1 三唑类杀菌剂的典型结构 Scheme 1 The typical structure of triazole fungicides |
近20年来,三唑类杀菌剂因其高效、低毒的特性而得到了较为广泛的应用,主要用于由锈菌、白粉菌、担子菌、子囊菌、半知菌等引起的动植物真菌病害的防治[3,4],是目前全球第二大杀菌剂品种,常用品种主要有戊唑醇(tebuconazole)、丙环唑(propiconazole)、苯醚甲环唑(difenoconazole)、氟环唑(epoxiconazole)、灭菌唑(triticonazole)、四氟咪唑(tetraconazole)、氟硅唑(flusilazole)和粉唑醇(flutriafol)等(图式 2)[5]。三唑类杀菌剂同时具有保护和治疗作用,为C-14-α-脱甲基化酶抑制剂类(DMIs),对真菌细胞膜的重要组成成分——麦角甾醇的合成有抑制作用,通过增大细胞膜的渗透性而抑制真菌的生长[6,7]。毒理学研究表明,三唑类杀菌剂对人及动物的内分泌激素有干扰作用。如氧唑菌(epoxiconazole)因较难降解、对水生生物高毒以及可诱发人类与激素有关的癌症,已于1997年被欧盟禁用[8];丙环唑、氟环唑和戊唑醇均可干扰雄性激素的分泌[9,10,11,12,13];腈菌唑(myclobutanil)、戊唑醇、苯醚甲环唑、丙环唑、三唑酮(triadimefon)以及三唑醇(triadimenol)均可损伤大鼠肝脏,且丙环唑和三唑酮已被美国环境保护署(EPA)列为“潜在人类致癌物”[14,15,16,17,18,19,20,21,22]。因止,许多国家已将该类杀菌剂中的多数品种列入了环境内分泌干扰物重点监测名单[23,24]。
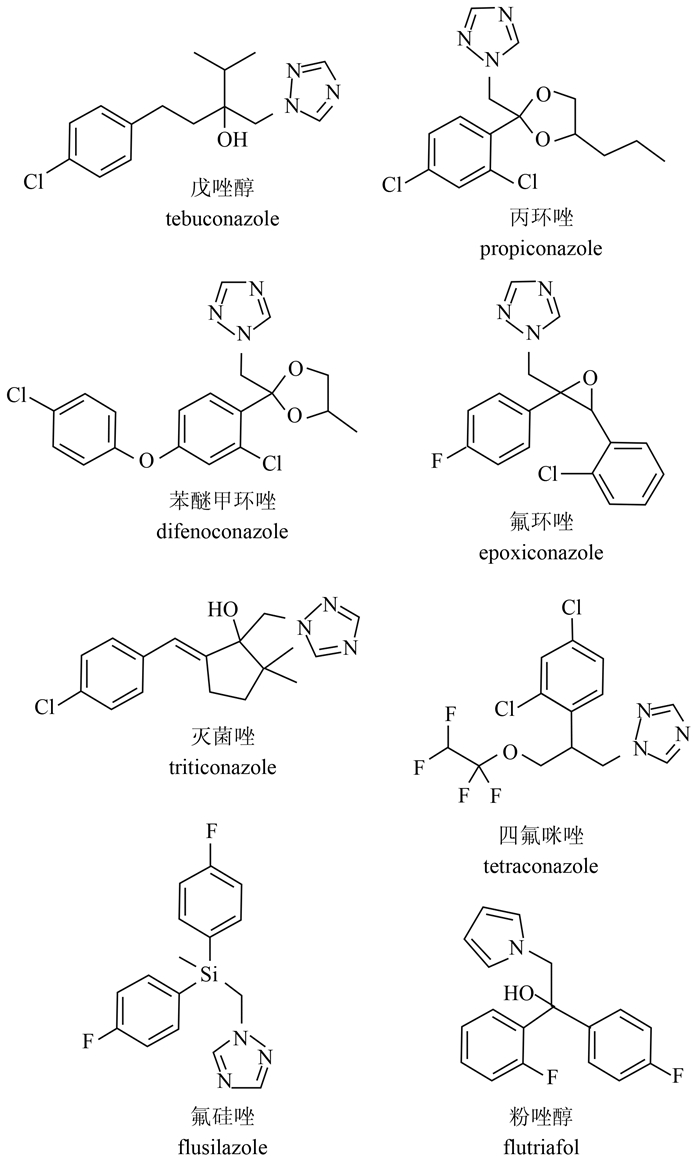 | 图式 2 几种代表性三唑类杀菌剂的结构式 Scheme 2 The structures of several triazole fungicides |
较高的化学及光化学稳定性以及较低的生物降解特性,使得该类杀菌剂在土壤中的残效期较长[25,26]。如在室内(20 ℃)条件下,三唑醇在砂壤土及粉砂壤土中的消解半衰期分别为57和178 d;三唑酮在砂壤土及壤土中的半衰期分别为18和6 d;室内(20 ℃)有氧条件下,腈菌唑的平均半衰期为354 d,田间条件下平均半衰期为23 d;苯醚甲环唑在土壤中的半衰期高达90~365 d;氟环唑的消解半衰期为60~90 d;灭菌唑的室内半衰期为20~80 d,田间为105~268 d;室内(20 ℃)有氧条件下,丙环唑的消解半衰期为29~128 d,田间为5~148 d[27]。如此长的残毒期不仅易污染土壤,而且容易导致环境和食品安全问题,因此对该类化合物污染土壤的修复已引起人们的广泛关注。
土壤修复主要有物理修复、化学修复、植物修复和微生物修复等方式,其中植物修复速度较慢,而微生物因其种类丰富、分布广泛、适应性强和代谢途径多样而在农药污染土壤修复方面显现出了明显的优势,且与物理和化学修复相比,微生物修复因其高效且环境相容性好而越来越受到重视[28]。本文拟从三唑类杀菌剂高效降解菌筛选、微生物代谢途径、降解机理及影响微生物降解的因素等方面对三唑类杀菌剂的微生物降解研究进展进行系统综述,以期为三唑类杀菌剂微生物修复相关研究提供参考。
1 可降解三唑类杀菌剂的微生物微生物同时具有物种、生理和遗传的多样性,可通过分泌各种降解酶类对农药进行降解[29]。其中,细菌、真菌和放线菌是转化和降解农药的主要微生物类群[30,31]。
目前有关戊唑醇降解菌的研究报道较多。Obanda等[32]研究了荧光假单胞菌Pseudomonas fluorescens、哈茨木霉菌Trichoderma harzianum、球毛壳菌Chaetomium globosum、黄孢原毛平革菌Phanerochaete chrysosporium和褐腐菌Meruliporia incrassata对戊唑醇的生物转化及初级代谢产物。结果发现,培养21 d后,褐腐菌、球毛壳菌、哈茨木霉菌和荧光假单胞菌对戊唑醇的降解率分别为40.4%、59.9%、68.2%和70.2%,而黄孢原毛平革菌降解戊唑醇的能力较弱。这与Morrell等[33]的研究一致,即黄孢原毛平革菌不能显著降解三唑类杀菌剂。Sehnem等[34]从被戊唑醇污染的土壤中分离出9个菌群,每个菌群包含50株不同的菌株,并从中筛选出3个对戊唑醇降解活性较高的菌群,进一步分离得到11株能有效降解戊唑醇的细菌,发现其在分类上主要为假单胞菌属、沙雷氏菌属和肠杆菌属,其中菌群TBZ5(包括假单胞菌和沙雷氏菌)对戊唑醇具有较高的降解活性,培养6 d后可将100 mg/L的戊唑醇降解46.48%。Woo等[35]研究发现,木材中的变色栓菌Trametes versicolor对戊唑醇和丙环唑具有降解作用,其中对7.71×105 mg/L的戊唑醇的降解率为54%,对1.39×106 mg/L的丙环唑的降解率为75%;而癞拟层孔菌Fomitopsis palustris对7.71×105 mg/L的戊唑醇的降解率为53%,对丙环唑则没有降解作用。
Sarkar等[13]在有氧条件下从茶树根部分离出了12株恶臭假单胞菌Pseudomonas putida,分别命名为MPR 1~MPR 12,其中4株(MPR 4、MPR 8、MPR 11和MPR 12)能降解丙环唑。在添加葡萄糖的无机盐培养基中培养24 h后,菌株MPR 4、MPR 12、MPR 8和MPR 11对丙环唑的降解率分别为78.2%、67.8%、56.2%和55.9%,其中MPR 4的降解效率最高。李体文等[36]从丙环唑生产车间所排出的原水、厂区内加工车间周围土壤、工厂排污口处污水和污泥4处分别采集样品,从中筛选出了7株可降解丙环唑的细菌(分别命名为BHZ-1、BHZ-2、BHZ-3、BHZ-4、BHZ-5、BHZ-6和BHZ-7),但培养7 d后发现,整体降解效果均不太好,其中降解能力相对较高的3株株菌BHZ-7、BHZ-3及BHZ-2的降解率分别仅为43.6%、31.1%和26.0%。
Chen等[37]分离得到1株能够以多效唑为唯一碳源和能源生长的假单胞菌属(Pseudomonas sp.)细菌,同时发现,混合菌群的降解效率高于单一菌株,48 h内混合菌群对54 mg/L多效唑的降解率达60%。通过对该混合菌群最适降解条件的探究,发现在30 ℃、pH为7时降解率最高;此外,该菌丝在酸性条件下生长缓慢,而在碱性条件下能够正常生长且能有效降解多效唑。Vaz等[38]的研究也表明,假单胞菌属能降解多效唑,加入丙三醇培养14 d后,菌株对多效唑的降解率为43%,28 d后可达70%。郑金伟等[2]从长期生产苯醚甲环唑的农药厂污泥中分离出1株能以苯醚甲环唑为唯一碳源的剑菌属(Ensifer sp.)细菌,并研究了其降解特性,发现在pH为7、30~35 ℃、接种量为3%时,该菌株24 h内对100 mg/L的苯醚甲环唑的降解率最高,可达85%以上。Lopes等[8]从长期施用氧唑菌和唑菌胺酯(pyraclostrobin)的大豆田土壤中分离得到3株细菌(命名为1805、2801和3803),其中菌株1805和3803对氧唑菌和唑菌胺酯的降解能力较强;根据菌株的生物化学和分子特点,鉴定1805属于克雷伯氏菌属(Klebsiella sp.)。Eizuka等[39]从沙壤土中筛选出了对种菌唑(ipconazole)具有降解活性的1株细菌、12株放线菌和7株真菌,发现其中8株放线菌的降解率高达90%,并从中选取降解活性较高的两株放线菌北里孢菌属(Kitasatospora sp.)A1和链霉菌属(Streptomyces sp.)D16,进一步进行了对种菌唑的降解机理研究。
从以上研究报道可看出,目前对于三唑类杀菌剂中降解菌的研究主要涉及戊唑醇、丙环唑、多效唑、苯醚甲环唑、氧唑菌、唑菌胺酯及种菌唑(表 1)。此外,有关三唑类杀菌剂降解菌的研究大多仅限于分离到的可降解某种单一三唑类农药的菌株,而对其底物多样性的研究报道较少,因此,今后应加强对菌株降解底物多样性的研究。
|
| 表 1 三唑类杀菌剂降解菌 Table 1 Degrading bacteria of triazole fungicides |
三唑类杀菌剂可通过水解、光解、微生物降解、植物降解及动物转化等方式发生氧化、还原、羟基化、酰基化、环裂解、脱卤化物等反应,从而被降解为无毒或毒性较低的化合物并最终降解为二氧化碳。其中土壤微生物降解因具有效率高、绿色、环保等特点而成为了研究的热点。微生物对土壤中农药的降解主要是酶促反应[40],包括氧化、还原、脱卤和烷基化等反应[41]。
氧化是微生物降解三唑类杀菌剂的重要方式。Eizuka等[39]发现,放线菌北里孢菌属A1菌株和链霉菌属D16菌株对种菌唑的降解主要是氧化其异丙基上甲基部分的碳原子以及环戊烷上亚甲基部分的碳原子(图式 3 A)。Obanda等[42]研究发现,土壤中哈茨木霉菌对戊唑醇的主要降解途径为使其三唑环裂解,以及使叔丁基部分发生氧化反应,其氧化产物再进一步酰基化形成酯,从而将戊唑醇降解为无毒产物。已有研究表明,霉菌降解戊唑醇时首先发生氧化反应,且戊唑醇在氧化的初始阶段发生了单加氧反应;此外,Strickland等[43]的研究表明,单加氧反应发生在戊唑醇氧化的初始阶段。Obanda等[32]发现,三唑环裂解是微生物降解戊唑醇的主要途径,其中大多数反应为氧化戊唑醇形成羟基,再进一步氧化形成戊唑醇的羧酸类似物,而哈茨木霉则是将戊唑醇叔丁基上的羟基乙酰化形成酯(图式 3 B)。
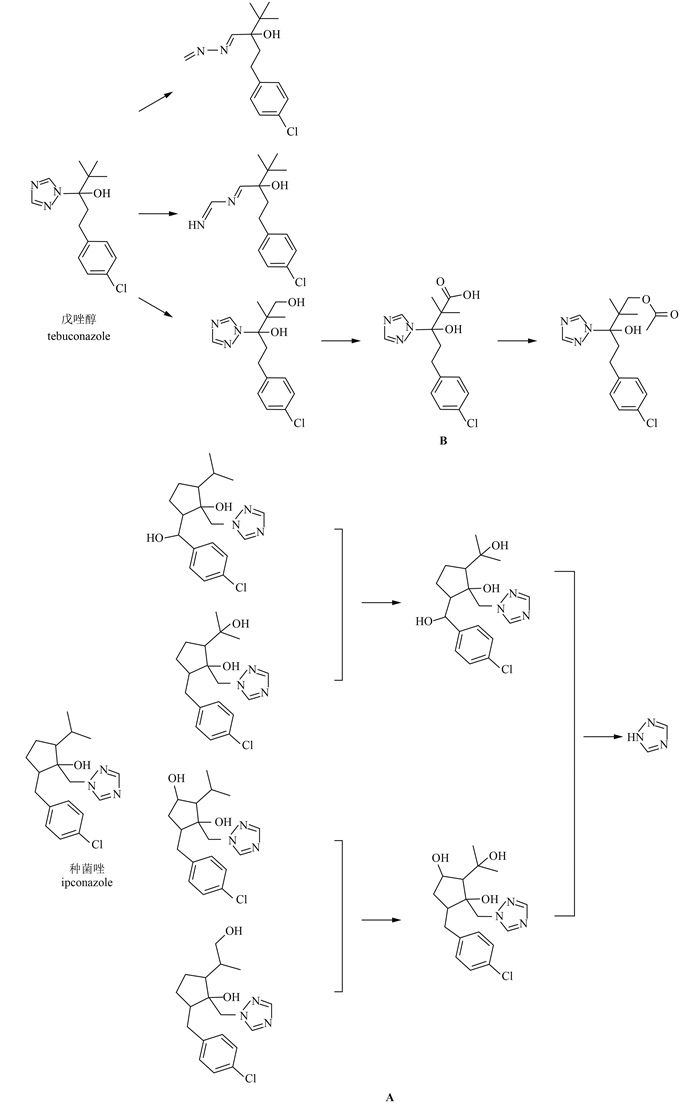 | 图式 3 种菌唑(A)[39]和戊唑醇(B)[33]的微生物降解途径 Scheme 3 The biodegradation pathway of ipconazole(A)[39] and tebuconazole(B)[33] |
羟基化是微生物降解三唑类杀菌剂的另一重要途径。Strickland等[43]在研究砂壤土中戊唑醇的微生物降解过程中鉴定出了4种代谢产物,其均为母体羟基化或氯苯基环断裂的产物。在土壤微生物作用下,抑霉唑的烯丙基键断裂形成1-[2(2,4-二氯苯基)-2-羟乙基]-1H-抑霉唑(图式 4 A)[44]1061-1063;而土壤中丙环唑的主要代谢途径是丙基侧链的羟基化,进一步降解形成1,2,4-三唑环(图式 4 B)[44]1080-1084。
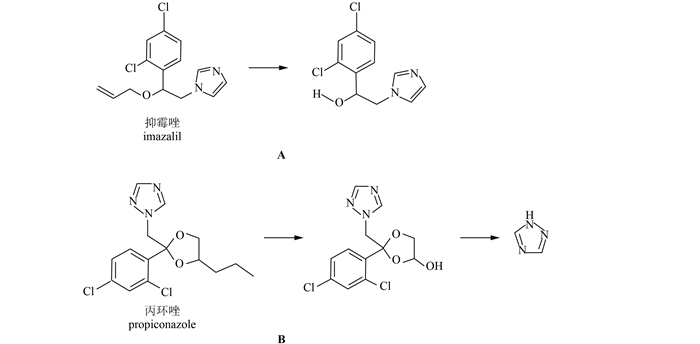 | 图式 4 抑霉唑(A)和丙环唑(B)的微生物降解途径[44] Scheme 4 The biodegradation pathway of imazalil(A)and propiconazole(B)[44] |
此外,微生物对三唑类杀菌剂的降解还涉及脱卤及还原等反应。Roberts等[44]研究发现:糠菌唑(bromuconazole)在土壤中的降解途径为含氧杂环上脱去Br原子并形成双键,进一步降解使双键断裂形成羟基(图式 5 A)[44]1025-1030;而土壤中氟硅唑的主要降解途径是硅甲基键断裂形成二(4-氟苯基)甲基硅醇和1H-1,2,4-苯三唑(图式5 B),只有很少一部分再经过降解和矿化作用最终形成二氧化碳[44]1050-1054;有氧条件下,微生物对土壤中腈菌唑的降解是使其三唑环断裂[44]1069-1070;三唑酮的羧基在土壤微生物作用下被还原成羟基,形成三唑醇,在真菌菌丝体中则形成三唑醇和比三唑醇少一个叔丁基基团的化合物,推测可能是叔丁基甲基化的产物[44]1090-1094。Sarkar等[13]在分析从茶树根际分离的细菌时发现,其在含葡萄糖的培养基中对丙环唑的降解速率较快,推测可能是由于共代谢的结果。Singh等[45]研究发现,在不同含氧条件下,土壤中微生物对三唑酮的降解机制有所不同:在未淹水(有氧条件)土壤中,三唑酮被降解为三唑醇,而在淹水(无氧条件)则其代谢物为二醇衍生物(图式 5 C)。
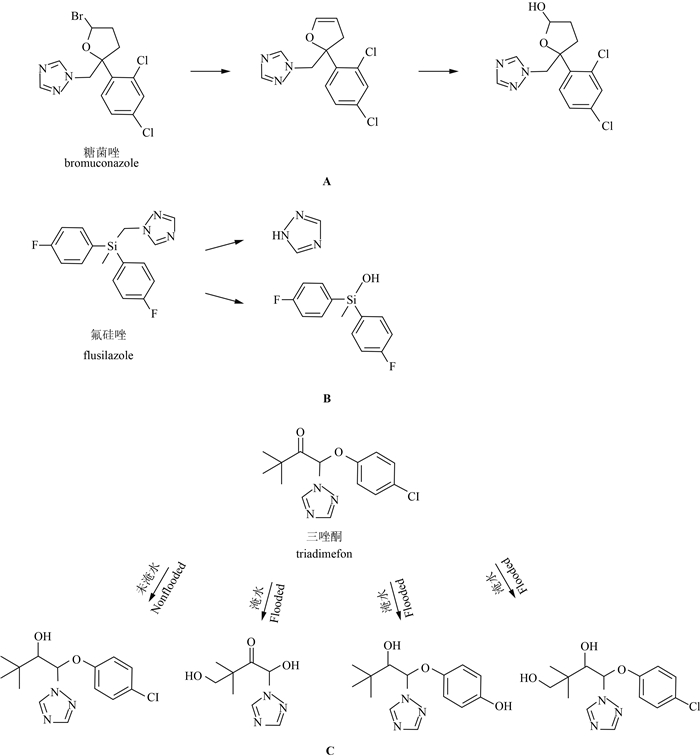 | 图式 5 糠菌唑(A)[44]、氟硅唑(B)[44]以及三唑酮(C)[45]的微生物降解途径 Scheme 5 The biodegradation pathway of bromuconazole(A)[44],flusilazole(B)[44] and triadimefon(C)[45] |
除此之外,因多数三唑类杀菌剂具有手性,因此也有研究人员对三唑类中手性杀菌剂的对映体选择性降解进行了研究。Dong等[1,2]发现,腈菌唑在土壤中的降解是(+)-腈菌唑优先降解,从而导致(-)-腈菌唑的积累。Clark等[46]以三唑醇对映体种衣剂处理大麦,49 d后测定其根区土壤发现,44%的RS体转化成了RR体,24%的SR体则转化成了17%的SS体和7%的RR体。Buerge等[47]开展了氟环唑和环唑醇(cyproconazole)对映体在不同类型土壤中降解速率差异的研究,发现氟环唑对映体在碱性和弱酸性土壤中均存在选择性降解,而在酸性土壤中则不存在选择性降解。
土壤中手性三唑类杀菌剂的对映体选择性降解可能与其中的微生物有关[2],但关于土壤中的微生物是否确实对该类杀菌剂产生了对映体选择性降解、究竟是何种微生物起的作用、以及微生物对该类杀菌剂的选择性降解机理等方面目前均尚不清楚。微生物对三唑类杀菌剂的降解可能是由其体内某个关键酶或基因控制的。Gianfreda等[31]指出,细胞可通过氧化还原酶或水解酶等胞内或胞外酶催化降解异型物质。Lopes等[8]认为,克雷伯氏菌属对氧唑菌的降解可能是由其体内的水解酶调控的,但并未就起调控作用的具体酶作进一步研究。研究人员发现,微生物对农药的降解能力可能与其质粒上某些基因的表达有关[48,49],这与缺陷假单胞菌Pseudomonas diminuta降解马拉硫磷以及假单胞菌降解莠去津的研究结论一致,即去除质粒后其与降解农药有关的基因也随之丢失[50,51]。
综上所述,关于三唑类杀菌剂的微生物降解途径、微生物对三唑类杀菌剂的对映体选择性降解以及降解过程中起关键作用的酶或基因等有关降解机理方面的研究均有待进一步加强。
3 影响微生物对三唑类杀菌剂降解的因素微生物降解三唑类杀菌剂的过程比较复杂,涉及的影响因素也较多,除微生物自身外,温度、湿度、pH值、含氧量及土壤类型等环境因素均会影响微生物对土壤中农药的降解速率[52]。
3.1 温度和湿度微生物降解农药的反应多数为酶促反应,因此受温度的影响较大。Taylor等[53]研究发现,温度和湿度是影响土壤中农药降解的两大主要因素。温度的影响主要是通过控制微生物的酶促反应速率从而影响其对农药的降解速率,在一定的温度范围内,温度较高时有利于微生物的降解行为。郑金伟等[2]在对降解苯醚甲环唑的剑菌属菌株B2的研究中发现,该菌株在较高或较低温度下对苯醚甲环唑的降解效果均较差,超过45 ℃几乎不降解,而在30~35 ℃时则对苯醚甲环唑降解效果最好。Singh等[54]研究发现,己唑醇在35 ℃下的降解速率大于27 ℃下,27 ℃时其在冲积土、红土及黑土中的半衰期分别为73、31和39 d,而35 ℃时半衰期分别为16、11和15 d。Bromilow等[55,56]指出,随温度从5℃升高到18 ℃,土壤中三唑酮的降解速率提高了3倍;而当土壤湿度由80%降低到60%时,其降解速率也随之减慢。
3.2 pH值土壤pH值是影响微生物降解农药的另一重要因素,多数微生物只能在一定的pH值范围内存活,且pH值会通过影响酶的活性而影响微生物的生长,从而影响微生物对农药的降解。Chen等[15]对分离得到的一株假单胞菌(Pseudomonas sp.)的研究表明,该菌在酸性条件(pH 5.0)下生长缓慢,而在碱性条件(pH 11.0)下生长较快并能有效降解多效唑。郑金伟等[2]对苯醚甲环唑降解菌株B2的研究发现,在基础培养基中,当pH值为6~7时,B2对苯醚甲环唑的降解效果最好,而当pH值< 4时几乎不降解。
3.3 含氧量微生物分为需氧型和厌氧型两种,因此土壤含氧量可影响微生物的生长,从而影响其对农药的降解效率。Chen[37]等的研究表明,其所分离的一株假单胞属细菌在有氧条件下的生长速率明显快于无氧条件下,同时其对多效唑的降解效率也明显高于无氧条件下:有氧条件下培养48 h后,多效唑的降解率高达90%,而无氧条件下培养28 d后,多效唑的降解率仅为2.8%。而Singh等[54]的研究则表明,三唑酮在无氧条件下降解明显快于有氧条件下,其在有氧条件下和无氧条件下的半衰期分别为14.7和28.9 d。研究表明,土壤微生物降解农药的最佳含氧量为大于0.2 mg/L[57]。
除以上因素外,影响微生物降解三唑类杀菌剂的因素还有很多。比如在基质中添加不同的碳源和氮源可促进菌株的生长,从而加速其对农药的降解速率[57]。Sarkar等[13]的研究表明,在不同碳源中,葡萄糖对4株假单胞菌属细菌生长的促进效果较明显,而在不同的氮源中,硝态氮对菌株生长的促进作用较强,因此葡萄糖和硝态氮的加入能促进微生物对土壤中三唑类杀菌剂的降解。Marín-Benito等[58]指出,土壤中添加有机物能够加强微生物的活动,从而促进其对腈菌唑等农药的降解。
4 结语三唑类杀菌剂的大量使用对保障农业增产增收起了重要作用,但由于其在土壤中残留期较长,对土壤生态系统和农产品质量安全存在潜在的危害。生物修复作为一种高效、绿色的土壤原位修复方法正越来越受到人们的青睐。目前已报道的可降解三唑类杀菌剂的微生物类群主要有细菌、真菌和放线菌,但有关三唑类杀菌剂的微生物代谢途径、微生物对手性三唑类农药的对映体选择性降解及微生物降解三唑类杀菌剂过程中起关键作用的酶或控制基因等降解机理方面的研究仍不是很清楚,因此,相关研究有待进一步加强,以期更有效地利用微生物修复环境中残留的三唑类杀菌剂。
| [1] | LI Y B, DONG F S, LIU X G, et al. Enantioselectivity in tebuconazole and myclobutanil non-target toxicity and degradation in soils[J]. Chemosphere, 2015, 122:145-153. |
| [2] | DONG F S, CHENG L, LIU X G, et al. Enantioselective analysis of triazole fungicide myclobutanil in cucumber and soil under different application modes by chiral liquid chromatography/tandem mass spectrometry[J]. J Agric Food Chem, 2012, 60(8):1929-1936. |
| [3] | ROBBERTSE B, VAN DER RIJST M, VAN AARDE I M P, et al. DMI sensitivity and cross-resistance patterns of Rhynchosporium secalis isolates from South Africa[J]. Crop Prot, 2001, 20(2):97-102. |
| [4] | 郑金伟, 何健, 王哲, 等. 苯醚甲环唑降解菌B2的分离、鉴定及其降解特性[J]. 中国环境科学, 2009, 29(1):42-46. ZHENG J W, HE J, WANG Z, et al. Isolation, identification and characteristics of a difenoconazole-degrading bacterial strain B2[J]. China Environ Sci, 2009, 29(1):42-46. |
| [5] | 张一宾. 全球三唑类杀菌剂的市场、品种、特点及发展[J]. 中国农药, 2010(12):11-13. ZHANG Y B. The market, varietr, characteristics and development of world's triazole fundicides[J]. China Pestic, 2010(12):11-13. |
| [6] | 周子燕, 李昌春, 高同春, 等. 三唑类杀菌剂的研究进展[J]. 安徽农业科学, 2008, 36(27):11842-11844. ZHOU Z Y, LI C C, GAO T C, et al. Research progress on triazole fungicides[J]. J Anhui Agri Sci, 2008, 36(27):11842-11844. |
| [7] | LAMB D C, MASPAHY S, KELLY D E, et al. Purification, reconstitution, and inhibition of cytochrome P-450 sterol Δ22-desaturase from the pathogenic fungus Candida glabrata[J]. Antimicrob Agents Chemother, 1999, 43(7):1725-1728. |
| [8] | LOPES F M, BATISTA K A, BATISTA G L A, et al. Biodegradation of epoxyconazole and piraclostrobin fungicides by Klebsiella sp. from soil[J]. World J Microbiol Biotechnol, 2010, 26(7):1155-1161. |
| [9] | AANES K J, BAKKEN T. Acute and long-term effects of propiconazole on freshwater invertebrate communities and periphyton in experimental streams[J]. Norw J Agric Sci, 1994(Suppl. 13):179-193. |
| [10] | KÄLLQVIST T, ROMSTAD R. Effects of agricultural pesticides on planktonic algae and cyanobacteria-examples of interspecies sensitivity variations[J]. Norw J Agric Sci, 1994(Suppl. 13):117-131. |
| [11] | KJÆRSTAD M B, TAXVIG C, NELLEMANN C L, et al. Do azole fungicides possess an endocrine disrupting hazard[J]. Toxicol Lett, 2008, 180:S108. |
| [12] | SANCHO E, VILLARROEL M J, FERNÁNDEZ C, et al. Short-term exposure to sublethal tebuconazole induces physiological impairment in male zebrafish(Danio rerio)[J]. Ecotoxicol Environ Saf, 2010, 73(3):370-376. |
| [13] | SARKAR S, SEENIVASAN S, PREMKUMAR R. Biodegradation of propiconazole by Pseudomonas putida isolated from tea rhizosphere[J]. Plant Soil Environ, 2009, 55(5):196-201. |
| [14] | GOETZ A K, ROCKETT J C, REN H Z, et al. Inhibition of rat and human steroidogenesis by triazole antifungals[J]. Syst Biol Reprod Med, 2009, 55(5-6):214-226. |
| [15] | GOETZ A K, DIX D J. Mode of action for reproductive and hepatic toxicity inferred from a genomic study of triazole antifungals[J]. Toxicol Sci, 2009, 110(2):449-462. |
| [16] | GOETZ A K, REN H, SCHMID J E, et al. Disruption of testosterone homeostasis as a mode of action for the reproductive toxicity of triazole fungicides in the male rat[J]. Toxicol Sci, 2007, 95(1):227-239. |
| [17] | 刘永霞, 戈扬, 李岩, 等. 苯醚甲环唑原药的亚慢性毒性研究[J]. 中国职业医学, 2007, 34(1):67-68. LIU Y X, GE Y, LI Y, et al. Study on the subchronic toxicity of difenoconazole tech[J]. Chin Occup Med, 2007, 34(1):67-68. |
| [18] | ALLEN J W, WOLF D C, GEORGE M H, et al. Toxicity profiles in mice treated with hepatotumorigenic and non-hepatotumorigenic triazole conazole fungicides:propiconazole, triadimefon, and myclobutanil[J]. Toxicol Pathol, 2006, 34(7):853-862. |
| [19] | U.S. Environmental Protection Agency, Office of Prevention, Pesticides and Toxic Substances. Myclobutanil; pesticide tolerances[J]. Fed Regist, 1995, 60:40500-40503. |
| [20] | U.S. Environmental Protection Agency OoP, Pesticides and Toxic, Substances. Myclobutanil, pesticide tolerances for emergency exemptions[J]. Fed Regist, 2001, 66:298-306. |
| [21] | U.S. Environmental Protection Agency OoP, Pesticides and Toxic, Substances. Myclobutanil; pesticide tolerances for emergency exemptions[J]. Fed Regist, 2005, 70:49499-49507. |
| [22] | U.S. Environmental Protection Agency OoP, Pesticides and Toxic, Substances. Propiconazole; pesticide tolerances for emergency exemptions[J]. Fed Regist, 2005, 70:43284-43292. |
| [23] | STAMATIS N, HELA D, KONSTANTINOU I. Occurrence and removal of fungicides in municipal sewage treatment plant[J]. J Hazard Mater, 2010, 175(1-3):829-835. |
| [24] | KAHLE M, BUERGE I J, HAUSER A, et al. Azole fungicides:occurrence and fate in wastewater and surface waters[J]. Environ Sci Technol, 2008, 42(19):7193-7200. |
| [25] | LI Y B, DONG F S, LIU X G, et al. Simultaneous enantioselective determination of triazole fungicides in soil and water by chiral liquid chromatography/tandem mass spectrometry[J]. J Chromatogr A, 2012, 1224:51-60. |
| [26] | Agriculture & Environment Research Unit(AERU), University of Hertfordshire. Pesticide Properties Database(PPDB)[DB/OL].[2015-03-10] . http://sitem.erts.c.k/aeru/ppdb/en/index.tm. |
| [27] | 农药电子手册[DB/OL].[2015-03-10] . e-Pesticide manual[DB/OL].[2015-03-10] . |
| [28] | SAATY R P, BOOTH S R. In situ bioremediation:cost effectiveness of a remediation technology field tested at the Savannah river integrated demonstration site[R]. LA-UR-94-1714, Los Alamos National Laboratory, Los Alamos, New Mexico, 1994. |
| [29] | 崔中利, 崔利霞, 黄彦, 等. 农药污染微生物降解研究及应用进展[J]. 南京农业大学学报, 2012, 35(5):93-102. CUI Z L, CUI L X, HUANG Y, et al. Advances and application of microbial degradation in pesticides pollution remediation[J]. J Nanjing Agric Univ, 2012, 35(5):93-102. |
| [30] | DE SCHRIJVER A, DE MOT R. Degradation of pesticides by actinomycetes[J]. Crit Rev Microbiol, 1999, 25(2):85-119. |
| [31] | GIANFREDA L, RAO M A. Potential of extra cellular enzymes in remediation of polluted soils:a review[J]. Enzym Microb Technol, 2004, 35(4):339-354. |
| [32] | OBANDA D N, SHUPE T F. Biotransformation of tebuconazole by microorganisms:evidence of a common mechanism[J]. Wood Fiber Sci, 2009, 41(2):157-167. |
| [33] | MORRELL J J, VELICHETI R K. Physiologic response of Phanerochaete chrysosporium to exposure to triazole fungicides[R]. IRG/WP 94-10066, Documen International Research Group Wood Preserv, 1994. |
| [34] | SEHNEM N T, SOUZA-CRUZ P, PERALBA M D C R, et al. Biodegradation of tebuconazole by bacteria isolated from contaminated soils[J]. J Environ Sci Heal B, 2009, 45(1):67-72. |
| [35] | WOO C, DANIELS B, STIRLING R, et al. Tebuconazole and propiconazole tolerance and possible degradation by Basidiomycetes:a wood-based bioassay[J]. Int Biodeterior Biodegrad, 2010, 64(5):403-408. |
| [36] | 李体文, 魏朝俊, 贾临芳, 等. 丙环唑降解菌筛选的初步研究[C]//农业环境与生态安全--第五届全国农业环境科学学术研讨会论文集. 南京, 2013:738-742. LI T W, WEI C J, JIA L F, et al. Preliminary research on screening of propiconazole-degrading bacteria[C]//Agricultural environment and ecological safety-the fifth session of the national agricultural academic conference on environmental science. Nanjing, 2013:738-742. |
| [37] | CHEN J, XU L, GIESY J P, et al. Biodegradation of paclobutrazol by a microbial consortium isolated from industrially contaminated sediment[J]. Toxicol Environ Chem, 2010, 92(8):1487-1494. |
| [38] | VAZ F L, NETTO A M, ANTONINO A C D, et al. Biodegradação de paclobutrazol por Pseudomonas spp. em sistemas de solo saturados[J]. Química Nova, 2012, 35(6):1090-1096. |
| [39] | EIZUKA T, ITO A, CHIDA T. Degradation of ipconazole by microorganisms isolated from paddy soil[J]. J Pestic Sci, 2003, 28(2):200-207. |
| [40] | 李岩, 蒋继志, 刘翠芳. 微生物降解农药研究的新进展[J]. 生物学杂志, 2007, 24(2):59-62. LI Y, JIANG J Z, LIU C F. Novel advances on pesticides degradation by microorganisms[J]. J Biol, 2007, 24(2):59-62. |
| [41] | 杨明伟, 叶非. 微生物降解农药的研究进展[J]. 植物保护, 2010, 36(3):26-29. YANG M W, YE F. Research progress in degradation of pesticides by microbes[J]. Plant Protect, 2010, 36(3):26-29. |
| [42] | OBANDA D N, SHUPE T F, CATALLO W J. Resistance of Trichoderma harzianum to the biocide tebuconazol-proposed biodegradation pathways[J]. Holzforsch, 2008, 62(5):613-619. |
| [43] | STRICKLAND T C, POTTER T L, JOO H. Tebuconazole dissipation and metabolism in Tifton loamy sand during laboratory incubation[J]. Pest Manag Sci, 2004, 60(7):703-709. |
| [44] | ROBERTS T, HUTSON D. Metabolic pathways of agrochemicals. Part 2:insecticides and fungicides[M]. Cambridge, UK:Royal Society of Chemistry, 1999. |
| [45] | SINGH N. Factors affecting triadimefon degradation in soils[J]. J Agric Food Chem, 2005, 53(1):70-75. |
| [46] | CLARK T, WONG W W C, VOGELER K. Comparative fate in soil of the enantiomers of triadimenol when applied individually to barley seed[J]. Pestic Sci, 1991, 33(4):447-453. |
| [47] | BUERGE I J, POIGER T, MÜLLER M D, et al. Influence of pH on the stereoselective degradation of the fungicides epoxiconazole and cyproconazole in soils[J]. Environ Sci Technol, 2006, 40(17):5443-5450. |
| [48] | NEILSON A H. The biodegradation of halogenated organic compounds[J]. J Appl Bacteriol, 1990, 69(4):445-470. |
| [49] | CHAUDHRY G R, CHAPALAMADUGU S. Biodegradation of halogenated organic compounds[J]. Microbiol Rev, 1991, 55(1):59-79. |
| [50] | SERDAR C M, GIBSON D T, MUNNECKE D M, et al. Plasmid involvement in parathion hydrolysis by Pseudomonas diminuta[J]. Appl Environ Microbiol, 1982, 44(1):246-249. |
| [51] | DE SOUZA M L, WACKETT L P, SADOWSKY M J. The atzABC genes encoding atrazine catabolism are located on a self-transmissible plasmid in Pseudomonas sp. strain ADP[J]. Appl Environ Microbiol, 1998, 64(6):2323-2326. |
| [52] | 尤民生, 刘新. 农药污染的生物降解与生物修复[J]. 生态学杂志, 2004, 23(1):73-77. YOU M S, LIU X. Biodegradation and bioremediation of pesticide pollution[J]. Chin J Ecol, 2004, 23(1):73-77. |
| [53] | TAYLOR A W, SPENCER W F. Volatilization and vapor transport processes[M]//CHENG H H. Pesticides in the soil environment:processes, impacts, and modeling. Madison, Wisconsin, USA:Science Society of America, Inc., 1990:213-269. |
| [54] | SINGH N, DUREJA P. Persistence of hexaconazole, a triazole fungicide in soils[J]. J Environ Sci Health Part B Pestic, 2000, 35(5):549-558. |
| [55] | BROMILOW R H, EVANS A A, NICHOLLS P H. Factors affecting degradation rates of five triazole fungicides in two soil types:1. Laboratory incubations[J]. Pestic Sci, 1999, 55(12):1129-1134. |
| [56] | BROMILOW R H, EVANS A A, NICHOLLS P H. Factors affecting degradation rates of five triazole fungicides in two soil types:2. Field studies[J]. Pestic Sci, 1999, 55(12):1135-1142. |
| [57] | NITI C, SUNITA S, KAMLESH K, et al. Bioremediation:an emerging technology for remediation of pesticides[J]. Res J Chem Environ, 2013, 17(4):88-105. |
| [58] | MARÍN-BENITO J M, HERRERO-HERNÁNDEZ E, ANDRADES M S, et al. Effect of different organic amendments on the dissipation of linuron, diazinon and myclobutanil in an agricultural soil incubated for different time periods[J]. Sci Total Environ, 2014, 476-477:611-621. |
 2016, Vol. 18
2016, Vol. 18


