丹皮酚 (paeonol,I) 又称为牡丹酚,化学名称 2-羟基-4-甲氧基苯乙酮,是毛莨科 (Ranunculaceae)植物牡丹 Paeonia suffruticosa Andr. 枝皮和根皮的主要活性成分之一[1],具有熔点低、易挥发、易氧化及水溶性差等特点,常用水蒸气蒸馏法提取[2]。现代药理学研究表明,丹皮酚具有抑菌、抗过敏、清热镇痛、抗凝血、抗肿瘤、保护肝脏及降血糖等药理活性[2, 3, 4],同时,对植物病原真菌也有显著的抑制作用[5],并对中药材害虫具有一定的触杀作用[6],在医药、化工、香料和食品等领域有着广泛的用途[7]。为了进一步开发丹皮酚的新用途,人们以天然产物丹皮酚为先导化合物进行了大量的结构改造和修饰研究[8],制备出了一系列丹皮酚衍生物[9],包括新型的查尔酮[10]和希夫碱[11]等,并进行生物活性试验研究[7, 8, 9, 10, 11],部分化合物对植物病原真菌具有抑制作用[12]。
笔者先从牡丹的根皮中提取丹皮酚并精制得到丹皮酚 (I),在室温下使其与 2-溴苯甲醛 (II) 在碱性介质中发生亲核加成反应,生成未见文献报道的丹皮酚衍生物——3-羟基-1-(2-羟基-4-甲氧基苯)-3-(2′-溴苯)-1-丙酮 (III),合成路线见图式 1,以丹皮酚为对照测定了目标化合物对 6 种植物病源真菌和8种病源细菌的抗菌活性。
|
图式 1 丹皮酚衍生物(Ⅲ)的合成 Scheme 1 Synthesis of the paeonol derivative (Ⅲ) |
UV-6300PC 紫外可见分光光度计 (上海美谱达有限公司);Nicolet170SX FT-IR 红外光谱仪 (日本岛津);Smart-1000CCD 型单晶 X 射线衍射仪 (瑞士Bruker);Bruker AM-300 超导核磁共振仪 (瑞士 Bruck);2400 型元素分析仪 (美国 Perkin-Elmer);6500 型质谱仪 (美国安捷伦)。
试剂均为分析纯,西安化学试剂厂;薄层硅胶 (化学纯),青岛海洋化工厂。
牡丹根皮,购于汉中市健康大药房,由陕西理工学院植物学分类专家赵桦教授鉴定,用研钵研细,过筛备用。试验的 6 种植物源真菌菌株:油菜菌核病菌 Sclerotinia sclerotiorum、番茄灰霉病菌 Botrytis cinerea、黄瓜枯萎病菌 Fusarium oxysporum、葡萄炭疽病菌 Colletotrichum gloeos- porioides、苹果炭疽病菌 Glomerella cingulate 和核桃果炭疽病菌 Pathogenic bacteria;试验的 8 种病源细菌:福氏志贺菌 51065 株 (Shigella flexne 51065)、枯草芽孢杆菌 CMCC63501 株 (Bacillus subtilis CMCC63501)、短小芽孢杆菌 CMCC63202 株 (Bacillus pumilus CMCC63202)、大肠杆菌 ATCC25922 株 (Escherichia coli ATCC25922)、金黄色葡萄球 ATTCC25925 株 (Staphyloccocus aureus ATTCC25925)、肠炎沙门菌 50040 株 (Salmonella enteritidis 50040)、鼠伤寒沙门菌 50013 株 (Salmonella typhimurium 50013) 和 白色假丝酵母菌 85021 株 (Monilia albican 85021),标准菌株冻干品购于中国预防医学科学院中国医学细菌保藏中心。马铃薯葡萄糖琼脂 (PDA) 培养基;Mueller-Hinton Broth(MHB) 肉汤,普通琼脂平板培养基以及普通 Nutrient Broth (NB) 肉汤培养基。
1.2 丹皮酚的提取与精制工艺流程牡丹根皮粉末→加水→加入氯化钠→浸泡(24 h)→水蒸气蒸馏→冷却→过滤→滤液中加入氯化钠→重蒸馏滤液→冷却滤液并过滤→合并 2 次结晶物→95% 的乙醇重结晶→干燥→丹皮酚产品→乙醇二次重结晶→干燥→丹皮酚精品,收率 1.68%,高效液相色谱法测定,纯度为 99.5%。
1.3 目标化合物的合成与表征准确称取 0.310 0 g 氢氧化钠于 50 mL 烧瓶中,用 1.5 mL 水溶解并冷却至室温;称取 0.518 0 g丹皮酚,用乙醇溶解后滴入含氢氧化钠水溶液的烧瓶中,磁力搅拌;滴加用乙醇溶解的 0.35 mL 2-溴苯甲醛,10 min 滴毕 (刚滴时为黄色溶液,逐渐有黄色固体析出,此后有大量黄色固体析出,随着反应进行,黄色固体部分溶解),用薄层色谱法 [(V(丙酮) : V(氯仿)=2 : 8)] 监测反应至结束 (持续搅拌 5 h)。将烧瓶置于冰水浴中冷却,用质量分数为 5% 的盐酸中和至 pH 为 4,静置 1 h ,抽滤,用少量无水乙醇淋洗后再用无水乙醇重结晶得到四棱柱状淡黄色晶体,干燥得目标化合物 0.860 g,产率 78.6 %。目标化合物易溶于氯仿、乙酸乙酯和二甲基亚砜,微溶于乙醇。熔点 99.8~101.7 ℃。MS (70 eV),m/z:351.08。元素分析 (C16H15BrO4) 理论值(%):C 54.72,H 4.31;测定值(%):C 54.66,H 4.28。
1.4 目标化合物的晶体结构测定选一粒 0.36 mm × 0.28 mm × 0.15 mm 的目标化合物晶体,用 Smart-1000CCD 型单晶衍射仪以石墨单色化的 Mo/Kα 射线 λ = 0.071 073 nm 为入射辐射,用 φ-ω 方式在 2.14~25.10° 范围内扫描,296(2) K 下收集独立衍射点 2 664 个,2 770 个 I > 2δ(I) 可观察点用于结构解析和最小二乘修正,参与精确修正参数为 194 个,由可观察点计算最终偏差因子 R = 0.029 0,ωR = 0.066 0。计算全部用 SHELXTL 软件包,强度数据经 LP 校正和经验吸收校正,用直接法确定所有非氢原子坐标,对所有非氢原子及其各向异性热参数进行全矩阵最小二乘法修正,氢原子坐标由几何学理论计算确定[13]。
1.5 抗菌活性试验将供试菌株移种于培养基中,于 37 ℃ 下在普通培养箱中孵育 24 h,制成试验菌液,比浊法计数,用培养液调配成 106 CFU/mL,同时设细菌对照,用微量二倍连续梯度稀释法测定最小抑菌浓度 (minimum inhibitory concentration,MIC),平板转种法测定最小杀菌浓度 (minimum bactericidal concentration,MBC)[10]。
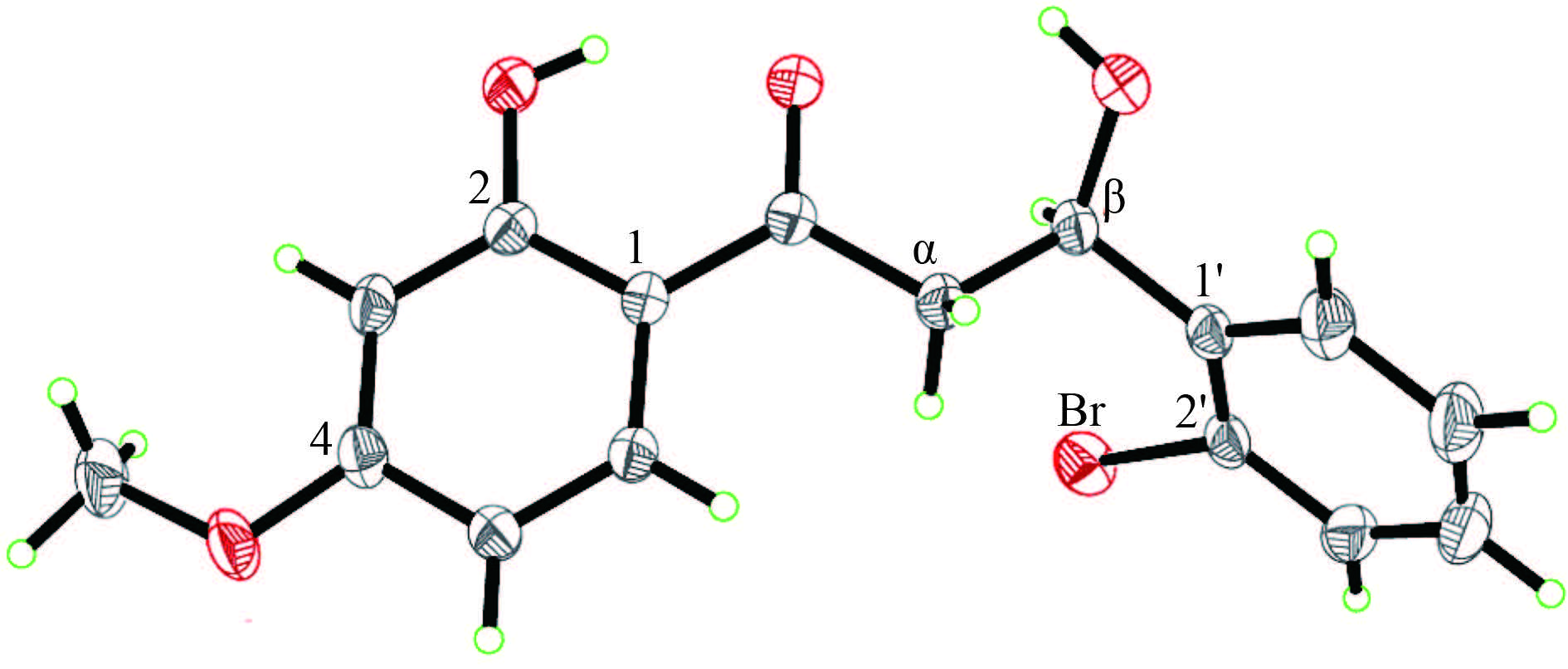
2 结果与讨论 2.1 目标化合物的结构表征 2.1.1 晶体结构目标化合物 (III) 的晶体结构见图 1;其晶体数据及修正参数见表 1;键长和键角参数、原子坐标和等效温度因子等相关晶体数据都以 CIF-file 的形式存放于 The Cambridge crystallographic Data Center (CCDC:793954)。

|
图 1 3-羟基-1-(2-羟基-4-甲氧基苯)-3-(2′-溴苯)-1- 丙酮(Ⅲ)的晶体结构 Fig. 1 Crystal structure of the paeonol derivative: 3-hydroxy-1-(2-hydroxy-4-methoxyphenyl)-3-(2'-bromophenyl)-1-acetone(Ⅲ) |
|
|
表 1 化合物 Ⅲ 的晶体数据和结构修正参数 Table 1 英文标题 |
UV-vis (EtOH),λmax/nm:217.0,277.0,316.0;IR (KBr),ν/cm-1: 3 525,3 457.13,3 392,1 636,1 567,1 508,1 367,1 292,1 232,1 203,1 120,1 014,963,952,804,789,721,661,613,559,453,在 3 457 cm-1 处有宽强吸收带,是氢键羟基的伸缩振动,1 636 cm-1 处有强吸收峰是羰基的吸收峰,963 cm-1 处有吸收峰,说明有芳香环存在。
2.1.3 NMR 谱1H NMR(300 MHz,DCCl3),δ:3.05,3.11(d,J = 9.6 Hz,J = 9.6 Hz,2H,Cα-2H),3.44~3.50(m,1H,Cβ-H),3.83(s,3H,CH3O-3H),5.63(s,1H,3-H),6.41(d,J = 8.1Hz,1H,5-H),6.42(s,1H,Cβ-OH),7.15(d,J = 14.4 Hz,H,C6′-H),7.37(d, J = 14.7 Hz,1H,C4′-H),7.53(d,J = 7.8 Hz,H,C5′-H),7.58(d,J = 8.7 Hz,1H,C2′-H),7.69(d,J = 7.5 Hz,1H,6-H),12.55(s,1H,OH)。
13C NMR(300 MHz,DCCl3),δ:44.8(C-α),55.7(CH3O),69.1(C-β),101.0(C-3),108.1(C-5),113.5(C-1),121.3(C-2′),127.6(C-5′),127.9(C-6′),129.1(C-4′),131.8(C-6),132.7(C-3′),141.8(C-1′),165.6(C-2),166.6(C-4),203.3(C=O)。
135°DEPT(300 MHz,DCCl3),δ:44.8(2°,C-α) ,55.7(1°,CH3O) ,69.1(3°,C-β) ,101.0(3°,C-3) ,108.1(3°,C-5) ,127.6(3°,C-5′) ,127.9(3°,C-6′) ,129.1(3°,C-4′) ,131.8(3°,C-6),132.7 (3°,C-3′)。
目标化合物的 1H NMR 谱、13C NMR 谱和 135°DEPT 谱与丹皮酚衍生物 3-羟基-1-(2-羟基-4-甲氧基苯)-3-(2′-溴苯)-1-丙酮的分子结构相符,也与其单晶 X-衍射测定的晶体分子结构一致。
2.2 抗菌活性抑菌活性测定结果表明,丹皮酚及其衍生物对供试的 6 种植物源真菌菌株和 8 种病源细菌菌株均有抑制和灭活作用,其 MIC 和 MBC 值见表 2。丹皮酚对不同真菌的抑菌活性由高到低依次为:葡萄炭疽病菌﹥黄瓜枯萎病菌﹥苹果炭疽病菌﹥核桃果炭疽病菌﹥油菜菌核病菌﹥番茄灰霉病菌;而丹皮酚衍生物对不同真菌的抑菌活性次序为:油菜菌核病菌﹥番茄灰霉病菌﹥葡萄炭疽病菌﹥苹果炭疽病菌﹥黄瓜枯萎病菌﹥核桃果炭疽病菌,其 MIC 值均较小,说明丹皮酚及其衍生物对 6 种植物源真菌菌株有显著的杀灭作用,但对不同菌株的杀灭效果存在差异。
|
|
表 2 丹皮酚及其衍生物对试验菌株的 MIC 和 MBC 值 Table 2 MIC and MBC of paeonol and its derivative against test strains |
丹皮酚衍生物对所有供试的 8 种病源细菌菌株有明显的抑制和杀灭作用,其 MIC 值在 0.02~6.22 g/L 之间,而且对部分菌株的抑制活性高于丹皮酚,其中对福氏志贺菌 51065 株和金黄色葡萄球 ATTCC25925 株具有极高的抑菌活性,MIC 值分别仅为 0.02 和 0.06 g/L。
3 结论以天然产物丹皮酚为原料,在碱性催化下,使其与 2-溴苯甲醛在室温下发生亲核加成反应,以较高产率合成了新型丹皮酚衍生物 3-羟基-1-(2-羟基-4-甲氧基苯)-3-(2′-溴苯)-1-丙酮,产物稳定,未出现 Claisen-Schmidt 缩合反应产物[10],其结构经过 NMR 谱和单晶 X-衍射等确认。抑菌活性测定结果表明,丹皮酚及其衍生物对供试植物源真菌和病源细菌均有较高的抑制和杀灭作用。
| [1] | AN R B, KIM H C, LEE S H, et al. A new monoterpene glycoside and antibacterial monoterpene glycosides from Paeonia suffruticosa[J]. Arch Pharm Res, 2006, 29(10):815-820. |
| [2] | MENG L, XU W D, GUO L H, et al. Paeonol inhibits the proliferation, invasion, and inflammatory reaction induced by TNF-α in vascular smooth muscle cells[J]. Cell Biochem Biophys, 2015, 73(2):495-503. |
| [3] | ZHAO Y, WANG B E, ZHANG S W, et al. Isolation of antifungal compound from Paeonia suffruticosa and its antifungal mechanism[J]. Chin J Integr Med, 2015, 21(3):211-216. |
| [4] | TSAO J Y, WU C P, TSAI H H, et al. Effect of hydroxypropyl-β-cyclodextrin complexation on the aqueous solubility, structure, thermal stability, antioxidant activity, and tyrosinase inhibition of paeonol[J]. J Incl Phenom Macrocycl Chem, 2012, 72(3-4):405-411. |
| [5] | 康业斌, 商鸿生, 成玉梅. 丹皮酚对植物病原真菌的体外抑制作用[J]. 植物保护学报, 2007, 34(6):580-584. KANG Y B, SHANG H S, CHENG Y M. Inhibition activities of paeonol to plant pathogenic fungi in vitro[J]. Acta Phytophy Sinica, 2007, 34(6):580-584. |
| [6] | 夏传国, 陈杰林. 丹皮提取物和丹皮酚对几种中药材害虫的毒杀作用研究[J]. 仲恺农业技术学院学报, 1999, 12(2):1-8. XIA C G, CHEN J L. Toxicity of fumigation and contact of moutan extracts and paeonol to several species of stored product insects of Chinese medicinal materials[J]. J Zhongkai Agrotech Coll, 1999, 12(2):1-8. |
| [7] | 孙言才, 沈玉先, 孙国平. 丹皮酚的主要药理活性研究进展[J]. 中成药, 2004, 26(7):579-582. SUN Y C, SHEN Y X, SUN G P. Research progress about the main pharmacological activities of paeonol[J]. Chin Tradit Pat Med, 2004, 26(7):579-582. |
| [8] | 赖普辉, 田光辉, 赵桦. 一种丹皮酚衍生物的合成及其抗菌活性[J]. 武汉大学学报(理学版), 2010, 56(5):523-526. LAI P H, TIAN G H, ZHAO H. Synthesis and antimicrobial activity of a paeonol derivative[J]. J Wuhan Univ (Nat Sci Ed), 2010, 56(5):523-526. |
| [9] | 田光辉. 牡丹酚缩乙醇胺的晶体结构及抗菌活性研究[J]. 陕西理工学院学报(自然科学版), 2012, 28(2):72-78. TIAN G H. Study of crystal structure and antimicrobial activities of paeonol-ethanolamine[J]. J Shaanxi Univ Technol (Nat Sci Ed), 2012, 28(2):72-78. |
| [10] | 赖普辉, 田光辉, 季晓晖, 等. 新型2'-羟基-4'-甲氧基-3-硝基査尔酮的合成及其抗菌活性[J]. 合成化学, 2010, 18(4):465-467. LAI P H, TIAN G H, JI X H, et al. Synthesis and antimicrobial activity of novel 2'-hydroxy-4'-methoxy-3-nitrochalcone[J]. Chin J Synth Chem, 2010, 18(4):465-467. |
| [11] | QIN D D, YANG Z Y, QI G F, et al. Crystal structure and biological activities of water-soluble nickel (II) and copper (II) complexes of a Schiff-base derived from paeonol[J]. Transition Met Chem, 2009, 34(5):499-505. |
| [12] | 吴晓慧, 吴国荣, 张卫明, 等. 丹皮酚提取、磺化及对植物病原菌的抑菌试验[J]. 中药材, 2003, 26(11):778-780. WU X H, WU G R, ZHANG W M, et al. Experiment on extraction, sulfonate of paeonol and its antibiotic effect on plant pathogen[J]. J Chin Med Mater, 2003, 26(11):778-780. |
| [13] | 刘存芳, 王芹, 史娟, 等. 6-亚甲基醋酸孕酮的晶体结构表征[J]. 陕西理工学院学报(自然科学版), 2015, 31(1):42-48. LIU C F, WANG Q, SHI J, et al. Study on crystal structure of 6-methylene progesterone acetate[J]. J Shaanxi Univ Tech(Nat Sci Ed), 2015, 31(1):42-48. |
 2016, Vol. 18
2016, Vol. 18

