2. 广西壮族自治区农业科学院植物保护研究所, 南宁 530007
2. Plant Protection Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China
氯虫苯甲酰胺 (图式1) 是由美国杜邦 (DuPont) 公司开发的第一个具有邻酰胺基苯甲酰胺类化学 结构的广谱杀虫剂[1],商品名康宽,于 2008 年在 我国取得临时登记,目前已经在多种作物上取得 正式登记并大量使用。该药通过破坏昆虫细胞质 内 Ca2+ 环境的稳定性而起到防治害虫的目的,具 有高效、低毒的特点,对多种鳞翅目害虫有较好 的防治效果,持效期长[2],并可有效防治对其他杀 虫剂已产生抗性的害虫[3, 4]。随着氯虫苯甲酰大面 积、多年连续使用,其对作物及环境的安全性日 益受到关注,国内外已报道了其在水稻、苜蓿、 甘蓝、黄瓜、白菜、番茄、辣椒、茄子、苹果、 梨、茭白、土豆和葡萄等作物上的残留分析及安 全性评价[5, 6, 7, 8, 9, 10]。印度的 Ramasubramanian 等[11]及 Sharma等[12]报道了氯虫苯甲酰胺在甘蔗中的残留 检测方法,并对其使用后的安全性进行了评价,但其前处理方法过于繁琐,且多采用液相色谱-串 联质谱等大型昂贵仪器。目前国内尚未见氯虫苯 甲酰胺在甘蔗上使用后对甘蔗及环境安全性的相 关报道。
|
图式 1 氯虫苯甲酰胺 Scheme 1 chlorantraniliprole |
本研究建立了一种更快捷高效、经济简便的 氯虫苯甲酰胺在甘蔗和土壤中残留的检测方法,并通过田间试验研究了氯虫苯甲酰胺在甘蔗茎 秆、植株和土壤中的残留消解动态及最终残留量,以期为氯虫苯甲酰胺在我国甘蔗主要种植区使用后的降解特性研究及对甘蔗的安全性评价提 供依据。
1 材料与方法 1.1 仪器与试剂Waters e2695 高效液相色谱紫外检测器 (美国 Waters 公司);FA25 高速匀浆机 (上海弗鲁克 公司);TGL-16M 高速台式冷冻离心机 (湖南湘仪 离心机仪器有限公司);Talboys 230 volt 涡流混合 器 (上海安谱科学仪器公司);BSA224S 电子天平 (精度 0 . 1 m g,德国 S a r t o r i u s 公司);B r a n d Transferpette 单道数字可调移液器 (德国 Brand 公 司)等。
99.5% 氯虫苯甲酰胺 (chlorantraniliprole)标准 品 (德国 Dr. Ehrenstorfer GmbH 公司);0.4% 氯虫 苯甲酰胺颗粒剂 (GR,江门市大光明农化新会有 限公司);Florisil 固相萃取柱 (上海安谱科学仪器 公司);色谱纯乙腈及 N-丙基乙二胺 (PSA) 等。
1.2 分析方法 1.2.1 样品前处理土壤:准确称取 5.0 g 土壤样 品,加 2 mL 水润湿后,加入 15 mL 乙腈、1 g 氯 化钠、3 g 无水硫酸镁,涡旋 1 min,于 4 500 r/min 下离心 5 min;取上清液 6 mL,于 45 ℃ 水浴下旋 蒸浓缩至干;用色谱纯乙腈定容至 2 mL,超声清 洗 30 s,过 0.22 μm 有机膜,待测。
植物样品:准确称取 10.0 g 样品,加 30 mL (甘蔗茎秆) 或 50 mL (甘蔗植株) 乙腈、1 g 氯化 钠、3 g 无水硫酸镁,涡旋 20 s,超声 2 min,涡 旋 1 min,于 4 500 r/min 下离心 5 min,取上清液 6 mL (甘蔗茎秆) 或 10 mL (甘蔗植株),于 45 ℃ 水浴下旋蒸浓缩至干; 用色谱纯乙腈定容至 2 mL,超声清洗 30 s,待净化。
甘蔗茎秆样品净化:将提取液倒入置有 50 mg PSA 的离心管中,涡旋 1 min,于 4 500 r/min 下离心 5 min,取上清液过 0.22 μm 有机膜,待测。
甘蔗植株样品净化:将 2 mL 提取液移入已用 5 mL 甲醇预淋洗过的 Florisil 固相萃取柱中,用 10 mL 甲醇分两次洗脱;收集所有洗脱液,于 45 ℃ 水浴下旋蒸浓缩至干;用色谱纯乙腈定容至 2 mL。超声清洗 30 s,倒入置有 50 mg PSA 的离 心管中,涡旋 1 min。于 4 500 r/min 下离心 5 min,取上清液过 0.22 μm 有机膜,待测。
1.2.2 色谱检测条件ZORBAX Eclipse XDB-C18 色谱柱 (250 mm × 4.6 mm,5 μm);流动相:植株 及茎秆样品为 V(乙腈) : V(超纯水) = 53 : 47,土壤 为 V (乙腈) : V (超纯水) = 5 5 : 4 5;检测波长 258 nm;进样量 10 μL。
1.2.3 标准溶液配制和标准曲线的绘制氯虫苯 甲酰胺母液的配制:准确称取 0.025 1 g 的氯虫苯 甲酰胺标准品,用乙腈溶解,定容至 25 mL,摇 匀,配制成 1 000 mg/kg 的储备母液,于 4 ℃ 保 存,备用。
采用外标法定量。将氯虫苯甲酰胺母液用流 动相分别稀释成 0.02、0.05、0.2、0.5、2 和 5 mg/L 的标准溶液,按 1.2.2 节的条件测定,以进 样质量浓度为横坐标、对应的峰面积为纵坐标绘 制标准曲线。
1.2.4 添加回收试验在空白甘蔗植株、茎秆和 土壤样品中分别添加氯虫苯甲酰胺标准溶液,添 加水平为 0.05、0.5 和 2 mg/kg,每个水平重复 5 次,按本研究所建的方法测定,计算平均添加回收率 和相对标准偏差。
1.3 田间试验甘蔗主要分糖蔗 (用于工业制糖) 和果蔗 (鲜吃 甘蔗),广西是目前我国最大的糖蔗生产基地,而 湖南的果蔗生产历史悠久,为更好地涵盖不同甘 蔗种植模式、不同甘蔗品种及不同气候带对氯虫 苯甲酰胺残留行为的影响,本研究于 2013—2014 两年分别在广西区南宁市广西大学农场和湖南省 长沙市安沙镇两地进行田间残留试验。供试甘蔗 品种:广西 2013 和 2014 年分别为桂柳 2 号和新 台糖 22 号 (均为糖蔗),湖南两年均为黑果蔗 (果蔗)。小区面积为 30 m2,重复 3 次,随机排 列,小区间设保护带,另设空白对照小区。
1.3.1 消解动态试验甘蔗样品:在甘蔗栽种 时,以推荐高剂量的 1.5 倍(有效成分为 180 g/hm2,制剂用量为 45 kg/hm2)将药剂直接撒施于种植沟内,于甘蔗生长到高约 50 cm 时计为 1 d (距用药 后约 40 d),此后依次于 3、7、14、21、30、45 和 60 d 随机采样。取地表以上的全株 2 kg,于 -20 ℃ 保存,备用。
土壤样品:选取 20 m2 的地块,同样以推荐 高剂量的 1.5 倍将药剂直接撒施后覆土,分别于施 药后 2 h 及 3、7、14、21、30、45、60 d 采样,随机取 5~10 个点,采集 0~10 cm 深的土壤 1~ 2 kg,除去碎石、杂草等杂物,采用四分法留 300 g 土样两份,于 -20 ℃ 保存,备用。
1.3.2 最终残留试验设两个施药剂量:低剂量 采用推荐高剂量,即有效成分 120 g/hm2 (制剂量 30 kg/hm2),高剂量采用推荐高剂量的 1.5 倍,即 有效成分 180 g/hm2。每个小区施药1次,每处理 3 次重复,小区面积 30 m2,于甘蔗成熟时随机采集 10~15 株长势良好、成熟的甘蔗地上至肥厚带部 分,除去植株顶部叶片、茎秆外包叶及根端部 分,每根甘蔗分别在上、中、下部位各取自然节 一节 (不少于 2 kg)。同时采集土壤样品,方法同 1.3.1 节。
田间样本采集后在 8 h 内立即制备成供试样 品,于 -20 ℃ 下保存,样品在 2 个月内完成检测 分析。据 Grant 等[12]的试验表明,氯虫苯甲酰胺在 苹果、小麦等作物基质中低温贮藏 12 个月(添加 水平为 0.10 mg/kg,-20 ℃),添加回收率在 83%~88% 之间,样品贮藏稳定性良好。
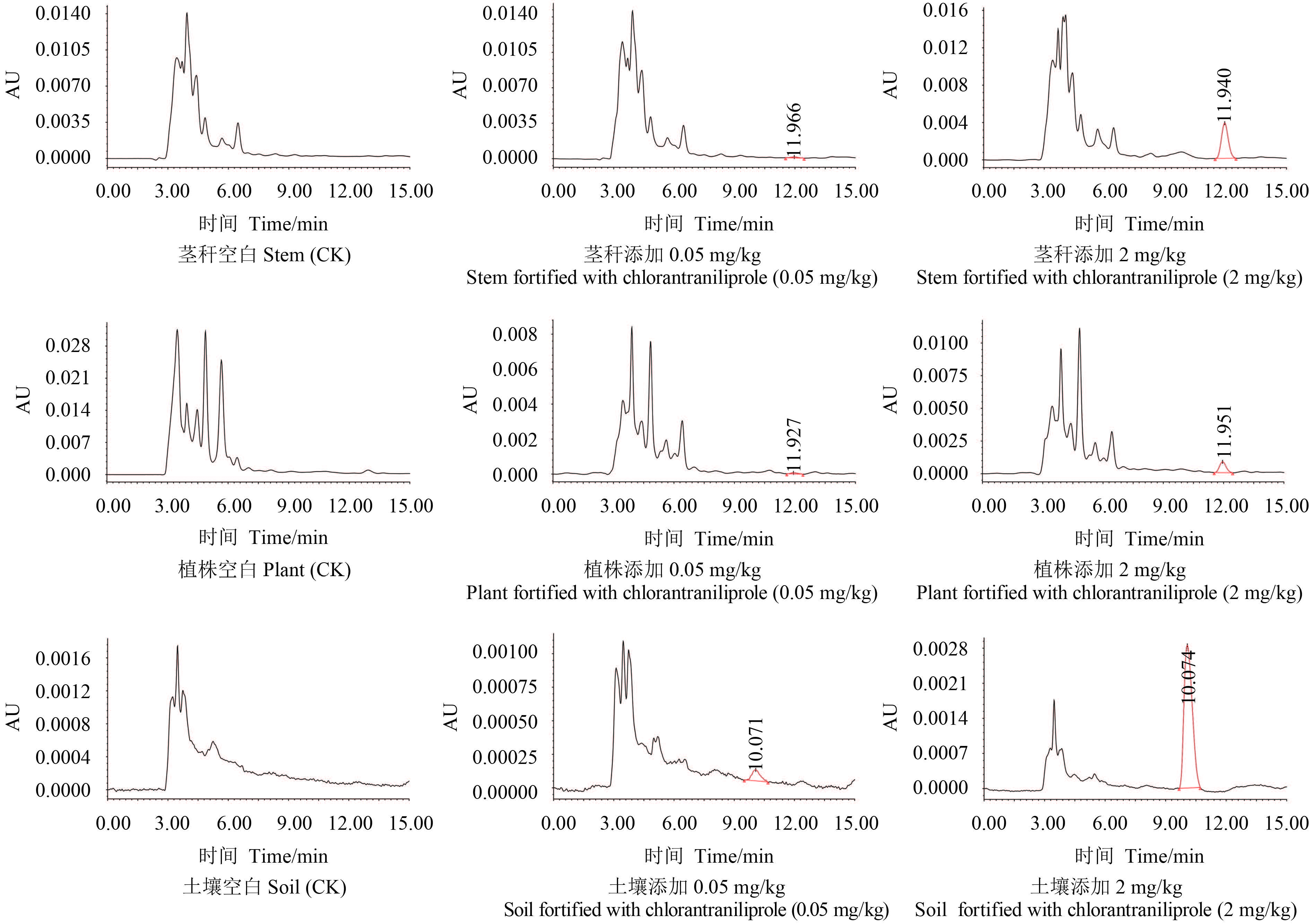
2 结果与分析 2.1 方法的线性范围、准确度和精密度结果 (表 1) 表明:在 0.02~5 mg/L 范围内,氯虫苯甲酰胺质量浓度与对应的峰面积间呈良好 的线性关系,线性回归方程为 y = 50 553 x - 1 312,R2 = 0.999 6,满足外标法定量检测的要 求。在 0.05~2 mg/kg 添加水平下,氯虫苯甲酰胺 在甘蔗中的平均添加回收率在 77%~97%,相对 标准偏差(RSD)为 3.4%~11.6%;在土壤中的回收 率为 80%~81%,RSD 为 6.1%~11.5%。氯虫苯 甲酰胺在甘蔗茎秆、甘蔗植株和土壤中的最小检 出量均为 0.2 ng,最低检测浓度均为 0.05 mg/kg,达到农药残留分析对灵敏度的要求[13]。典型色谱 图见图 1。
|
|
表 1 甘蔗植株、茎秆及土壤中氯虫苯甲酰胺的添加回收率及相对标准偏差 Table 1 Recovery and relatives standard deviation of chlorantraniliprole in soil, plant and stem of sugarcane |
|
图 1 样品典型色谱图 Fig. 1 High performance liquid chromatogram of samples |
结果 (表 2) 表明:2013 和 2014 年,氯虫苯甲酰胺在广西点土壤中的原始沉积量分别为 3.07 和 3.57 mg/kg,药后 60 d 消解率分别为 97.2% 和 97.3%,半衰期 (t1/2) 分别为 12.4 和 12.8 d;在湖 南土壤中的原始沉积量分别为 1.60 和 1.18 mg/kg,药后 60 d 消解率分别为 94.3% 和 94.4%,半衰期 分别为 18.2 和 17.8 d。
|
|
表 2 土壤中氯虫苯甲酰胺的消解动态 Table 2 Dissipation dynamics of chlorantraniliprole in soil |
最终残留试验结果表明:除 2 0 1 3 年湖南 180 g/hm2 处理土壤样品的残留量为 0.72 mg/kg外,其他处理土壤样品中氯虫苯甲酰胺的残留量均 < 0.05 mg/kg (表 3)。
|
|
表 3 甘蔗成熟时土壤样品中氯虫苯甲酰胺的最终残留量 Table 3 Terminal residues of chlorantraniliprole in soil at maturity |
残留消解动态试验表明:在甘蔗下种时撒施 药剂后覆土至甘蔗出苗约 5 0 c m 采样检测,2013—2014 年广西点、湖南点两年两地甘蔗植株 中氯虫苯甲酰胺的残留量均 < 0.05 mg/kg。
最终残留试验表明:按照推荐高剂量和推荐 高剂量的 1.5 倍在甘蔗栽种时直接撒施处理,施药 1 次,于甘蔗成熟时采样,茎秆中氯虫苯甲酰胺的 残留量均 < 0.05 mg/kg。
3 结论与讨论本研究建立了氯虫苯甲酰胺在土壤和甘蔗中 残留的分析方法,在章虎、钱鸣蓉等[7, 9]使用甲 醇、乙腈萃取基础上增加了超声提取步骤,提高 了氯虫苯甲酰胺在甘蔗样品中的添加回收率,重 现性好,添加回收率及检出限均能满足农药残留 分析的要求,且不需要质谱联用,更快捷、高 效,更经济简便。
田间土壤消解动态试验结果表明,氯虫苯甲 酰胺以有效成分 180 g/hm2 于甘蔗下种时撒施于种 沟覆土,一次施药,氯虫苯甲酰胺在土壤中的原 始沉积量为 1 . 1 8 ~3 . 5 7 m g / k g ,半衰期为 12.4~18.2 d。其中,氯虫苯甲酰胺在我国广西主 要甘蔗种植区土壤中的消解速率快于湖南,可能 的原因是: 广西试验点红壤的有机质含量 (16.7 g/kg) 略高于湖南的壤土 (15.6 g/kg),丰富的 有机质更利于土壤微生物的生长,从而加速氯虫 苯甲酰胺的消解。此外,广西土壤的 pH 值为 6.4,也低于湖南的 6.8,较低的 pH 值也可能缩短 了氯虫苯甲酰胺的消解周期。此外,与印度种植 区[14]相比,氯虫苯甲酰胺在我国两地土壤中的消 解半衰期均更长,消解速率更慢,原因可能也与两国甘蔗种植区土壤类型、土壤微生物种群及气候特点等的差异性有关。由于氯虫苯甲酰胺在我 国甘蔗种植区土壤中的消解半衰期较长,长期大 面积使用后其对土壤、水体的累积残留风险[15]也 需要进一步探索。
田间甘蔗植株消解动态试验结果表明,于甘 蔗下种时施药,至甘蔗出苗 50 cm 后,植株内氯 虫苯甲酰胺的残留量均小于 0.05 mg/kg。由于氯 虫苯甲酰胺在甘蔗植株内持效期较短,不利于甘 蔗螟虫的防治,因此建议在甘蔗培土期再施药 1次,以增强防治效果。
氯虫苯甲酰胺以有效成分 120 及 180 g/hm2 的 两个剂量,在甘蔗种植时撒施于种植沟处理 1 次,成熟时采收,其在甘蔗茎秆中的残留量均低 于我国制定的甘蔗上氯虫苯甲酰胺临时的最大残 留限量值(0.05 mg/kg)[16],也低于 CAC 制定的最大 残留限量值 0.5 mg/kg 和日本的 14 mg/kg。可见,氯虫苯甲酰胺以推荐高剂量及推荐高剂量的 1.5 倍 在甘蔗下种时沟施 1 次,成熟时采收的甘蔗是安 全的。
| [1] | LAHM G P, STEVENSON T M, SELBY T P, et al. RynaxypyrTM:a new insecticidal anthranilic diamide that acts as a potent and selective ryanodine receptor activator[J]. Bioorg Med Chem Lett, 2007, 17(22):6274-6279. |
| [2] | 于永浩, 龙秀珍, 曾宪儒, 等. 200 g/L氯虫苯甲酰胺悬浮剂对甘蔗螟虫的防效及对甘蔗产量的影响[J]. 安徽农业科学, 2013, 41(34):13230-13231. YU Y H, LONG X Z, ZENG X R, et al. Control of sugarcane borers by using chlorantraniliprole 20% SC and the impact on the sugarcane production[J]. Anhui Agric Sci, 2013, 41(34):13230-13231. |
| [3] | 徐尚成, 俞幼芬, 王晓军, 等. 新杀虫剂氯虫苯甲酰胺及其研究开发进展[J]. 现代农药, 2008, 7(5):8-11. XU S C, YU Y F, WANG X J, et al. Rynaxypyr, A new insecticide and its Research & Development in Application[J]. Modern Agrochemicals, 2008, 7(5):8-11. |
| [4] | 牛芳, 崔新倩, 王开运. 小菜蛾对氯虫苯甲酰胺抗性发展趋势及其种群生物适合度代价初步研究[J]. 农药学学报, 2011, 13(5):543-546. NIU F, CUI X Q, WANG K Y. Development of resistance of Plutella xylostella to chlorantraniliprole and its fitness costs[J]. Chin J Pestic Sci, 2011, 13(5):543-546. |
| [5] | CABONI P, SARAIS G, ALBERTO A, et al. Liquid chromatography-tandem mass spectrometric ion-switching determination of chlorantraniliprole and flubendiamide in fruits and vegetables[J]. J Agric Food Chem, 2008, 56(17):7696-7699. |
| [6] | 王广成, 吴春先, 高立明, 等. 氯虫苯甲酰胺悬浮剂的高效液相色谱分析[J]. 农药, 2009, 48(4):267-269. WANG G C, WU C X, GAO L M, et. al. Analyzed chlorantraniliprole SC by HPLC[J]. Agrochemicals, 2009, 48(4):267-269. |
| [7] | 章虎, 钱鸣蓉, 李振, 等. 高效液相色谱-串联质谱快速测定稻米中氯虫苯甲酰胺残留[J]. 农药, 2010, 49(12):906-908. ZHANG H, QIAN M R, LI Z, et. al. Determination of chlorantraniliprole residue in rices by HPLC-MS/MS[J]. Agrochemicals, 2010, 49(12):906-908. |
| [8] | 秦冬梅, 秦旭, 徐应明, 等. 土壤和番茄中氯虫苯甲酰胺的残留检测与消解动态研究[J]. 农业环境科学学报, 2010, 29(5):858-863. QIN D M, QIN X, XU Y M, et. al. Residue determination and degradation of chlorantraniliprole in soil and tomato[J]. J Agro-Environ Sci, 2010, 29(5):858-863. |
| [9] | 钱鸣蓉, 章虎, 吴俐勤, 等. 高效液相色谱-串联质谱法测定蔬菜中氯虫苯甲酰胺和氟虫双酰胺残留[J]. 分析化学, 2010, 38(5):702-706. QIAN M R, ZHANG H, WU L Q, et al. Determination of flubendiamide and chlorantraniliprole residues in vegetables using liquid chromatography-tandem mass spectrometry[J]. Chin J Anal Chem, 2010, 38(5):702-706. |
| [10] | MANDAL K, KAUR R, SAHOO S K, et al. Degradation pattern and risk assessment of chlorantraniliprole on berseem (Trifolium alexandrinum L.) using high performance liquid chromato-graphy[J]. Chemosphere, 2014, 112:100-104. |
| [11] | RAMASUBRAMANIAN T, PARAMASIVAM M, SALIN K P, et al. Dissipation kinetics of chlorantraniliprole in soils of sugarcane ecosystem[J]. Bull Environ Contam Toxicol, 2012, 89(6):1268-1271. |
| [12] | GRANT J. 2006 Stability of DPX-E2Y45 in representative crops stored frozen. E. I. du Pont de Nemours and Company. DuPont Report No.DuPont-12985[DB/OL](2010-01-28)[2015-10-25].//MACLACHLAN D. Chlorantraniliprole (230). http://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/JMPR/Evaluation08/Chlorantraniliprole.pdf. |
| [13] | 中华人民共和国农业部. 农药残留试验准则:NY/T 788-2004[S]. 北京:中国农业出版社, 2004. Ministry of Agriculture of the People' Republic of China. Guideline on pesticide residue trials:NY/T 788-2004[S]. Beijing:Chinese Agricultural Press, 2004. |
| [14] | SHARMA N, MANDAL K, KUMAR R, et al. Persistence of chlorantraniliprole granule formulation in sugarcane field soil[J]. Environ Monit Assess, 2014, 186(4):2289-2295. |
| [15] | US Environmental Protection Agency. Pesticide Fact Sheet:Chlorantraniliprole[R]. Washinton DC:US EPA, 2008:11-14. |
| [16] | 食品中农药最大残留限量:GB 2763-2014[S]. 北京:中国标准出版社, 2014. National food safety standard-Maximum residue limits for pesticides in food:GB 2763-2014[S]. Beijing:Standards Press of China, 2014. |
 2016, Vol. 18
2016, Vol. 18


