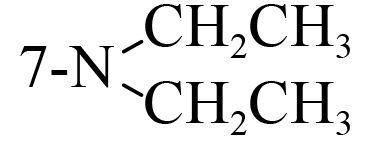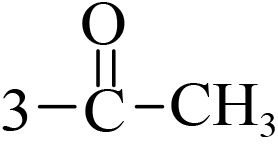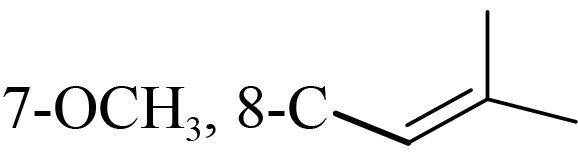香豆素 (coumarin) 是一类具有邻羟基肉桂酸内酯结构的化合物,在高等植物中广泛存在[1],截至 2009 年至少已有 1 300 种香豆素类化合物被鉴定[2]。其在医学上具有抗 HIV、抗癌、抗氧化、降压、抗心律失常及抗菌等多方面活性[3, 4, 5, 6]。在农业上,其不仅具有植物生长调节活性,还具有杀虫、杀螨和抑菌等活性[7, 8]。
植物性害螨的危害遍及世界范围内所有的农作物和地区。在我国危害比较严重的植食性害螨约 40 余种,主要为叶螨类、瘿螨类等,以朱砂叶螨 Tetranychus cinnabarinus、二斑叶螨 Tetranychus urticae、柑橘全爪螨 Panonychus citri、苹果全爪螨 Panonychus ulmi 及茶黄螨 Polyphagotarsonemus latus 等较为常见,严重危害多种蔬菜和瓜果。植食性害螨多为孤雌生殖,其具有繁殖力强、代数多、适应性强、易产生抗药性等特点,是最难防治的有害生物之一[9]。目前主要采用化学防治[10],但化学杀螨剂对农业生态环境危害严重,且在一些地区已产生严重的抗药性[11, 12, 13],防治难度及成本均大为增加。因此,寻找新型环境相容性的螨类控制剂势在必行。植物源杀螨剂具有低毒、选择性高、环境相容性好以及不易产生抗性等优点,因而备受国内外农药研究专家的青睐[14, 15]。
传统的新农药开发研究方法主要是通过生物活性测定发现并筛选高活性化合物,发现几率小且工作量大,严重阻碍了新农药发展。定量构效关系 (quantitative structure-activity relationship,QSAR) 是一种借助分子的理化性质参数或结构参数,以数学和统计学手段定量研究有机小分子与生物大分子相互作用,有机小分子在生物体内吸收、分布、代谢、排泄等生理相关性质的方法[16]。该方法已广泛应用于环境化学、农业化学及药物化学等领域[17, 18, 19, 20, 21],在杀螨剂开发应用中也有报道[22]。为了开发具有较高杀螨活性的植物源杀螨剂,本研究先采用玻片浸渍法测定了 25 种香豆素类化合物对朱砂叶螨的触杀活性,再通过定量构效关系研究获得了影响该类化合物杀螨活性的主要结构参数,以期为筛选具有理想杀螨活性的候选化合物提供指导。
1 材料与方法 1.1 试验材料 1.1.1 供试螨类朱砂叶螨 T. cinnabarinus 为采自重庆市北碚区田间豇豆苗上,于人工气候室内 (温度 26 ℃ ± 1 ℃、相对湿度 60%~80%、光照条件 L∶D = 14 h∶10 h) 用盆栽虹豆苗饲养多年,未接触任何药剂所获得的品系,选用 3~5 日龄的活泼雌成螨供试。
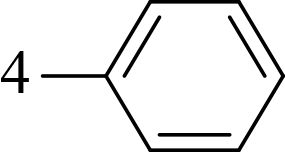
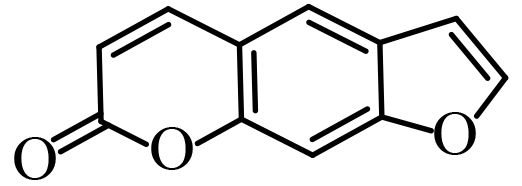
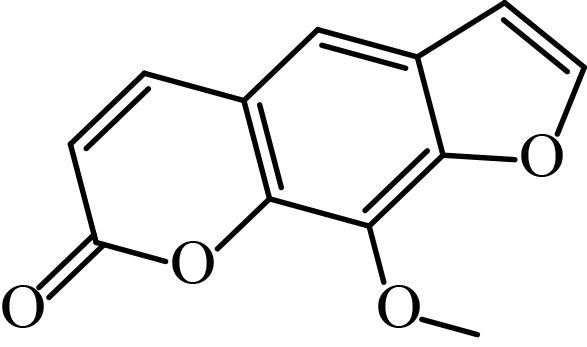
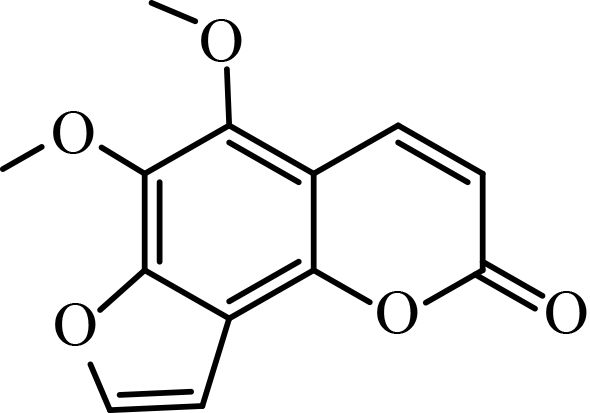
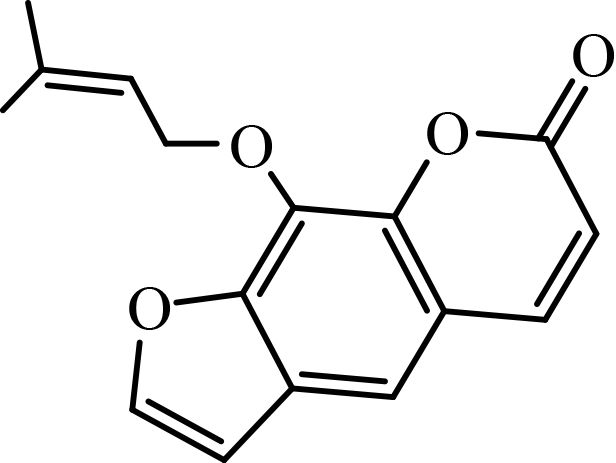
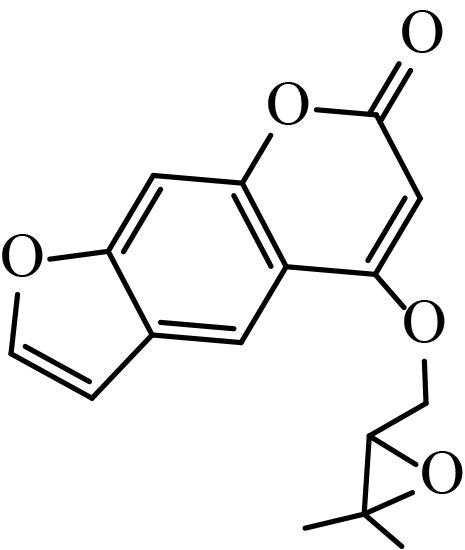
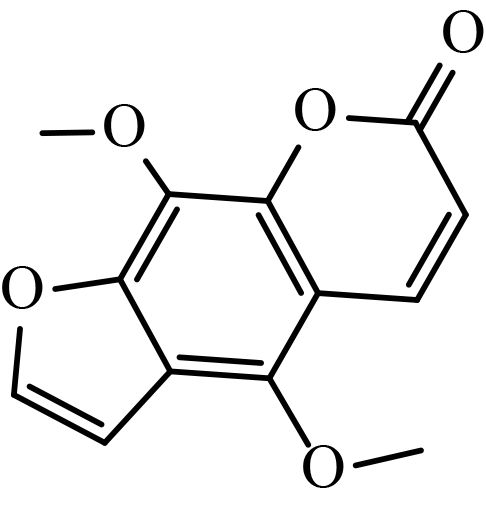
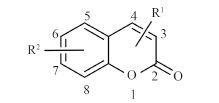
1.1.2 供试化合物25 种香豆素类化合物标准品购自成都艾科达化学试剂有限公司和上海源叶生物技术有限公司,纯度均大于 98%。该类化合物的骨架结构见图式 1,理化参数见表 1。
|
图式 1 供试化合物的骨架结构 Scheme 1 Core structure of tested compounds |
|
|
表 1 供试化合物的取代基及物理化学常数 Table 1 Structure and physicochemical parameters of the tested compounds |
采用FAO推荐的玻片浸渍法[23]。分别称取适量供试化合物,用少量丙酮溶解,再用含 0.1% 吐温-80 的水溶液稀释配制成有效成分为 2 000 mg/L 的药液,供初筛使用。在初筛的基础上选用 5~7 个系列浓度进行毒力回归分析。以 0.1% 的吐温-80 水溶液为空白对照,98.32% 螺螨酯(spirodiclofen)原药 (陕西美邦农药有限公司提供) 为药剂对照。选择健康活泼、整齐一致的朱砂叶螨雌成螨,将其背部粘在贴有双面胶的载玻片上,每片 2 行,每行 15~20 头,置于 26 ℃ ± 1 ℃、相对湿度 60%~80%、光照 L∶D = 14 h∶10 h 的条件下饲养 4 h ,用双目解剖镜检查,剔除死亡和不活泼的个体,记录活螨数。将粘有螨的载玻片在供试药液中浸渍 5 s 后取出,吸去多余药液,置于相同饲养条件下培养 3 d,每隔 24 h 检查一次结果。试验重复 3 次。用毛笔轻触螨体,以其螯肢不动者为死亡。采用 Excel 2010 对试验数据进行基本统计处理,计算总供试螨数及死亡螨数,以 Finney 机率值分析法求出毒力回归方程、LC50 值及其 95% 置信区间,由 SPSS17.0 软件进行统计分析。
1.2.2 香豆素类化合物理化参数获取
运用化学软件 ChemDraw Ultra 获得 25 种供试化合物的 2D 初始结构,并通过 Chem3D Ultra 软件中自带的分子力学分析模块 MM2,对化合物的化学结构进行几何构型预优化,最终获得化合物的较低能量构象。在此基础上,运用量子化学计算软件 Gaussian
的密度泛函理论中的 DFT/B3LYP 方法,在 6-311G(d,p) 基组水平上对 25 种化合物进行几何构型的全优化,并进行频率分析。若频率分析结果中未出现虚频,说明已得到各化合物能量最低的稳定构型。确定获得稳定构型后,用 Chem3D 中的 Calculations-Gaussian Interface、Calculations-Compute Properties 和 HyperChem 等计算出相关物化参数共 34 个,作为描述子。
在建立 QSAR 模型之前,需要先对得到的描述子进行预相关性分析,通过数学统计软件 SPSS 对描述子的相关性分析,得到各变量之间的 Pearson 相关系数矩阵。当描述子与香豆素类化合物的 LC50 值的 Pearson 相关系数较小,即两者之间的相关性较低时,说明该化学参数对该类香豆素化合物活性的影响较小[16]。因此,在后续的建模过程中可以将其剔除,从而减少数据处理的工作量及降低构建模型过程中误差出现的概率。在剔除相关性较差的变量后,以剩余化合物的描述子为自变量,杀螨活性的 LC50 值为因变量,采用 SPSS 中的 Stepwise 逐步回归法建立多元回归模型。
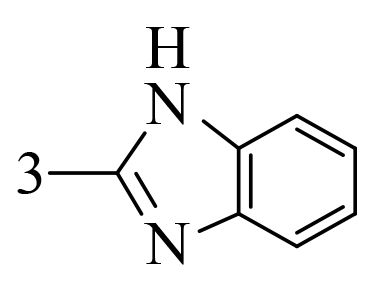
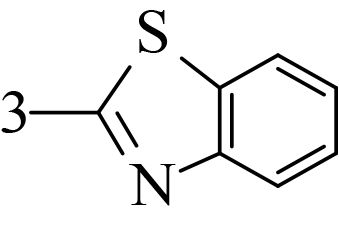
2 结果与讨论 2.1 香豆素类化合物对朱砂叶螨的触杀活性供试化合物对朱砂叶螨雌成螨的室内毒力测定结果见表 2。可见,所有化合物均对朱砂叶螨具有触杀活性,且随处理时间的延长活性升高。处理 48 h 后,LC50 值低于 1 000 mg/L 的化合物有 8 个,分别是 3-(2-苯并咪唑)-7-(二乙氨基) 香豆素(1)、3-(2-苯并噻唑)-7-(二乙氨基) 香豆素(2)、3-氨基香豆素 (3)、3-乙酰基香豆素 (4)、4-甲氧基香豆素 (5)、6-硝基香豆素 (8)、6,7-二甲氧基香豆素 (13) 和 7,8-二羟基香豆素 (21),其中化合物 1、2、3、5 和 13 的杀螨活性优于对照药剂螺螨酯原药或与其活性相当。活性最好的化合物为 13,处理 48 h 后 LC50 值为 284.8 mg/L,其毒力是螺螨酯的 2.06 倍;处理 72 h 后 LC50 值为 122.2 mg/L,是螺螨酯的 1.68 倍。化合物 1、2、3、5 和 13 可作为进一步开发研究的具有杀螨活性的候选化合物。
|
|
表 2 供试香豆素类化合物对朱砂叶螨雌成螨的触杀活性 Table 2 Contact activity against T. cinnabarinus of tested coumarin compounds |
香豆素类化合物是具有苯骈 α-吡喃酮结构的一大类植物次生代谢产物,具有多种生物活性,表现出明显的结构官能团与活性相关性[24]。本研究中供试化合物的杀螨活性强弱也与其结构及理化性质密切相关:结构骨架中 6,7 位连接呋喃环时活性总体较低,3 位氢被取代后活性显著提高,而 6,7 位同为甲氧基时杀螨活性最好。有关其杀螨机制及靶标位点还有待进一步探讨。
2.2 模型的建立共获得疏水、电性、立体、几何和拓扑 5 大类共 34 个物化参数 (表 3)。
|
|
表 3 供试香豆素类化合物的理化参数 Table 3 Physicochemical parameters of the tested coumarin compounds |
以各化合物对朱砂叶螨 48 h 的 LC50 数据集合 Y 作因变量,各化合物物化参数数据集合 X1、X2、……Xn 作自变量,建模前对所有参数 X1、X2、……Xn 与 Y 作 pearson 相关性分析,得到相关性矩阵,见表 4。选取与 Y 相关性系数绝对值较高的 17 种描述子,运用 SPSS 中的 Stepwise 逐步回归法进行分析,最终得到以 4 个描述子为自变量,以 48 h LC50 值为因变量的 QSAR 方程。构建模型见式 (1)。
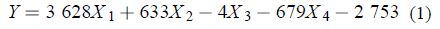
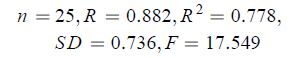
其中: X1 表示扭转力(Stretch-Bend); X2 表示取向力(Dipole-Dipole);X3 表示分子总能量(E);X4 表示分子半径(Radius)。
|
|
表 4 Pearson 相关系数矩阵 Table 4 Pearson correlation matrix |
由模型 (1) 可知:复相关系数 R 为 0.882,复判定系数 R2 为 0.778,说明对 77.8% 的目标化合物有解释能力,检验值 F 达到较高的 17.549。77.8% 的解释能力同时说明,在该系列化合物中可能存在具有不同杀螨机理的化合物。为了构建更为有效、解释能力更高、更符合大多数化合物的 QSAR 方程,本研究剔除了具有异常杀螨机理的化合物。由模型 (1) 可以获得这些化合物对朱砂叶螨 48 h LC50值的预测值,结合实测值,可以得到化合物实测值与预测值之间的残差值 (表 5)。
|
|
表 5 基于模型 (1) 得出的 48 h LC50 的实测值、预测值和残差值 Table 5 48 h LC50 Value obtained from experiments, prediction and residual based on Eq.(1) |
由表 5 可以看出,化合物 6、11 和 14 存在较大的残差值,说明这 3 种化合物可能与其他系列化合物的杀螨作用机理不同。剔除这 3 种化合物,将其余 22 种化合物用 SPSS 作关于已知 4 个变量的多元回归分析,得到新的 QSAR 方程,构建模型见 (2) 式。
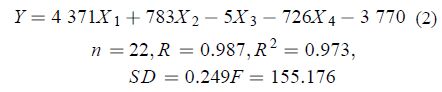
其中: X1 表示扭转力(Stretch-Bend);X2 表示取向力(Dipole-Dipole);X3表示分子总能量(E); X4 表示分子半径(Radius)。
由模型 (2) 可得:复相关系数 R 达到了 0.987,R2为 0.967,即解释能力达 96.7%,远高于 50%,说明该模型对绝大多数目标化合物有解释能力,其检验值 F 为 155.176,远大于 F (0.005,4,17) = 5.50 和 F (0.001,4,17) = 7.68,表明此模型相关性非常显著。
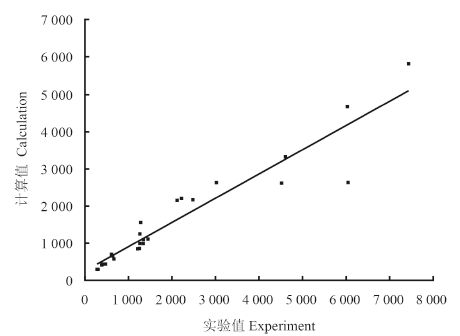
用 Origin 软件将预测值与实测值进行线性拟合,得到的拟合数据见图 2。从图中可以看出,预测值和实测值对应点均匀地分布在拟合曲线的两侧,说明预测值与实测值之间的相关性较高。
|
图 2 基于模型 (2) 的预测值与实测值之间的拟和曲线 Fig. 2 Plot of observed versus predicted LC50 (48 h) based on Eq. 2 |
回归方程的可靠性可用所构建模型中变量与变量之间是否存在共线性来判断,而变量之间的共线性一般采用变量间的变异膨胀因子 (variance inflation factors,VIF) 及容忍度 (T0) 来判定[25, 26]。VIF = 1/(1 - R2),式中 R2 是模型中某一变量与剩余变量的判定系数。若 VIF = 1,说明变量之间不存在自相关性;如果 1<VIF<5,说明变量之间不存在显著的自相关性;而当 VIF>5,则说明变量之间存在显著的共线性,此时所构建的模型就不能用于化合物生物活性的预测[27]。此外,共线性还可以采用各变量的容忍度 T0 来进行检验,当 T0 均大于 0.1 时,则表明模型中各变量之间没有明显的共线性现象。QSAR 模型 (2) 的自相关矩阵、VIF 和 T0 值见表 6。由表 6 可以看出,各变量间的相关系数小于 0.500,VIF 均小于 5,T0 均大于 0.1,说明模型 (2) 中的变量之间不存在明显的自相关性。
|
|
表 6 模型 (2) 中各描述符的自相关性、变异膨胀因子 (VIF) 与容忍度 (T0) Table 6 Descriptor’s autocorrelations, VIF and T0 based on Eq. 2 |
建立 QSAR 模型的意义在于可对目标化合物的生物活性进行预测。本研究选取 5 种未参与建模的香豆素类化合物,依照上述方法进行了化合物相关物化参数计算和杀螨活性测定,相关数据见表 7。可以看出,各供试化合物实测值与预测值之间的残差值 (绝对值) 均较小,表明本研究所建模型的预测性能较好。
|
|
表 7 模型 (2) 对目标化合物的预测性验证 Table 7 Predicted verification of target compounds based on Eq.(2) |
以朱砂叶螨为供试对象,采用玻片浸渍法筛选了 25 种香豆素类化合物的杀螨活性,其中 4 种化合物活性较为理想,优于或与商品化杀螨剂螺螨酯相当。通过计算获得 25 种香豆素类化合物的 34 个物化参数,将这些量子化学参数通过 SPSS 相关性分析和回归分析,构建了一个以扭转力、取向力、总能量和分子半径为自变量的 2D-QSAR 模型,该模型具有很好的预测能力,复相关系数 R 达到 0.987,复判定系数 R2 达到 0.967。本研究对于创制具有自主知识产权的香豆素类杀螨剂具有重要的参考价值。
| [1] | 孔令义. 香豆素化学[M]. 北京:化学工业出版社, 2008:10-15. KONG L Y. Coumarin chemical[M]. Beijing:Chemical Industry Press, 2008:10-15. |
| [2] | MURRAY R D H. Cheminform abstract:naturally occurring plant coumarins[J/OL]. Cheminform, 2010, 28(52)[2015-06-02]. http://onlinelibrary.wiley.com/doi/10.1002/chin.199752304/abstract. |
| [3] | MIZUNO A, TAKATA M, OKADA Y, et al. Structures of new coumarins and antitumor-promoting activity of coumarins from Angelica edulis[J]. Planta Med, 1994, 60(4):333-336. |
| [4] | MCKEE T C, FULLER R W, COVINGTON C D, et al. New pyranocoumarins isolated from Calophyllum lanigerum and Calophyllum teysmannii[J/OL]. J Nat Prod, 1996, 59(8):754-758[2015-06-02]. http://pubs.acs.org/doi/abs/10.1021/np960677t. |
| [5] | MCKEE T C, COVINGTON C D, FULLER R W, et al. Pyranocoumarins from tropical species of the genus Calophyllum:a chemotaxonomic study of extracts in the national cancer institute collection[J/OL]. J Nat Prod, 1998, 61(10):1252-1256[2015-06-03]. http://pubs.acs.org/doi/abs/10.1021/np980140a. |
| [6] | ZHOU P, TAKAISHI Y, DUAN H Q, et al. Coumarins and bicoumarin from Ferula sumbul:anti-HIV activity and inhibition of cytokine release[J/OL]. Phytochemistry, 2000, 53(6):689-697[2015-06-03]. http://www.sciencedirect.com/science/article/pii/S0031942299005543. doi:10.1016/S0031-9422(99)00554-3. |
| [7] | TAGUCHI G, FUJIKAWA S, YAZAWA T, et al. Scopoletin uptake from culture medium and accumulation in the vacuoles after conversion to scopolin in 2,4-D-treated tobacco cells[J/OL]. Plant Sci, 2000, 151(2):153-161[2015-06-04]. http://www.sciencedirect.com/science/article/pii/S0168945299002125. doi:10.1016/S0168-9452(99)00212-5. |
| [8] | 张永强, 丁伟, 赵志模, 等. 黄花蒿提取物对朱砂叶螨生物活性的研究[J]. 中国农业科学, 2008, 41(3):720-726. ZHANG Y Q, DING W, ZHAO Z M, et al. Studies on acarcidal bioactivities of the extracts from Artemisia annua L. against Tetranychus cinnabarinus bois. (Acari:Tetranychidae)[J]. Scientia Agric Sinica, 2008, 41(3):720-726. |
| [9] | DE OLIVEIRA CRUZ E M, COSTA-JUNIOR L M, PINTO J A O, et al. Acaricidal activity of Lippia gracilis essential oil and its major constituents on the tick Rhipicephalus (Boophilus) microplus[J/OL]. Vet Parasitol, 2013, 195(1-2):198-202[2015-06-06]. http://www. sciencedirect.com/science/article/pii/S0304401712007091.doi:10. 1016/j.vetpar.2012.12.046. |
| [10] | BONCRISTIANI H, UNDERWOOD R, SCHWARZ R, et al. Direct effect of acaricides on pathogen loads and gene expression levels in honey bees Apis mellifera[J/OL]. J Insect Physiol, 2012, 58(5):613-620[2015-06-06]. http://www.sciencedirect.com/science/article/pii/S0022191011003556. doi:10.1016/j.jinsphys.2011.12.011. |
| [11] | CABRERA A R. Advances in resistance monitoring of agricultural pests and in the elucidation of mite reproductive physiology[D]. Ann Arbor:North Carolina State University, 2010. |
| [12] | ILIAS A, VONTAS J, TSAGKARAKOU A. Global distribution and origin of target site insecticide resistance mutations in Tetranychus urticae[J/OL]. Insect Biochem Mol Biol, 2014,48:17-28[2015-06-10]. http://www.sciencedirect.com/science/article/pii/S0965174814000320.doi:10.1016/j.ibmb.2014.02.006. |
| [13] | MONTEIRO V B, GONDIM M G C Jr, DE MOLIVEIRA J E, et al. Monitoring Tetranychus urticae Koch (Acari:Tetranychidae) resistance to abamectin in vineyards in the Lower Middle São Francisco Valley[J/OL]. Crop Prot, 2015, 69:90-96[2015-06-10]. http://www.sciencedirect.com/science/article/pii/S0261219414003846. doi:10.1016/j.cropro.2014.12.012. |
| [14] | ZANDI-SOHANI N, RAMEZANI L. Evaluation of five essential oils as botanical acaricides against the strawberry spider mite Tetranychus turkestani Ugarov and Nikolskii[J/OL]. Int Biodeterior Biodegrad, 2015, 98:101-106[2015-06-11]. http://www.sciencedirect.com/science/article/pii/S096483051400376X. doi:10.1016/j.ibiod. 2014.12.007. |
| [15] | DAMIANI N, GENDE L B, MAGGI M D, et al. Repellent and acaricidal effects of botanical extracts on Varroa destructor[J/OL]. Parasitol Res, 2011, 108(1):79-86[2015-06-11]. http://link.springer.com/article/10.1007/s00436-010-2043-3. doi:10.1007/s00436-010-2043-3. |
| [16] | 约翰·加斯泰格尔, 托马斯·恩格. 化学信息学教程[M]. 梁逸曾, 徐峻, 姚建华, 译. 北京:化学工业出版社, 2005:410-413. GASTEIGER J, ENGEL T. Chemoinformatics[M]. LIANG Y Z, XU J, YAO J H, trans. Beijing:Chemical Industry Press, 2005:410-413. |
| [17] | 顾云兰, 刘漫, 陈文靖, 等. 氯酚类化合物对海洋微藻毒性的QSAR研究[J]. 科技通报, 2015, 31(5):1-5. GU Y L, LIU M, CHEN W J, et al. Study on QSAR of the toxicity of chlorophenols to microalgae (Dunaliella tertiolecta)[J]. Bull Sci Technol, 2015, 31(5):1-5. |
| [18] | MALIK J K, SONI H, PANDEY H, et al. QSAR-application in drug design[J]. J Hist Med Allied Sci, 2013, 2(1):1-13. |
| [19] | 周喜斌, 韩文静, 陈晶, 等. 几种QSAR建模方法在化学中的应用与研究进展[J]. 计算机与应用化学, 2011, 28(6):761-764. ZHOU X B, HAN W J, CHEN J, et al. Research progress and application of some QSAR modeling approach in chemistry[J]. Comput Appl Chem, 2011, 28(6):761-764. |
| [20] | 王瑾玲, 孙命, 苏华庆, 等. 咪唑-1-羧酸酯类化合物的构效关系研究[J]. 物理化学学报, 1998, 14(5):444-447. WANG J L, SUN M, SU H Q, et al. 3D-quantitative structure-activity relationship studies of imidazole-1-carboxylates[J]. Acta Phys-Chim Sinica, 1998, 14(5):444-447. |
| [21] | BARTHOMEUF C, LIM S, IRANSHAHI M, et al. Umbelliprenin from Ferula szowitsiana inhibits the growth of human M4Beu metastatic pigmented malignant melanoma cells through cell-cycle arrest in G1 and induction of caspase-dependent apoptosis[J/OL]. Phytomedicine, 2008, 15(1-2):103-111[2015-06-14]. http://www.sciencedirect.com/science/article/pii/S0944711307000578. doi:10. 1016/j.phymed.2007.04.001. |
| [22] | BADAWY M E I, EL-ARAMI S A A, ABDELGALEIL S A M. Acaricidal and quantitative structure activity relationship of monoterpenes against the two-spotted spider mite, Tetranychus urticae[J]. Exp Appl Acarol, 2010, 52(3):261-274[2015-6-14]. http://link.springer.com/article/10.1007/s10493-010-9363-y. doi:10.1007/s10493-010-9363-y. |
| [23] | 农药室内生物测定试验准则杀虫剂第12部分:叶螨玻片浸渍法:NY/T 1154.12-2008[S]. 北京:中国农业出版社, 2008. Guideline for laboratory bioassay of pesticides Part 12:Slide-dip method immersion:NY/T 1154.12-2008[S]. Beijing:China Agriculture Press, 2008. |
| [24] | 李林虎, 陈莉, 夏玉凤. 抗肿瘤香豆素类化合物的研究进展[J]. 中国药科大学学报, 2013, 44(4):374-379. LI L H, CHEN L, XIA Y F. Progress in the study of coumarin derivatives as antitumor agents[J]. J China Pharm Univ, 2013, 44(4):374-379. |
| [25] | 冯长君. 3-取代硫基-5-(2-羟基苯基)-4H-1, 2, 4-三唑类化合物抑菌活性的定量构效关系和结构修饰的理论研究[J]. 化学学报, 2012, 70(4):512-518. FENG C J. Theoretical studies on quantitative structure-activity relationship and structural modification for 3-substituted sulfur-5-(2-hydroxyphenyl)-4H-1,2,4-triazole compounds[J]. Acta Chim Sinica, 2012, 70(4):512-518. |
| [26] | 薛超彬, 丁琦, 罗万春, 等. 苯甲醛类、苯甲酸类和苯甲醛缩氨基硫脲类昆虫酚氧化酶抑制剂的2D-QSAR研究[J]. 农药学学报, 2008, 10(3):275-281. XUE C B, DING Q, LUO W C, et al. 2D-QSAR studies of benzaldehyde, benzoic acid, benzaldehyde thiosemicarbazone, and their derivatives as insect phenoloxidase inhibitors[J]. Chin J Pestic Sci, 2008, 10(3):275-281. |
| [27] | 许禄. 化学计量学方法[M]. 北京:科学出版社, 1995:67-81. XU L. Methods of chemometrics[M].Beijing:Science Press, 1995:67-81. |
 2016, Vol. 18
2016, Vol. 18