稻瘟病是由灰色大角间座壳菌(Magnaporthe grisea,无性态为Pyricularia oryzae)所引起的重要病害,在我国水稻栽培区均有发生,为水稻三大病害之首,目前的防治措施主要是抗病品种选育、药剂防治和栽培管理,其中,化学防治因经济、高效等优点而占据着不可替代的地位[1]。但由于化学药剂的常年单一使用,已出现稻瘟病菌抗药性增强和药剂防效降低的现象,稻瘟灵、稻瘟净、异稻瘟净等药剂都已有田间抗性菌株产生[2, 3]。此外,菌株经过连续驯化后对三环唑的敏感性也会降低[4]。因此,关于稻瘟病防治新药剂的研究开发已迫在眉睫。
戊唑醇(tebuconazole)是一种高效、广谱、内吸性的DMIs类杀菌剂,对作物的多数真菌病害均有良好的防治效果。但由于DMIs类杀菌剂的作用位点单一,田间已有多种重要的植物病原真菌对该类杀菌剂产生了不同程度的抗药性[5, 6, 7, 8]。西南地区是我国稻瘟病的常发区,但不同地域不同年份发病程度不一,常用的防治药剂主要有三环唑、稻瘟灵等,戊唑醇在该地区尚未大面积使用。笔者针对西南地区稻瘟病菌对戊唑醇敏感性基线的建立及抗药性监测进行了研究,以期为戊唑醇在该地区的应用前景评价及合理使用提供参考。
1 材料与方法1.1 供试材料1.1.1 菌株于2013—2014年在重庆市及四川、贵州省的16个区县采集水稻稻瘟病穗颈瘟标样,通过单孢分离纯化,共获得902个稻瘟病菌Magnaporthe grisea菌株。
1.1.2 药剂97%戊唑醇(tebuconazole)原药(湖北康宝泰精细化工有限公司),用丙酮配制为1×104 μg/mL的母液,4 ℃冰箱保存,备用。
1.1.3 培养基马铃薯琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂粉20 g,水1 000 mL。
1.1.4 含药平板将戊唑醇母液用丙酮稀释成系列浓度,取100 μL分别加入至200 mL、约 55 ℃的灭菌培养基中,分装制得含药平板。
1.2 试验方法1.2.1 病原菌的分离、纯化与保存
将所采集的穗颈瘟样品用灭菌水浸泡后保湿培养2 d,在PDA平板上抖孢子培养2 d,单孢纯化。纯化后的菌株于4 ℃下保存在PDA斜面上。
1.2.2 戊唑醇对稻瘟病菌的最低抑制浓度测定从保存的菌株中随机选取30个野生菌株,于菌落边缘打取直径5 mm的菌丝块,分别接种至含2.5、3.0、3.5、4.0、4.5、5.0 μg/mL戊唑醇的PDA平板上,以用等量丙酮配制的无药培养基作为对照,每处理重复3次。10 d后观察,以菌株未生长的最低戊唑醇浓度作为戊唑醇对稻瘟病菌野生菌株的最低抑制浓度(MIC)值。
1.2.3 稻瘟病菌对戊唑醇敏感性基线的建立从保存的菌株中随机选取150个野生菌株,采用菌丝生长速率法[9]测定稻瘟病菌对戊唑醇的敏感性。
将供试菌株于PDA培养基上、28 ℃黑暗培养10 d,于菌落边缘打取直径5 mm的菌丝块,分别接种到含0.062 5、0.125、0.25、0.5、1.0 及 2.0 μg/mL戊唑醇的PDA平板上,以加入等体积丙酮的平板作为对照,每处理重复 3 次。28 ℃黑暗培养,10 d后用十字交叉法测量各处理的菌落直径,计算菌丝生长抑制率。 通过Excel对各处理组药剂浓度的对数(x)和菌丝生长抑制率的几率值(Y)进行线性回归分析,求出线性回归方程,计算戊唑醇对各供试菌株的抑制中浓度(EC50值)。根据150株野生稻瘟病菌株对戊唑醇的敏感性频率分布,建立敏感性基线[10]。
1.2.4 西南地区稻瘟病菌对戊唑醇的田间抗性监测将全部菌株活化培养3 d后,于菌落边缘打取直径5 mm的菌丝块,接种至戊唑醇质量浓度为4 μg/mL的含药平板上,以加入等体积丙酮的平板为对照。28 ℃培养10 d,观察菌株生长情况,将能在含药平板上生长的菌株重新活化,通过菌丝生长速率法测定其EC50值,计算其与敏感基线的比值,得到抗性倍数(resistance factor)。 根据抗性倍数将供试菌株划分为敏感、低抗、中抗和高抗菌株。其中,抗性倍数≤3为敏感菌株;3<抗性倍数≤10为低抗菌株;10<抗性倍数≤100为中抗菌株;抗性倍数>100为高抗菌株[11]。计算各抗性菌株的频率。
2 结果与分析2.1 西南地区稻瘟病菌对戊唑醇的敏感性基线测定结果显示,供试150株稻瘟病菌对戊唑醇的敏感性呈连续性分布(图 1A ),其EC50值变化范围在0.047 5~0.599 6 μg/mL之间,其中最不敏感菌株的EC50值是最敏感菌株的12.62倍。将其EC50值划分为几个区间,统计每个区间的菌株数及发生频率,绘制菌株敏感性频率分布图(图 1B )。由图 1可见,供试稻瘟病菌对戊唑醇的敏感性频率分布呈连续性单峰曲线,未出现敏感性明显下降的抗药性亚群体,因此可将此150株敏感菌株的平均EC50值作为田间菌株抗性监测的参考标准。其EC50平均值为(0.215 4±0.149 7) μg/mL,MIC值≤4 μg/mL,该平均EC50值0.215 4 μg/mL可作为西南地区稻瘟病菌对戊唑醇敏感性基线的参考值,用于田间抗药性监测。
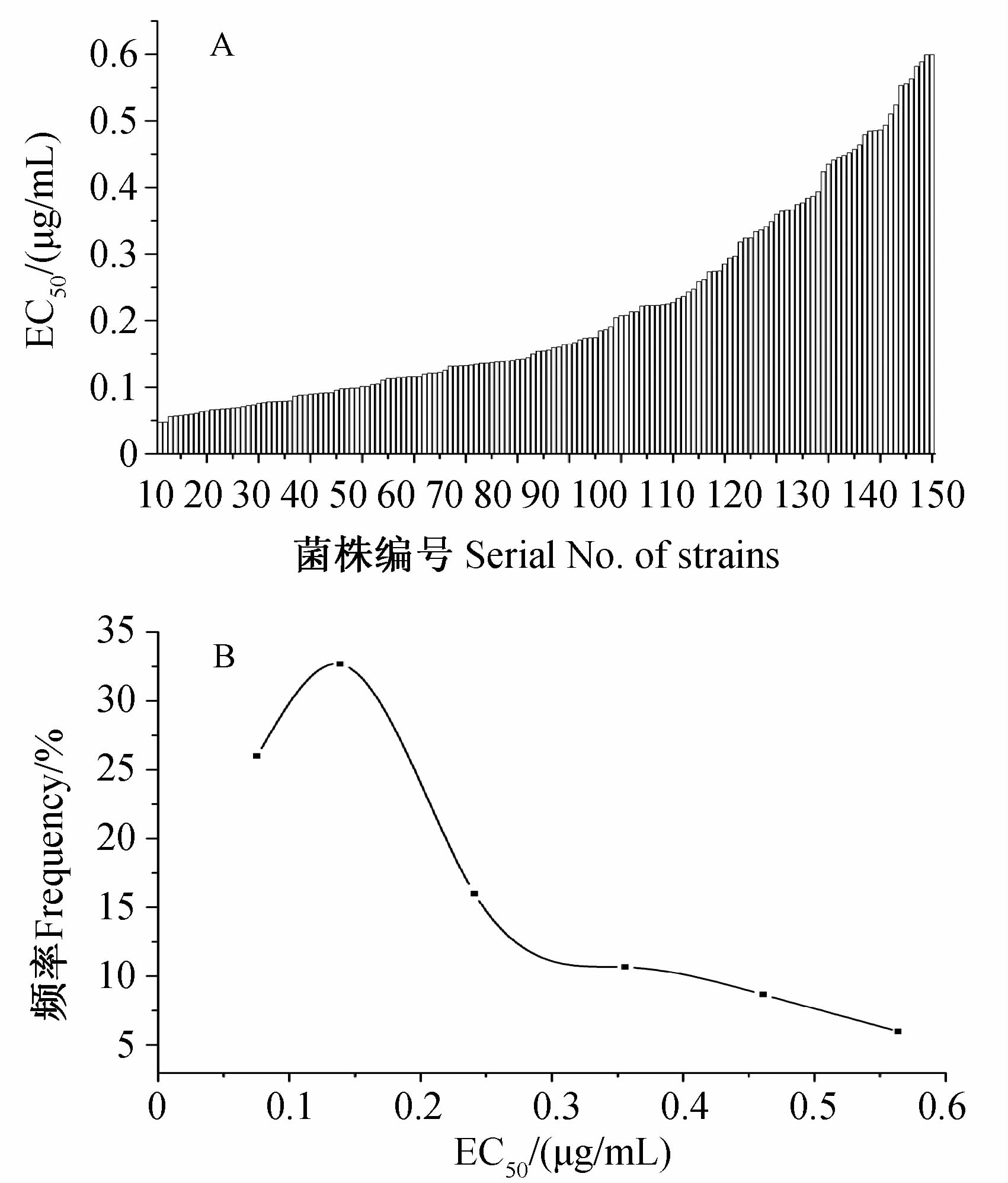
|
图 1 稻瘟病菌对戊唑醇的敏感性(A)及频率分布(B) Fig. 1 Sensitivity (A) and distribution (B) of EC50 |
|
|
表 1 部分地区稻瘟病菌对戊唑醇的敏感性比较 Table 1 Sensitivity (EC50 value) of M.grisea from different areas to tebuconazole |
通过SPSS软件分析了西南地区10个区县的田间稻瘟病菌菌株对戊唑醇的敏感性,结果(表 1)表明,不同地区稻瘟病菌对戊唑醇的敏感性存在显著性差异。其中,四川绵阳菌株最敏感,其平均EC50值为(0.087 2±0.046 1) μg/mL;贵州六枝特区和四川宣汉的菌株最不敏感,平均EC50值分别为(0.457 0±0.085 5)和(0.443 6±0.128 9) μg/mL;四川绵阳菌株与四川宣汉菌株的敏感性相差5.09倍。
2.2 西南地区稻瘟病菌对戊唑醇的抗性以MIC值作为田间稻瘟病菌对戊唑醇抗性的区分剂量,对分离于重庆市(永川、酉阳、璧山、武隆、涪陵、忠县、石柱)、四川省(都江堰、宣汉、阆中、绵阳、岳池、雅安、武胜)和贵州省(盘县、六枝特区)16个区县的902株稻瘟病菌菌株进行抗性监测。结果表明,所采集的病原菌仅四川宣汉和重庆涪陵各有1株能在含4 μg/mL戊唑醇的PDA平板上生长,视为疑似抗性菌株。
测定该疑似抗性菌株对戊唑醇的敏感性,得其EC50值分别为0.651 2和0.655 7 μg/mL,抗性倍数分别为3.02和3.04。由此可见,西南地区稻瘟病菌对戊唑醇多数仍为敏感菌株,仅极少数出现了低水平抗性。
3 小结与讨论DMIs类农药属于较易产生抗性的中等风险杀菌剂,而稻瘟病菌属于易产生抗性的高风险病原菌[12]。建立病原菌对杀菌剂的敏感性基线是研究田间菌株敏感性变化的重要步骤,也是进行抗药性风险分析的基础[13]。本研究采用菌丝生长速率法,测定了采自西南地区未使用戊唑醇区域的150株野生稻瘟病菌菌株对戊唑醇的EC50值,其平均EC50值为0.215 4 μg/mL,该值与Yan等[14]测定的稻瘟病菌野生敏感菌株对戊唑醇的EC50值相近,因此可将其作为田间稻瘟病菌对戊唑醇抗性监测的参考标准。在敏感性基线建立过程中,最敏感菌株与最不敏感菌株EC50值差异达12.62倍,分别出现在四川岳池与重庆涪陵,且各区县之间的平均EC50值存在显著性差异,说明不同地区稻瘟病菌对戊唑醇的敏感性并不一致,推测这可能与各地病原菌本身的差异性有关。
同时,本研究采用4 μg/mL作为区分剂量,对西南地区采集的稻瘟病菌进行了田间抗性监测,其中采自四川省和重庆市的菌株对戊唑醇的抗性频率分别为0.33%和0.21%,表明供试菌株对戊唑醇多数仍表现为敏感,仅极少数为低水平抗性,即戊唑醇在西南地区稻瘟病防治中具有较好的应用价值。因此,戊唑醇可作为西南地区稻瘟病防治的候选药剂,但需做好田间抗药性监测,并注意与作用机制不同的药剂混合或交替使用,以延缓抗性的产生,延长药剂使用寿命。
| [1] | 丁锦华, 苏建亚. 农业昆虫学[M]. 北京:中国农业出版社, 2001:333-352. Ding Jinhua, Su Jianya. Agricultural Entomology[M]. Beijing:Agricultural Press Chinese, 2001:333-352.(in Chinese) |
| [2] | 曹阳, 柏志美, 陈巨红, 等. 基于磷化氢击倒中时间的储粮害虫抗性快速测定方法研究[J]. 中国粮油学报, 2006, 21(3):184-188. Cao Yang, Bai Zhimei, Chen Juhong, et al. A quick method to measure phosphine resistance of stored grain insects basing on knockdown time of median(KDTm) with phosphine treatment[J]. J Chin Cereals Oils Assoc, 2006, 21(3):184-188(in Chinese) |
| [3] | 曹阳. 我国谷蠹、赤拟谷盗、锈赤扁谷盗和土耳其扁谷盗磷化氢抗药性调查[J]. 河南工业大学学报:自然科学版, 2006, 27(1):1-6. Cao Yang. Survey of the resistance of stored-grain pests to phosphine in China[J]. J Henan Univ Technol:Nat Sci Ed, 2006, 27(1):1-6(in Chinese) |
| [4] | 周天智, 刘士强, 马文斌, 等. 鄂中地区四种储粮害虫对磷化氢抗性发展及对策研究[J]. 粮食储藏, 2011, 40(4):6-9. Zhou Tianzhi, Liu Shiqiang, Ma Wenbin, et al. Development and strategy on resistance of four kinds of stored grain insects to phosphine in middle area of Hubei province[J]. Grain Storage, 2011, 40(4):6-9(in Chinese) |
| [5] | 谢更祥, 唐易, 张连中, 等. 海南地区扁谷盗抗药性和实仓防治研究[J]. 粮食储藏, 2013, 42(1):9-12. Xie Gengxiang, Tang Yi, Zhang Lianzhong, et al. Study on the resistance of Cryptoestes ganglb and field study on trail of phosphine fumigation in Hainan province[J]. Grain Storage, 2013, 42(1):9-12(in Chinese) |
| [6] | 王晶磊, 王殿轩, 肖雅斌, 等. 辽宁地区储粮害虫对磷化氢抗性测定及对策研究[J]. 粮食与饲料工业, 2014, 11(9):16-18. Wang Jinglei, Wang Dianxuan, Xiao Yabin, et al. Determination of phosphine resistance of stored grain pest and countermeasures in Liaoning province[J]. Cereal Feed Ind, 2014, 11(9):16-18(in Chinese) |
| [7] | Price L A, Mills K A. The toxicity of phosphine to the immature stages of resistant and susceptible strains of some common stored product beetles, and implications for their control[J]. J Stored Prod Res, 1998, 24(1):51-59. |
| [8] | Bengston M, Collins P J, Daglish G J. Inheritance of phosphine resistance in Tribolium castaneum (Coleoptera:Tenebrionidae)[J]. J Econ Entomol, 1999, 92(1):17-20. |
| [9] | Bell C H. Fumigation in the 21st century[J]. Crop Prot, 2000, 19(8-10):563-569. |
| [10] | Hooper J L, Desmarchelier J M, Ren Yonglin, et al. Toxicity of cyanogen to insects of stored grain[J]. Pest Manag Sci, 2003, 59(3):353-357. |
| [11] | CSIRO. Cyanogen fumigants and methods of fumigation using cyanogen:US19970765058[P]. 1999-12-14. |
| [12] | 李保同, 曾鑫年, 任永林, 等. 顶空气相色谱法测定小麦中熏蒸剂氰及其代谢物氰化氢的残留量[J]. 农药学学报, 2011, 13(6):613-620. Li Baotong, Zeng Xinnian, Ren Yonglin, et al. Determination of fumigant residues of cyanogen and its metabolite hydrogen cyanide in wheat by headspace gas chromatography[J]. Chin J Pestic Sci, 2011, 13(6):613-620(in Chinese) |
| [13] | 李保同, 曾鑫年, Ren Yonglin. 吹扫捕集法测定粮食中熏蒸剂氰与氰化氢残留量[J]. 中国粮油学报, 2013, 28(3):113-116. Li Baotong, Zeng Xinnian, Ren Yonglin. Determination of cyanogen and hydrogen cyanide residues of fumigant in cereals by GC with purge and trap Method[J]. J Chin Cereals Oils Assoc, 2013, 28(3):113-116, 128(in Chinese) |
| [14] | 李保同, Ren Yonglin, 曾鑫年. 氰在土壤中的吸附与转化[J]. 土壤学报, 2013, 50(2):237-243. Li Baotong, Ren Yonglin, Zeng Xinnian. Adsorption and transformation of cyanogen in soil[J]. Acta Pedologica Sinica, 2013, 50(2):237-243(in Chinese) |
| [15] | Scott Hofer Application Group. Determination of ammonia(salicylate) in 2 M KCl soil extracts by flow injection analysis(QuikChem Method 12-107-06-2-A)[Z]. Lachat Instruments 5600 Lindburgh Drive Loveland, Colorado 80539 USA, 2003:9. |
| [16] | Krista Knepel Applications Group. Determination of nitrate in 2 M KCl soil extracts by flow injection analysis(QuikChem Method 12-107-04-1-B)[Z]. Lachat Instruments 5600 Lindburgh Drive Loveland, Colorado 80539 USA, 2003:8. |
| [17] | 江利国. 几种因素对粮食吸附磷化氢能力影响程度的比较[J]. 粮食储藏, 1999, 28(4):18-22. Jiang Liguo. Comparison of effect of multifactors on grain adsorbing PH3[J]. Grain Stor, 1999, 28(4):18-22(in Chinese) |
| [18] | 程小丽, 姜建枝, 贾克强. 储粮中磷化氢残留的影响因素及预防措施[J]. 粮食加工, 2012, 37(4):81-83. Cheng Xiaoli, Jiang Jianzhi, Jia Keqiang. Influence factors of phosphine residue in stored grain and preventive measures[J]. Grain Processing, 2012, 37(4):81-83(in Chinese) |
 2015,Vol. 17
2015,Vol. 17


