2. 浙江工业大学教科学院, 杭州 310014
2. College of Educational Science & Technology, Zhejiang University of Technology, Hangzhou 310014, China
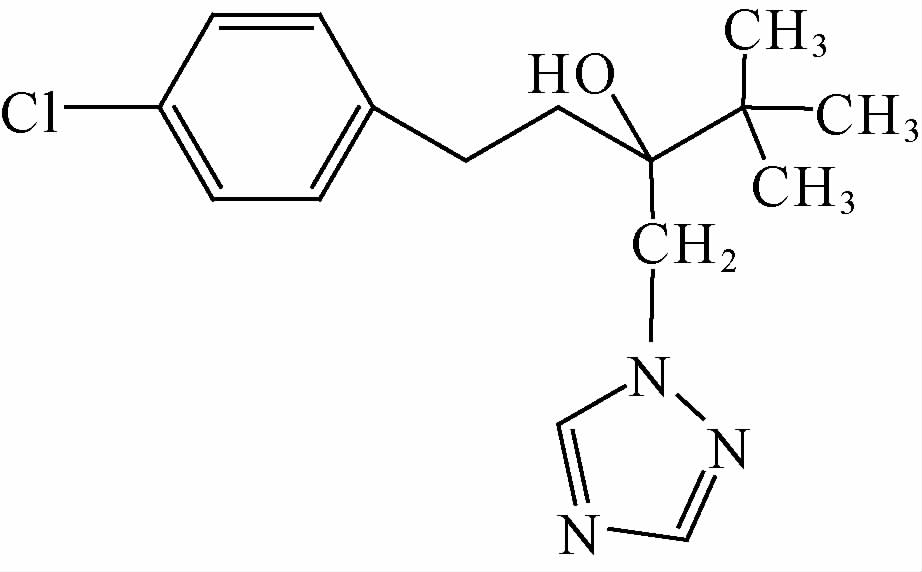
戊唑醇(tebuconazole,简称TEB,结构式如(I)所示)属于三唑类杀菌剂,具有高效、广谱和内吸性,主要用于由子囊菌、担子菌等真菌引起的多种病害的防治[1]。
|
戊唑醇(tebuconazole) (I) |
随着戊唑醇使用量的增加,由其残留所带来的环境污染问题日趋严重[2, 3],亟需先进的残留检测手段。目前,有关戊唑醇残留的检测方法很多,如液相色谱法(HPLC)、气相色谱法(GC)和色谱-质谱联用技术等,然而这些方法对于样品的要求高,需要复杂的样品前处理过程,并且仪器昂贵,检测过程复杂。因此,研究开发廉价、简便、易操作的新型检测技术具有重要的意义。电化学传感器因具有检测快捷、灵敏度高、价格低廉、易于微型化和自动化优点,在环境监测、食品分析等方面已受到关注,将其用于农药残留分析领域也已成为当前的研究热点[4, 5, 6, 7, 8, 9, 10]。
分子印迹电化学传感器是将分子印迹技术(Molecular imprinting technology,MIT)与电化学检测手段相结合,将分子印迹聚合物的特异识别性应用于电化学传感器,其同时具备分子印迹技术和电化学检测技术的优点,可大大提高分子检测的专一性和检测效率[11, 12, 13]。1994年,Mosbach等[14]根据MIT结合分析物后场效应电容器电容的改变,实现了对分析物的定量检测,由此揭开了分子印迹传感器蓬勃发展的篇章。González等[15]制备了对血清样品中的地高辛具有选择性识别性能的荧光传感器,采用多相竞争荧光分析法,用MIP膜检测地高辛的浓度,取得了令人满意的结果。Barrios等[16]制成了对恩诺沙星具有识别作用的微影分子印迹二维衍射光栅抗生素生物传感器,该传感器在用含三氟乙酸的甲醇溶液浸洗后分子印迹光栅可多次重复使用,并不降低其选择识别特性。Liang等[17]成功制备了检测牛奶中三聚氰胺的离子选择性分子印迹聚合物膜电位式传感器,该传感器可在较高离子干扰下快速检测目标分子。总之,分子印迹传感器的研究在国内外已取得了很大进展。
目前,以三唑类分子作为分子印迹的模板分子已陆续有研究结果,但用其制备分子印迹传感器还少有报道[18, 19, 20]。本研究拟利用分子印迹技术制备新型戊唑醇分子印迹电化学传感器,并通过电化学方法检测戊唑醇残留,同时利用多壁碳纳米管(multi-walled carbon nanotubes,CNTs)来提升分子印迹电化学传感器的性能。将功能化碳纳米管(functional carbon nanotubes,F-CNTs)作为基底材料修饰电极制备高选择性的新型传感器,预期在三唑类农残检测中具有广泛的应用前景[21, 22]。
1 材料与方法 1.1 仪器与试剂CHI660C 电化学工作站(上海辰华仪器有限公司,中国);三电极系统:玻碳电极(glassy carbon electrode,GCE,φ=3 mm) 为工作电极、饱和甘汞电极(saturated calomel electrode,SCE)为参比电极、铂电极为对电极。SS-550-IC型溅射仪(岛津,日本);SS-550型扫描电子显微镜(岛津,日本)。
99%戊唑醇(tebuconazole)原药、95%苯醚甲环唑(difenoconazole)原药及六氰合铁(Ⅲ)酸钾(分析纯),均为上海三鹰化学试剂有限公司产品;多壁碳纳米管 (CNTs,纯度>95%),中国科学院成都化学有限公司产品;甲基丙烯酸(MAA)、乙二醇二甲基丙烯酸酯(EDMA)等试剂均为分析纯;试验用水为二次蒸馏水。pH 7.2、0.02 mol/L的PBS 缓冲液由0.2 mol/L 的磷酸二氢钠和0.2 mol/L 的磷酸氢二钠(Na2HPO4·12H2O) 配制稀释而成。
1.2 戊唑醇分子印迹传感器制备 1.2.1 F-CNTs/GCE修饰电极的制备在抛光布上将玻碳电极(GCE) 用0.05 μm 的A12O3粉末抛光,大量二次蒸馏水冲洗后移入超声清洗仪中,依次用二次蒸馏水、无水乙醇和二次蒸馏水超声清洗(8 min/次),室温下晾干。处理后的电极浸入0.5 mol/L硫酸溶液中,在-0.8~0.8 V电位范围内以0.1 mV/s的速率进行循环伏安扫描,获得循环伏安曲线。羧基化碳纳米管F-CNTs 的制备及滴涂法制备F-CNTs/GCE 修饰电极参照文献方法[23, 24]获得,以F-CNTs/GCE 修饰电极为工作电极。
1.2.2 印迹传感器与非印迹电极的制备 1.2.2.1 印迹传感器(TEB-MIP/F-CNTs/GCE)的制备将0.077 3 g戊唑醇(TEB,模板分子)和0.086 1 g甲基丙烯酸(MAA,功能单体) 溶于乙腈,25 ℃预聚合12 h,加入0.042 8 g氯化锂(支持电解质)和1.011 3 g乙二醇二甲基丙烯酸酯(EDMA,交联剂),超声振荡配制成10 mL溶液。利用电化学聚合法制备印迹传感器:将三电极体系 (工作电极为F-CNTs/GCE 修饰电极,参比电极为甘汞电极,对电极为铂丝电极) 置于上述10 mL溶液中,在0.5~0.8 V电位范围内,以0.07 V/s的速率循环伏安扫描50圈,晾干后,再将电极浸入到体积比为V(甲醇)∶V(乙酸)=7∶3的洗脱液中洗脱4 min,获得保留有戊唑醇分子识别位点的印迹传感器(TEB-MIP/F-CNTs/GCE)。
1.2.2.2 非印迹电极(N-MIP/F-CNTs/GCE)的制备除不含戊唑醇外,其他制备过程与TEB-MIP/F-CNTs/GCE的制备过程相同。
1.3 传感器的电化学表征方法采用三电极电解池及CHI660C电化学工作站对电极/传感器进行电化学表征。
1.3.1 循环伏安法在含5.0 mmol/L K3Fe(CN)6的0.1 mol/L KCl 溶液中,于0.6 ~-0.2 V电位范围内进行循环伏安扫描,获取电极/传感器的循环伏安图。
1.3.2 交流阻抗谱表征以5.0 mmol/L 的[Fe(CN)6]4-/3-为氧化还原探针,在频率范围1×10-2~1×105 Hz、振幅0.005 V条件下,于0.1 mol/L 的氯化钾电解质溶液中进行电极/传感器的电化学阻抗表征。将TEB-MIP/F-CNTs/GCE 和N-MIP/FCNTs/GCE 用二次蒸馏水小心清洗后浸入1.0×10-5 mol/L 的戊唑醇溶液中10 min,再次清洗后进行电化学阻抗谱测试。
1.4 传感器的表观形貌分析采用SS-550-IC型溅射仪对电极/传感器进行喷金处理,在SS-550型扫描电子显微镜下观察不同电极/传感器表观形貌的变化。
1.5 传感器检测性能将传感器浸入0.02 mol/L 的PBS缓冲液(pH 7.2)中进行差分脉冲伏安扫描,记录未受农药抑制时传感器的峰电流I0;然后将该传感器浸入含不同浓度戊唑醇的上述缓冲液中抑制10 min,用二次蒸馏水洗净后再于上述缓冲液中进行差分脉冲伏安扫描,检测受农药抑制后传感器的峰电流I1,按公式(1)计算农药对该传感器的抑制率( I%)。同一传感器在含戊唑醇的溶液中平行测定10 次,检测该传感器对戊唑醇的响应性能和稳定性能。
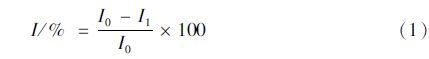
本研究以甲基丙烯酸为功能单体,戊唑醇为模板分子,乙二醇二甲基丙烯酸酯为交联剂,应用电化学聚合法制备了戊唑醇分子印迹电化学传感器(TEB-MIP/F-CNTs/GCE)。甲基丙烯酸是一类容易形成水溶性聚合物的单体分子,其结构上含有羧基,具有结合位点,可与戊唑醇形成氢键或通过静电作用等结合形成聚合物,再通过乙二醇二甲基丙烯酸酯交联可形成三维空间网络结构,若从三维空间网络结构上洗脱模板分子,则原被戊唑醇分子所占据的位置就形成了孔穴,继而形成了对戊唑醇具有特异识别的分子印迹膜。其制备原理如图 1所示。
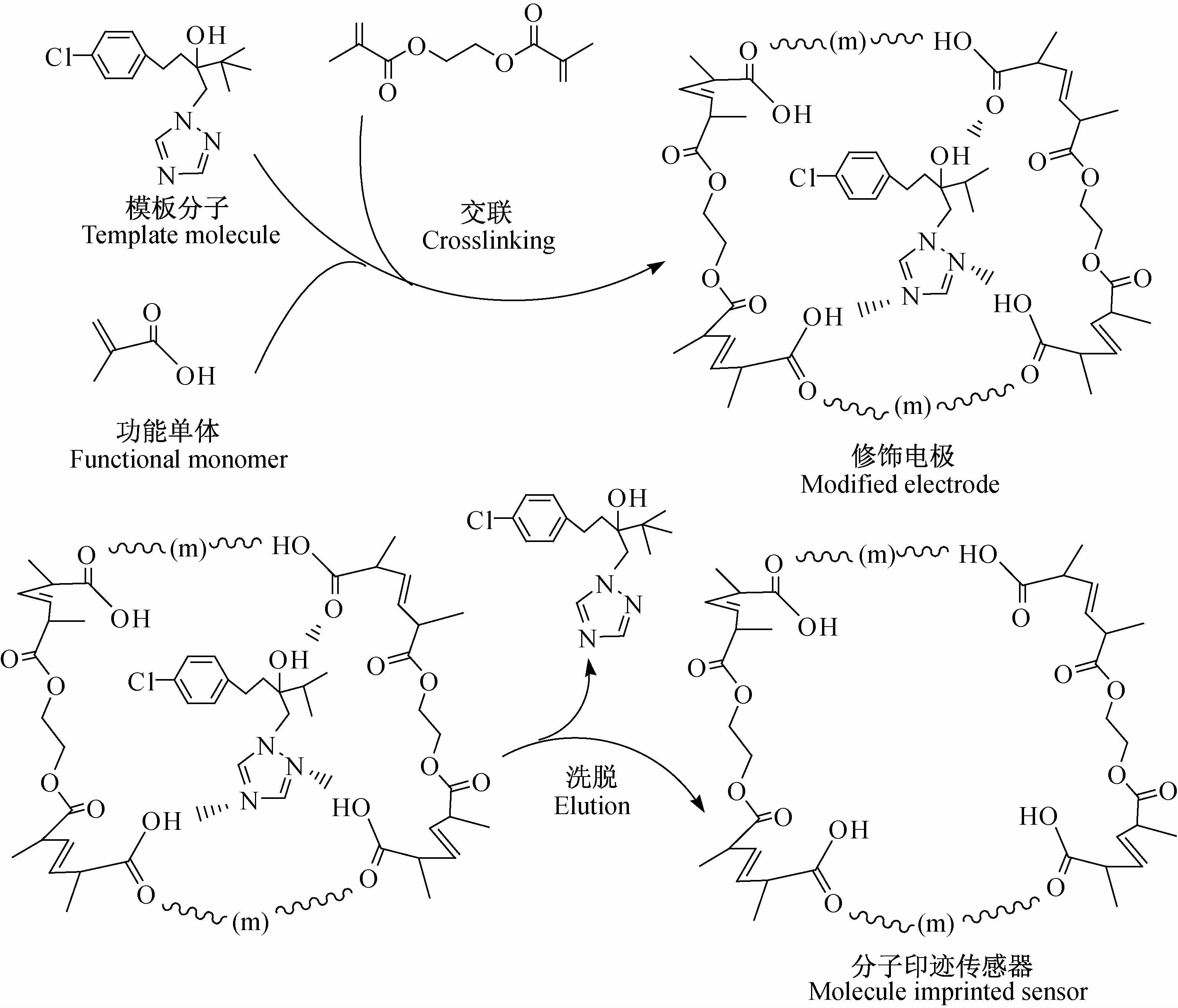 | 图 1 戊唑醇分子印迹电化学传感器的制备及特异性识别机理 Fig. 1 Preparation of the TEB MIP electrochemical sensor and its specific recognition mechanism |
戊唑醇分子印迹膜电聚合过程的循环伏安曲线见图 2。
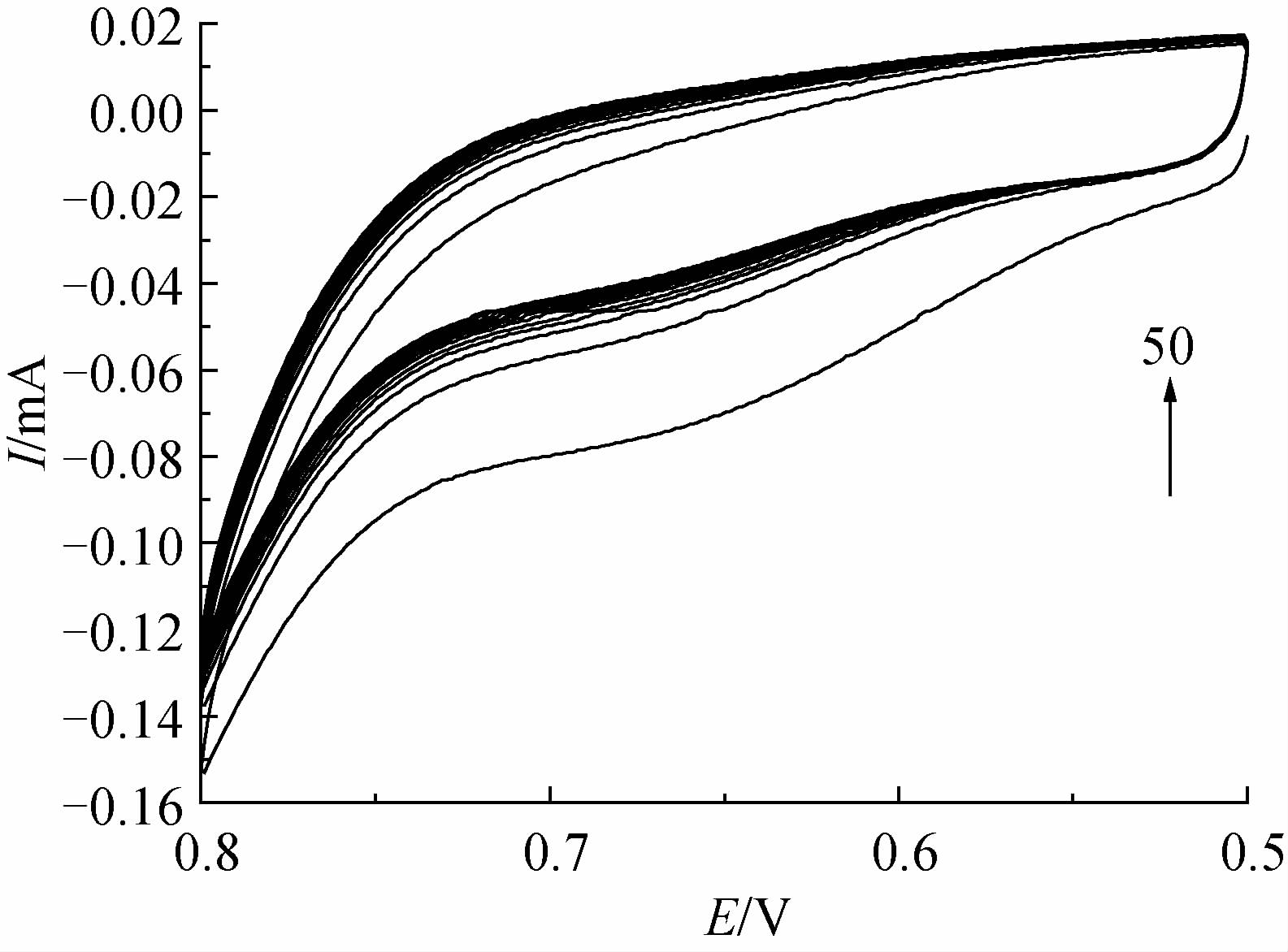 | 图 2 戊唑醇分子印迹膜电聚合过程的循环伏安 (CV)曲线 Fig. 2 Cyclic voltammograms for electropolymerization of imprinted film in the presence of TEB and non-imprinted film |
由图 2可知,在0.65 V附近有一个氧化峰,且随着扫描圈数的增加,峰强减弱。另外,图中曲线未出现还原峰,说明在电极表面的电聚合反应过程为不可逆反应。当扫描50 圈时,氧化峰的峰值不再有明显的减少,说明此时电极已经被分子印迹膜所覆盖,电极表面的电聚合反应不再发生。非印迹膜的电聚合循环伏安曲线与印迹膜的相同。表明戊唑醇分子在电聚合条件下不具有电活性,在印迹膜的电聚合过程中戊唑醇分子未被氧化,结构也未发生变化。
2.2.2 循环伏安法分析以Ke3Fe(CN)6为探针,采用循环伏安法对各电极进行电化学表征,结果见图 3。
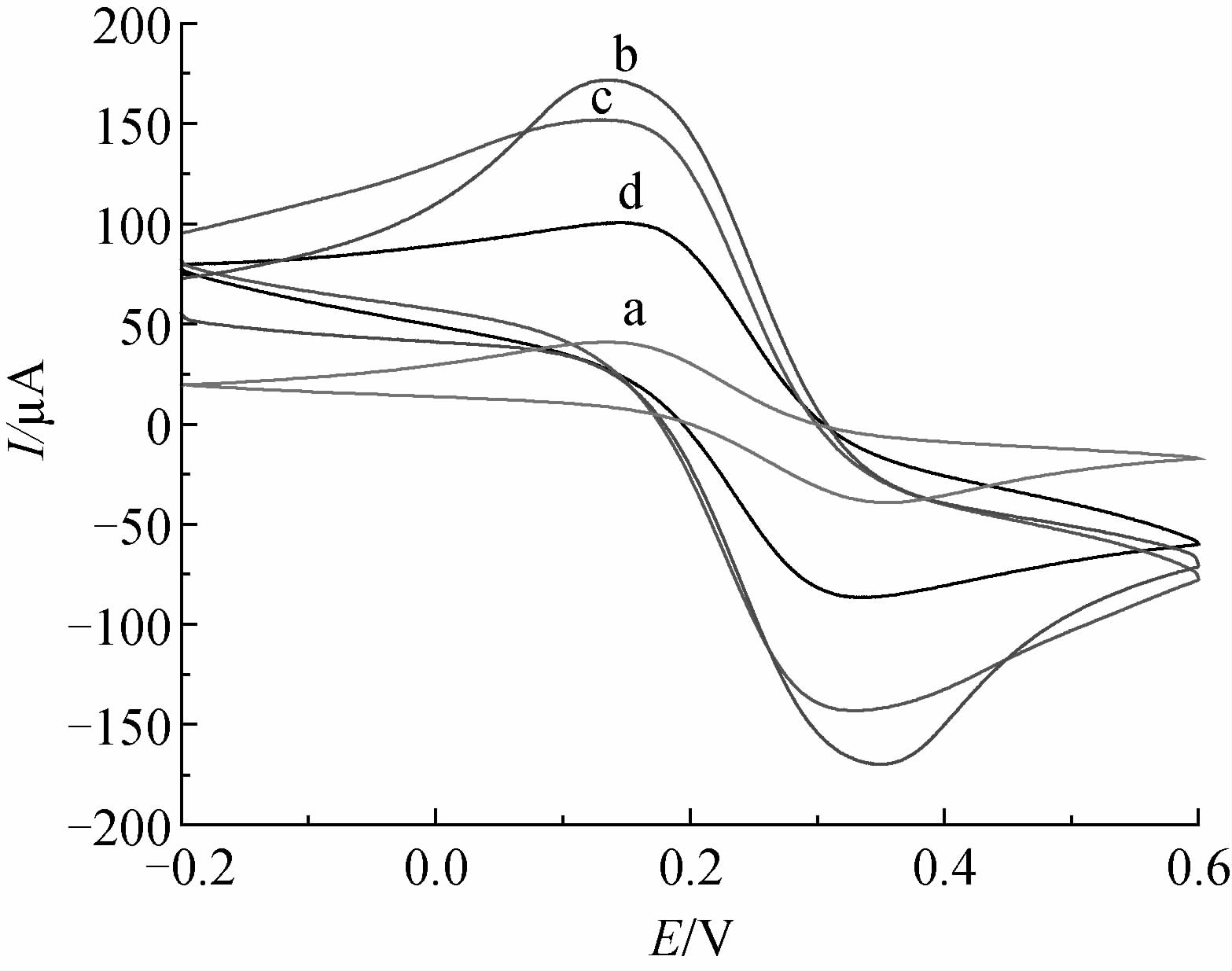
|
a. Bare GCE; b. F-CNTs/GCE; c. TEB-MIP/F-CNTs/GCE; d. N-MIP/F-CNTs/GCE 图 3 不同电极及传感器上的CV曲线 (扫描速率: 0.1 V/s) Fig. 3 Cyclic voltammetric responses at different electrodes/electrochemical sensors(scan rate: 0.1 V/s) |
从图 3可见,反应的氧化还原峰在各电极上都呈明显的对称性,说明探针离子在修饰电极上的电化学反应是准可逆过程。其中,探针[Fe(CN)6]4-/3-在F-CNTs/GCE(图 3b)上的峰电流最大,这是因为电极表面修饰F-CNTs之后,其表面积得到了极大程度的增加;探针在TEB-MIP/F-CNTs/GCE(图 3c)上的峰电流较F-CNTs/GCE上的小,是由于生成的印迹膜比较平整,阻碍了[Fe(CN)6]4-/3-在电极表面发生的氧化还原反应;而N-MIP/F-CNTs/GCE(图 3d)上的响应电流比TEB-MIP/F-CNTs/GCE上的峰电流更小,是因为非印迹膜相对于印迹膜而言更紧密、厚实,阻碍了探针[Fe(CN)6]4-/3-向电极表面扩散,导致峰电流较小。
数据表明,F-CNTs的存在有利于电子的转移,可有效改善原基底电极的性能。在各修饰电极表面出现了不同的CV曲线,可以认为电极修饰达到预期目的。结合图 3和图 4,对于可逆过程,在不同扫描速率下可根据Randles-Sevcik方程(2)计算修饰电极的表观表面积。
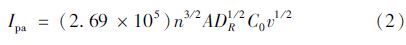
其中,Ipa为阳极峰电流,n为电子转移数,A为电极表观表面积,DR为扩散系数,C0为溶液浓度,v为扫描电位。当探针为K3Fe(CN)6,n=1,DR=7.60×10-6 cm2/s时,计算得到F-CNTs/GCE的表观表面积为0.194 8 cm2,相比于裸电极(表观表面积0.120 0 cm2),其表观表面积大幅度增大,说明F-CNTs的加入增大了电极的表观表面积,更有利于待测物质发生吸附和富集,增强电信号。而TEB-MIP/F-CNTs/GCE和N-MIP/F-CNTs/GCE的表观表面积分别为0.183 2 cm2和0.114 6 cm2,比F-CNTs/GCE分别减少了5.95%和41.17%,同样证明了上述的结果分析。
传感器在不同扫描速率下的循环伏安结果和峰电流与扫描速率平方根的关系如图 4所示。
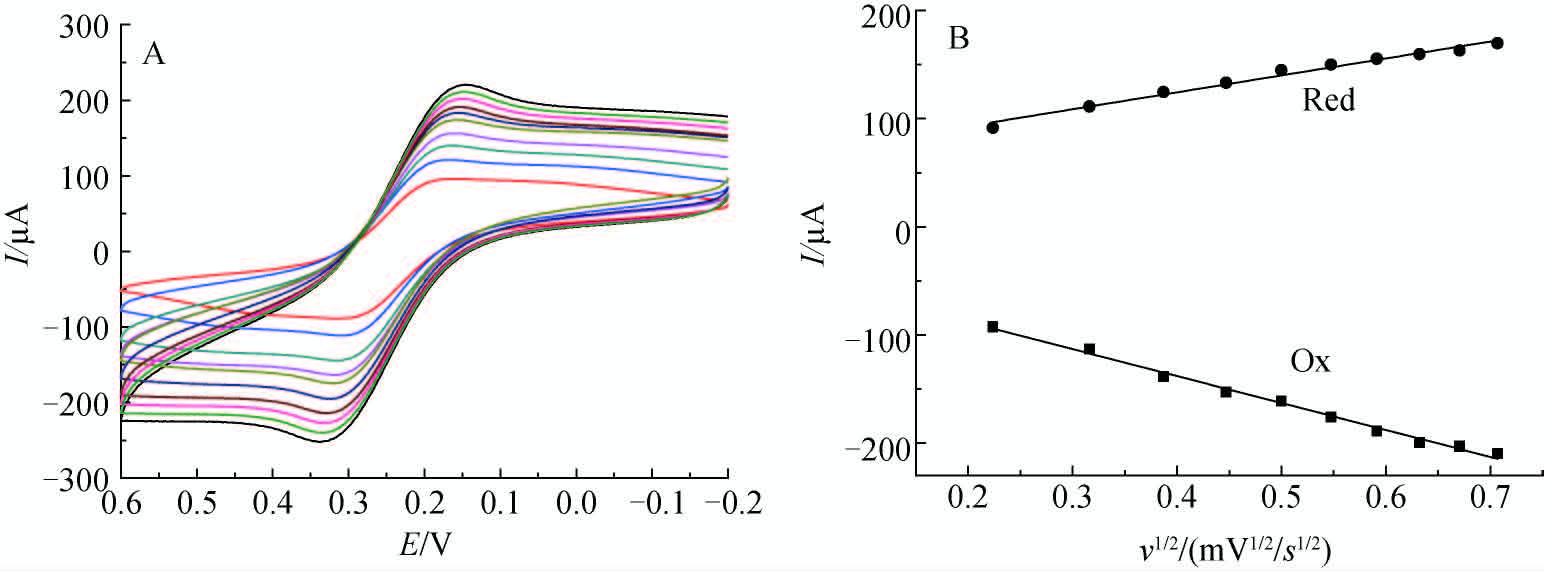
|
扫描速率(scan rates): 50,100,150,200,250,300,350,400,450,500 mV/s; c([Fe(CN)\-6]4-/3-)=5.0 mmol/L; c(KCl)=0.1 mol/L 图 4 传感器在不同扫描速率下的循环伏安图 (A) 和峰电流与扫描速率平方根的关系图 (B) Fig. 4 Cyclic voltammograms of sensor at different scan rates (A) and the dependence of peak currents vs. v1/2 (B) |
由图 4可知,随着扫描速率增加,电极反应的氧化峰电流和还原峰电流与扫描速率的平方根呈线性关系,其线性回归方程列于表 1。
|
|
表 1 扫描速率平方根对峰电流的拟合方程 Table 1 Fitting equation of the square root of scan rate on the peak current |
结合图 4 和表 1 可知,随着扫描速率的增加,峰电流相应增加,峰电流与扫描速率的平方根呈良好的线性关系,说明TEB-MIP/F-CNTs/GCE传感器反应过程受扩散控制。
2.2.3 交流阻抗谱分析对各电极/传感器进行电化学阻抗表征,得到交流阻抗谱,如图 5所示。
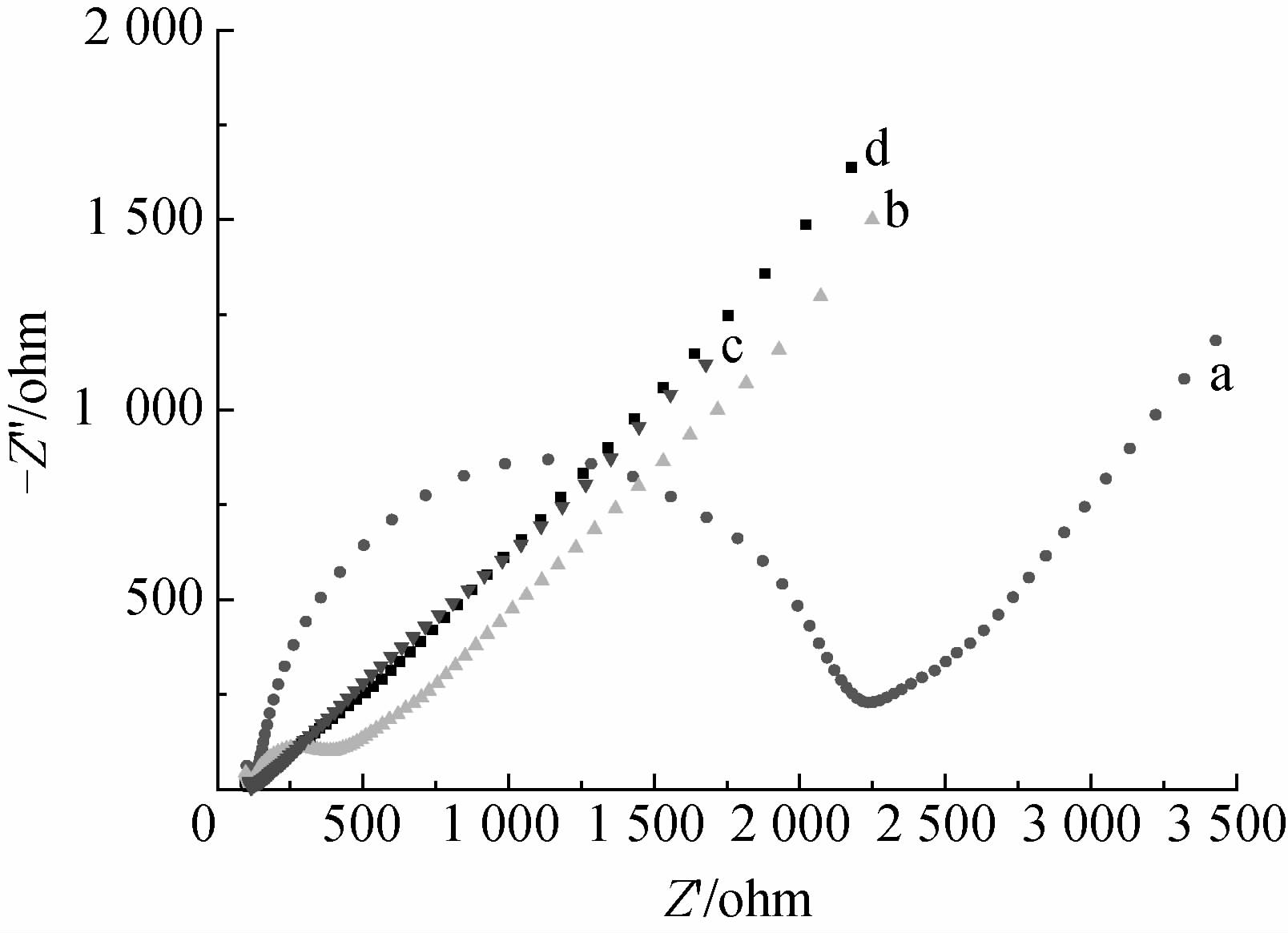
|
a. Bare GCE; b. F-CNTs/GCE; c. TEB-MIP/F-CNTs/GCE; d. N-MIP/F-CNTs/GCE。 图 5 不同电极/传感器在[Fe(CN)6]4-/3-+KCl 溶液中的交流阻抗谱 Fig. 5 A.C. impedance spectra of different electrodes in [Fe(CN)6]4-/3-+KCl solution |
由图 5可知:裸电极(图 5a)在高频区出现了弧形,低频区则呈线性,说明电极反应过程受电子转移和扩散联合控制。裸电极的界面电子传递阻力(Ret)很大,将CNTs修饰到电极表面后,各修饰电极/传感器电子传递阻力明显减少,电子传递加速。探针[Fe(CN)6]4-/3-在F-CNTs/GCE(图 5b)、TEB-MIP/F-CNTs/GCE(图 5c)和N-MIP/F-CNTs/GCE(图 5d)上未出现明显半圆形电子阻抗谱,而是以直线为主,说明此时电子转移阻抗很小,电极/传感器反应过程主要受扩散步骤控制。阻抗变化说明TEB-MIP/F-CNTs复合膜已成功地修饰到电极表面。
2.2.4 各电极/传感器的形貌表征采用扫描电镜(SEM) 分别对裸电极(bare GCE)、F-CNTs/GCE修饰电极、N-MIP/F-CNTs/GCE修饰电极和IMI-MIP/F-CNTs/GCE传感器表面进行表征,结果见图 6。

|
A.Bare GCE; B.F-CNTs/GCE; C.N-MIP/F-CNTs/GCE; D.TEB-MIP/F-CNTs/GCE。 图 6 各电极/传感器的扫描电镜图(×1 000) Fig. 6 The SEM images of different electrodes/ electrochemical sensors (×1 000) |
图 6A 显示,裸电极表面光滑平整,无杂质。由图 6B 可见,电极表面明显被一层F-CNTs 所覆盖,与图 6A 相比,说明F-CNTs 已成功修饰到电极上; 由图 6D 可见,在经过电聚合过程后的传感器TEB-MIP/F-CNTs/GCE 上,其F-CNTs 粒子已明显被一层膜所覆盖,表明印迹膜层成功地修饰到了电极上;N-MIP/F-CNTs/GCE 电极表面(图 6C) 已几乎完全被非印迹膜覆盖,这可能是由于相对于TEB-MIP/F-CNTs/GCE传感器,N-MIP/F-CNTs/GCE 在聚合过程中没有模板分子阻碍聚合物链的增长,致使其聚合度相对较大,聚合膜相对较厚、较紧致。应用分子印迹技术得到的印迹膜为有一定孔径分布的多孔结构,这有利于戊唑醇的吸附和分离。
2.3 TEB-MIP/F-CNTs/GCE传感器对农药的检测性能 2.3.1 TEB-MIP/F-CNTs/GCE传感器的特异性识别性能将TEB-MIP/F-CNTs/GCE 和N-MIP/F-CNTs/GCE分别置于含1.0×10-5 mol/L 戊唑醇的PBS缓冲液(0.02 mol/L,pH 7.2) 中,观察印迹膜传感器上的电流降低值ΔIp随吸附时间的变化。结果见图 7。
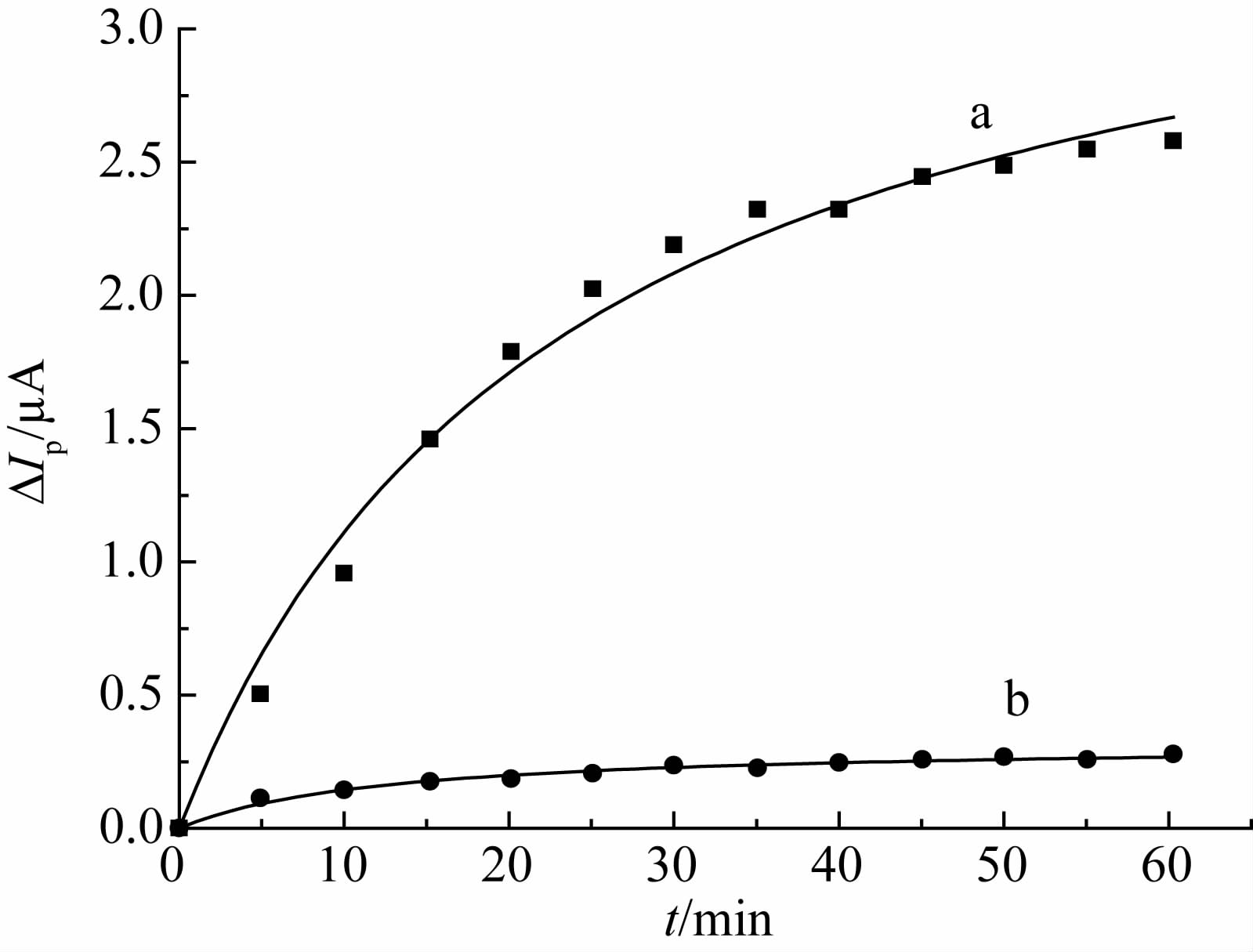 | 图 7 TEB-MIP/F-CNTs/GCE(a)和N-MIP/F-CNTs/ GCE(b) 对戊唑醇的识别动力学曲线 Fig. 7 Recognition kinetic curves of the imidacloprid at TEB-MIP/F-CNTs/GCE(a) or N-MIP/F-CNTs/GCE(b) |
假设模板分子与识别位点的结合符合一级动力学方程,根据Langmuir 吸附模型,利用公式(3)拟合上述TEB-MIP/F-CNTs/GCE 和N-MIP/F-CNTs/GCE 吸附戊唑醇的动力学曲线。

其中: ΔIp表示t 时刻传感器吸附溶液中戊唑醇的响应电流变化值,ΔIpm为平衡时的响应电流变化值,t代表吸附时间,k为动力学速率常数。得到拟合参数见表 2。
|
|
表 2 TEB-MIP/F-CNTs/GCE 和N-MIP/FCNTs/ GCE 的吸附动力学曲线参数 Table 2 Adsorption kinetic parameters of TEB-MIP/ F-CNTs/GCE or N-MIP/F-CNTs/GCE |
根据ΔIpm的值计算TEB-MIP/F-CNTs/GCE对N-MIP/F-CNTs/GCE 的印迹因子α(α=ΔIpm(TEB-MIP)ΔIpm(N-MIP)) 为11.486。由此可知,印迹膜的存在增强了TEB-MIP/F-CNTs/GCE 的特异识别性能。由图 7可见,随着吸附时间的增长,电流降低值ΔIp逐渐增大,25 mim 后趋于稳定,意味着TEB-MIP/FCNTs/GCE 对戊唑醇的响应达到平衡。
2.3.2 TEB-MIP/F-CNTs/GCE传感器对农药的差分脉冲分析TEB-MIP/F-CNTs/GCE传感器在PBS缓冲液(0.02 mol/L,pH 7.2)中进行差分脉冲伏安法检测,结果见图 8。
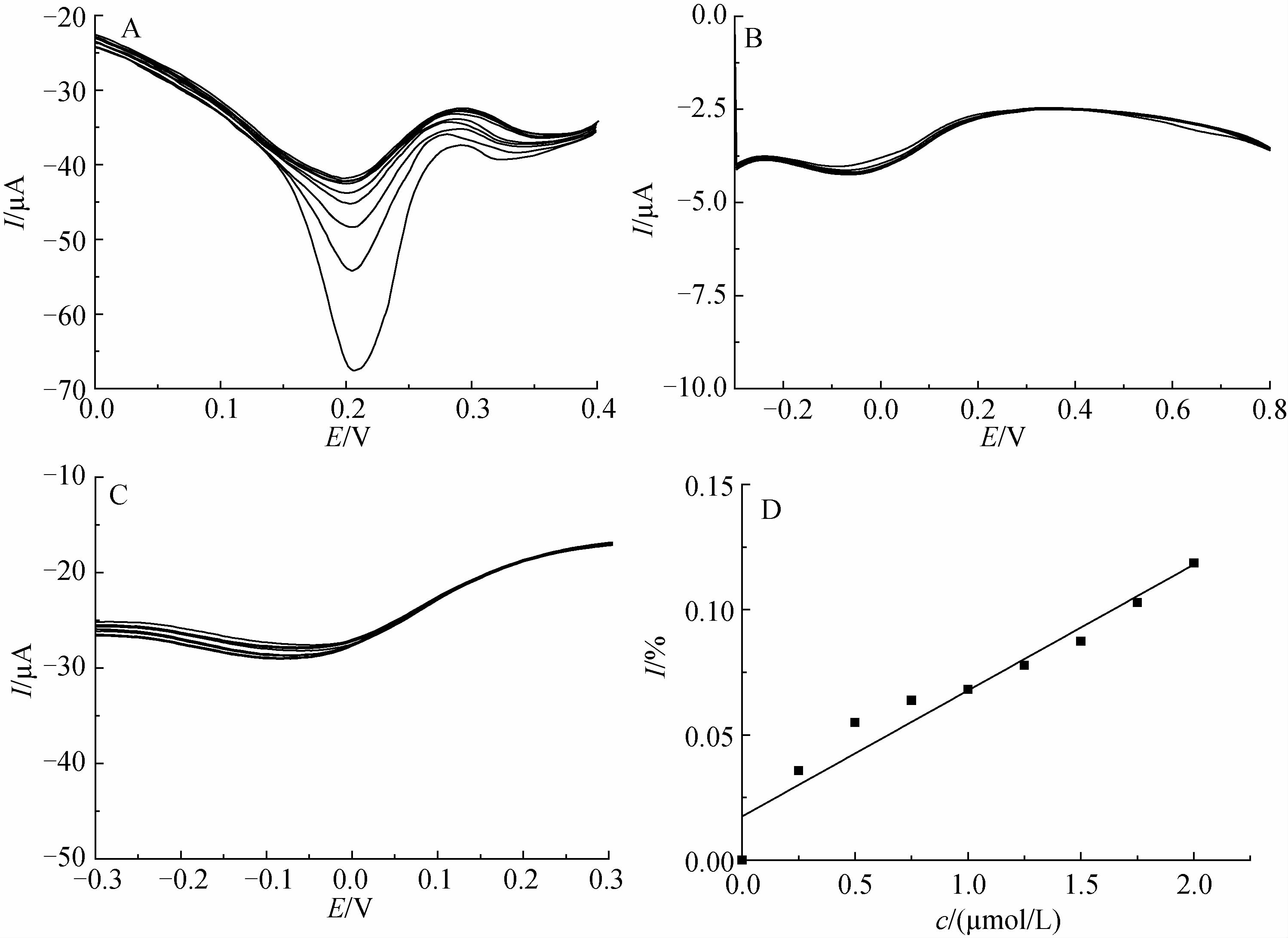 | 图 8 TEB-MIP/F-CNTs/GCE对戊唑醇(A)和苯醚甲环唑(B)的差分脉冲伏安图、N-MIP/F-CNTs/GCE 对戊唑醇的差分脉冲伏安图(C)及峰电流与戊唑醇浓度的关系图(D) Fig. 8 The differential pulse voltammetry of TEB-MIP/F-CNTs/GCE for tebuconazole (A) and difenoconazole (B) and the differential pulse voltammetry of N-MIP/F-CNTs/GCE for tebuconazole relationship between peak current(C) and tebuconazole concentration (D) |
图 8A为TEB-MIP/F-CNTs/GCE对戊唑醇的DPV图,显示了传感器对不同浓度戊唑醇检测的响应情况。从中可以看出:峰电流变化明显,随戊唑醇浓度的增加,峰电流增加,表明印迹传感器对模板分子戊唑醇已具有识别性能。同时,图 2所示的氧化峰为0.65 V,而图 8A所示的氧化峰为0.2 V,是因为在电聚合过程中出现了自由基负离子,因而影响了电位的响应结果所致。从图 8B可以看出:峰电流基本无变化,说明所制备的分子印迹传感器与苯醚甲环唑结合能力弱,其选择性能良好。从分子结构上来看,戊唑醇和苯醚甲环唑都属于三唑类化合物,具有相似的结构,而戊唑醇分子上有羟基,苯醚甲环唑上没有,以致于戊唑醇上更容易形成氢键,并且苯醚甲环唑多含有一个苯环以及三唑环的位置与戊唑醇的不同,导致苯醚甲环唑的结构与传感器印迹膜上的识别位点的空间构型不匹配,二者结合能力弱,以至于电流变化相较于戊唑醇的相应结果不明显。图 8C表明非印迹膜上没有模板分子的识别位点,戊唑醇在N-MIP/F-CNTs/GCE上无响应,电流变化不明显。图 8D表明,峰电流与戊唑醇浓度在小于2.0×10-6 mol/L范围内呈现良好的响应特性。其相关方程见表 3。
|
|
表 3 峰电流与戊唑醇浓度的关系数据拟合方程 Table 3 The fitting equation of relationship between peak current and tebuconazole concentration |
综合图 8和表 3的结果可以看出,传感器的电流强度和戊唑醇浓度间存在一定的关系,并且可在cTEB≤2.0×10-6 mol/L范围内进行定量检测。
2.3.3 传感器的重复性同一支传感器在含1.0×10-5 mol/L戊唑醇的溶液中平行测定7次,峰电流值的相对标准偏差(RSD)为1.59%,说明该传感器对戊唑醇的响应性稳定;采用5支不同的传感器对1.0×10-5 mol/L戊唑醇的溶液进行测定,RSD为0.84%。
需要说明的是,碳纳米管本身具有非特异性吸附性能,其巨大的比表面积对检测对象(戊唑醇)也应具有吸附能力。本研究采用双层膜电极,碳纳米管为底层,MAA和EMDA形成的印迹膜为上层,由于印迹膜层已将碳纳米管覆盖,从而尽可能地减弱了碳纳米管层对戊唑醇的吸附能力。而在制备的目标传感器中,碳纳米管主要起到了增强导电能力的作用。
2.4 传感器的机理分析及等效电路模型建立利用Zview软件对上述裸电极及各电极/传感器的交流阻抗谱(图 5)进行拟合,得到相应的等效电路图,见图 9。其模型为R1(CPE1(R2(CPE2(R3))))。
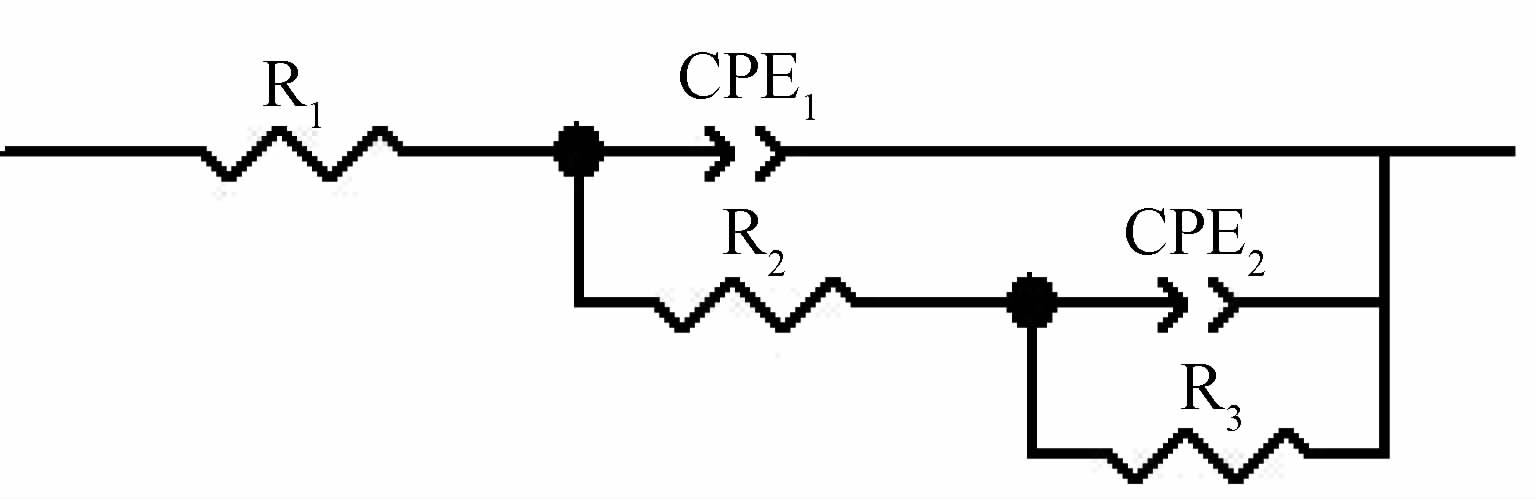 | 图 9 各电极/传感器的交流阻抗谱模型 Fig. 9 Equivalent circuit model of electrochemical impedance spectra of each electrodes and sensors |
图 9中R1表示电极外表面和参比电极之间的溶液电阻,CPE1表示表征双电层电容的常相位元件,CPE2为法拉第反应过程双电层电容的常相位元件,R2为电子迁移阻抗,R3为Warburg阻抗。由等效电路计算得到的相关元件的参数值见表 4。可以看出,裸电极的阻抗谱在高频段为一偏心半圆的容抗弧,表明体系出现了弥散效应,这是由于电极表面与溶液界面的不均匀所致。由于电极是在含 5.0 mmol/L K3Fe(CN)6的0.1 mol/L氯化钾溶液中进行测试,因此R1值不大,电流可较易在参比电极与裸电极之间进行传输。从图 5 可以看出,裸电极的直线斜率小于F-CNTs/GCE、TEB-MIP/F-CNTs/GCE和N-MIP/F-CNTs/GCE电极/传感器的直线斜率,说明加入碳纳米管和分子印迹膜修饰的电极表面的电容性更好。
|
|
表 4 各电极/传感器等效电路各元件参数值 Table 4 The equivalent circuit parameters of each electrodes/sensors |
采用F-CNTs修饰的电极R1明显减小,说明F-CNTs的加入增大了印迹膜与电极表面的结合能力,改善了阻抗性能。采用F-CNTs修饰的电极的电子转移电阻R2明显小于表面没有任何增强电子转移物质的裸电极,说明F-CNTs可极大地提高电子传递速率,减小电阻。TEB-MIP/F-CNTs/GCE的R2明显大于N-MIP/F-CNTs/GCE的R2,这可能是因为前者在电极表面形成的印迹膜,一方面增大了[Fe(CN)6]4-/3- 通过膜时的阻力,另一方面使[Fe(CN)6]4-/3- 向电极表面扩散的有效截面积进一部减小。用n(0~1) 来表示弥散效应的大小,n 值越小,表示弥散效应越大,电极表面越粗糙;当n=1时无弥散效应[23]。TEB-MIP/F-CNTs/GCE的n值最小,为0.397 34,说明TEB-MIP/F-CNTs/GCE表面的粗糙程度最大,与其他各电极/传感器有明显的区别。R3大于R1和R2,说明电极受电子转移阻抗的影响小,电极反应扩散控制加强,电极呈Warburg扩散阻抗特征,这与交流阻抗的研究结果一致。
3 结论本研究以甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,戊唑醇为模板分子,应用电聚合法制备了印迹膜电极并构建传感器。采用循环伏安法、差分脉冲伏安法及交流阻抗法对传感器的性能进行了表征。结果表明:该制备方法具有可行性;TEB-MIP/F-CNTs/GCE对模板分子戊唑醇的选择识别性能良好,且在cTEB≤2.0×10-6 mol/L范围内传感器峰电流与cTEB存在定量关系,线性方程为I%=0.050 34cTEB+ 0.017 4。所制备的传感器具有良好的稳定性和重现性。同时,本研究建立了印迹分子传感器的交流阻抗谱等效电路模型,数据模拟分析获得传感器电学阻抗谱等效电路模型为R1(CPE1(R2(CPE2(R3)))),计算等效电路各元件参数证明该模型能有效模拟传感器检测戊唑醇的传感机理。可应用于印迹传感器检测机理的分析,进而对农药残留目标进行靶向设计传感器,达到高效应用传感器的目的。本研究结果为选择性检测三唑类农药(如戊唑醇)提供了一种新的有效方法,在农药检测领域具有一定的参考意义。
| [1] | 张之行, 孙绪兵, 梁孝生. 杀菌剂戊唑醇的合成研究[J]. 农药科学与管理, 2004, 25(5):23-25. Zhang Zhixing, Sun Xubin, Liang Xiaosheng. Study on synthesis of the new fungicide tebuconazole[J]. Pestic Sci Admin, 2004, 25(5):23-25(in Chinese) |
| [2] | 华乃震. 杀菌剂戊唑醇的剂型与应用[J]. 农药, 2013, 52(11):781-786. Hua Naizhen. Formulation and application of fungicide tebuconazole[J]. Agrochemicals, 2013, 52(11):781-786(in Chinese) |
| [3] | 史长生. 农药残留危害以及检测技术的分析[J]. 食品研究与开发, 2009, 31(9):218-221. Shi Changsheng. Pesticide residue hazards and the analysis of detection techniques[J]. Food Res Devel, 2009, 31(9):218-221(in Chinese) |
| [4] | Wu Y T, Zhang Y H, Zhang M, et al. Selective and simultaneous determination of trace bisphenol A and tebuconazole in vegetable and juice samples by membrane-based molecularly imprinted solid-phase extraction and HPLC[J]. Food Chem, 2014, 164(10):527-535. |
| [5] | Yang J, Wang Q, Zhang M, et al. An electrochemical fungicide pyrimethanil sensor based on carbon nanotubes/ionic-liquid construction modified electrode[J]. Food Chem, 2015, 187(11):1-6. |
| [6] | Zhang W, Tang Y, Liu J, et al. An electrochemical sensor for detecting triglycerid based on biomimetic polydopamine and gold nanocomposite[J]. J Mat Chem, 2014, 2(12):8490-8495. |
| [7] | 袁永海, 李建平. 电化学生物传感器在农药检测中的应用[J]. 分析测试学报, 2006, 25(5):121-127. Yuan Yonghai, Li Jianping. Applications of electrochemical biosensor for detecting pesticides[J]. J Instrum Anal, 2006, 25(5):121-127(in Chinese) |
| [8] | 孙春燕, 李宏坤, 平红, 等. AuNPs/Sol-gel复合膜法固定乙酰胆碱酯酶生物传感器检测有机磷农药[J]. 高等学校化学学报, 2011, 32(11):2533-2538. Sun Chunyan,Li Hongkun,Ping Hong,et al. Determination of organophosphorus pesticides using a biosensor based on acetylcholinesterase immobilized by Au nanoparticles/sol-gel composite membrane[J]. Chem J Chinese Univ, 2011, 32(11):2533-2538(in Chinese) |
| [9] | Gan T, Hu S S. Electrochemical sensors based on graphene materials[J]. Microchim Acta, 2011(175):1-19. |
| [10] | 张静, 顾婷婷. 直接电化学酶传感器的研究进展[J]. 辽宁科技大学学报, 2009, 32(5):460-465. Zhang Jing, Gu Tingting. Development of direct electrochemical enzyme sensor[J]. J Univ Sci Tech Liaoning, 2009, 32(5):460-465(in Chinese) |
| [11] | Yang G, Zhao F. A novel electrochemical sensor for the determination of lidocaine based on surface-imprinting on porous three-dimensional film[J]. J Mat Chem C, 2014, 2(12):10201-10208. |
| [12] | 郭明, 谭贤, 梁东军, 等. 吡虫啉分子印迹电化学传感器的制备及电学传感机理分析[J]. 农药学学报, 2014, 16(5):559-569. Guo Ming, Tan Xian, Liang Dongjun, et al. Preparation of imidacloprid imprinted electrochemical sensor and its electrical sensing mechanism[J]. Chin J Pestic Sci, 2014, 16(5):559-569(in Chinese) |
| [13] | 王艳玲, 刘俊渤, 孙佳妮, 等. 恩诺沙星与甲基丙烯酸分子印迹作用的理论研究[J]. 高分子学报, 2013(12):1525-1530. Wang Yanling, Liu Junbo, Sun Jiani, et al. Theoretical studies on molecular imprinted interaction between enrofloxacin and methacrylic acid[J]. Acta Polymerica Sinica, 2013(12):1525-1530(in Chinese) |
| [14] | 余会成, 黄学艺, 谭学才, 等. 基于电聚合的苯巴比妥分子印迹电化学传感器的制备及其应用研究[J]. 分析测试学报, 2014, 33(7):752-757. Yu Huicheng, Huang Xueyi, Tan Xuecai, et al. Preparation and application of phenobarbital electrochemical sensor based on molecular imprinted technique and electropolymerization membrane[J]. J Instrum Anal, 2014, 33(7):752-757(in Chinese) |
| [15] | Gonzalez G P, Hernando P F, Alegria J S D. An optical sensor for the determination of digoxin inserum samples based on a molecularly imprinted polymer membrane[J]. Analytica Chimica Acta. 2009, 638(2):209-212. |
| [16] | Barrios C A, Zhenhe C, Navarro-Villoslada F, et al. Molecularly imprinted polymer diffraction grating as label-free optical bio(mimetic) sensor[J]. Biosensors and Bioelectronics, 2011, 26(5):2801-2804. |
| [17] | Liang R N, Zhang R M, Qin W. Potentiometric sensor based on molecularly imprinted polymer for determination of melamine in milk[J]. Sensor and Actuators B:Chemical, 2009, 141(2):544-550. |
| [18] | 胡静, 褚建功, 高文惠. 三唑醇分子印迹聚合物的制备及在食品检测中的应用[J]. 药物分析杂志, 2011, 31(12):2260-2265. Hu Jing, Chu Jiangong, Gao Wenhui. Preparation of triadimenol molecularly imprinted polymer and its application in food detection[J]. Chinese J Pharmaceut Anal, 2011, 31(12):2260-2265(in Chinese) |
| [19] | 彭畅, 刘维娟, 张春涛, 等. 识别三唑类农药的片段印迹聚合物的合成及在固相萃取中的应用[J]. 高等学校化学学报, 2009, 30(11):2159-2164. Peng Chang, Liu Weijuan, Zhang Chuntao, et al. Preparation of a fragment imprinted polymer for recognition of triazole pesticides and its application to solid-phase extraction[J]. Chem J Chinese Univ, 2009, 30(11):2159-2164(in Chinese) |
| [20] | 高文惠, 庞军, 王姣姣, 等. 联苯三唑醇分子印迹电化学传感器的制备及识别性能研究[J]. 现代食品科技, 2015, 31(1):96-100. Gao Wenhui, Pang Jun, Wang Jiaojiao, et al. Preparation and recognition properties of a bitertanol electrochemical sensor based on molecular imprinting technology[J]. Modern Food Sci Technol, 2015, 31(1):96-100(in Chinese) |
| [21] | 胡陈果, 王万录. 碳纳米管的电化学性质及其应用研究[J]. 功能材料, 2005, 36(5):730-733. Hu Chenguo, Wang Wanlu. Investigation of electrochemical properties and their applications on CNT electrodes[J]. J Functional Mat, 2005, 36(5):730-733(in Chinese) |
| [22] | Du D, Wang M H. Sensitive acetylcholinesterase biosensor based on assembly of β-cyclodextrins on to multiwall carbon nanotubes for detection of organophosphates pesticide[J]. Sens Actuators:B, 2010, 146(1):337-341. |
| [23] | 郭明, 梁东军, 谭贤. 农药残留检测用新型碳纳米管固载酶生物传感器的制备及其电学传感性能分析[J]. 农药学学报, 2014, 16(3):319-329. Guo Ming, liang Dongjun, Tan Xian. Preparation of new carbon nanotubes immobilized enzyme biosensor for pesticide residue detection and analysis of its electrochemical sensing properties[J]. Chin J Pestic Sci, 2014, 16(3):319-329(in Chinese) |
| [24] | Calfuman K, Aguirre M J, Villagra D. Nafion/tetraruthenated porphyrin glassy carbon-modified electrode:characterization and voltammetric studies of sulfite oxidation in water-ethanol solutions[J]. J Solid State Electrochem, 2010, 14(6):1065-1072. |
 2015, Vol. 17
2015, Vol. 17


