2. 军事医学科学院卫生学环境医学研究所, 天津市环境与食品安全风险监控技术重点实验室, 天津 300050;
3. 天津市农业质量标准与检测技术研究所, 天津 300381
2. Institute of Health and Environment Medicine, Academy of Military Medical Sciences, Tianjin Key Laboratory of Risk Assessment and Control Technology for Environment and Food Safety, Tianjin 300050, China;
3. Tianjin Institute of Agricultural Quality Standard and Testing Technology, Tianjin 300381, China
莠去津(atrazine,以下简称AT)属于三嗪类除草剂,由汽巴-嘉吉公司于1958年开发并生产,因其除草活性高、价格低廉,曾为世界上产量最高的除草剂,目前仍被大量使用[1]。但是由于其残留期长、使用范围广以及水溶性高等特点[2],已广泛残留于地表水、地下水和土壤中,造成了一定的环境污染[3, 4, 5]。虽然其急性毒性低,但长期高浓度暴露仍可造成动物心脏、肾脏和肝脏损伤,长期低浓度暴露则具有致癌性和致畸性,同时会影响内分泌系统和生殖系统[6],目前已被明确列为内分泌干扰物[7, 8]。因此,建立快速、灵敏、准确的莠去津残留检测方法对于保护环境、保障饮水和农产品安全具有重要意义。
目前,常用的莠去津残留检测方法为基于色谱和色谱-质谱联用的仪器分析法[9, 10, 11],这类方法虽然具有灵敏度高、重现性好等优点,但并不适于现场快速检测。表面等离子体共振(surface plasmon resonance,SPR)技术是20世纪90年代发展起来的新型传感技术,具有样品无需标记、可实时监测、检测时间短和易于小型化等优点[12]。该技术早期主要用于研究生物大分子之间的相互作用[13],随后逐渐应用于环境检测[14]及食品安全等领域[15]。在农药残留检测方面,通常是将SPR传感技术与免疫分析技术结合,构建SPR免疫传感检测系统实现农药残留检测[16, 17]。中国科学院电子学研究所崔大付课题组利用自行研制的多参数SPR生物传感器,采用间接竞争免疫法,对莠去津残留进行检测,检测限为10 ng/mL[18]。本课题组通过设计半抗原和优化传感条件,对SPR免疫传感检测莠去津残留的方法进行了改进,将莠去津检出限降低至2.34 ng/mL[19]。随着SPR传感检测技术的发展,将金属纳米材料引入SPR生物传感系统,以提高对目标物检测的灵敏度,是目前SPR免疫传感检测方法的研究方向之一[20]。磁性纳米材料不仅具有磁导向性、生物相容性和生物降解性等特点,还可以改变SPR折射率[21]。将磁性纳米材料与目标物抗体偶联后,作为识别元件引入SPR免疫传感检测系统,通过磁性纳米材料与SPR传感芯片上金属膜发生表面等离子体局域耦合,可增强传感响应信号[22]。本研究将磁性纳米微球(MNP)作为传感信号增强材料引入SPR免疫传感检测系统,建立MNP增强信号的SPR免疫传感检测方法(图 1),实现对水中痕量莠去津残留的检测。
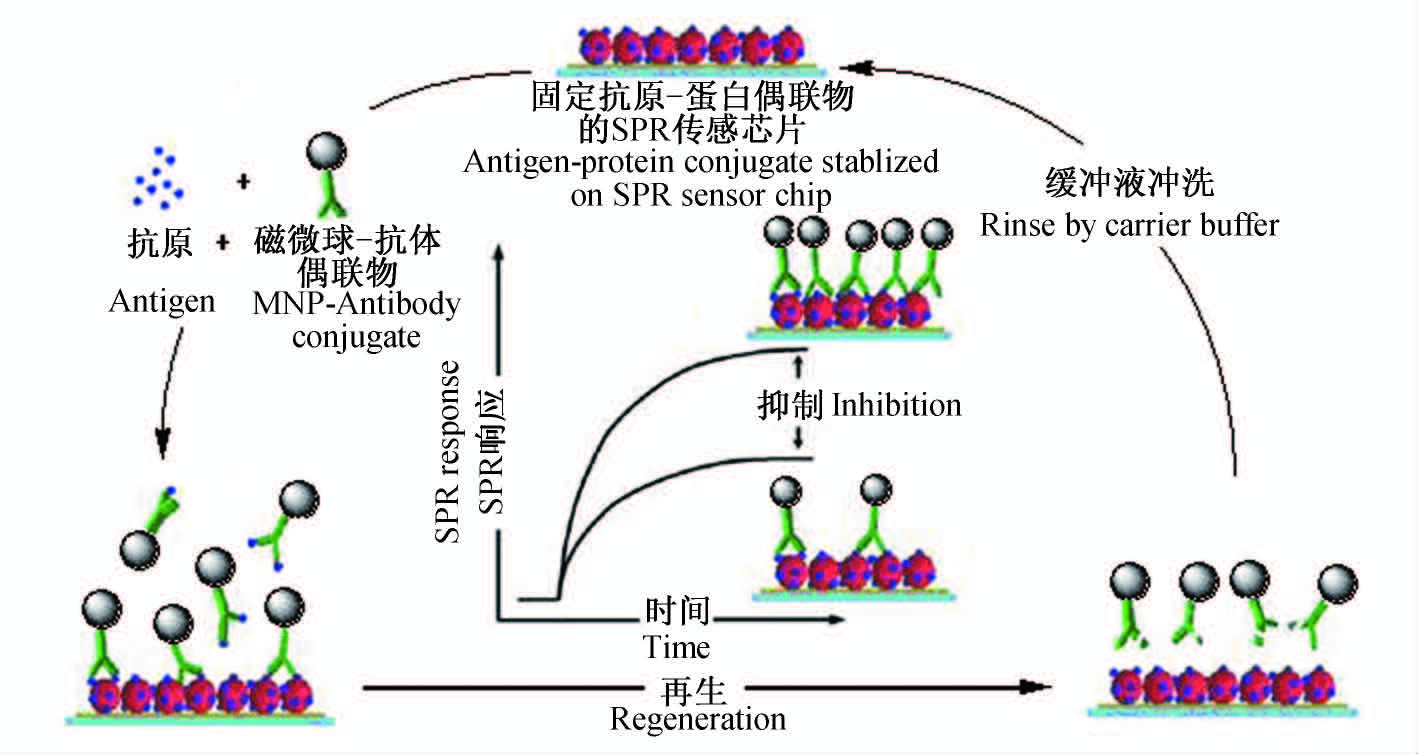 | 图 1 磁性纳米微球参与的间接竞争免疫检测原理示意图 Fig. 1 Schematic view of the indirect competitive inhibition immunoassay with magnetic nanoparticles |
SPR传感器(Autolab ESPRIT,荷兰);纳米磁颗粒分离器(WJZX,全军卫生监测中心定制,中国);透射电子显微镜(日立H-7650,日本);高效液相色谱仪(Agilent 1200,美国);电子天平(METTLER TOLEDO AL-204,美国);紫外分光光度仪(普析通用TU-1901,中国);超纯水设备(Milli-Q Advantage A10,美国);漩涡振荡器(IKA MS-3,德国);0.22 μm滤器(BIOFIC,美国)。
1.2 药剂及试剂莠去津(atrazine)标准品(99.8%)(美国Sigma-Aldrich);莠去津单克隆抗体(AT-mAb,2.5 mg/mL)、莠去津完全抗原(AT-OVA)、Piranha洗液、磷酸盐缓冲液含体积分数为0.005%的吐温-20(PBST,pH 7.5)和醋酸-醋酸钠缓冲液(10 mmol/L,pH 4.5)(天津市环境与食品安全风险监控重点实验室自制);N-羟基琥珀酰亚胺(NHS)、1-乙基3-(3-二甲氨基)碳二亚胺盐酸盐(EDC·HCl)和牛血清白蛋白(BSA)(美国Sigma-Aldrich);巯基十一酸(MUA)(中国北京百灵威科技有限公司); 磁性纳米微球(MNP,表面修饰羧基的磁性四氧化三铁微球,粒径50~100 nm,质量浓度5.0 mg/mL)(无锡中德伯尔生物技术有限公司);乙醇胺、十二烷基磺酸钠(SDS)、吐温-20(Tween-20)等其他试剂均为国产分析纯, 使用前未经纯化处理;实验用水为18.2 MQ·cm超纯水;除特别指明外,实验所用溶剂均为PBST。
1.3 试验方法 1.3.1 莠去津单克隆抗体与磁性纳米微球偶联参考文献方法[23],通过NHS/EDC活化法将莠去津单克隆抗体(AT-mAb)与磁性纳米微球偶联。首先将10 μL NHS/EDC(质量浓度均为50 mg/mL)溶液和80 μL 醋酸-醋酸钠缓冲液加入500 μL一定质量浓度的MNP溶液中,室温下涡旋振荡(600 r/min)20 min,使MNP表面的羧基活化。将其置于纳米磁颗粒分离器的外加磁场中静置分离,以去除过量的NHS和EDC。加入500 μL 25 μg/mL的 AT-mAb溶液,室温下涡旋振荡(600 r/min)4 h,进行偶联反应。再将反应产物于纳米磁颗粒分离器的外加磁场中静置,分离去除上清液中未偶联的AT-mAb。利用BSA溶液将MNP表面未与AT-mAb偶联的羧基封闭,封闭后所制得的偶联物(AT-mAb-MNP)溶液经PBST清洗后待用。
1.3.2 偶联条件优化 1.3.2.1 MNP质量浓度优化分别将终浓度为0.01、0.10、1.00、5.00 mg/mL的MNP溶液与终浓度为25 μg/mL的AT-mAb进行偶联,通过实验室前期建立的SPR免疫传感检测系统[13]分析各AT-mAb-MNP偶联物的响应信号,确定MNP的最佳偶联质量浓度。
1.3.2.2 AT-mAb质量浓度优化在1.3.2.1节确定的MNP最佳质量浓度下,分别以终浓度为25、50、100 μg/mL的AT-mAb进行偶联反应,通过SPR免疫传感系统分别检测偶联物和上清液中分离出的过量AT-mAb的质量,以确定AT-mAb的最佳偶联质量浓度。
1.3.3 SPR传感检测芯片的制备及其稳定性测试参考课题组前期建立的方法[19],先将莠去津完全抗原(AT-OVA)固定在经NHS/EDC活化处理的SPR传感检测芯片表面,再经乙醇胺溶液封闭和盐酸溶液再生后制备SPR传感检测芯片。采用不同质量浓度的AT-OVA溶液(0.01、0.1、0.5、1.0、2.0 mg/mL)分别进行固定化试验,以确定其最佳固定化浓度。间隔1 d后检测相同浓度的AT-mAb与所制备SPR传感检测芯片的结合性能,以测定其稳定性。
1.3.4 SPR免疫传感检测条件优化根据间接竞争免疫分析原理,以所制备的偶联物AT-mAb-MNP代替莠去津单克隆抗体(AT-mAb),建立信号增强的SPR免疫传感检测方法,并对检测条件进行优化。
1.3.4.1 结合时间优化偶联物AT-mAb-MNP与固定在SPR传感检测芯片表面的AT-OVA通过抗原抗体特异性结合反应而结合,分别选择300、900、1 800 s作为结合时间,通过比较SPR响应信号的变化对结合时间进行优化。
1.3.4.2 AT-mAb-MNP质量浓度优化将1.3.2节通过偶联条件优化后制备的偶联物AT-mAb-MNP溶液用PBST进行梯度稀释(稀释倍数分别为2、4、8倍),将AT-mAb-MNP原溶液和稀释后的溶液分别用SPR免疫传感检测系统分析,选择最佳AT-mAb-MNP质量浓度进行后续间接竞争免疫检测。
1.3.5 间接竞争免疫检测方法将最佳浓度的AT-mAb-MNP偶联物与经PBST稀释的莠去津标准液(质量浓度为0、8、40、100、250、500、2 500、5 000 ng/mL)混合后加入SPR免疫传感检测系统,其中莠去津与AT-OVA竞争结合AT-mAb-MNP,随着系统中莠去津浓度的增大,其与AT-mAb-MNP的结合逐渐增加,导致与SPR传感检测芯片结合的AT-mAb-MNP减少,SPR传感响应信号降低。以莠去津浓度对数与SPR响应信号抑制率作图,绘制标准曲线,计算检测方法的检出限和检测范围,并进行实际样品添加回收试验。
1.3.5.1 检测方法的准确度和精密度以取自天津市空港经济区的自来水为基质样品,配制含莠去津终浓度为10、100、1 000 ng/mL的供试样品,经0.22 μm滤器过滤后进行添加回收试验,每个浓度3组平行,测试添加回收率,以考察方法的准确度。通过检测莠去津质量浓度为10、100、1 000 ng/mL的自来水样品,每个样品3组平行,3片SPR传感检测芯片,比较批内和批间差异,以测试方法的精密度。
1.3.5.2 检测方法比对试验以莠去津质量浓度分别为1.0、2.0、5.0 ng/mL的自来水溶液为测试样品,分别采用SPR免疫传感检测系统和HPLC检测方法[24]测定其中莠去津的含量,进行检测方法的比对。
2 结果与讨论 2.1 偶联条件优化 2.1.1 MNP浓度优化在SPR免疫传感检测系统中,抗体用量应遵从以下原则:即应保证抗体在SPR传感检测芯片表面的结合量接近饱和水平,以使目标物和完全抗原有效地竞争结合抗体[25, 26]。AT-mAb-MNP偶联物代替单克隆抗体参与间接竞争免疫反应,同样应遵循该原则。MNP质量浓度与AT-mAb-MNP偶联物在SPR免疫传感系统中响应信号的关系如图 2所示。可见:当MNP的质量浓度由0.01 mg/mL增加至1.0 mg/mL时,SPR响应信号显著增大,说明此时SPR传感检测芯片表面结合的AT-mAb-MNP尚未达到饱和;而当MNP质量浓度大于1.0 mg/mL后,SPR响应信号进入平台期,说明SPR传感检测芯片表面结合的AT-mAb-MNP趋于饱和。故最终选择1.0 mg/mL作为MNP的最佳偶联质量浓度。
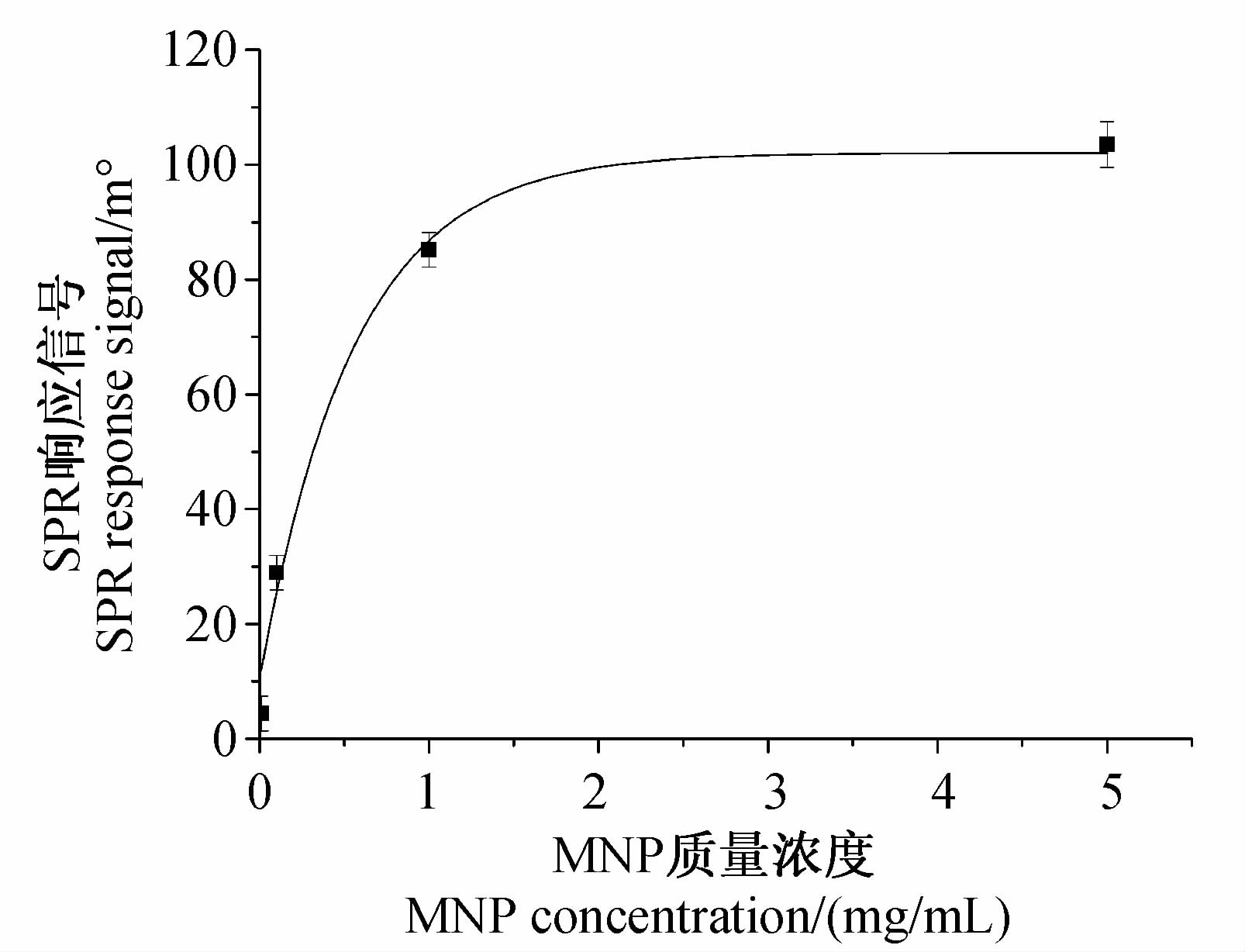 | 图 2 MNP浓度与偶联物SPR响应信号关系 Fig. 2 Relationship between MNP concentration and SPR response of the conjugate |
通过透射电镜(TEM)对MNP和AT-mAb-MNP的形貌进行了表征,结果见图 3。其中A为MNP形貌图,其粒径为50~100 nm;B为AT-mAb-MNP偶联物形貌图,MNP与莠去津单克隆抗体偶联后再用BSA封闭,由于偶联产物外部被BSA包裹,故粒径有所增加。
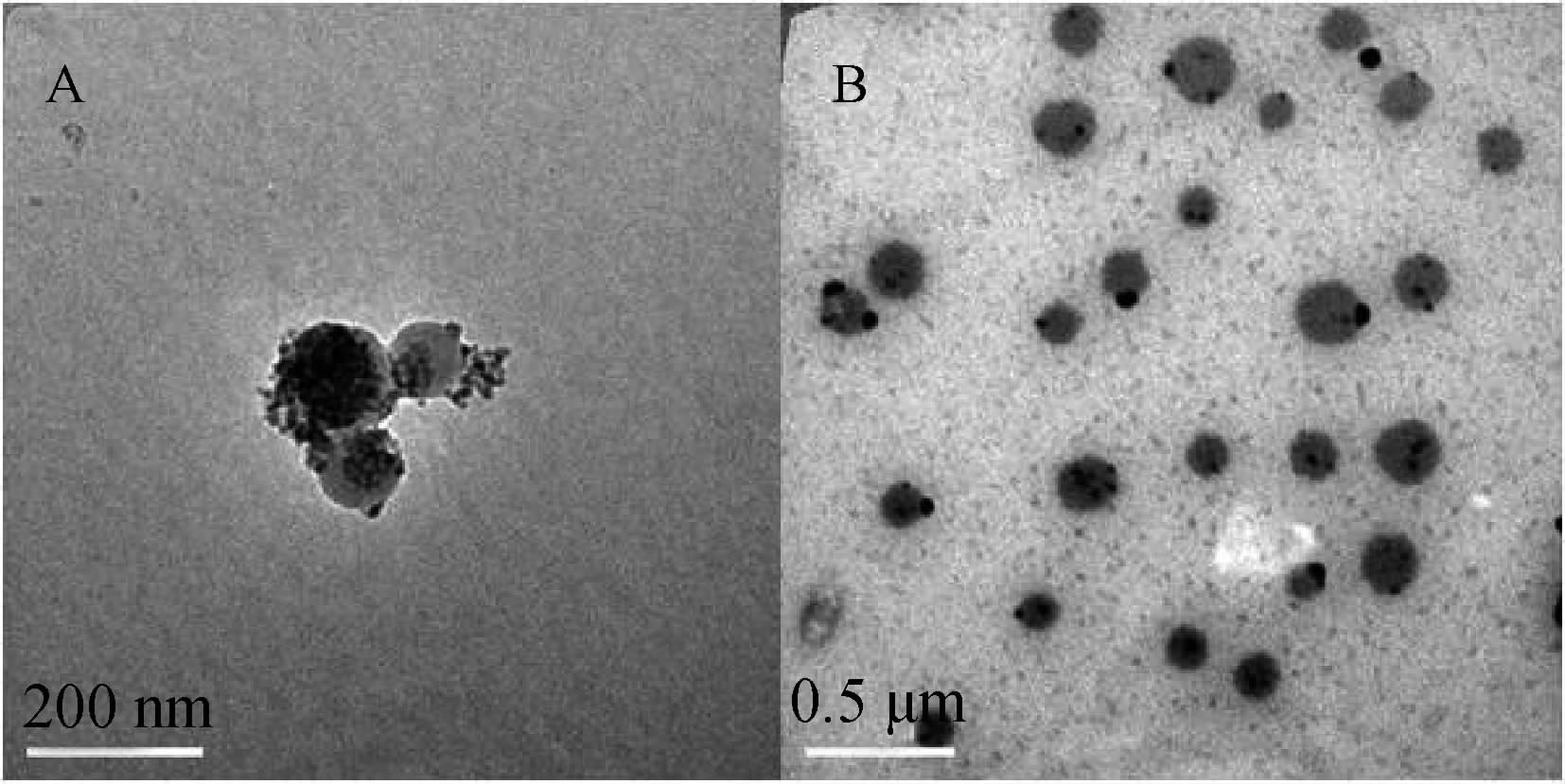 | 图 3 用透射电镜(TEM)表征的MNP和 AT-mAb-MNP形貌图 Fig. 3 TEM images of MNP and AT-mAb-MNP |
不同质量浓度的AT-mAb与1.0 mg/mL的 MNP偶联后,偶联物及上清液中过量的AT-mAb的SPR响应信号值见表 1。其中,采用25 μg/mL的AT-mAb与MNP进行偶联时,SPR响应信号值为50 μg/mL AT-mAb时的54.1%,且上清液中未检测到AT-mAb,说明25 μg/mL的AT-mAb质量浓度较低,不足以与MNP完全偶联;而100 μg/mL的AT-mAb又比50 μg/mL所得偶联物的响应信号值降低了8.6%,且上清液中AT-mAb的响应信号明显上升,表明此时AT-mAb显著过量。因而最终选择50 μg/mL作为AT-mAb的最佳偶联浓度。
|
|
表 1 AT-mAb偶联浓度优化结果 Table 1 AT-mAb coupling concentration optimization results |
不同浓度的AT-OVA在SPR传感检测芯片表面固定化的结果见图 4。可见:随着AT-OVA质量浓度的增加,SPR响应信号值逐渐增大;而当AT-OVA质量浓度大于1.0 mg/mL后,SPR响应值增加变缓,说明此时AT-OVA在SPR传感检测芯片表面的固定化趋于饱和。故选择1.0 mg/mL作为AT-OVA的最佳固定化浓度。
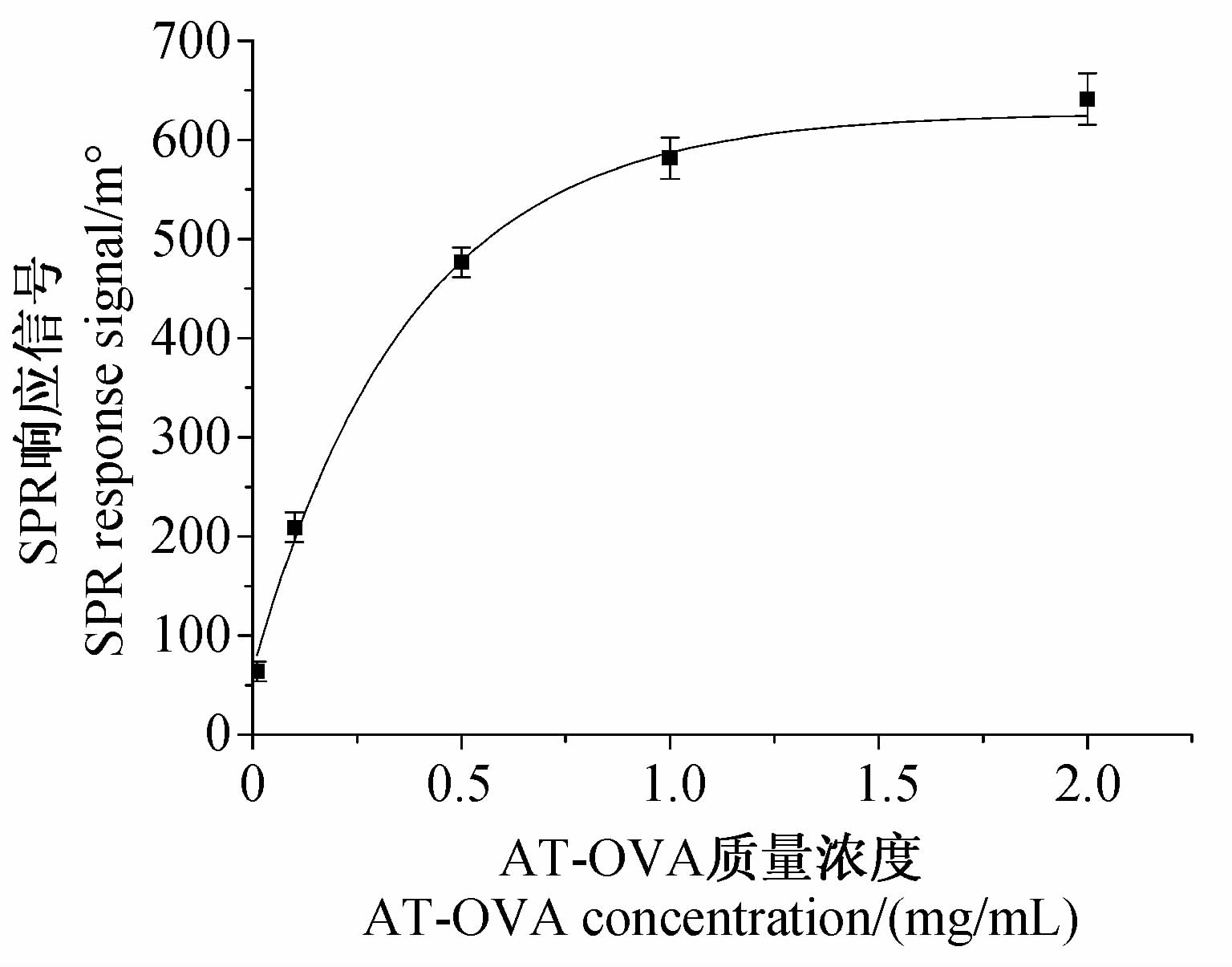 | 图 4 AT-OVA固定化浓度与SPR响应信号的关系 Fig. 4 Relationship between AT-OVA immobilizing concentration and SPR response signal |
设第1天测得的SPR响应信号值为R0,第2天及以后每天测得的SPR 响应信号值为R。以测试天数为横坐标,R/R0为纵坐标制图,结果见图 5。可见,尽管从第5天开始 SPR响应信号小幅下降,但第6天信号值仍可保持在首次测试的65%,表明所制备SPR传感检测芯片的稳定性可以满足检测需求。
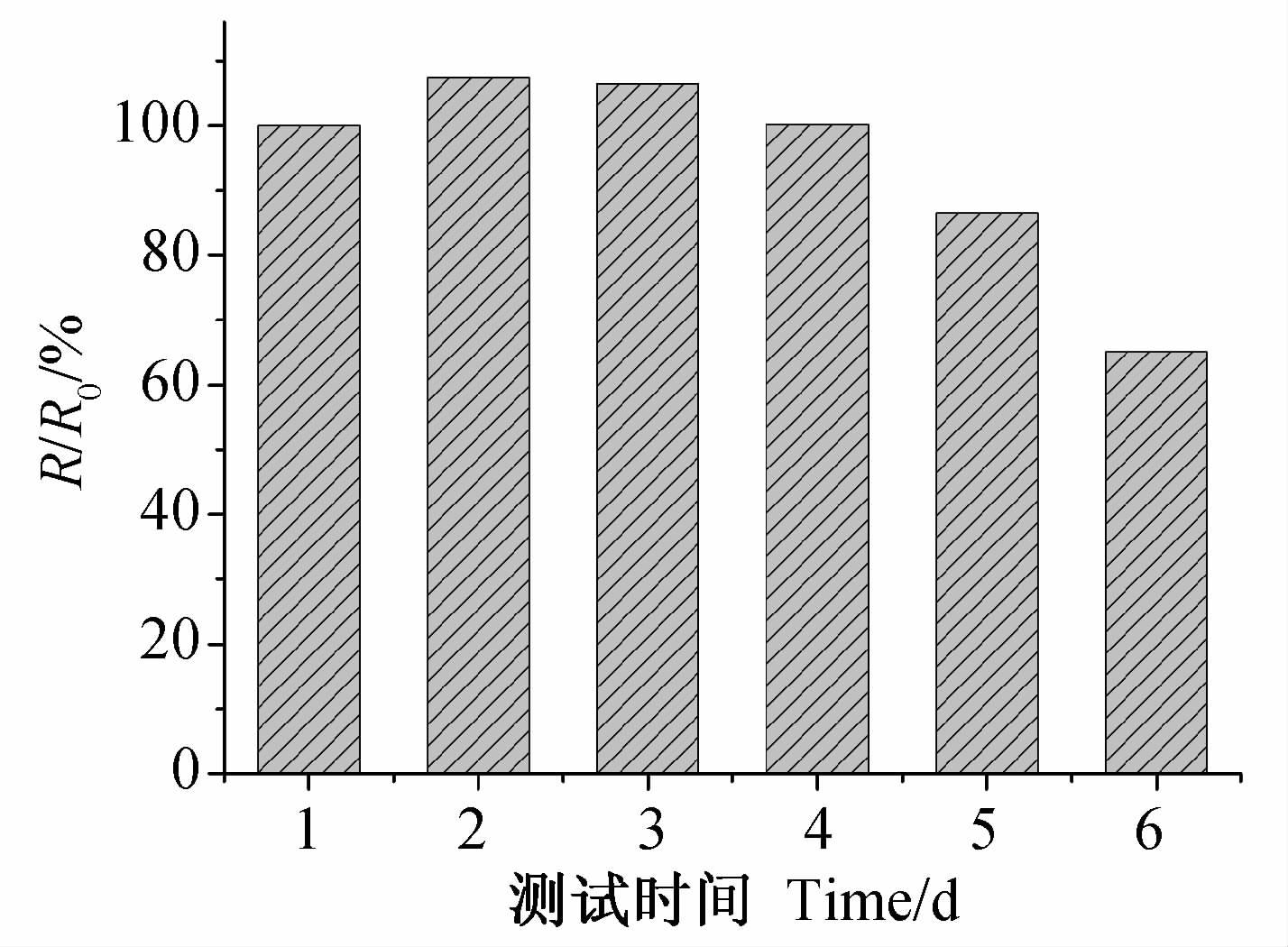 | 图 5 SPR传感检测芯片的稳定性 Fig. 5 Stability test for SPR sensing chip |
结果(表 2)表明,室温(20 ℃±1 ℃)下结合反应900 s(15 min)时,AT-mAb-MNP 与SPR传感检测芯片表面AT-OVA 的结合已接近饱和,故将其作为最佳结合时间。
|
|
表 2 结合时间与SPR响应信号的关系 Table 2 Relationship between coupling time and SPR response |
AT-mAb-MNP浓度对SPR免疫传感检测方法的灵敏度和检测范围影响显著(图 6)。其中2倍稀释的AT-mAb-MNP(原液质量浓度为1.0 mg/mL,以MNP计)的SPR响应信号值下降了33%,且强度适中,兼顾成本因素,故将其作为最佳浓度进行后续试验。
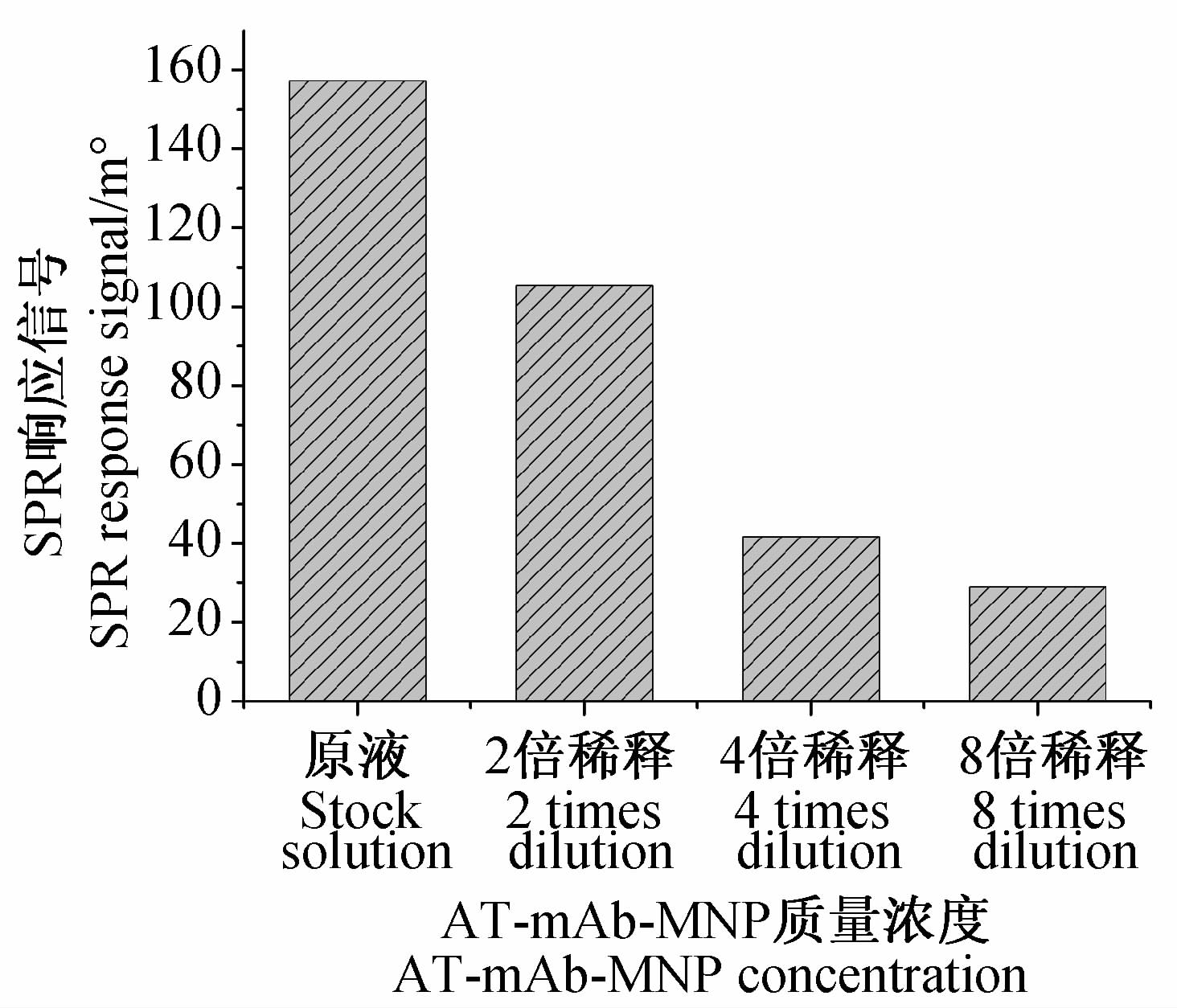 | 图 6 AT-mAb-MNP浓度与SPR响应信号的关系 Fig. 6 Relationship between AT-mAb-MNP concentration and SPR response |
以莠去津质量浓度为0 ng/mL时SPR的响应信号值为R0,其他质量浓度下为R,计算抑制率(R0-R)/R0。间接竞争抑制曲线(图 7)线性拟合回归方程为y=0.239 7x-0.074 3,R2=0.982,检测范围8.62~7.18×103 ng/mL,检出限为0.89 ng/mL(S/N=3)。与本课题组前期研究中未经MNP增强的SPR免疫传感方法相比[19],本方法在莠去津质量浓度为100 ng/mL时的SPR响应信号相对增强了52%(未经MNP增强时SPR响应信号为40.8 m°,增强后为62.0 m°),检出限由2.34 ng/mL降低至0.89 ng/mL,检测范围由5.75~1.82×102 ng/mL扩大至8.62~7.18×103 ng/mL,信号强度、灵敏度和检测范围均明显增加。
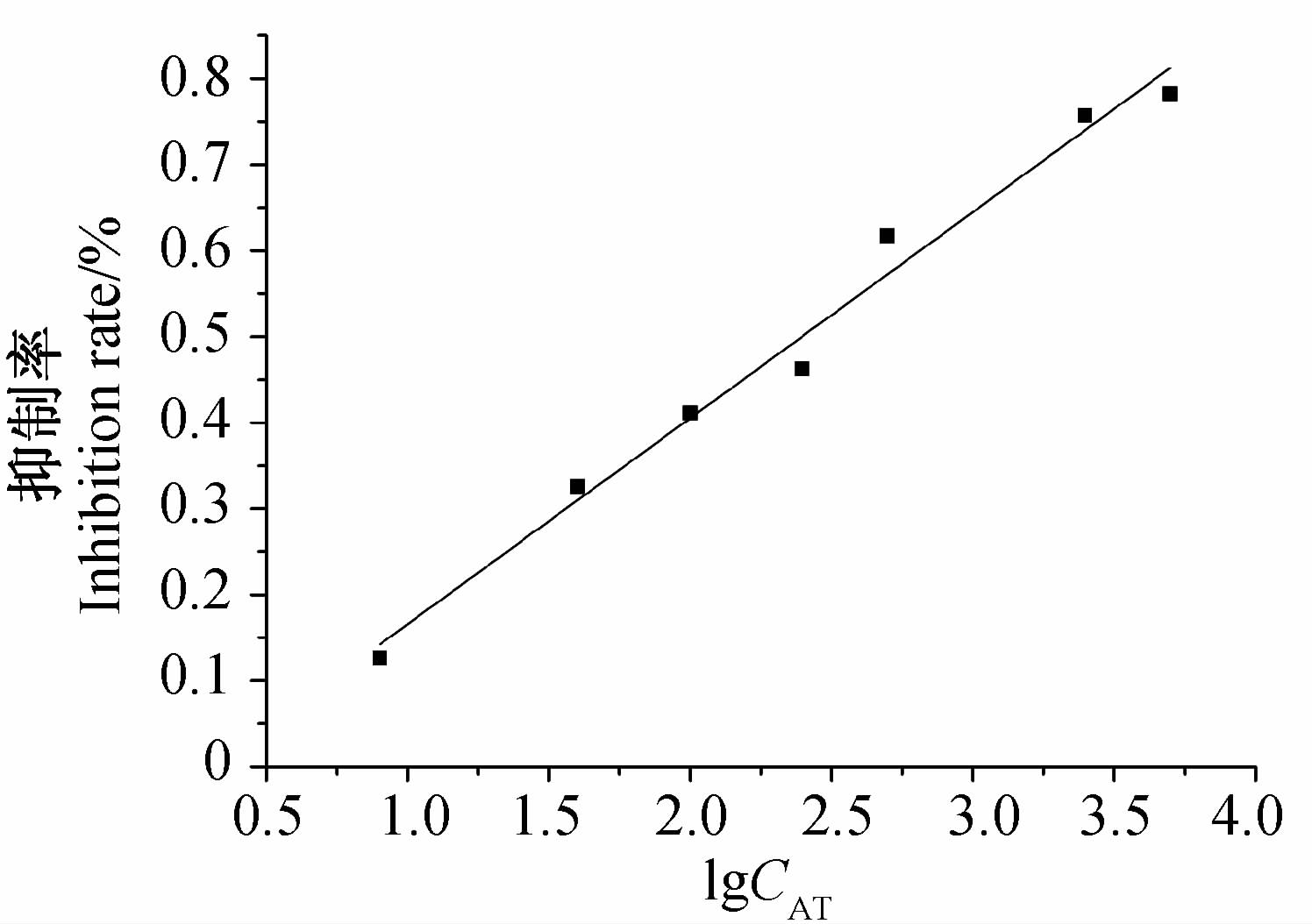 | 图 7 SPR免疫传感检测莠去津间接竞争抑制曲线 Fig. 7 Indirect competitive inhibition curve for detection of atrazine by SPR immunosensor |
添加回收试验结果见表 3。在未添加莠去津的自来水样品中未检出莠去津;在添加水平为10~1 000 ng/mL范围内,莠去津的添加回收率为94%~102%,相对标准偏差(RSD)为5.1%~7.3%。
|
|
表 3 莠去津在自来水样品中的添加回收试验结果 Table 3 Results for spiked sample recovery test of atrazine in tap water |
用3片SPR传感检测芯片检测莠去津的批间差异测试结果见表 4,批间RSD为10.1%~13.7%,表明本方法准确度和精密度较好,可以满足一般检测需求。
|
|
表 4 SPR传感检测芯片批间差异测试结果 Table 4 Results for batch-to-batch variation test of SPR sensing chip |
结果见表 5。当自来水样品中莠去津的质量浓度为 1.0~5.0 ng/mL时,采用HPLC法检测的检出限为0.08 ng/mL,平均添加回收率为83%~112%,RSD为5.0~6.3%;用SPR免疫传感法测定时,其检出限为0.89 ng/mL,平均添加回收率为90%~98%,RSD为3.9%~5.9%。通过比较,HPLC法的检出限低于SPR免疫传感法,两种方法的平均添加回收率和RSD测试结果相当。
|
|
表 5 SPR免疫传感检测系统和HPLC方法比对测试结果 Table 5 Results for method comparison test between SPR immuno-sensing system and HPLC |
本研究在SPR免疫传感检测系统中引入磁性纳米微球,不仅可以在样品前处理过程中提高目标化合物的分离纯化效率(本文侧重于传感条件优化和检测方法建立),而且磁性纳米微球还可以在SPR免疫传感检测系统中起到增强传感信号的作用。通过优化,确定最佳SPR免疫传感检测条件为:MNP质量浓度为1.0 mg/mL,AT-mAb质量浓度为50 μg/mL,结合时间15 min,AT-mAb-MNP浓度为原液2倍稀释浓度。所建立的磁性纳米微球增强信号的SPR免疫传感检测方法,检测范围8.62~7.18×103 ng/mL,检出限为0.89 ng/mL(S/N=3),与未经磁性纳米微球增强信号的SPR免疫传感检测方法相比,传感响应信号明显增强,检出限更低,检测范围更宽。莠去津在自来水样品中的添加回收率为94%~102%,不同SPR传感检测芯片的批间RSD为10.1%~13.7%,具有较好的准确度和精密度。本研究所建立检测方法的检出限虽不及HPLC标准方法(0.08 ng/mL),但磁性纳米微球的引入显著提高了方法灵敏度和检测范围,为此类方法的进一步发展和实际应用提供了技术基础。
尽管目前本方法还存在偶联抗体用量较高、偶联封闭时响应信号强度下降和检出限有待进一步降低等需要改进之处,但通过后续研究的进一步优化和完善,相信本方法可为研发快速、灵敏、特异性强的莠去津残留现场检测技术和相关设备提供技术基础,具有较好的实用价值和应用前景。
| [1] | 杨梅, 林忠胜, 姚子伟, 等. 三嗪类除草剂莠去津的研究进展[J]. 农药科学与管理, 2006, 25(11):31-37. Yang Mei, Lin Zhongsheng, Yao Ziwei, et al. Process of study on the herbicide atrazine[J]. Pestic Sci Admin, 2006, 25(11):31-37(in Chinese) |
| [2] | 范润珍, 钱传范, 卢向阳. 莠去津对水稻的药害及NA解毒技术研究[J]. 中国农业大学学报, 1998, 3(增刊):111-115. Fan Runzhen, Qian Chuanfan, Lu Xiangyang. Study on the phytotoxicity of atrazine to rice and the method of detoxification Using NA[J]. J China Agric Univ, 1998, 3(Suppl.):111-115(in Chinese) |
| [3] | 谢文明, 刘兴泉, 范志先, 等. 莠去津在土壤中的残留动态和淋溶动态[J]. 农药学学报, 2003, 5(1):82-87. Xie Wenming, Liu Xingquan, Fan Zhixian, et al. The Residual dynamics and leaching dynamics of atrazine in soil[J]. Chin J Pestic Sci, 2003, 5(1):82-87(in Chinese) |
| [4] | 史伟, 李香菊, 张宏军. 除草剂莠去津对环境的污染及治理[J]. 农药科学与管理, 2009, 30(8):30-33. Shi Wei, Li Xiangju, Zhang Hongjun. Environment contamination and management of atrazine[J]. Pestic Sci Admin, 2009, 30(8):30-33(in Chinese) |
| [5] | 吴颖慧, 蔡磊明, 王捷, 等. 除草剂莠去津对7种藻类的生长抑制[J]. 农药, 2007, 46(1):48-51. Wu Yinghui, Cai Leiming, Wang Jie, et al. Growth inhibition of herbicide atrazine to the seven algae[J]. Agrochemicals, 2007, 46(1):48-51(in Chinese) |
| [6] | Agency for Toxic Substances and Disease Registry. Toxicological Profile for Atrazine[M]. Atlanta, GA:US Department of Health and Human Services, Public Health Service, 2003:529-538. |
| [7] | 李家男, 宋肖垚, 吴沿萍, 等. 阿特拉津对大鼠多巴胺神经元凋亡相关因子表达的影响[J]. 癌变·畸变·突变, 2015, 27(2):121-124. Li Jianan, Song Xiaoyao, Wu Yanping, et al. Preliminary study of atrazine on the apoptosis of dopaminergic neurons in rats[J]. Carcinogen, Teratogen Mutagen 2015, 27(2):121-124(in Chinese) |
| [8] | 刘浩华, 伊雄海, 陆贻通. 内分泌干扰物莠去津对鲫鱼血清激素的影响[J]. 生态毒理学报, 2007, 2(2):184-189. Liu Haohua, Yi Xionghai, Lu Yitong. Effects of atrazine on serum sex steroids, TSH and T3 in juvenile male Carassius auratus [J]. Asian J Ecotox, 2007, 2(2):184-189(in Chinese) |
| [9] | 李克斌, 郭宏升, 陈经涛. 高效液相色谱同柱分析土壤中灭草松和莠去津残留[J]. 农业环境科学学报, 2005, 24(增刊):280-283. Li Kebin, Guo Hongsheng, Chen Jingtao. Simultaneous determination of bentazone and atrazine residues in soils by using high-performance liquid chromatography[J]. J Agro-Environ Sci, 2005, 24(Suppl.):280-283(in Chinese) |
| [10] | 刘红河, 朱舟, 刘桂华, 等. 高效液相色谱-串联质谱联用法测定饮用水和水源水中莠去津、呋喃丹和甲基对硫磷[J]. 中国卫生检验杂志, 2012, 22(10):2267-2270. Liu Honghe, Zhu Zhou, Liu Guihua, et al. Determination of three pesticides in drinking water by high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Health Lab Technol, 2012, 22(10):2267-2270(in Chinese) |
| [11] | 赵琳, 张晓波, 任红波, 等. 在线GPC-GC-MS法测定玉米中砜嘧磺隆和莠去津残留[J]. 农药, 2012, 51(12):907-909. Zhao Lin, Zhang Xiaobo, Ren Hongbo, et al. Determination residues of rimsulfuron and atrazine in maize by GPC-GC-MS[J]. Agrochemicals, 2012, 51(12):907-909(in Chinese) |
| [12] | Baccar H, Mejri M B, Hafaiedh I, et al. Surface plasmon resonance immunosensor for bacteria detection[J]. Talanta, 2010, 82(2):810-814. |
| [13] | Fägerstam L G, Frostell-Karlsson Å, Karlsson R, et al. Biospecific interaction analysis using surface plasmon resonance detection applied to kinetic, binding site and concentration analysis[J]. J Chromatogr A, 1992, 597(1-2):397-410. |
| [14] | Rogers K R. Recent advances in biosensor techniques for environmental monitoring[J]. Analytica Chimica Acta, 2006, 568(1-2):222-231. |
| [15] | Liu Ming, Ning Baoan, Qu Lijie, et al. Development of indirect competitive immunoassay for highly sensitive determination of ractopamine in pork liver samples based on surface plasmon resonance sensor[J]. Sens Act B:Chem, 2012, 161(1):124-130. |
| [16] | Mauriz E, Calle A, Manclús J J, et al. Single and multi-analyte surface plasmon resonance assays for simultaneous detection of cholinesterase inhibiting pesticides[J]. Sen Act B:Chem, 2006, 118(1-2):399-407. |
| [17] | Gouzy M F, Keβ M, Krämer P M. A SPR-based immunosensor for the detection of isoproturon[J]. Biosen Bioelectron, 2009, 24(6):1563-1568. |
| [18] | 李辉, 蔡浩原, 张璐璐, 等. 利用多参数表面等离子谐振(SPR)生物传感器检测莠去津[J]. 环境化学, 2010, 29(5):966-969. Li Hui, Cai Haoyuan, Zhang Lulu, et al. The study of SPR biosensor detection method for atrazine[J]. Environ Chem, 2010, 29(5):966-969(in Chinese) |
| [19] | 柳明, 祁军, 刘磊, 等. SPR免疫传感技术检测水中阿特拉津除草剂[J]. 解放军预防医学杂志, 2013, 13(4):299-301. Liu Ming, Qi Jun, Liu Lei, et al. Detection of atrazine herbicide in water using surface plasmon resonance immunosensor[J]. J Prev Med Chin PLA, 2013, 13(4):299-301(in Chinese) |
| [20] | Shankaran D R, Gobi K V, Miura N. Recent advancements in surface plasmon resonance immunosensors for detection of small molecules of biomedical, food and environmental interest[J]. Sens Act B:Chem, 2007, 121(1):158-177. |
| [21] | Wang Xue, Hu Chenguo, Xi Yi, et al. Al-doped Fe3O4 nanoparticles and their magnetic properties[J]. J Supercond Novel Magn, 2010, 23(6):909-911. |
| [22] | Zhu Shaoli, Du Chunlei, Fu Yongqi. Localized surface plasmon resonance-based hybrid Au-Ag nanoparticles for detection of Staphylococcus aureus enterotoxin B[J]. Opt Mater, 2009, 31(11):1608-1613. |
| [23] | Wang Jianlong, Munir A, Zhu Zanzan, et al. magnetic nanoparticle enhanced surface plasmon resonance sensing and its application for the ultrasensitive detection of magnetic nanoparticle-enriched small molecules[J]. Anal Chem, 2010, 82(16):6782-6789. |
| [24] | HJ 587-2010, 水质 阿特拉津的测定 高效液相色谱法[S]. 北京:中国环境科学出版社, 2010. HJ 587-2010, Water quality Determination of Atrazine High performance liquid[S]. Beijing:China Environmental Science Press, 2010.(in Chinese) |
| [25] | Miura N, Sasaki M, Vengatajalabathy Gobi K, et al. Highly sensitive and selective surface plasmon resonance sensor for detection of sub-ppb levels of benzo[a]pyrene by indirect competitive immunoreaction method[J]. Biosen Bioelectron, 2003, 18(7):953-959. |
| [26] | Yu Qiuming, Chen Shengfu, Taylor A D, et al. Detection of low-molecular-weight domoic acid using surface plasmon resonance sensor[J]. Sens Act B:Chem, 2005, 107(1):193-201. |
 2015, Vol. 17
2015, Vol. 17


