2. 吉林农业大学中药材学院, 长春 130118
2. College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China
中国是水稻生产大国,水稻种植面积约占全球的20%,占全国耕地面积的23%[1]。为了提高作物产量,化肥和农药的施用量逐年增加,未被利用的化肥和农药会随地表径流、农田退水等方式流入地表水环境中。农田退对于缺水退化的湿地是可利用的水资源,但其中残留的化肥、农药等污染物可能会对湿地生态系统造成一定影响。尽管湿地植物和土壤对这些污染物具有一定消解作用[2, 3],但过量的农药输入仍可能会影响湿地生态系统的结构和功能[4, 5]。目前,关于湿地植被对农药的吸收和截留作用,以及农药在土壤中的降解等已有较多研究报道[6, 7, 8],但针对农田退水中的除草剂对湿地的植被生长及其土壤酶活性的影响鲜有报道。芦苇作为重要且分布广泛的湿地优势植物种群,具有良好的生态功能和广泛的抗逆性,同时具有良好的经济价值。本研究选择广泛用于稻田杂草控制的酰胺类除草剂,也是我国用量最大的3种除草剂之一——丁草胺(butachlor) [9],在松嫩平原西部盐碱芦苇湿地集中分布区,通过大田模拟试验研究了丁草胺对湿地植物芦苇的生长发育和土壤酶活性的影响,旨在为科学评价农田退水中残留的除草剂对湿地生态系统的影响和加强湿地的净化功能提供参考。
1 材料与方法 1.1 供试药剂600 g/L丁草胺乳油(butachlor 600 g/L EC,大连越达农药化工有限公司)。
1.2 试验设计试验于2014年夏季在吉林省西部牛心套保盐碱芦苇沼泽湿地进行,试验前检测试验田中无丁草胺残留,每小区面积为6 m×4 m。参考丁草胺田间推荐施用剂量(720 μg/L),分别设T1(360 μg/L)、T2(720 μg/)和T3(1 440 μg/L)3个药剂处理;另设不施药剂的空白对照试验(CK)。 先将丁草胺乳油溶于水中,再加入到试验田水中搅拌均匀,试验期间试验小区的淹水深度保持15 cm。每处理重复3次,试验小区随机区组排列。
1.3 测定项目与方法 1.3.1 水中丁草胺残留量测定采用液-液萃取及气相色谱-质谱联用法[10]测定。
1.3.2 芦苇株高、茎粗和干重测定分别于试验处理开始和结束时测定每个试验小区随机标记过的3株芦苇株高,计算株高增长量:增长量=试验末株高-试验初株高。待试验结束后,用游标卡尺测量芦苇的基部茎粗。按50 cm×50 cm的样方随机采取芦苇,在烘箱105 ℃条件下杀青5 min,65 ℃下烘干至恒重。
1.3.3 光合速率测定在芦苇生长期(8月)用L6400XT便携式光合仪(美国LI-COR公司)测定净光合速率(Pn)、气孔导度(Gn)等参数。测量时设定光强为(1 000±50)μmol·m-2·s-1,CO2浓度为(360±20) μL/L,测定时间为上午8:00—11:00。
1.3.4 可溶性糖测定采用蒽酮比色法[11]测定。
1.3.5 土壤酶活性测定采用磷酸苯二钠比色法[12]测定土壤碱性磷酸酶活性;3,5-二硝基水杨酸比色法[13]测定土壤蔗糖酶活性;高锰酸钾滴定法[13]测定土壤过氧化氢酶活性。
1.4 数据处理采用SPSS13.0和Origin7.5进行数据分析及作图。试验结果采用邓肯氏新复极差多重比较法(DMRT)进行显著性分析。
2 结果与分析 2.1 丁草胺在湿地水体中的残留量添加不同质量浓度的丁草胺后,丁草胺在湿地水体中消解过程见图 1。结果表明,不同质量浓度的丁草胺在湿地水体中均随处理时间的延长而快速下降,1个月后,各处理的丁草胺降解较快,但在2个月后各处理仍有微量丁草胺残留可以检出。
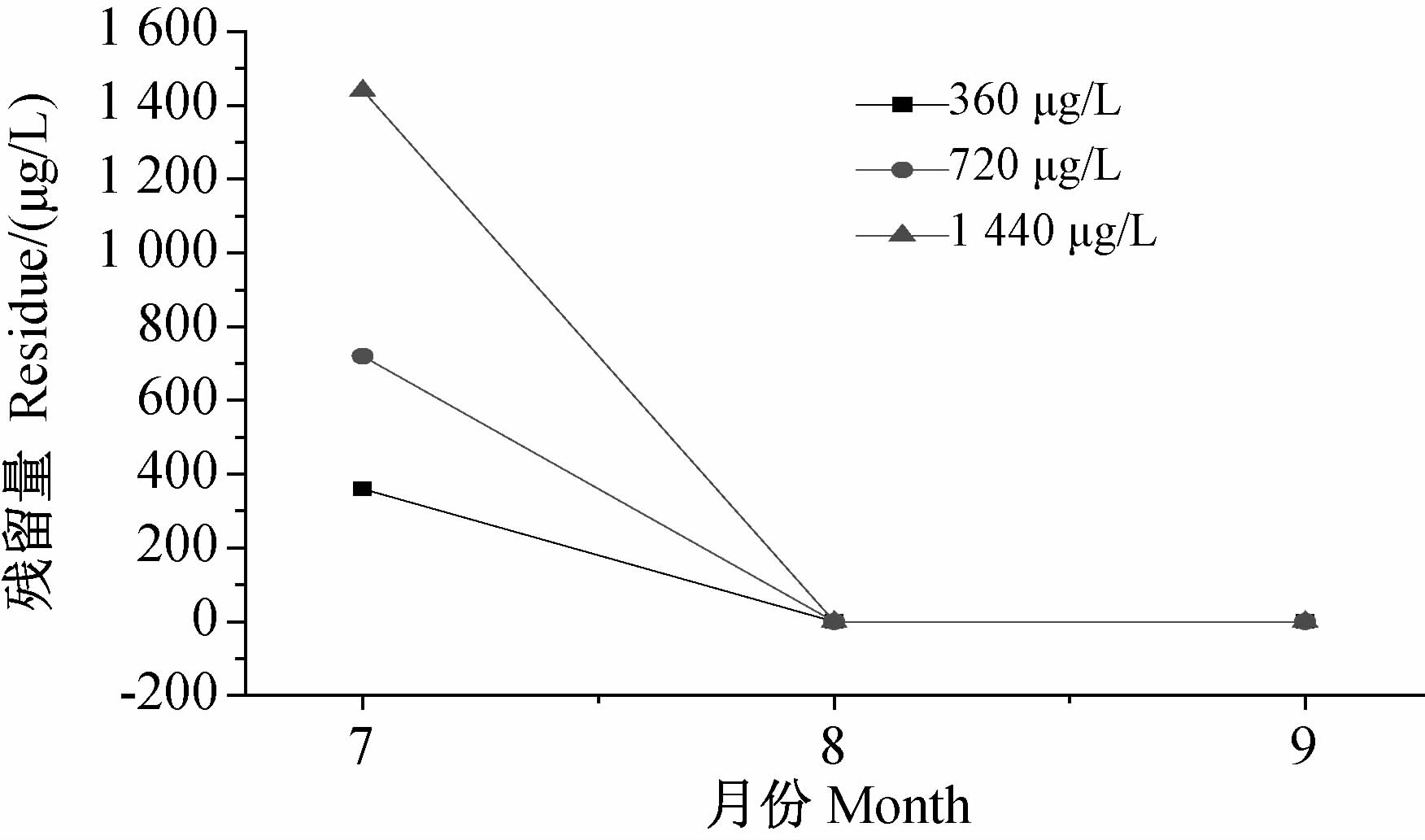 | 图 1 丁草胺在湿地水体中的残留量随时间的变化情况 Fig. 1 Persistences of butachlor in the wetland water sample as time variation |
从图 2可以看出:在不同质量浓度丁草胺处理下,湿地芦苇株高增长量均低于对照,T1,T2和T3处理分别比对照低1.55、5.89和8.89 cm,即随丁草胺处理浓度的增加,芦苇株高增长量降低;各处理组芦苇茎粗均高于对照,T1、T2和T3分别比对照增加0.04、0.32和0.17 mm;不同浓度丁草胺处理对芦苇干重的影响无明显规律。总体来看,丁草胺各浓度处理对湿地芦苇的株高、茎粗及干重的影响均未达到显著水平。
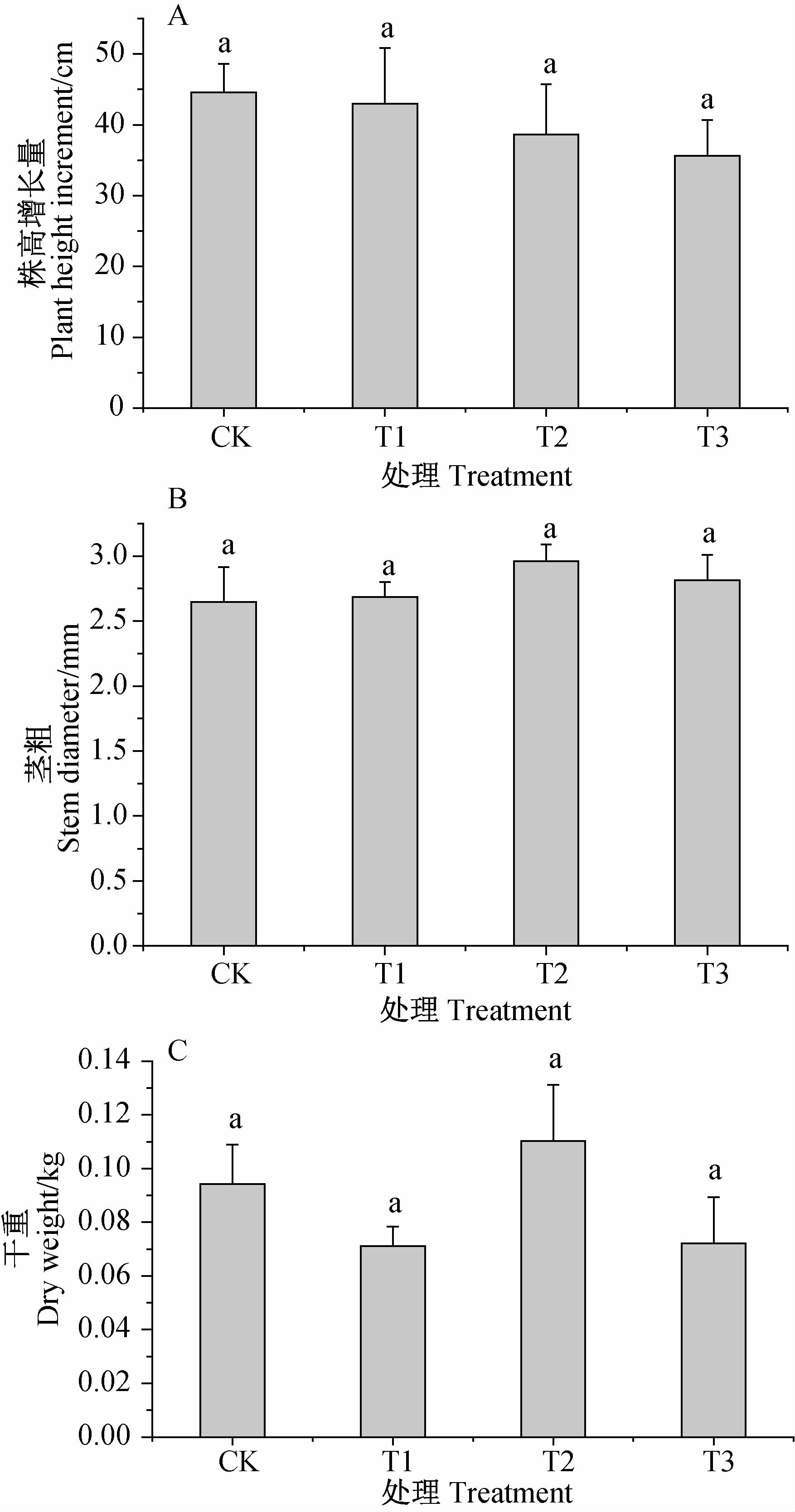
|
CK.空白对照组;T1.丁草胺(butachlor)360 μg/L;
T2.丁草胺(butachlor) 720 μg/L;T3.丁草胺(butachlor)
1 440 μg/L
A.株高增长量(plant height increment);B.茎粗(stem diameter);
C.干重(dry weight)
注:不同小写字母表示不同处理间在P=0.05水平上差异显著。 Note: Different small letters are significantly different at P=0.05. 图 2 丁草胺对芦苇生长的影响 Fig. 2 Effects of butachlor on reed growth |
不同浓度丁草胺处理下,湿地芦苇植株可溶性糖含量均显著低于对照(图 3),表明丁草胺处理可显著降低芦苇植株可溶性糖含量,但各处理间差异不显著。
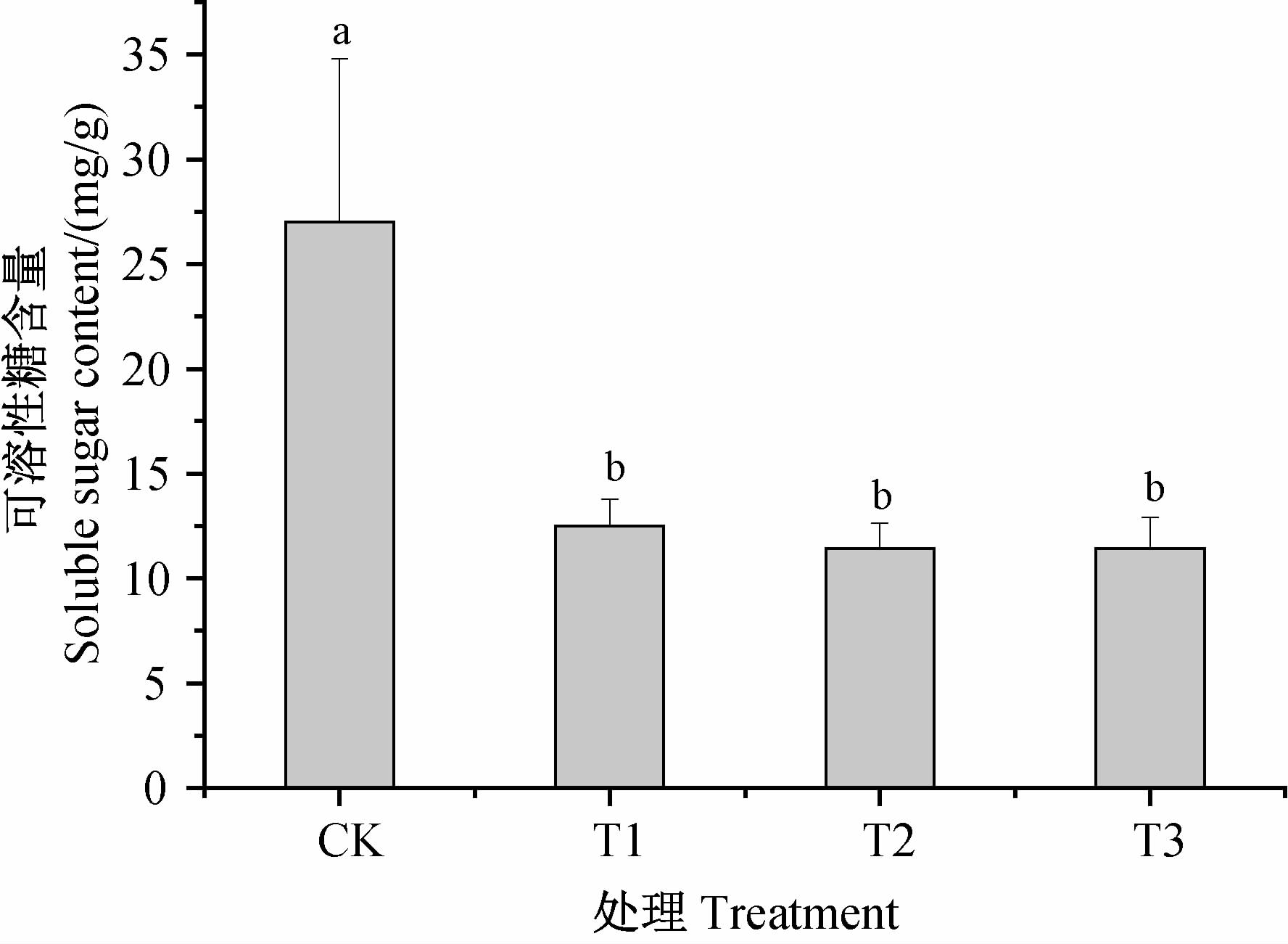
|
CK.空白对照组;T1.丁草胺(butachlor) 360 μg/L;
T2.丁草胺(butachlor) 720 μg/L;
T3.丁草胺(butachlor) 1 440 μg/L。
注:不同小写字母表示不同处理间在P=0.05水平上差异显著。 Note: different small letters are significantly different at P=0.05. 图 3 丁草胺对芦苇植株可溶性糖的影响 Fig. 3 Effects of butachlor on reed soluble sugar content |
丁草胺不同浓度处理对湿地芦苇光合特性的影响见表 1。湿地芦苇的光合速率(Pn)和气孔导度(Gn)随丁草胺质量浓度的增加而有降低趋势,芦苇胞间CO2浓度(Ci)有上升趋势,对蒸腾速率(E)的影响表现为CK>T3>T2>T1,但差异均未达显著水平。可见,丁草胺对湿地芦苇光合作用未产生显著影响。
|
|
表 1 丁草胺对湿地芦苇光合特性的影响 Table 1 Effects of butachlor on the wetland reed photosynthetic parameters |
丁草胺不同浓度处理下,芦苇湿地土壤过氧化氢酶活性均低于对照(图 4)。其中T2和T3处理中的过氧化氢酶分别比对照低1.14和1.00 mL/g,处理间差异达显著水平; T1和T3处理下,土壤碱性磷酸酶活性分别比对照低0.17和0.3 mL/g,而T2处理酶活性却比对照高0.32 mL/g,各处理间差异不显著;丁草胺中浓度处理(T2)对土壤蔗糖酶活性有显著促进作用,其他两个处理则对其活性无明显影响。
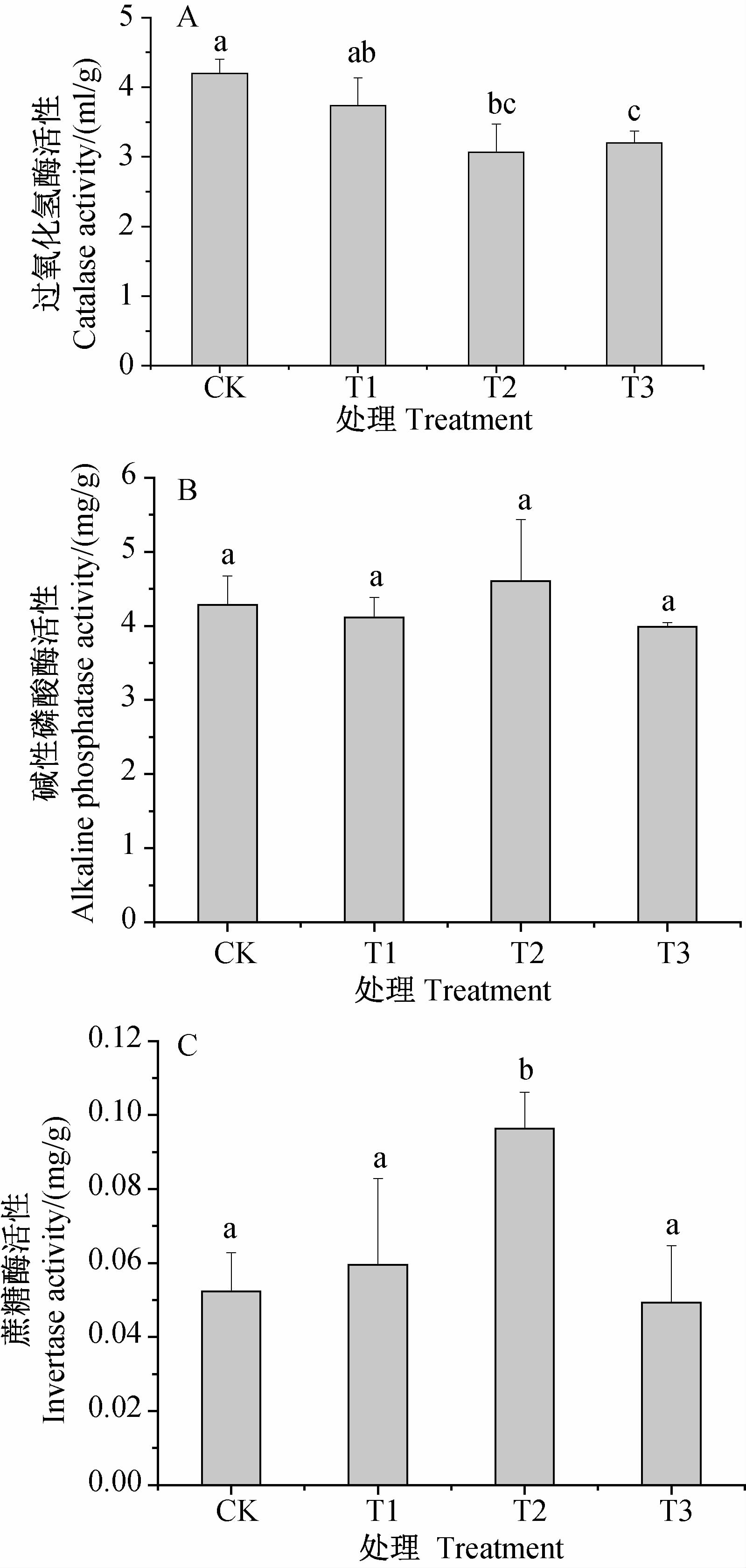
|
CK.空白对照组;T1.丁草胺(butachlor)360 μg/L;T2.丁草胺(butachlor) 720 μg/L;
T3.丁草胺(butachlor) 1 440 μg/L。
A.过氧化氢酶;B.碱性磷酸酶;C.蔗糖酶
A.catalase;B.alkaline phosphatase;C.invertase
注:不同小写字母表示不同处理间在P=0.05水平上差异显著。 Note: Different small letters are significantly different at P=0.05. 图 4 丁草胺对湿地土壤酶活性的影响 Fig. 4 Effects of butachlor on wetland soil enzyme activity |
有的除草剂本身也是植物生长调节剂,会对植物的形态、生理和生化代谢等产生影响[14]。本研究结果表明,丁草胺对湿地芦苇株高、茎粗和干重均无显著影响,这可能与其在水体中降解速率较快有关。与已有研究相比,丁草胺对芦苇株高的影响与其对水稻株高影响结果相似[15],对芦苇生物量的影响与其对意大利黑麦草的影响相似[16]。
植物光合作用的强弱常用叶片的净光合速率、蒸腾速率、气孔导度和胞间CO2浓度等指标来表示。本研究表明,不同浓度丁草胺处理下,芦苇光合速率、气孔导度有降低趋势,胞间CO2浓度和蒸腾速率有上升趋势,但各处理间差异均未达到显著水平,表明湿地中残留的丁草胺对芦苇光合作用未表现出显著的抑制作用。丁草胺作为电子传递链的抑制剂和解偶联剂[17],对一年生禾本科植物及某些阔叶植物光合作用应具有一定影响[18],但可能由于其在湿地中消解较快,导致丁草胺对芦苇的光合特性并未产生显著影响。芦苇中可溶性糖含量随丁草胺处理浓度的增加而降低,这与丁草胺对水稻中可溶性糖含量的影响结果一致[19]。植物体中可溶性糖作为植物光合作用的主要产物,其含量变化是植物自身生理过程和外在环境条件综合作用的结果。
湿地土壤酶活性是湿地生态功能的重要指标[20]。人工湿地中土壤酶活性的高低与其去除污染物的能力相关[21]。土壤过氧化氢酶能有效地防止土壤及生物体在新陈代谢过程中产生的过氧化氢的毒害。本研究表明,随丁草胺浓度的增加,土壤过氧化氢酶活性在中、高浓度丁草胺处理时受到显著抑制。这可能是由于除丁草胺自身对土壤过氧化氢酶活性有抑制作用外,也可能是由于酰胺类除草剂降解产物对土壤过氧化氢酶影响更大[22]。土壤碱性磷酸酶对土壤中的有机磷化物转化为植物可吸收的无机磷酸盐具有重要作用。本研究表明,丁草胺对湿地土壤碱性磷酸酶的活性未表现出促进作用,这与淹水条件下丁草胺对土壤碱性酶的影响相似[23]。但本研究发现,丁草胺对湿地土壤蔗糖酶活性未表现出抑制作用,这与已有的研究结果不同[24],可能是由于在不同生态环境下丁草胺对土壤微生物种群的影响不同[24, 25],以及土壤中微生物的数量不同有关[26]。丁草胺对不同土壤酶活性的影响不同,可能与除草剂对土壤酶的作用机理不同有关,因为除草剂分子可能是某种酶的最适底物,也可能是另外一种酶的天然抑制剂[27]。
芦苇湿地系统对丁草胺的生态响应是一个复杂的过程,涉及众多物质代谢、能量代谢及激素调节等生理生化过程,本研究仅观测了丁草胺对湿地芦苇生长发育部分生物学指标及土壤酶活性的影响,关于造成这些影响的生理生化及分子机理等还有待进一步研究。
致谢:感谢吉林牛心套保国家湿地公园管理中心在本研究野外工作中的支持和帮助。
| [1] | Frolking S, Qiu J J, Boles S, et al. Combining remote sensing and ground census data to develop new maps of the distribution of rice agriculture in China[J]. Glob Biogeochem Cycl , 2002,16(4):38-1-38-10. |
| [2] | Moore M T, Cooper C M, Smith S, et al. Mitigation of two pyrethroid insecticides in a Mississippi Delta constructed wetland[J]. Environ Pollut, 2009, 157(1):250-256. |
| [3] | 姜明, 吕宪国, 杨青. 湿地土壤及其环境功能评价体系[J]. 湿地科学, 2006,4(3):168-173. Jiang Ming, Lü Xianguo, Yangqing. Wetland soil and its system of environment function assessment[J]. Wetland Sci, 2006, 4(3):168-173(in Chinese) |
| [4] | Blankenberg A G, Haarstad K, Braskerud B. Pesticide retention in an experimental wetland treating non-point source pollution from agriculture runoff[J]. Water Sci Technol, 2007, 55(3):37-44. |
| [5] | Laabs V, Wehrhan A, Pinto A, et al. Pesticide fate in tropical wetlands of Brazil:an aquatic microcosm study under semi-field conditions[J]. Chemosphere, 2007, 67(5):975-989. |
| [6] | Hand L H, Kuet S F, Lane M C G, et al. Influences of aquatic plants on the fate of the pyrethroid insecticide Lambda-cyhalothrin in aquatic environments[J]. Environ Toxicol Chem, 2001, 20(8):1740-1745. |
| [7] | Watanabe H, Grismer M E. Diazinon transport through inter-row vegetative filter strips:micro-ecosystem modeling[J]. J Hydrol, 2001, 247(3-4):183-199. |
| [8] | Oh B Y, Jeong Y H, Lee B M. Studies on degradation of butachlor and nitrofen in different soil conditions[J]. J Korean Agric Chem Soc, 1981, 24(2):112-119. |
| [9] | Min H, Ye Y F, Chen Z Y, et al. Effects of butachlor on microbial populations and enzyme activities in paddy soil[J]. J Environ Sci Health, Part B Pesticy Food Contam, Agric Wastes, 2001, 36(5):581-595. |
| [10] | 马又娥, 刘宝峰. 环境水中 7 种酰胺类和磺酰脲类除草剂残留检测方法研究[J]. 现代农药, 2011, 10(4):44-46. Ma Youe, Liu Baofeng. Determination of seven acetanilide and sulfonylurea herbicide residues in environmental water[J]. Mod Agrochem, 2011, 10(4):44-46(in Chinese) |
| [11] | 张志良,瞿伟菁. 植物生理学实验指导[M].北京:高等教育出版社, 2004. Zhang Zhiniang, Qu Weijing. The Experimental Guide for Plant Physiology[M]. Beijing:Higher Education Press, 2004.(in Chinese) |
| [12] | 严旭升. 土壤肥力研究方法[M]. 北京:中国农业出版社, 1988. Yan Xusheng. Research Method of Soil Fertility[M]. Beijing:China Agriculture Press, 1988.(in Chinese) |
| [13] | 关松荫.土壤酶及其研究法[M]. 北京:中国农业出版社, 1983. Guan Songyin. Soil Enzyme and Its Research Methods[M]. Beijing:China Agriculture Press,1983.(in Chinese) |
| [14] | 刘井兰, 于建飞, 印建莉, 等. 化学农药对植物生理生化影响的研究进展[J]. 农药, 2006, 45(8):511-514. Liu Jinglan,Yu Jianfei,Yin Jianli, et al. Research progress on the effect of chemical pesticides on plant physiology and biochemistry[J]. Agrochemicals, 2006, 45(8):511-514.(in Chinese) |
| [15] | 余保文, 朱诚. 丁草胺对镉胁迫条件下水稻生长、镉积累及活性氧代谢的影响[J]. 环境科学学报,2008, 28(9):1878-1886. Yu Baowen, Zhu Cheng. Effects of butachlor on the growth cadmium accumulation and oxidative metabolism of rice under Cd2+ stress[J]. Acta Scientiae Circumstantiae,2008, 28(9):1878-1886(in Chinese) |
| [16] | Wang S R, Li H S, Lin C X. Physiological, biochemical and growth responses of Italian ryegrass to butachlor exposure[J]. Pestic Biochem Physiol, 2013, 106(1-2):21-27. |
| [17] | 徐虹, 张宗俭,郭蔼光. 除草剂对水稻、稗草种子萌发后幼芽生长的影响[J]. 中国农学通报, 2001, 17(3):20-23. Xu Hong, Zhang Zongjian, Guo Aiguang. Influence of herbicide to young shoots of rice and Echinochloa crusgalli(L.)Beauv.after germernation[J].Chinese Agric Sci Bull, 2001, 17(3):20-23(in Chinese) |
| [18] | 丁丽, 付颖, 叶非. 酰胺类除草剂的研究和应用进展[J]. 农药科学与管理, 2011, 32(9):22-26. Ding Li, Fu Ying, Ye Fei. Progress in research and application of Amide herbicides[J]. Pestic Sci Admin, 2011, 32(9):22-26(in Chinese) |
| [19] | 袁树忠,吴进才,徐建祥,等.丁草胺等除草剂对水稻生理生化的影响[J].植物保护学报,2001,28(3):274-278. Yuan Shuzhong, Wu Jincai, Xu Jianxiang, et al. Influences of herbicides on physiology and biochemistry of rice[J]. Acta Phytophylacica Sinica, 2001, 28(3):274-278(in Chinese) |
| [20] | 刘存歧, 王伟伟, 李贺鹏, 等. 湿地生态系统中土壤酶的研究进展[J]. 河北大学学报:自然科学版, 2005, 25(4):443-448. Liu Cunqi, Wang Weiwei, Li Hepeng, et al. Recent progress in studies on soil enzymes in wetland ecosystem[J]. J Hebei Univ:Nat Sci Ed, 2005, 25(4):443-448(in Chinese) |
| [21] | Reddy K R, D'angelo E M. Biogeochemical indicators to evaluate pollutant removal efficiency in constructed wetlands[J]. Water Sci Technol, 1997, 35(5):1-10. |
| [22] | Sette L D, Da Costa L A M A, Marsaioli A J, et al. Biodegradation of alachlor by soil streptomycetes[J]. Appl Microbiol Biotechnol, 2004, 64(5):712-717. |
| [23] | Rasool N, Reshi Z A, Shah M A. Effect of butachlor(G) on soil enzyme activity[J]. Eur J Soil Biol, 2014, 61:94-100. |
| [24] | 单敏,虞云龙,方华,等. 丁草胺对土壤微生物数量和酶活性的影响[J].农药学学报, 2005,7(4):383-386. Shan Min, Yu Yunlong, Fanghua, et al. Effect of Butachlor on soil microbial populations and enzyme activites[J]. Chin J Pestic Sci, 2005, 7(4):383-386(in Chinese) |
| [25] | 张仕颖,夏运生,肖炜,等. 除草剂丁草胺对高产水稻土微生物群落功能多样性的影响[J].生态环境学报,2013,22(5):815-819. Zhang Shiying, Xia Yunsheng, Xiao Wei, et al. Effects of Butachlor on the functional diversity of microbial communities in high-yield paddy soil[J].Ecol Environ Sci,2013,22(5):815-819(in Chinese) |
| [26] | 万忠梅,吴景贵. 土壤酶活性影响因子研究进展[J].西北农林科技大学学报:自然科学版,2005,33(6):87-92. Wan Zhongmei,Wu Jinggui.Study progress on factors affecting soil enzyme activity[J].J Northwest A & F Univ:Nat Sci Ed),2005,33(6):87-92(in Chinese) |
| [27] | 杜慧玲, 吴济南, 王丽玲, 等. 苯磺隆对土壤酶活性的影响[J]. 核农学报, 2010, 24(3):585-588. Du Huiling,Wu Jinan, Wang Liling, et al. Effect of tribenuron-methyl application on activity of soil enzyme[J]. Acta Agriculturae Nucleatae Sinica,, 2010, 24(3):585-588(in Chinese) |
 2015, Vol. 17
2015, Vol. 17


