2. 温州市农业科学研究院, 浙江温州 325006
2. Wenzhou Academy of Agricultural Science, Wenzhou 325006, Zhejiang Province, China
甜玉米籽粒中碳水化合物的组成和含量是决定其品质的重要因素,其中可溶性糖含量的高低决定甜玉米的食用品质,其主要组分为蔗糖[1, 2]。蔗糖是光合作用的产物,是碳水化合物在作物体内贮藏和积累的主要形式[2]。因此,提高甜玉米光合功能是改善其品质和产量的重要手段。胺鲜酯(diethyl aminoethyl hexanoate,DTA-6),属叔胺类化合物,化学名称为己酸二乙氨基乙醇酯,化学式为C12H25NO2,相对分子质量为215.33(结构式见 Scheme 1),易溶于水,具有高生物活性以及提高作物产量、改善品质等特点[3]。已有研究表明,DTA-6可显著提高玉米、大豆等作物叶片光合作用,促进干物质积累[4, 5],还能显著提高菠菜叶片维生素C和可溶性糖含量[6],提高甜菊糖苷含量和质量[7, 8]。张明才等[9]研究发现,DTA-6处理显著提高了甜豌豆主要营养物质如可溶性糖、可溶性蛋白和游离氨基酸的含量。但有关DTA-6对甜玉米含糖量和产量影响的研究尚未见报道。因此,本研究探讨了DTA-6处理对甜玉米光合特征、籽粒蔗糖代谢等的调节作用,以期明确DTA-6对甜玉米产量和品质改善的作用及机理,为甜玉米高产栽培提供新的技术手段。

|
Scheme 1 |
供试甜玉米品种为金玉甜1号,由温州市农业科学研究院提供。
98%胺鲜酯可湿性粉剂(DTA-6)(河南郑州化工集团);蒽酮(分析纯,上海迈瑞尔化学技术有限公司);38%盐酸和蔗糖均为分析纯(国药集团化学试剂有限公司);淀粉(分析纯,北京华威锐科化工有限公司);99%甘油、90%聚乙烯吡咯烷酮(PVP)、碳酸氢钠、三羟甲基氨基甲烷(Tris)、乙二醇、焦磷酸钠、 氯化镁、 乙二胺四乙酸(EDTA)和β-烟酰胺腺嘌呤二核苷酸二钠盐(NADH)均为分析纯(百灵威科技有限公司);β-巯基乙醇、苹果酸脱氢酶(MDH)、3-磷酸甘油醛脱氢酶(GAP-GDH)均为分析纯(成都贝斯特试剂有限公司);磷酸烯醇丙酮酸三(环己基铵)盐(PEP)和 二硫代苏糖醇(DTT)均为分析纯,(上海迈瑞尔化学技术有限公司);三磷酸腺苷(ATP)和腺苷二磷酸葡萄糖钠盐(ADPG)均为分析纯(北京中生瑞泰科技有限公司);3-磷酸甘油酸激酶(PGK,分析纯,上海倍卓生物科技有限公司); 尿苷-5′-二磷酸酯(UDP,分析纯,武汉易泰科技有限公司上海分公司)。
SPDA-502叶绿素测定仪(Konica Minolta Sensing,Inc.日本);LI-6400便携式光合系统测定仪(LI-COR Lincoln公司);Varian100分光光度计(美国Varian公司);ZY-100型粉碎机(江阴市振亚粉体机械制造有限公司)。
1.2 试验设计试验于2014年春季在温州市农业科学研究院藤桥试验基地进行,试验田块纬度28°09′ N,经度 120°52′ E,海拔 9 m,年均温度17 ℃,年降水量1 800 mm,土壤为粉质黏土,pH值5.67,有机质34.7 g/kg,总氮2.18 g/kg,有效磷38.0 mg/kg,有效钾79 mg/kg。采用宽垄垄上双行种植,垄长×垄宽×沟宽=7 m×1 m×0.2 m。每小区5垄,面积为42 m2。于4月10日直播于地膜覆盖的垄上,种植密度4.8万株/hm2,株距×行距=0.35 m×0.60 m。试验地一次性施入过磷酸钙300 kg/hm2、氯化钾225 kg/hm2和尿素225 kg/hm2作为基肥,其他管理措施按常规要求。
于玉米吐丝后5 d,参照顾万荣等[5]的方法,于叶面喷施20 mg/L胺鲜酯(DTA-6),每小区喷药液量为1.5 L,小区面积为42 m2。以清水为对照。处理与对照药液中均加入质量分数为0.02%的Tween-20。药液均匀喷施在“棒三叶”(穗位叶、穗位上一叶和穗位下一叶)部位,以在叶片上呈欲滴未滴时的量为准。每处理重复4次。
于处理后第3~12天内每隔3 d取样和进行生理测定:随机取5株玉米上的穗位叶叶片中部,除去叶脉,用锡箔纸封好,立即放入液氮中于-20 ℃条件下贮存,备用;随机取4个玉米穗的中部籽粒并混匀,取100粒,用排酒精法[10]测定籽粒体积,称量籽粒鲜重,重复4次。同时测定千粒重,重复3次。于处理后第15天测定鲜穗产量,每个处理取2垄共80穗,重复4次。
1.3 光合特征指标及光合产物的测定 1.3.1 叶绿素与光合速率按叶绿素测定仪说明书操作流程,测定叶绿素含量。
按LI-6400便携式光合系统测定仪说明书操作流程,测定玉米穗位叶的净光合速率,每个处理(DTA-6和对照)重复10次。测定条件:内置光强为1 000 μmol/(m2·s),温度30 ℃,CO\-2 浓度450 μmol/L。
1.3.2 可溶性糖、蔗糖和淀粉含量采用蒽酮比色法[11]测定可溶性糖和淀粉含量。取玉米籽粒,利用ZY-100型粉碎机粉碎,取0.1 g干粉末样品,放入10 mL离心管中,加7 mL蒸馏水,在沸水浴中煮沸20 min,冷却,于3 500 r/min条件下离心10 min,收集上清液,用蒸馏水定容至50 mL。取待测液0.1 mL,加水到1 mL,加蒽酮4.0 mL,在40 ℃水浴中显色10~15 min。测定620 nm处吸光度值OD,计算可溶性糖含量。
向测糖所剩残渣中加入7 mL 3 mol/L的盐酸,在沸水浴中煮沸45 min,冷却,于4 000 r/min条件下离心15 min,取上清液于50 mL容量瓶中,加入7 mL 3 mol/L的NaOH,用蒸馏水定容至50 mL。取待测液0.1 mL,加水到1 mL,加蒽酮4.0 mL,在40 ℃水浴中显色10~15 min。测定620 nm处吸光度OD值,计算淀粉含量。
采用间苯二酚法[12]测定蔗糖含量。取玉米籽粒干粉末样品0.5 g,放入10 mL离心管中,加入80%乙醇4 mL,于80 ℃水浴中搅拌40 min,于4 000 r/min条件下离心,收集上清液。在上清液中加入10 mg活性炭,于80 ℃下脱色30 min,用80%乙醇定容至10 mL,过滤后取滤液待测。取0.5 mL 待测液,加入 2 mol/L NaOH 200 μL,100 ℃煮沸5 min,冷却,加入9.45 mol/L HCl 2.8 mL和0.1%间苯二酚0.8 mL,摇匀,于80 ℃水浴中反应10 min,冷却后在480 nm处测定吸光度OD值,计算蔗糖含量。
1.4 光合作用和蔗糖代谢相关酶活性的测定 1.4.1 磷酸烯醇式丙酮酸羧化酶(PEPCase)和核酮糖二磷酸羧化酶(RuBPCase)酶的提取按Sayre等的方法[13]进行。取叶片鲜样0.5 g,加少量石英砂和3 mL预冷的提取液进行研磨提取。提取液中包含100 mmo/L的Tris-HCl(pH 7.8),10 mmol/L的MgCl2,1 mmol/L的EDTA,20 mmol/L的β-巯基乙醇,10%(m/V)glycerin 和1%的PVP。过滤,滤液在4 ℃、15 000× g条件下离心10 min,取上清液待测定。
1.4.1.1 PEPCase活性采用Blanke等的酶偶联法[14]测定。反应体系为1 mL,反应混合液包含50 mmol/L的Tris-HCl(pH 7.8)、10 mmol/L的MgCl2、0.25 mmol/L的EDTA、5.0 mmol/L 的NaHCO3、2.0 mmol/L的DTT、0.1 mmol/L的NADH、4 U的MDH和2.0 mmol/L的PEP各0.1 mL,加0.2 mL酶液启动反应,测定340 nm处吸光度OD值,测定时间为3 min。
1.4.1.2 RuBPCase活性参考Racker方法[15]测定。反应体系为3.1 mL,包含100 mmol/L的Tris-HCl 缓冲液 (pH 8.0)、100 mmol/L的MgCl2、50 mmol/L的ATP、50 mmol/L的DTT、2.0 mmol/L的NADH和1.0 mmol/L的EDTA-Na 各0.3 mL,200 μmol/L的NaHCO3 0.1 mL,蒸馏水1.0 mL,3-磷酸甘油酸激酶(PGK)/3-磷酸甘油醛脱氢酶(GAP-GDH)(15U/15U)0.1 mL,酶提取液0.1 mL。在30 ℃水浴中保温10 min,于340 nm处测定吸光度OD值,最后加入9.0 mmol/L的1,5-二磷酸核酮糖(RuBP)0.1 mL 启动反应,每隔10~15 s测定吸光度OD值,测定时间为3 min。
1.4.2 蔗糖磷酸化酶和蔗糖合成酶蔗糖磷酸化酶(SPS)和蔗糖合成酶(SS)活性的测定参照Doehlert等[16]和Wardlaw[17]的方法。
1.4.2.1 SS酶液的提取与活性称取约0.5 g的鲜玉米籽粒,加入5 mL提取液(含50 mmol/L Hepes-1、2 mmol/L MgCl2.6H2O、3%乙二醇、1 mmol/L DTT、1 mmol/L EDTANa2和1 mol/L NaCl),冰浴研磨,于4 ℃下15 000×g离心10 min,上清液即为粗酶液。反应体系中加入50 mmol/L Hepes-NaOH (pH7.2)50 μL、10 mmol/L UDP 100 μL、10 mmol/L MgCl2 100 μL、100 mmol/L蔗糖150 μL和粗酶液100 μL。将酶液换成水作为对照。于30 ℃水浴中反应30 min,100 ℃终止5 min,加入1 mL DNS(3,5-二硝基水杨酸),于100 ℃条件下反应2 min,再加入蒸馏水4.5 mL稀释,于540 nm处比色,测定SS酶活性。
1.4.2.2 SPS酶液的提取与活性SPS粗酶液提取方法和SS粗酶液一样。反应体系中加入50 mmol/L的Hepes(pH 7.2)150 μL、15 mmol/L的DTT 150 μL、10 mmol/L的MgCl2 75 μL、32 mmol/L的ADPG 20 μL、40 mmol/L的焦磷酸钠155 μL和粗酶液300 μL。于30 ℃条件下保温20 min,于100 ℃条件下反应1 min,终止反应。以提前杀死酶活性的相同处理作为空白对照。对照反应体系中加入50 mmol/L的Hepes(pH 7.2)1 200 μL、6 mmol/L的NADPNa2 100 μL和蒸馏水65 μL,1 U的变位酶和1U的脱氢酶各50 μL,在340 nm处比色,测定SPS活性。
1.5 数据处理与统计分析试验结果以平均值表示,数据的统计分析采用SAS软件(V 9.0,SAS Institute Inc.,Cary,USA)中的ANOVA分析方法处理。
2 结果与分析 2.1 DTA-6处理对甜玉米果穗性状、籽粒品质及产量的影响 2.1.1 果穗性状及产量由表 1可知:DTA-6处理可显著提高甜玉米鲜穗产量、穗粒数和千粒重,与对照比较分别增加了15.8%、9.6%和11.9%。同时,DTA-6处理显著降低了玉米秃尖长度,但对果穗长度和穗粗影响较小。研究表明,DTA-6在甜玉米吐丝期处理后,可通过提高穗粒数和粒重、减少秃尖长度实现产量增加。
|
|
表 1 DTA-6对甜玉米果穗性状与鲜穗产量的影响 Table 1 Effect of DTA-6 on ear characters and the fresh ear yield of sweet corn |
结果(图 1)表明:DTA-6处理显著提高了甜玉米籽粒的灌浆物质积累;显著提高了处理后9和12 d的籽粒体积,同时显著促进了处理后6、9和12 d的物质积累量。

|
注:不同字母表示不同时间内处理与对照间在0.05
水平上差异显著。 Note: Different letters in the different column indicated significant difference at 0.05 level. 图 1 DTA-6处理对甜玉米籽粒灌浆的影响 Fig. 1 Effect of DTA-6 on the grain filling of sweet corn |
DTA-6显著提高了处理后6、9和12 d甜玉米籽粒中的可溶性糖和蔗糖含量,同时也显著提高了处理后12 d的淀粉含量(图 2)。

|
注:不同字母表示不同时间内处理与对照间
在0.05水平上差异显著。
Note:Different letters in the different column indicated significant difference at 0.05 level. 图 2 DTA-6处理对甜玉米籽粒可溶性糖、 蔗糖和淀粉含量的影响 Fig. 2 Effect of DTA-6 on soluble sugar,sucrose and starch contents of sweet corn grain |
DTA-6处理提高了穗位叶叶绿素含量和光合速率,其中在处理后6~12 d内均高于对照;此外,还显著提高了穗位叶光合作用关键酶PEPCase和RuBPCase的活性(图 3)。研究表明,DTA-6处理通过增加叶绿素积累,改善光合作用关键酶的活性,提高光合速率,从而促进了同化产物的积累。
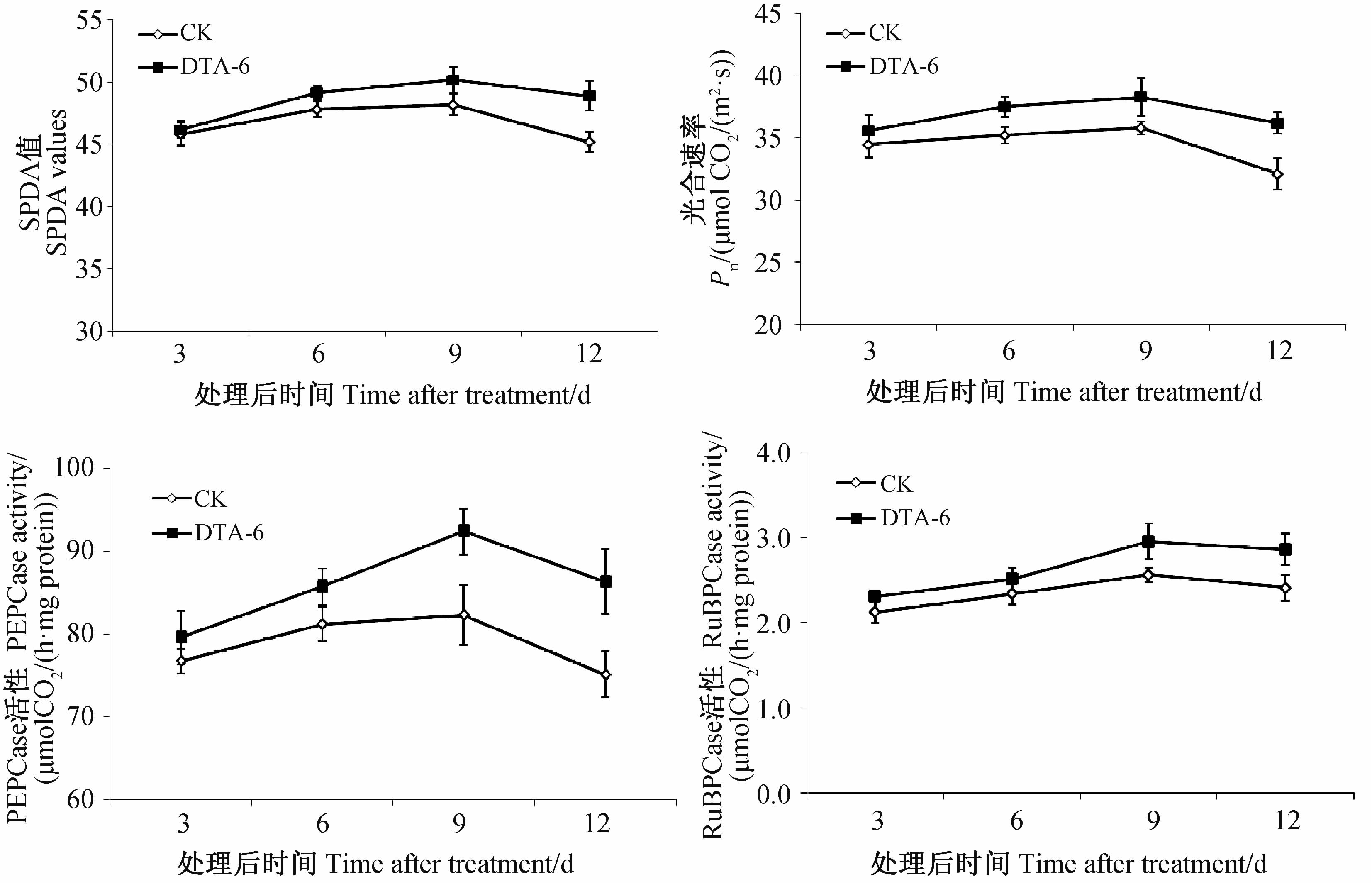 | 注:不同字母表示不同时间内处理与对照间
在0.05水平上差异显著。 Note: Different letters in the different column indicated significant difference at 0.05 level. 图 3 DTA-6处理对甜玉米穗位叶叶绿素含量、光合速率和光合作用关键酶活性的影响 Fig. 3 Effect of DTA-6 on photosynthetic rate,chlorophyll content and photosynthetic key enzyme activities of sweet corn ear leaf |
DTA-6显著提高了处理后6、9和12 d的蔗糖磷酸化酶活性,使蔗糖合成酶合成方向活性显著高于对照,而在处理后9和12 d其分解方向活性显著高于对照(图 4)。
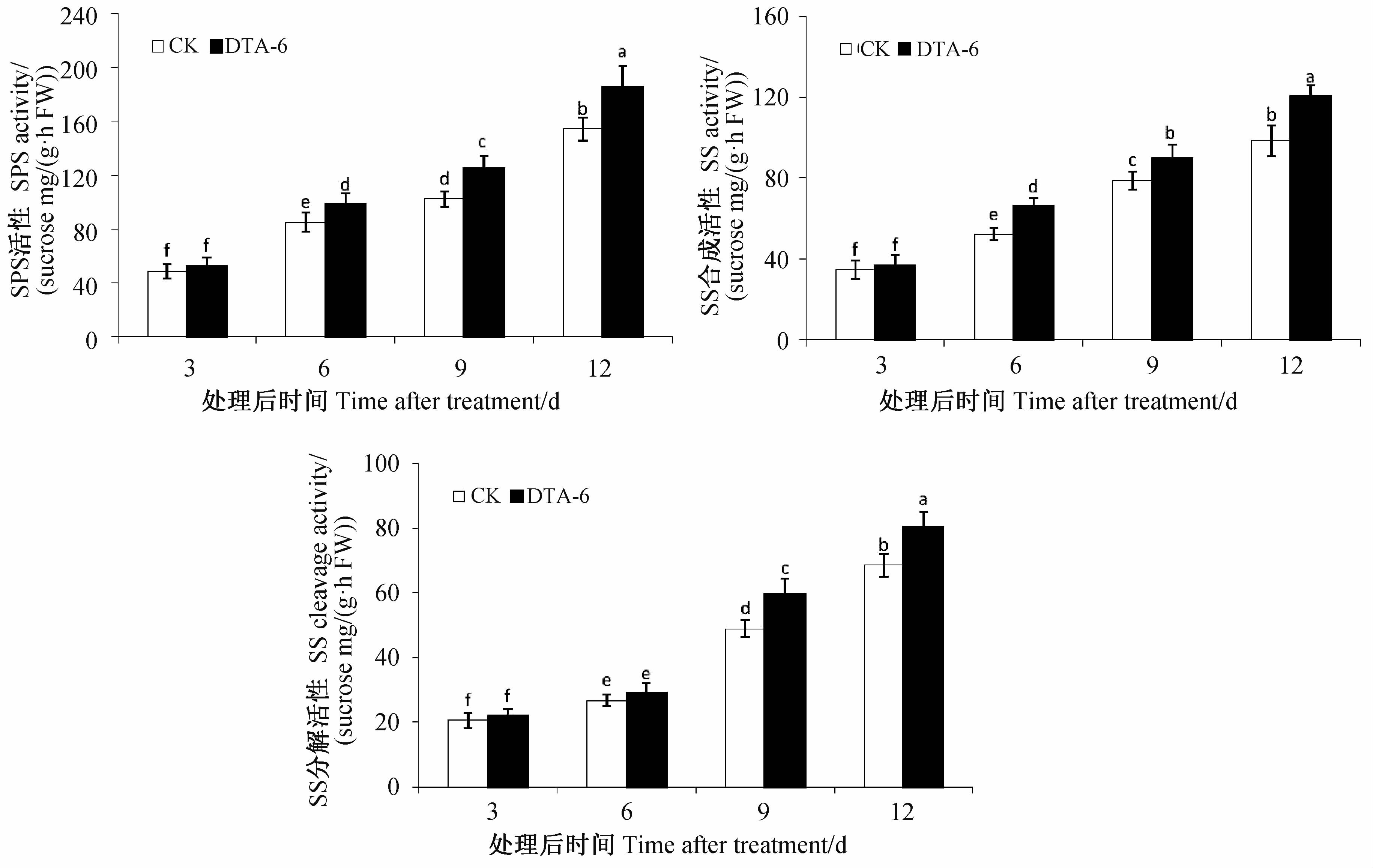
|
图 4 DTA-6处理对甜玉米籽粒蔗糖磷酸化酶 和蔗糖合成酶活性的影响 Fig. 4 Effect of DTA-6 on activities of sucrose phosphorylase and sucrose synthase of sweet corn grain |
玉米干物质积累量的95%左右来源于光合作用,因此改善光合性能是提高玉米产量的生理基础。本研究结果表明,DTA-6处理显著提高了甜玉米穗位叶叶绿素含量和光合速率,增强了光合作用关键酶PEPC羧化酶和RuBP羧化酶活性,从而促进了甜玉米光合同化产物的积累。这一研究结果与在普通玉米、大豆等作物上的效果基本一致[4, 5],适宜浓度的2-(3,4-二氯苯氧基)-乙基-二乙胺(DCPTA)和DTA-6处理能够显著提高玉米苗期叶片光合速率、PEPC羧化酶和RuBP羧化酶的活性,同时增加植株的生物量[5]。
鲜食甜玉米籽粒中碳水化合物组成和含量是决定其品质的重要因素,其中可溶性糖和蔗糖含量对甜玉米的食用品质具有决定作用[1, 2]。DTA-6处理显著提高了甜玉米籽粒形成过程中可溶性糖和蔗糖含量,提高了处理后期淀粉的积累量,这表明DTA-6在吐丝期处理可以改善甜玉米籽粒品质,提高产量。已有研究报道,DTA-6处理可以显著增加甜豌豆、甜叶菊等作物产量,提高其含糖量[7, 9]。Keithly等[18]报道,DCPTA(DTA-6类似物)通过促进番茄幼果中光合产物向淀粉方向积累,从而增强了库的储存和再生能力,改善了果实品质。蔗糖是重要的光合产物又是碳水化合物积累和贮藏的主要形式,而SPS是蔗糖合成途径中的限速酶,其活性反映蔗糖合成能力[12]。本研究发现,DTA-6处理后显著提高了甜玉米籽粒中SPS活性,同时显著提高了SS合成酶活性。SS存在于细胞质中,可调节胞内蔗糖合成,其催化反应是可逆的,即SS分解活性大于合成活性时,蔗糖被分解,而小于合成活性时,则有利于蔗糖的形成[2, 12]。DTA-6处理后玉米籽粒中SS合成活性显著高于其分解活性,有利于蔗糖积累,改善品质。因此,DTA-6处理显著改善了叶片光合功能,促进了同化产物向籽粒的供给量,加速了籽粒灌浆进程。籽粒中同化产物积累量增加可能会加速同化产物代谢,从而激活了SPS和SS酶活性,提高了籽粒可溶性糖和蔗糖的积累量,改善了甜玉米的可食性。至于DTA-6是直接还是间接调节SPS和SS酶活性还有待进一步研究。
从产量构成因素分析,DTA-6处理增加了单穗粒数和千粒重,从而增加了鲜穗产量。粒重增加主要是由于DTA-6加速了甜玉米籽粒灌浆速率和体积增大速率。张明才等[9, 19]研究发现,DTA-6显著增加了花生和甜豌豆单株生产能力,提高了产量。顾万荣等[5]研究报道,DTA-6 可以显著增加玉米苗期干物质积累量。本研究结果表明,DTA-6通过改善甜玉米光合功能,调节籽粒中蔗糖代谢,加速籽粒灌浆速率,从而提高产量及改善品质。
| [1] | Tracy W F, Whitt S R, Buckler E S. Recurrent mutation and genome evolution example of sugary 1 and the origin of sweet maize[J]. Crop Sci, 2006, 46:49-54. |
| [2] | 曹玉军, 赵宏伟, 王晓慧, 等. 施钾对甜玉米产量、品质及蔗糖代谢的影响[J]. 植物营养与肥料学报, 2011, 17(4):881-887. Cao Yujun, Zhao Hongwei, Wang Xiaohui, et al. Effects of potassium fertilization on yield, quality and sucrose metabolism of sweet maize[J]. Plant Nutrition and Fertilizer Science, 2011, 17(4):881-887(in Chinese) |
| [3] | James H, Keithly J H, Yokoyama H. Regulation of crop growth and yield by tertiary amine bioregulators//Gausman H W. Plant Biochamical Regulator[M]. New York:Marcel Dekker, 1991:223-246. |
| [4] | 顾万荣, 李召虎, 翟志席, 等. DCPTA和DTA-6对大豆叶片光合及叶绿素荧光特性的调控[J]. 大豆科学, 2008, 27(5):777-782. Gu Wanrong, Li Zhaohu, Zhai Zhixi, et al. Regulation of DCPTA and DTA-6 on photosynthesis and chlorophyll fluorescence parameters of soybean leaves[J]. Soybean Science, 2008, 27(5):777-782(in Chinese) |
| [5] | 顾万荣, 李召虎, 翟志席, 等. 叔胺类活物质对玉米叶片光合特性与叶绿素荧光特性的调控效应[J]. 华北农学报, 2008, 23(3):85-89. Gu Wanrong, Li Zhaohu, Zhai Zhixi, et al. Regulation of tertiary amine bioregulator on photosynthesis and chlorophyll fluorescence parameters of corn leaves[J]. Acta Agriculturae Boreali-Sinica, 2008, 23(3):85-89(in Chinese) |
| [6] | 梁广坚, 李芸瑛, 邵玲. DA-6和BR+GA-3对菠菜生长和光合速率的影响[J]. 园艺学报, 1998, 25(4):356-360. Ling Guangjian, Li Yunying, Shao Ling. Effect of DA-6 and BR+GA3 on growth and photosynthetic rate in spinach[J]. Acta Horticulturae Sinica, 1998, 25(4):356-360(in Chinese) |
| [7] | 林永顺, 陈睦传, 沈明山, 等. DA-6对甜菊叶片糖苷含量和组分影响研究[J]. 中国糖料, 1998,(3):12-15. Lin Yongshun, Chen Muchuan, Shen Mingshan, et al. Studies on effect of content and component of steviol glucosides with DA-6 in stevia rebaudiana bertoni[J]. Sugar Crops of China, 1998,(3):12-15(in Chinese) |
| [8] | 沈明山, 林永顺, 陈睦传, 等. DA-6对甜菊叶片细胞超微结构的影响研究[J]. 中国糖料, 1999,(4):1-3. Shen Mingshan, Lin Yongshun, Chen Muchuan, et al. Studies on influence of DA-6 regulation on leaf cells ultrastructure in stevia rebaudianabertoni[J]. Sugar Crops of China, 1999,(4):1-3(in Chinese) |
| [9] | 张明才, 何钟佩, 王玉琼, 等. 植物生长调节剂DTA-6在甜豌豆上的应用效果[J]. 农药学学报, 2001,3(4):53-58. Zhang Mingcai, He Zhongpei, Wang Yuqiong, et al. Effects of plant growth regulator DTA-6 on sweet pea[J]. Chin J Pestic Sci, 2001, 3(4):53-58(in Chinese) |
| [10] | 樊庆琦, 杨克诚, 乔善宝. 普通玉米3个籽粒性状的遗传分析[J]. 2005, 18(4):378-381. Fan Qingqi, Yang Kecheng, Qiao Shanbao. Analysis of genetics of four kernel traits in maize(Zea mays L.)[J]. Southwest China Journal of Agricultural Sciences, 2005, 18(4):378-381(in Chinese) |
| [11] | 张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京:高等教育出版社, 2003:127-132. Zhang Zhiliang, Qu Weiqing. Plant physiology experiment instruction[M]. Beijing:Higher Education Press, 2003:127-132.(in Chinese) |
| [12] | 中国科学院上海植物生理研究所. 现代植物生理学实验指南[M]. 北京:科学出版社, 1999:131-134. Chinese Academy of Sciences Shanghai Institute of Plant Physiology. Modern Plant Physiology Lab Guide[M]. Beijing:Science Press, 1999:131-134.(in Chinese) |
| [13] | Sayre R T, Kennedy R A. Photosynthetic enzyme activities and localization in Mollugo verticillata populations differing in the leaves of C3 and C4 cycle operation[J]. Plant Physiol, 1979, 64(2):293-299. |
| [14] | Blanke M M, Ebert G. Phosphoenolpyruvate carboxylase and carbon economy of apple seedlings[J]. J Exp Bot, 1992, 43(7):965-968. |
| [15] | Racker E. Ribulose diphosphate carboxylase from spinach leaves//Colowick S P, Kaplan N O. Methods in Enzymology[M]. NewYork:Academic Press, 1962:266-278. |
| [16] | Doehlert D C, Kuo T M, Felker F C. Enzymes of sucrose and hexose metabolism in developing kernels of two inbreeds of maize[J]. Plant Physiol, 1988, 86:1013-1019. |
| [17] | Wardlaw I F. The early stages of grain development in wheat:Response to water stress in a single variety[J].Australian Journal of Biological Sciences, 1971, 24:1047-1055. |
| [18] | Keithly J H, Yokoyama H, Gausman H W. Regulation of crop growth and yield by tertiary amine bioregulators[J]. Hort Science, 1991, 117:294-297. |
| [19] | 张明才, 何钟佩, 田晓莉, 等. 植物生长调节剂DTA-6对花生产量、品质及其根系生理调控研究[J]. 农药学学报, 2003, 5(4):47-52. Zhang Mingcai, He Zhongpei, Tian Xiaoli, et al. Regulation of plant growth regulator DTA-6 on peanut yield and quality and its root physiology[J]. Chin J Pestic Sci, 2003, 5(4):47-52(in Chinese) |
 2015, Vol. 17
2015, Vol. 17


