b. 湖南农业大学 农业环境保护研究所, 长沙 410128
b. Institute of Agricultural Environmental Protection, Hu'nan Agricultural University, Changsha 410128, China
新烟碱类杀虫剂具有杀虫谱广、用量低、内吸传导性好、作用机制新颖和环境相容性高等特点,可有效防治同翅目、鞘翅目、双翅目和鳞翅目等害虫,对用传统杀虫剂防治产生抗药性的害虫也有良好的活性[1]。呋虫胺、吡虫啉和啶虫脒作为新一代烟碱类杀虫剂,对蚜虫、叶蝉、飞虱等刺吸式害虫有较好的防治效果,广泛用于防治水稻虫害[2]。因此及时准确地了解其在稻田样品中的残留状况十分必要。
将新烟碱类杀虫剂呋虫胺、吡虫啉和啶虫脒混用,一次性可防除多种虫害,具有比单剂更好的防治效果[3]。目前,烟碱类杀虫剂的检测方法主要有气相色谱法[4, 5]、液相色谱-质谱法[6]、高效液相色谱法[7, 8, 13, 14, 15, 16, 17]、酶联免疫法[9, 10]和分光光度法[11, 12]等。乙小娟等[13]用乙腈提取,采用ENVI-Florisil 和 Carb 复合固相萃取柱萃取净化,高效液相色谱(HPLC)高通量 RRHT 色谱柱,258 nm下紫外测定,建立了HPLC快速测定大米中4种烟碱类农药残留的分析方法。目前尚未见有关水稻及其生态环境中呋虫胺、吡虫啉和啶虫脒多残留分析方法的报道。本研究在已有研究的基础上[13],建立了同时测定上述3种杀虫剂的HPLC方法,以期为其科学合理施用及环境安全性评价提供残留检测参考方法。
1 材料与方法 1.1 主要仪器与药剂HP-1260型高效液相色谱仪(美国安捷伦公司);CCA-20低温冷却水循环泵(巩义市予华仪器有限责任公司);RE-2000A型旋转蒸发仪(上海亚荣生化仪器厂);SHZ-D(Ⅲ)循环水式真空泵(浙江黄岩求精真空泵厂);TP-220A电子天平(湘仪天平仪器设备有限公司);SHY-2AS水浴恒温振荡器(上海智城分析仪器制造有限公司)。
95%呋虫胺(dinotefuran)标准品,南京乐邦化工有限公司;98.5%吡虫啉(imidacloprid)标准品,上海思域化工科技有限公司;97.3%啶虫脒(acetamiprid)标准品,赣州卫农农药有限公司;甲醇(色谱纯)、乙腈(分析纯)、氯化钠(140 ℃烘烤 4 h,置于干燥器内备用)、无水硫酸钠(140 ℃烘烤 6 h,置于干燥器内备用),均购自天津市恒兴化学试剂制造有限公司;弗罗里硅土(60~100目,颗粒度≥85%,用前于650 ℃烘3~5 h,待冷却后以质量分数为3%的蒸馏水脱活,于130 ℃烘箱中保存,备用),国药集团化学试剂有限公司。
1.2 高效液相色谱检测条件Agilent HC-C18(2)色谱柱(4.6 m×250 mm,5 μm);进样量20 μL;柱温40 ℃;流动相为V(甲醇)∶V(水)=30∶70;流速:0 min为0.7 mL/min,7.5 min为0.7 mL/min,8 min升至0.8 mL/min;检测波长254 nm。在此条件下,呋虫胺、啶虫脒和吡虫啉的保留时间分别为6.8、13.7和18.6 min。
1.3 样品的提取与净化 1.3.1 田水样品的提取准确量取20 mL水样于250 mL三角瓶中,加入20 mL乙腈,在30 ℃恒温条件下振荡提取30 min;移入250 mL分液漏斗中,加入5 g氯化钠,剧烈振摇2 min,静置分层,取有机相10 mL,旋蒸浓缩至干,用甲醇定容至5 mL,待HPLC测定。
1.3.2 土壤及水稻植株、稻壳和稻秆样品的提取准确称取解冻至室温的20.0 g土样(或水稻植株10.0 g、稻壳5.0 g及稻秆5.0 g),置于250 mL具塞三角瓶中,加入80 mL乙腈,在30 ℃下恒温振荡提取30 min,抽滤,用20 mL乙腈洗涤残渣和抽滤瓶,收集全部滤液,旋蒸浓缩至干,待净化。
1.3.3 糙米样品的提取准确称取糙米20.0 g,置于250 mL具塞三角瓶中,先加入40 mL蒸馏水浸泡10 min,再加入40 mL乙腈,在30 ℃恒温条件下振荡提取30 min;移入250 mL分液漏斗中,加入5 g氯化钠,剧烈振摇2 min,静置分层,取有机相20 mL,旋蒸浓缩至干,待净化。
1.3.4 样品的净化弗罗里硅土净化柱自下至上依次装填少许脱脂棉、2 cm厚无水硫酸钠、5 g弗罗里硅土和2 cm厚无水硫酸钠;用20 mL乙腈预淋洗,弃去淋出液;转入待净化液,用乙腈淋洗5次,每次10 mL,收集全部淋出液,旋蒸浓缩至干,用甲醇定容至5 mL,待HPLC测定。
1.3.5 标准曲线的绘制准确称取呋虫胺、吡虫啉和啶虫脒标准品各0.010 5、0.010 1和0.010 2 g(精确至0.000 1 g)于100 mL的容量瓶中,用甲醇溶解配成质量浓度为100.0 mg/L的标准品母液。使用时再用甲醇梯度稀释成0.05、0.1、0.2、0.5、1、2、5及10 mg/L的标准工作溶液,按1.2节的条件测定。以质量浓度(x,mg/L)为横坐标,相应的色谱峰面积(y)为纵坐标,绘制标准曲线。
2 结果与讨论 2.1 检测条件的优化 2.1.1 流动相的选择在文献[12, 13, 14, 15, 16, 17]的基础上,分别考察了不同比例的甲醇-水、乙腈-水作为流动相时的洗脱效果。结果表明:以V(甲醇)∶V(水)=30∶70为流动相时,无杂质峰干扰,故选其作为流动相。
2.1.2 检测波长的选择采用分光光度计测得呋虫胺、吡虫啉和啶虫脒的最大吸收波长分别为270、270和246 nm,综合考虑3种农药同时检测的灵敏度,发现当检测波长为254 nm 时,相同质量浓度的呋虫胺、啶虫脒和吡虫啉标准溶液能够获得相似的灵敏度,故最终选择254 nm作为检测波长。
2.2 样品前处理条件的优化溶于水的乙腈、丙酮以及不溶于水的二氯甲烷等在烟碱类杀虫剂残留检测中均有应用[18]。
2.2.1 提取溶剂的选择对于稻田田水、稻田土壤、水稻植株、稻壳和稻秆,分别考察了丙酮、二氯甲烷和乙腈的提取效果。结果表明:采用丙酮或二氯甲烷提取时,3种农药的添加回收率偏低或出峰处有杂质峰干扰;而采用乙腈提取时,3种农药的添加回收率均可达到检测要求[19],因此选用乙腈作为提取溶剂。
而对于水稻糙米,则分别考察了乙腈、丙酮、二氯甲烷和V(乙腈)∶V(水)=1∶1的混合液的提取效果。结果表明:采用二氯甲烷、乙腈或丙酮提取时,提取效率均较低(60%~70%),且杂质峰较多;而采用V(乙腈)∶V(水)=1∶1的混合液提取时,回收率可达到80%以上,杂质峰相对较少,因此采用V(乙腈)∶V(水)=1∶1的混合液对糙米进行提取。
2.2.2 净化条件的选择比较了乙腈、丙酮、V(正己烷)∶V(丙酮)=1∶1和V(正己烷)∶V(丙酮)=9∶1混合溶液对提取液的净化效果。结果表明:采用V(正己烷)∶V(丙酮)=9∶1混合溶液淋洗后,3种农药的回收率均不能达到要求;采用V(正己烷)∶V(丙酮)=1∶1混合溶液淋洗,呋虫胺的回收率不足50%; 采用丙酮淋洗,虽然回收率较高,但色素较多,杂质峰干扰较明显;而采用乙腈为淋洗液时,3种农药的回收率均达到80%以上,且色素较少,与杂质分离效果良好,故选用乙腈作为淋洗液,用量为50 mL。
2.3 方法的线性范围与检出限在0.05~10 mg/L范围内,3种药剂的质量浓度与其相对应的色谱峰面积之间呈良好的线性关系,其线性方程分别为呋虫胺:y= 62.55x+4.039 2(R2=0.999 2),吡虫啉:y=99.968x+7.525 1(R2=0.998 6),啶虫脒:y=97.084x+6.072(R2=0.999 4)。
在选定的检测条件和样品前处理方法下,呋虫胺、吡虫啉和啶虫脒的检出限(LOD)分别为0.016、0.012和0.012 mg/kg,在稻田水、稻田土壤、水稻植株、稻秆、稻壳和糙米中的定量限(LOQ)均为0.05 mg/kg。
2.4 方法的准确度及精密度结果(见图 1、图 2和表 1)表明:在稻田水、稻田土壤、水稻植株、稻秆、稻壳和糙米的空白样品中,分别添加呋虫胺、吡虫啉和啶虫脒的混合标准工作溶液, 在0.05、0.5、2 mg/L(或mg/kg)3个添加水平下,呋虫胺在不同样品中的平均回收率为83%~97%,相对标准偏差(RSD)为1.5%~6.5%;吡虫啉的平均回收率为82%~97%,RSD为1.5%~5.5%;啶虫脒的平均回收率为81%~99%,RSD为1.2%~7.9%。表明该分析与检测方法均符合农药残留量分析与检测的技术要求[19],可以用于实际样品的分析与检测中。
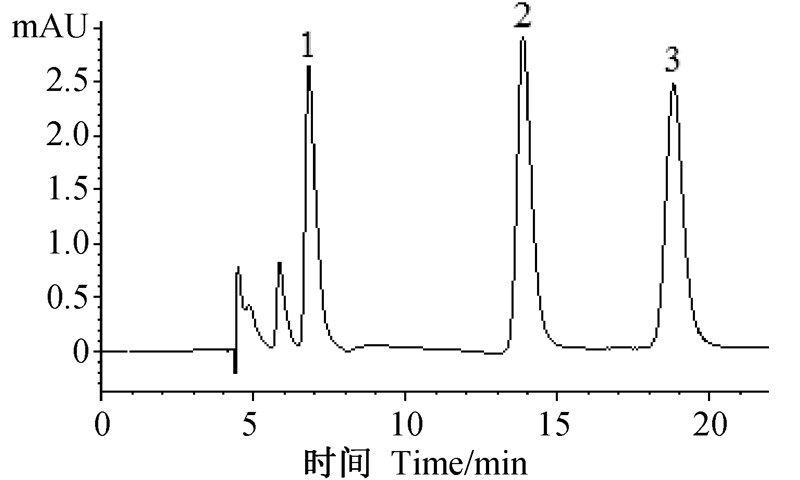 |
1.呋虫胺; 2.吡虫啉; 3.啶虫脒。 1. dinotefuran; 2. imidacloprid; 3. acetamiprid. 图 1 呋虫胺、吡虫啉和啶虫脒混合标准溶液的高效液相色谱图(1.0 mg/L) Fig. 1 The HPLC chromatogram of dinotefuran, imidacloprid and acetamiprid in mixed standard solution (1.0 mg/L)f |
 |
1.呋虫胺; 2.吡虫啉; 3.啶虫脒。a. 稻田水空白样品; b. 稻田水添加样品; c. 稻田土壤空白样品; d. 稻田土壤添加样品; e. 水稻植株空白样品; f. 水稻植株添加样品; g. 稻秆空白样品; h. 稻秆添加样品; i. 稻壳空白样品; j. 稻壳添加样品; k. 糙米空白样品; l. 糙米添加样品。 1. dinotefuran; 2. imidacloprid; 3. acetamiprid. a. control blank paddy water sample; b. added blank paddy water sample; c. control blank paddy soil; d. added blank paddy soil; e. control blank rice plants; f. added blank rice plants; g. control blank paddy rice straw; h. added blank paddy rice straw; i. control blank rice husk; j. added blank rice husk; k. control blank coarse rice; l. added blank coarse rice. 图 2 呋虫胺、吡虫啉和啶虫脒在稻田各类样品中的HPLC图(0.50 mg/L或mg/kg) Fig. 2 The HPLC chromatograms of dinotefuran, imidacloprid and acetamiprid in various samples from paddy field(0.50 mg/L or mg/kg) |
|
|
表 1 呋虫胺、吡虫啉和啶虫脒在不同样品中的添加回收率和相对标准偏差 Table 1 Recoveries and RSDs of dinotefuran, imidacloprid and acetamiprid in different samples(n=5) |
本研究通过对样品前处理条件及HPLC法的优化,建立了高效液相色谱-紫外检测器法同时检测呋虫胺、吡虫啉和啶虫脒在稻田水、稻田土壤、水稻植株、稻秆、稻壳和糙米中残留量的分析方法。该方法分离度高,样品前处理步骤较简单,且处理后杂质干扰较少,重复性好,其回收率和最小检出浓度均能满足农药残留量分析与检测的技术要求。
| [1] | 王建军, 韩召军, 王荫长. 新烟碱类杀虫剂毒理学研究进展[J]. 植物保护学报, 2001, 28(2): 178-182. Wang Jianjun, Han Zhaojun, Wang Yinchang. A review on the toxicology of new nicotinyl insecticides[J]. Phytophylacica Sinica, 2001, 28(2): 178-182. (in Chinese) |
| [2] | 张国生, 侯广新. 烟碱类杀虫剂的应用、开发现状及展望[J]. 农药科学与管理, 2004, 25(3): 22-26. Zhang Guosheng, Hou Guangxin. Present status of development and prospect of nicotinoid insecticides[J]. Pestic Sci Admin, 2004, 25(3): 22-26. (in Chinese) |
| [3] | 刘长令. 世界农药大全: 杀虫剂卷[M]. 北京: 化学工业出版社, 2012. Liu Changling. The World Encyclopedia of Pesticide Insecticide Volume[M]. Beijing: Chemical Industry Press, 2012. (in Chinese) |
| [4] | Khay S, Abd El-Aty A M, Cho S-K, et al. Development of extraction procedures for the determination of imidacloprid: application to residue analysis and dynamics of two formulations in Chinese cabbage[J]. Biomed Chromatogr, 2008, 22(6): 581-589. |
| [5] | 卢声宇, 徐敦明, 李捷, 等. 气相色谱法测5种农产品中啶虫脒残留量[J]. 分析试验室, 2008, 27(S): 7-9. Lu Shengyu, Xu Dunming, Li Jie, et al. Determination of acetamiprid residues in five kinds of agricultural pproducts with gas chromatography[J]. Chin J Anal Lab, 2008, 27(S): 7-9. (in Chinese) |
| [6] | 李立, 付建, 初玉圣, 等. 食品中呋虫胺残留量的HPLC-MS/MS检测方法研究[J]. 食品科学, 2008, 29(11): 538-540. Li Li, Fu Jian, Chu Yusheng, et al. Determination of dinotefuran residue in foods with HPLC-MS/MS [J]. Food Sci, 2008, 29(11): 538-540 |
| [7] | 樊苑牧, 顾晓俊, 俞雪钧, 等. 高效液相色谱法测定蔬菜和水果中吡虫啉农药残留量[J]. 分析科学学报, 2007, 23(5): 583-585. Fan Yuanmu, Gu Xiaojun, Yu Xuejun, et al. Determination of imidacloprid residue in vegetables and fruits by HPLC[J]. J Anal Sci, 2007, 23(5): 583-585. (in Chinese) |
| [8] | 曹爱华, 徐光军, 朱先志, 等. 烟草及土壤中吡虫啉的残留分析方法研究[J]. 中国烟草科学, 2001, 22(4): 45-48. Cao Aihua, Xu Guangjun, Zhu Xianzhi, et al. Analysis method of imidacloprid residues in tobacco and soil study[J]. Chin Tob Sci, 2001, 22(4): 45-48. (in Chinese) |
| [9] | Watanabe E, Eun H, Baba K, et al. Evaluation and validation of a commercially available enzyme-linked immunosorbent assay for the neonicotinoid insecticide imidacloprid in agricultural samples[J]. J Agric Food Chem, 2004, 52(10): 2756-2762. |
| [10] | Fang Song, Zhang Bin, Ren Kewei, et al. Development of a sensitive indirect competitive enzyme-linked immunosorbent assay (ic-ELISA) based on the monoclonal antibody for the detection of the imidaclothiz residue[J]. J Agric Food Chem, 2011, 59(5): 1594-1597. |
| [11] | Guzsvány V J, Lazic' S D, Vidakovic' N, et al. Derivative spectrophotometric determination of acetamiprid in the presence of 6-chloronicotinic acid[J]. J Serb Chem Soc, 2012, 77(7): 911-917. |
| [12] | 樊静, 邵小静, 魏娅方, 等. 吡虫啉和啶虫脒的离子液体双水相萃取顺序注射光度分析研究[J]. 分析化学, 2008, 36(10): 1411-1414. Fan Jing, Shao Xiaojing, Wei Yafang, et al. Extraction of imidacloprid and acetamiprid in ionic liquid/aqueous two phrase system-sequential injection spectrophotometric analysis [J]. Chin J Anal Chem, 2008, 36(10): 1411-1414. (in Chinese) |
| [13] | 乙小娟, 朱加叶, 丁萍, 等. 高效液相色谱法快速测定大米中的4种烟碱农药残留量[J]. 食品科学, 2011, 32(6): 169-172. Yi Xiaojuan, Zhu Jiaye, Ding Ping, et al. Determination of neonicotinoid residues in rice by HPLC[J]. Food Sci, 2011, 32(6): 169-172. (in Chinese) |
| [14] | 汤富彬, 刘光明, 罗逢健, 等. 茶叶中吡虫啉残留量的HPLC测定方法[J]. 农药, 2004, 43(12): 561-562. Tang Fubin, Liu Guangming, Luo Fengjian, et al. Determination of imidacloprid residues in tea by HPLC[J]. Chin J Pestic, 2004, 43(12): 561-562. (in Chinese) |
| [15] | 侯如燕, 卞红正, 赵秀霞, 等. 固相萃取-液相色谱测定复杂基质蔬菜中9种烟碱类残留[J]. 分析测试学报, 2011, 30(1): 58-63. Hou Ruyan, Bian Hongzheng, Zhao Xiuxia, et al. Determination of nicotinoid residues in complicated matrix vegetables by solid phase extraction and HPLC method [J]. J Instrum Analys, 2011, 30(1): 58-63. (in Chinese) |
| [16] | 彭莎, 杨仁斌, 邹蓉, 等. 高效液相色谱测定水稻和稻田中呋虫胺残留分析法的建立[J]. 湖南农业科学, 2013(7): 79-81. Peng Sha, Yang Renbin, Zou Rong, et al. Establishment of high performance liquid chromatography analytic method for determining dinotefuran residue in rice and paddy field[J]. Hunan Agric Sci, 2013(7): 79-81. (in Chinese) |
| [17] | 郭建亭, 于飞, 李中, 等. 20%呋虫胺悬浮剂的高效液相色谱分析[J]. 农学学报, 2013, 3(12): 28-31. Guo Jianting, Yu Fei, Li Zhong, et al. Analysis of high performance liquid 20% dinotefuran suspension chromatography[J]. J Agric, 2013, 3(12): 28-31. (in Chinese) |
| [18] | Watanabe E, Baba K, Eun H. Simultaneous determination of neonicotinoid insecticides in agricultural samples by solid-phase extraction cleanup and liquid chromatography equipped with diode-array detection[J]. J Agric Food Chem, 2007, 55(10): 3798-3804. |
| [19] | 钱传范. 农药残留分析原理与方法[M]. 北京: 化学工业出版社, 2011. Qian Chuanfan. Principle and Method of Pesticide Residue Analysis[M]. Beijing: Chemical Industry Press, 2011. (in Chinese) |
 2015, Vol. 17
2015, Vol. 17


