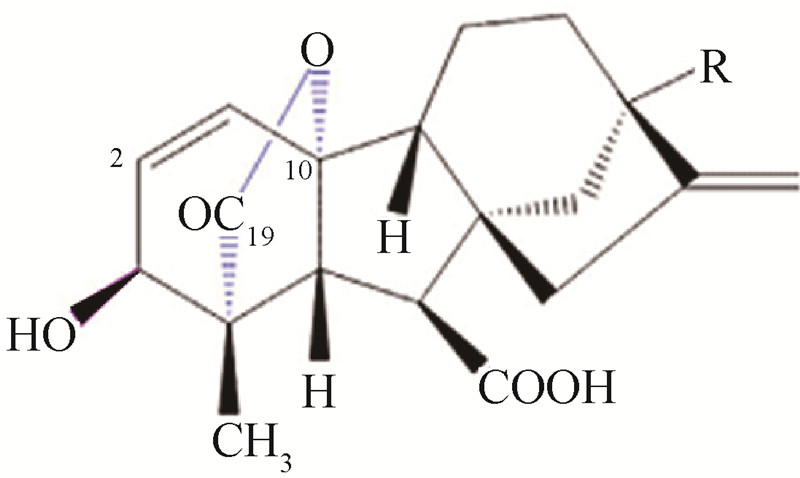
赤霉素A3(gibberellin A3,GA3)是一种双萜内酯有机化合物,其C19 骨架和 C19/C10γ-内酯环决定着GA3 的生物活性(结构式见Scheme 1)。GA3可调控植物生长发育的诸多进程,如种子萌发、根的生长、茎的伸长、叶片的扩展和去黄化、开花以及果实发育等[1],其对高等植物最突出的作用是在较低浓度下可刺激茎的伸长,使植株明显增高,但不改变节间数目,广泛用于打破种子休眠[2]、促进茎叶生长[3]、提早开花及增大果实[4, 5]等方面。
|
Scheme 1 |
GA3在中性 pH 值水溶液中可发生异构化,转变成具有C19/C2γ-内酯环的iso-GA3,导致其生物活性丧失[6]。环糊精(cyclodextrin,CD)是一种由数个葡萄糖残基通过 α-1,4-糖苷键连接的、具有环状分子结构的酶促变性淀粉。该环状结构提供了一个疏水性内部空腔,而外部的许多羟基使 CD 外表面具有亲水性,从而形成外亲水、内疏水的特殊结构[7]。CD 借助其疏水空腔可与客体分子在溶液中互相识别,并在范德华力、氢键和疏水力作用下,将客体分子包合进入其空腔,形成包合物。其外亲水特性能增强客体分子的水溶性,空腔的包裹能提高客体分子的稳定性,增强抗氧、抗光和抗热等能力,阻止客体活性物质的分解,从而提高其生物利用率[8]。因此,近年来 CD 在生物医药、食品工业、农业生产、化妆品、化学工业以及环境保护等领域有着广泛应用。其中应用最多的是 β-CD,但由于其结构中C2 和C3羟基之间可形成分子内氢键,从而导致其在水中溶解度较低,在20 ℃ 时仅为 1.85 g/100 mL,因而限制了其应用[9]。
羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD)是 β-CD 的C2、C3和C8位羟基被羟丙基取代后生成的衍生物。羟丙基的引入部分打开了 β-CD 的分子内氢键,使其水溶性大大提高,室温下溶解度大于50%(m/V),甚至高达 75% 以上[10]。此外,HP-β-CD对光、碱和热稳定。与母体 β-CD相比,HP-β-CD具有许多优良特性,因此具有更广泛的应用空间[11]。本研究根据 HP-β-CD 独特的“外亲水,内疏水”的空腔结构,采用其对GA3进行包合,以期改善GA3 在溶液中不稳定、易分解的缺陷,进而探索提高GA3 生理功效的可能途径。
1 材料与方法 1.1 试剂及仪器设备试剂:90% 赤霉素A3(GA3)标准品(江苏丰源生物工程有限公司);羟丙基-β-环糊精(HP-β-CD,山东滨州智源生物科技有限公司);吐温-80(国药集团化学试剂有限公司);二乙醇胺和磷酸(分析纯);甲醇(色谱纯)。
仪器设备:TP-214万分之一电子天平(丹佛仪器有限公司);XW-80A微型旋涡混合仪(上海沪西分析仪器厂);HJ-6A六联数显控温磁力搅拌器(江苏金坛金城国胜实验仪器厂);Lambda 25紫外分光光度计(美国珀金埃尔默公司);TEMI880药品稳定性试验箱(上海一恒科学仪器有限公司);PB-10 pH计(Sartorius);Agilent 1290超高效液相色谱仪(UPLC)(安捷伦科技有限公司)。
1.2 试验方法 1.2.1 包合物的制备准确称取一定量的HP-β-CD和相应量的GA3,在不断搅拌下依次缓慢加入到二乙醇胺溶液中,此过程需待HP-β-CD全部溶解后再加入 GA3,之后在一定温度下继续搅拌一定时间,制备成 GA3-HP-β-CD 包合物溶液[12]。采用药品稳定性试验箱对包合物进行耐贮性试验,在(54±2) ℃ 条件下贮藏14 d 后,备用。
1.2.2 正交试验设计根据影响HP-β-CD包合的因素,以包合率为考察指标,选取HP-β-CD与GA3 的摩尔比、包合温度、搅拌时间 3 个因子,每个因子3个水平,设计正交试验方案[13](见表 1)。
|
|
表 1 正交试验因素水平 Table 1 Factors and levels in orthogonal experiment |
包合率是衡量包合工艺的重要参数。未被包合的GA3 的含量测定方法为:取适量的包合物溶液,加入相同体积的乙酸乙酯快速对溶液中未被包合的游离GA3 进行萃取[14],分离后测定游离GA3 的含量,计算得到未被包合的 GA3 的量。按公式(1)和(2)计算包合率。

采用紫外分光光度法验证包合物的形成[15]。扫描溶液分别为:HP-β-CD、GA3(直接溶解在二乙醇胺中)、GA3和 HP-β-CD 的混合物(将两者直接混合,搅拌均匀)以及GA3-HP-β-CD 包合物(用二乙醇胺稀释)。4种溶液中GA3和 HP-β-CD 的浓度均相同,依次用紫外分光光度计扫描,扫描范围为200~280 nm。得到其紫外光谱,观察其波峰的位置及波峰值,确定包合物是否形成。
1.2.5 GA3 的生物活性测试法(茎伸长试验)选取饱满、整齐一致的豌豆Pisum sativum L.种子,用次氯酸钠溶液消毒15 min,去离子水洗净,浸种过夜,于25 ℃ 下催芽 24 h,随后播于装有V(蛭石)∶V(营养土)=2∶1的营养钵中。待幼苗长至第 4 节时,进行叶面喷施处理,检验溶液中GA3 的生物活性。
试验设4个处理:新配制的GA3 水溶液(T1,GA3先用少量乙醇溶解)、(54±2) ℃ 贮藏 14 d 的GA3 水溶液(T2)、新配制的GA3-HP-β-CD 包合物溶液(T3)和(54±2) ℃ 贮藏 14 d 的GA3-HP-β-CD 包合物溶液(T4),各处理组溶液中的GA3 质量浓度均为 1 mg/L。以清水为对照。3 次重复,每个重复5 株幼苗。于处理7 d 后,测定株高以及第 4、5、6、7 节间长度,根据公式(3)计算株高伸长率。
采用UPLC法。色谱条件:Comatex C18 色谱柱(4.6 mm×25 cm,5 μm),柱温35 ℃,流动相为V(甲醇)∶V(0.1 mol/L、pH 值为2.2的磷酸水溶液)=40∶60,流速0.2 mL/min,进样量2 μL,检测波长210 nm[16, 17]。
1.2.7 标准曲线方程的建立准确称取GA3 标准品,先用少量甲醇溶解并用去离子水定容到200 mL,配制成1 000 mg/L的GA3 标准溶液,再稀释成200、250、300、350和400 mg/L的系列标准工作溶液。按 1.2.6 节的条件检测,绘制GA3质量浓度与色谱峰面积的标准曲线,拟合后得到其标准曲线方程。
检测样品均用去离子水稀释至理论质量浓度为 300 mg/L。
1.3 数据分析采用 Microsoft Excel 2010 和 SPSS 20.0软件对数据进行统计分析。
2 结果与分析 2.1 正交试验结果结果(表 2)表明:影响包合率的因素依次为:HP-β-CD 与GA3的摩尔比>包合温度>搅拌时间。筛选出最优包合条件为 A1B2C2,即n(HP-β-CD):n(GA3)=1∶1,于35 ℃ 下搅拌2 h。在此条件下包合率为 81.7%。
|
|
表 2 包合物制备的正交试验结果 Table 2 Results of orthogonal test |
如图 1所示,GA3包合前后紫外吸收峰发生了变化。GA3-HP-β-CD 包合物的紫外光谱不同于 HP-β-CD、GA3 以及两者的混合物,GA3 包合后,其最大吸收峰发生红移,最大吸收波长由原来的 210 和 254 nm 分别迁移到215 和 258 nm 处,并且吸收强度降低。表明 GA3与 HP-β-CD 在溶液中存在相互作用并形成了包合物。
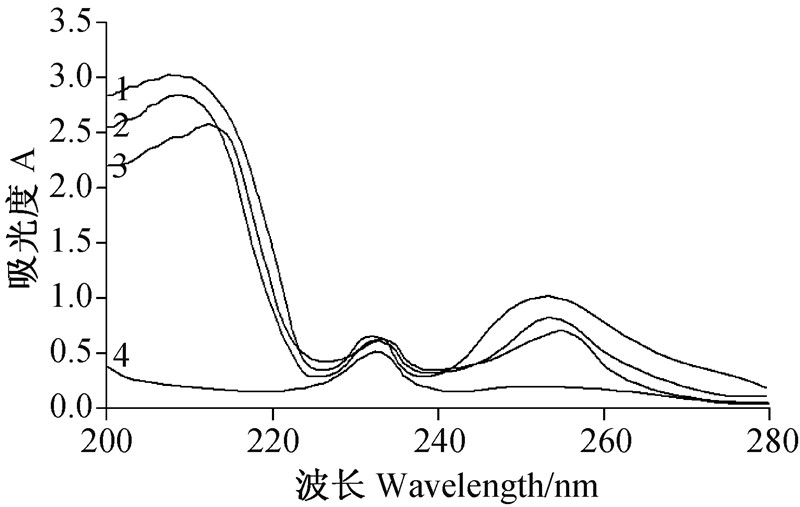 |
1. GA3溶液; 2. GA3和HP-β-CD 混合溶液; 3. GA3-HP-β-CD 包合溶液; 4. HP-β-CD 溶液。 1. GA3 solution; 2. Solution of the mixture GA3and HP-β-CD; 3. GA3-HP-β-CD inclusion complex solution; 4. HP-β-CD solution. 图 1 GA3-HP-β-CD 包合物的验证紫外扫描光谱图 Fig. 1 Ultraviolet-spectrophotometry for demonstration of GA3-HP-β-CD |
GA3 能够加速植物细胞的伸长生长,促进细胞分裂,使植株迅速生长。如图 2(A)所示,与对照相比,用新配制的 GA3水溶液(T1)、新配制的 GA3-HP-β-CD 包合物溶液(T3)、经(54±2) ℃ 贮藏 14 d 的 GA3-HP-β-CD 包合物溶液(T4)处理豌豆幼苗 7 d 后,株高均显著伸长,而经 (54±2) ℃ 贮藏 14 d 的 GA3水溶液(T2)处理则与对照无显著差异。由图 2(B)可知:对照组的株高伸长率为 114.53%,T1 为 311.41%,T3 为 306.72%。T1 与 T3 之间无显著差异,表明包合过程对GA3的活性损伤很少,并且包合后的 GA3 与未包合 GA3 的浓度效应一致;T2 的株高伸长率仅为 145.78%,与T1 相比,降低了约 165.63%;而T4 达到了276.72%,与T3相比,降低约 30%。上述结果表明,采用HP-β-CD 包合有效地保护了GA3 的活性,即使在 14 d 的高温贮藏条件下,活性丧失也较缓慢。
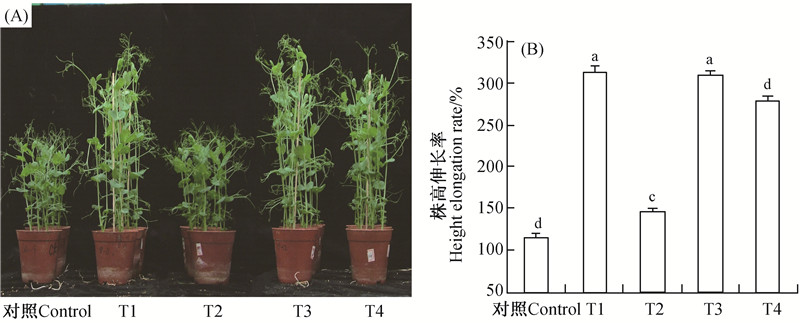 |
对照:清水; T1:新鲜配制的GA3 水溶液; T2:54 ℃±2 ℃ 贮藏14 d的GA3水溶液; T3:新鲜配制的GA3-HP-β-CD 包合物溶液;
T4:54 ℃±2 ℃ 贮藏14 d的GA3-HP-β-CD包合物溶液。 Control: water; T1: Newly prepared aqueous solution of GA3; T2: Aqueous solutions of GA3 kept for 14 d at 54 ℃±2 ℃; T3: Newly prepared GA3-HP-β-CD inclusion complex solution; T4: GA3-HP-β-CD inclusion complex solution kept for 14 d at 54 ℃±2 ℃. 图 2 不同GA3溶液处理对豌豆幼苗株高形态(A)及伸长率(B)的影响 Fig. 2 Effects of various GA3 solutions on the morphology (A) and elongation rate (B) in pea seedlings |
由表 3可知:与对照相比,各处理豌豆幼苗的各节间长度均有所增加,其中T1 和T3处理的第4节间长度分别增加了0.92 和0.76 cm,且达显著差异,但两处理间无显著差异;T2 处理的第4节间长度虽有所增加,但与对照无显著差异,说明高温使 GA3的生物活性丧失严重;T4 处理显著增加了豌豆幼苗第4节间的长度,表明包合作用有效减缓了GA3 生物活性的丧失。第5~7节间长度均与第4节间表现出相同的趋势。上述结果表明,HP-β-CD 的包合作用有效地保护了GA3的生物活性,在高温条件下减缓了GA3活性的丧失,延长了其保存时间。
|
|
表 3 不同 GA3溶液处理对豌豆幼苗各节间长度的影响 Table 3 Effects of certain GA3 solutions on the internode length in pea seedlings |
用峰面积(y)对质量浓度(x,mg/L)作线性回归曲线,得到 GA3 标准工作曲线为y=26.341 x+523.30,R2=0.999 4。
图 3 显示:GA3的保留时间为1.07 min左右,与其他组分的分离效果较好。根据峰面积和标准曲线方程,计算得到新鲜配制的GA3水溶液中GA3的质量浓度为299.3 mg/L,与理论质量浓度 300 mg/L基本一致。GA3-HP-β-CD 包合物中GA3的质量浓度为290.8 mg/L,即GA3在包合过程中降解了约3.1%。在(54±2) ℃ 贮藏14 d 后,GA3水溶液中GA3为11.07 mg/L,表明经过高温处理后,水溶液中的GA3 几乎全部降解;经高温贮藏后,GA3-HP-β-CD 包合物溶液中GA3的质量浓度为198 mg/L,降解率为34%,表明HP-β-CD的包合作用有效降低了GA3的降解。
 |
注:图中*所示为GA3的保留时间。A:新鲜配制的 GA3水溶液(GA3为299.3 mg/L); B:(54±2) ℃ 贮藏 14 d的 GA3水溶液(GA3为11.07 mg/L); C:新鲜配制的GA3-HP-β-CD 包合物溶液(GA3为290.8 mg/L); D:(54±2) ℃ 贮藏 14 d的GA3-HP-β-CD包合物溶液(GA3为198 mg/L)。 Note: * shown the peak time of GA3. A: Aqueous solution of GA3newly prepared (the content of GA3 was 299.3 mg/L); B: Aqueous solutions of GA3 kept for 14 d at (54±2) ℃ (the content of GA3 was 11.07 mg/L); C: GA3-HP-β-CD inclusion complex solution newly prepared (the content of GA3 was 290.8 mg/L); D: GA3-HP-β-CD inclusion complex solution kept for 14 d at (54±2) ℃ (the content of GA3 was 198 mg/L). 图 3 不同GA3溶液的UPLC图谱 Fig. 3 UPLC analysis for certain GA3 solutions |
本研究选择 HP-β-CD为包合主体对GA3 进行包合,得到了GA3-HP-β-CD 包合物溶液。在包合试验中,HP-β-CD与 GA3 的配比要合适[18],HP-β-CD 的量较小,不足以包合所有的 GA3,而其量过大则造成原料 HP-β-CD 的浪费;温度也是影响包合的重要因素[19],由于 GA3分子不稳定,包合温度太高会使 GA3大量降解,丧失生物活性,太低则使HP-β-CD在溶液中的溶解度降低,不利于包合反应的进行;此外,搅拌可以降低 GA3 粒径,使其均匀分散在溶液中,有利于形成均匀微球状,更易被 HP-β-CD 的疏水空腔包合,因此,搅拌时间也是影响包合反应的一个重要因素[20],加热搅拌的时间太短,会导致包合反应不完全,过长则会使已经包合的主客体分子分离,包合反应平衡逆向移动,不利于GA3的包合。综合上述因素,并通过正交试验,最终确定包合反应的最佳条件为:n(HP-β-CD)∶n(GA3)=1∶1,包合温度为35 ℃,加热搅拌时间2 h,该条件下的包合率为81.7%。并通过紫外分光光度法对包合物进行了鉴定,确定了包合物的形成。
本研究结果表明,HP-β-CD 的包合大大降低了GA3的降解,有效保护了GA3 的活性,可能是由于羟丙基的引入打开了其母体 β-环糊精的分子内氢键,有助于它与客体分子形成复合物,并有利于复合物的稳定存在[21]。此外,包合物的稳定程度还取决于主客体立体匹配、范德华作用、疏水相互作用、偶极作用、静电相互作用和氢键等的作用,且随客体分子极性等的不同表现出一系列差异[22]。如果客体分子太小,其和HP-β-CD空腔的作用力太小,极易从空腔中游离出来;相反,太大的客体分子不能和HP-β-CD形成包合物[23]。所以 GA3 分子与 HP-β-CD 空腔的匹配使包合物易形成且稳定。其次,客体分子的疏水性也影响HP-β-CD包合物的稳定性,客体分子的极性必须比水小才能与环糊精形成稳定的包合物,亲水性强的客体比亲水性弱的客体与环糊精形成包合物的能力弱[24],这也是 GA3 能与HP-β-CD形成稳定包合物的一个原因。再者,HP-β-CD分子内空腔无论在固相还是在溶液中均结合有水分子,因此,HP-β-CD分子与客体分子之间形成氢键以及高能水的释放对包合物的形成及稳定性也有重要作用。客体分子的疏水性部分进入HP-β-CD的空腔,取代腔内高能水,降低了其空腔与水分子的非极性-极性相互作用能量,空腔的疏水性也使主客体间非极性-非极性结合在热力学上具有较大的稳定性[25],因此,GA3 分子与HP-β-CD的羟基形成氢键,增强了包合物的稳定性。
GA3在中性 pH 值水溶液中可发生异构化,使结构中的 C19/C10γ-内酯环转变成 C19/C2γ-内酯环而失去生物活性,因此其水溶液极不稳定。目前农业上使用的 GA3 剂型主要是粉剂、乳油和片剂。粉剂结构稳定,利于贮存,但使用时需先溶于乙醇等有机溶剂后再用水稀释,使用不方便;乳油虽然效力高,但会对幼果产生刺激作用,同时会促进农药渗入;片剂的理化性质稳定,但其有效成分含量低。因此本研究利用 HP-β-CD 与 GA3 形成包合物溶液,克服了 GA3 在溶液中不稳定易分解的缺点,对完善现有剂型的不足,探索提高 GA3 的生理功效提供了可能途径。
| [1] | Swain S M, Singh D P. Tall tales from sly dwarves: novel functions of gibberellins in plant development [J]. Trends Plant Sci, 2005, 10(3): 123-129. |
| [2] | Chen S Y, Chien C T, Baskin J M, et al. Storage behavior and changes in concentrations of abscisic acid and gibberellins during dormancy break and germination in seeds of Phellodendron amurense var. wilsonii (Rutaceae) [J]. Tree Physiol, 2010, 30(2): 275-284. |
| [3] | Ayano M, Kani T, Kojima M, et al. Gibberellin biosynthesis and signal transduction is essential for internode elongation in deepwater rice [J]. Plant Cell Environ, 2014, 37(10): 2313-2324. |
| [4] | Linkies A, Leubner-Metzger G. Beyond gibberellins and abscisic acid: how ethylene and jasmonates control seed germination [J]. Plant Cell Reports, 2012, 31(2): 253-270. |
| [5] | Mutasa-Göttgens E, Hedden P. Gibberellin as a factor in floral regulatory networks [J]. J Exp Bot, 2009, 60(7): 1979-1989. |
| [6] | Pérez F J, Vecchiola A, Pinto M, et al. Gibberellic acid decomposition and its loss of biological activity in aqueous solutions [J]. Phytochemistry, 1996, 41(3): 675-679. |
| [7] | 黄丽珍. β-环糊精衍生物包合药物的研究与分析应用[D]. 兰州: 兰州大学, 2011. Huang Lizhen. Investigations on drug inclusion complexes by β-cyclodextrin derivatives and their analytical application [D]. Lanzhou: Lanzhou University, 2011. (in Chinese) |
| [8] | Hussein A K, Ibrahim M A, Amin M A, et al. Improved in vitro dissolution parameters and in vivo hypolipidemic efficiency of atorvastatin calcium through the formation of hydrophilic inclusion complex with cyclodextrins [J]. Drug Develop Res, 2011, 72(5): 379-390. |
| [9] | 王轶伟. β-环糊精及2-羟丙基-β-环糊精与几种药物的包结研究[D]. 天津: 天津大学, 2007. Wang Yiwei. Drug inclusion behavior research of β-cyclodextrin and 2-hydroxypropyl-β-cyclodextrins[D]. Tianjin: Tianjin University, 2007. (in Chinese) |
| [10] | Semcheddine F, Guissi N E I, Liu Xueyin, et al. Effects of the preparation method on the formation of true nimodipine SBE-β-CD/HP-β-CD inclusion complexes and their dissolution rates enhancement [J]. AAPS Pharm SciTech, 2015, 16(3): 704-715. |
| [11] | Härtl E, Winter G, Besheer A. Influence of hydroxypropyl-beta-cyclodextrin on the stability of dilute and highly concentrated immunoglobulin G formulations [J]. J Pharm Sci, 2013, 102(11): 4121-4131. |
| [12] | 逯芳. 赤霉素-β-环糊精包合物制备工艺及其稳定性研究[D]. 南京: 南京农业大学, 2006. Lu Fang. Preparation of inclusion compound of gibberellic acid with β-cyclodextrin and study on its stability [D]. Nanjing: Nanjing Agricultural University, 2006. (in Chinese) |
| [13] | 杜宏伟, 和燕. 正交试验法优选柏子仁油的包合工艺[J]. 陕西中医, 2008, 29(10): 1398-1399. Dong Hongwei, He Yan. Inclusion process of Platycladus orientalis Linn. by orthogonal [J]. Chin Trad Med Shaanxi, 2008, 29(10): 1398-1399. (in Chinese) |
| [14] | 简利茹, 李哲斐, 韩青梅, 等. 固相萃取-HPLC测定外生菌根真菌产生植物激素IAA和GA3[J]. 西北农业学报, 2011, 20(9): 165-168. Jian Liru, Li Zhefei, Han Qingmei, et al. Determination of plant hormone IAA and GA3 by ectomycorrhizal fungi in pure culture by solid phase extraction and HPLC [J]. Acta Agric Borealioccid Sinica, 2011, 20(9): 165-168. (in Chinese) |
| [15] | 郑晓霞, 张丹参, 黄红娜, 等. 大黄酚-羟丙基-β-环糊精包合物的工艺优选及鉴定[J]. 中成药, 2010, 32(9): 1518-1521. Zheng Xiaoxia, Zhang Danshen, Huang Hongna, et al. Cyclodextrin complex process optimization and evaluation of chrysophanol with HP-β-CD [J]. Chin Trad Patent Med, 2010, 32(9): 1518-1521. (in Chinese) |
| [16] | Urbanová T, Tarkowská D, Novák O, et al. Analysis of gibberellins as free acids by ultra performance liquid chromatography-tandem mass spectrometry [J]. Talanta, 2013, 112: 85-94. |
| [17] | 包琴, 唐洁, 马力, 等. HPLC法检测柑橘中赤霉酸残留量的色谱条件[J]. 食品研究与开发, 2011, 31(11): 141-145. Bao Qin, Tang Jie, Ma Li, et al. Chromatographic conditions of the determination of GA3 residue in citrus by HPLC [J]. Food Res Develop, 2011, 31(11): 141-145. (in Chinese) |
| [18] | Szejtli J. Introduction and general overview of cyclodextrin chemistry [J]. Chem Rev, 1998, 98(5): 1743-1754. |
| [19] | 宋玉英, 于玲, 李彦艳, 等. 羟丙基-β-环糊精在药剂学中的应用进展[J]. 医药导报, 2010, 10(29): 1314-1317. Song Yuying, Yu Ling, Li Yanyan, et al. Application of hydroxypropyl-β-cyclodextrin in pharmaceutics [J]. Herald Med, 2010, 10(29): 1314-1317. (in Chinese) |
| [20] | Yang Xinghao, Ke Weizhong, Zi Peng, et al. Detecting and identifying the complexation of nimodipine with hydroxypropyl-β-cyclodextrin present in tablets by raman spectroscopy [J]. J Pharm Sci, 2008, 97(7): 2702-2719. |
| [21] | 王翠敏. 几种环糊精衍生物的制备及其与药物分子的包合行为研究[D]. 云南: 昆明理工大学, 2011. Wang Cuimin. The study of synthesis and inclusion behaviors of several cyclodextrin derivatives with drug molecules [D]. Yunnan: Kunming University of Science and Technology, 2011. (in Chinese) |
| [22] | Patel R, Patel M, Shah D. Applications of cyclodextrin in drug delivery [J]. Int J Pharm World Res, 2011, 1(2): 1-22. |
| [23] | Zhang Jianxiang, Ma P X. Cyclodextrin-based supramolecular systems for drug delivery: recent progress and future perspective [J]. Adv Drug Deliv Revi, 2013, 65(9): 215-1233. |
| [24] | 何仲贵. 环糊精包合物技术[M]. 北京: 人民卫生出版社, 2008: 187-189. He Zhonggui. Cyclodextrin Inclusion Technology [M]. Beijing: People's Medical Publishing House, 2008: 187-189. (in Chinese) |
| [25] | Wang Tiewei, Zhang Chunling, Liang Xingjie, et al. Hydroxypropyl-β-cyclodextrin copolymers and their nanoparticles as doxorubicin delivery system [J]. J Pharm Sci, 2011, 100(3): 1067-1079. |
 2015, Vol. 17
2015, Vol. 17


