2. 北京市小汤山地区地热开发公司, 北京 102211
2. Beijing Xiaotangshan Zone Terrestrial Heat Development Company, Beijing 102211, China
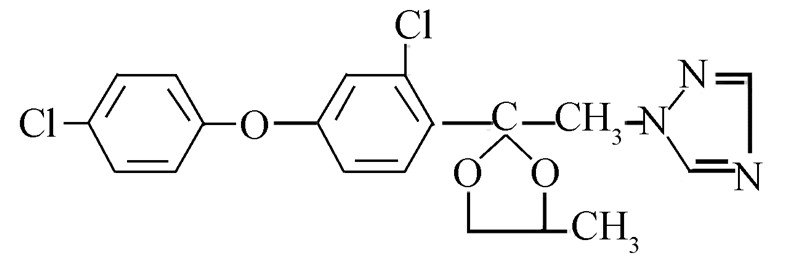
苯醚甲环唑(结构式见Scheme 1)属于三唑类内吸性杀菌剂,其杀菌机理是通过抑制细胞壁甾醇的生物合成而阻止真菌生长。其杀菌谱广,对子囊菌纲、担子菌纲和包括链格孢属、壳二孢属、尾孢霉属、刺盘孢属、球痤菌属、茎点霉属、柱隔孢属、壳针孢属、黑星菌属在内的半知菌、白粉菌科、锈菌目及某些种传病原菌有持久的防治和治疗作用,同时对甜菜褐斑病、小麦颖枯病、叶枯病、锈病和由几种致病菌引起的霉病均有较好的治疗效果[1, 2, 3]。
|
Scheme 1 |
已有研究表明,苯醚甲环唑对罗非鱼Oreochromis spp.为高毒药物[4],对蜜蜂低毒[5, 6],对家蚕中毒[7, 8]。Hinfray 等[9]报道,苯醚甲环唑可抑制虹鳟鱼 Oncorhynchus mykiss脑部和卵巢微粒体中 P450 芳香酶的活性,从而产生毒性效应;Abd-Alrahman等[10]研究表明,苯醚甲环唑对雄性大白鼠的胆碱酯酶活性有抑制作用;Mukhopadhyay等[11]报道,苯醚甲环唑在辣椒果实和土壤中的半衰期分别为2.15 d~2.32和4.68 d~8.09 d;Guo等[12]报道苯醚甲环唑在苹果和土壤中的半衰期分别为6.3~10.2和9.6~68.4 d。初春[13]研究表明,苯醚甲环唑在北京和济南两地的3类作物(菜豆、葡萄和芹菜)土壤中的降解较慢,半衰期分别为51.3~125.8、43.6~69.3和47.5~63.6 d。
生物修复(bioremediation)是利用生物,主要是微生物将环境污染物降解为毒性较低的物质。近年来,以生物修复为理论基础的农药残留降解菌技术为降低农产品和农业生产环境中的农药残留物提供了希望,该技术以其高效安全、经济实用、快捷简便等特点逐渐成为农药残留污染修复的一种重要方法[14, 15, 16]。利用生物滤床有效处理了径流水中残留的异恶草酮和氟乐灵[17],Garipova[18]强调农业土壤生物修复中植物-微生物的相互关系的特殊作用,并且评估内生菌相比土壤和根际细菌的优势。关于三唑类农药降解菌的分离筛选及其生理特性报道较少,目前降解苯醚甲环唑的仅分离到剑菌属细菌[19]。硝基还原假单胞菌Pseudomonas nitroreducens对不良环境的高度适应性使其在环境治理中具有明显优势,广泛用于降解有机化合物和重金属污染的修复。前人研究中该菌主要用于降解苯并噻唑、2,4-二氯苯氧乙酸丁酯和1,2,4-三氯苯,尚未见有关其降解苯醚甲环唑的报道[15]。本研究以苯醚甲环唑为惟一碳源,从江苏某农药厂污水区污泥中分离筛选出一株降解能力较强的细菌BMJHZ-01,经鉴定其为硝基还原假单胞菌,研究了苯醚甲环唑初始浓度、培养基pH值、培养温度和培养时间对该菌株降解效率的影响。
1 材料与方法 1.1 试验材料及仪器 1.1.1 培养基基础培养基(g/L):NaCl 1.0 g,MgSO4 0.2 g,(NH4)2SO4 1.0 g,KH2PO4 0.5 g,K2HPO4 1.5 g,FeSO4 0.01g,CaCl2 0.01g,去离子水1 000 mL。固体基础培养基在上述培养基中加入2.0% 琼脂。用 1 mol/L HCl或NaOH调节 pH 值为 7,121 ℃湿热灭菌 15 min。
富集培养基(g/L):蛋白胨10.0 g,酵母膏5.0 g,氯化钠10.0 g,琼脂20.0 g,去离子水1 000 mL。用 1 mol/L的HCl 或 NaOH 调节 pH 值为7,121 ℃湿热灭菌 15 min。
1.1.2 药品与试剂丙酮、乙腈和甲醇,均为色谱纯,购自北京百灵威科技有限公司。100 μg/mL苯醚甲环唑(difenoconazole)标准品,购自农业部环境保护科研监测所;30%苯醚甲环唑乳油,购自北京信德科兴科学器材有限责任公司。
1.1.3 试验仪器Agilent 1200高效液相色谱仪,安捷伦科技(中国)有限公司;Eclipse DXB-C18(150 mm×4.6 mm,5 μm),安捷伦科技(中国)有限公司;BSD-150 型振荡培养箱,上海博讯实业有限公司医疗设备厂;SW-CJ-1FD型单人单面净化工作台、LDZX-50KBS 立式压力蒸汽灭菌器和XW-80A 旋涡混合器,上海青浦沪西仪器厂;LG10-2.4A 高速离心机,北京医用离心机厂;KQ-600 型超声波清洗器,昆山市超声仪器有限公司;DTC-3G plus PCR 基因扩增仪,上海精密仪器仪表有限公司;DYY-6B 型稳流稳压电泳仪,南京普阳科学仪器研究所南达生物技术开发公司。
1.2 菌种的分离筛选用于降解菌筛选的样品采自生产苯醚甲环唑原药的江苏某农药厂污水区污泥中。采用对角线采样法,取1~2 kg污泥样品于4 ℃条件下保存,备用。
准确量取100 mL 基础培养基于250 mL 三角瓶中灭菌,冷却,在无菌条件下加入30 g/L的苯醚甲环唑标准品母液(丙酮为溶剂),使苯醚甲环唑最终质量浓度分别为30、60、90、120、180、210和240 mg/L。加入5.00 g污泥样品,于 30 ℃、200 r/min下培养7 d;之后每7 d以 5%的接种量转接到相同的培养基中,连续转接3次[20]。取1 mL 富集液梯度稀释,将 10-3~10-5稀释液涂布于以相应质量浓度的苯醚甲环唑为惟一碳源的固体基础培养基平板上,于30 ℃下培养 3 d,发现当苯醚甲环唑质量浓度大于180 mg/L时菌落生长情况较差,故挑取生长良好的单菌落(编号为BMJHZ-01)接种于含180 mg/L苯醚甲环唑的基础培养基中,于30 ℃、200 r/min下摇床培养 48 h,验证其降解效果。
1.3 苯醚甲环唑的提取与检测 1.3.1 标准溶液的配制与标准曲线绘制100 μg/mL苯醚甲环唑标准品母液用丙酮配制成质量浓度分别为 0.1、0.2、0.5、1、2、5和10 μg/mL的标准工作液。以苯醚甲环唑质量浓度(x)为横坐标,相应的峰面积(y)为纵坐标绘制标准曲线。
1.3.2 检测方法的建立采用高效液相色谱法。在装有10mL BMJHZ-01菌株培养液的三角瓶中,加入10 mL乙腈,超声振荡30 min,移入装有7 g NaCl 的分液漏斗中,静置。准确移取 5 mL有机相于装有3 g无水硫酸钠的离心管中,在6 000 r/min下离心10 min。取 1 mL上清液 于1.5 mL进样瓶中,氮气吹干后用甲醇溶解并定容至1 mL。
色谱条件:Eclipse DXB-C18不锈钢色谱柱(150 mm×4.6 mm,5 μm),流动相V(乙腈)∶V(水)=70∶30溶液,检测波长231 nm,流速1.0 mL/min[21]。苯醚甲环唑保留时间为 4.73 min。
根据公式(1)计算苯醚甲环唑的降解率:
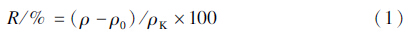
式中:R为降解率,ρ为对照组中苯醚甲环唑质量浓度(mg/L),ρ0为试验组中苯醚甲环唑质量浓度(mg/L),ρK为试验初始时所测苯醚甲环唑真实质量浓度(mg/L)[22]。
1.3.3 添加回收试验在基础培养基中以0.5、2.0和10.0 μg/mL 3个添加水平分别加入一定量的苯醚甲环唑标准品,按1.3节的条件分析其含量,计算回收率。
1.4 菌种的鉴定对筛选出的菌株BMJHZ-01在固体基础培养基上于30 ℃下培养 48 h,进行形态学观察、生理生化鉴定和16S rDNA 序列同源性比对,确定其分类地位。
菌株 16S rDNA 序列的测定及系统发育分析:以提取的细菌总DNA为模板,采用细菌 16S rDNA 通用引物 (正向引物: 5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物: 5′-ACGGHTACCTTGTTTACGACTT-3′)进行扩增,PCR 反应体系(50 μL) : DNA 模板 1 μL,10 × PCR Buffer 5 μL,dNTP(2.5 mmol/L) 4 μL,引物(10 μmol/L) 各1 μL,Tap 酶(5 U/ μL) 0.5 μL,双蒸水37.5 μL[20]。反应条件:95 ℃ 5 min,94 ℃ 45 s,50 ℃ 45 s,72 ℃1 min 15 s;循环32 次;72 ℃ 10 min,反应完成后,经1%琼脂糖电泳,检测扩增片段的大小和特异性[23]。PCR 扩增产物纯化后,委托北京三博远志生物技术有限责任公司测序,将序列在GenBank数据库中利用 BLAST进行比对分析,选择同源性高的相关序列利用ClustalX 1.8进行多序列联配,用MEGA 4构建分子进化树,采用Neighbor. Joining 法的Complete Deletion模式建树,Bootstrap进行检验,重复1 000次[24, 25]。
1.5 影响菌株降解苯醚甲环唑的因素基础培养基100 mL,以体积比为5%的接种量分别接种菌种母液(1011 CFU/mL),于200 r/min下恒温振荡培养,3次重复。以不接菌的含180 mg/L苯醚甲环唑的基础培养基作为空白对照。根据公式(1)计算降解率。
1.5.1 培养温度设定振荡培养箱温度分别为20、25、30、35和40 ℃,苯醚甲环唑质量浓度为180 mg/L,pH值7.0,7 d后提取并检测苯醚甲环唑残留量。
1.5.2 初始 pH 值设定基础培养基的初始 pH 值分别为 5.0、6.0、7.0、8.0和9.0,苯醚甲环唑质量浓度为180 mg/L,培养箱温度为 30 ℃,7 d后提取并检测苯醚甲环唑残留量。
1.5.3 农药初始浓度设定基础培养基中苯醚甲环唑初始质量浓度为 60、120、180、240和300 mg/L,初始 pH 值为 7,培养箱温度为 30 ℃,7 d后提取并检测苯醚甲环唑残留量。
1.5.4 培养时间设定基础培养基中苯醚甲环唑初始浓度为 180 mg/L,初始 pH 值设为 7,培养箱温度为 30 ℃,分别于接种1、3、5、7和9 d后提取并检测苯醚甲环唑残留量。
2 结果与讨论 2.1 分析方法的准确度与精密度结果表明:在0.1~10 μg/mL范围内,苯醚甲环唑的质量浓度与相应的峰面积间呈良好的线性关系,标准曲线为y=26.841x-4.576 3,R2=0.999。在0.5、2.0和10.0 μg/mL 3个添加水平下,平均回收率在97.9%~113.5%之间,相对标准偏差(RSD)在0.91%~1.10%之间,可满足农药残留分析要求[22]。
2.2 苯醚甲环唑降解菌的筛选和鉴定经过初筛得到1株降解效果非常明显的菌株BMJHZ-01(图 1),故取BMJHZ-01做进一步的鉴定。结果显示:BMJHZ-01为革兰氏阴性、有鞭毛、无芽孢的杆菌,菌落较大为白色、隆起,边缘规则,表面光滑,严格好氧,化能异养。用明胶不能液化,硝酸盐可以被还原成亚硝酸盐,氧化酶呈阳性;接触酶呈阳性;不产硫化氢,不能淀粉水解。
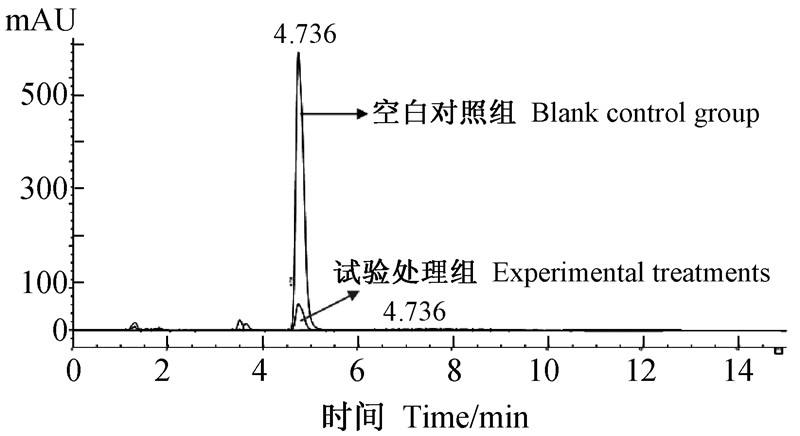 | 图 1 HPLC 法验证BMJHZ-01降解效果 Fig. 1 The BMJHZ-01 degradation was determined by HPLC method |
将测定的BMJHZ-01的16S rDNA序列在GenBank上登录,序列号为 KJ410680。与其他菌株的16S rRNA基因的同源性进行比较后发现,菌株BMJHZ-01与KJ410680(Pseudomonas nitroreducens)的同源性为99%。结合生理生化特性,发现BMJHZ-01与P. nitroreducens的模式株一致,故将其鉴定为硝基还原假单胞菌Pseudomonas nitroreducens。Complete Deletion模式建树见图 2。
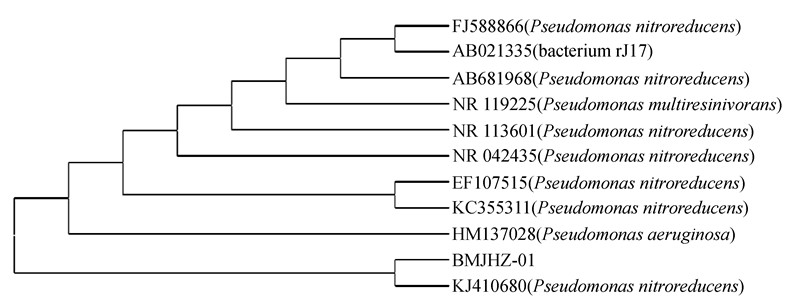 | 图 2 BMJHZ-01的系统进化树 Fig. 2 Phylogenetic analysis of BMJHZ-01 |
从图 3可以看出:在20~40 ℃区间内,降解率随培养温度升高呈先升后降的趋势,7 d后在30 ℃时降解率达到最大,为 91.5%,与35 ℃时无显著差异(P>0.05),但与其他温度处理间均存在显著差异(P<0.05)。 温度过高或过低降解率均下降,因此选择最佳降解温度为30 ℃。
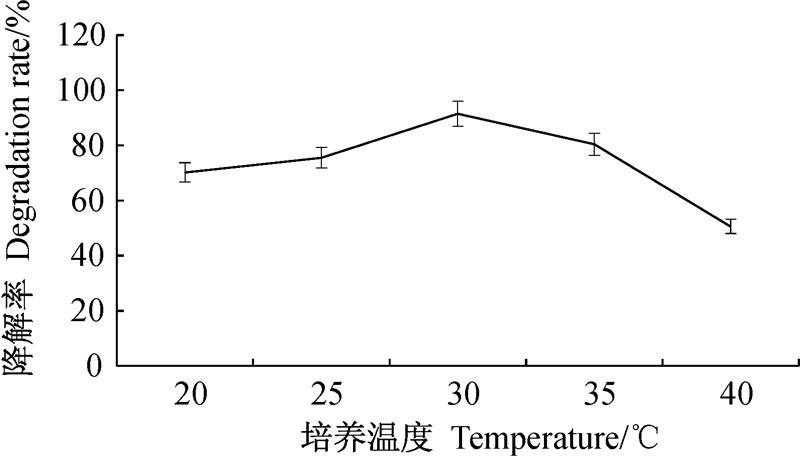 | 图 3 培养温度对苯醚甲环唑降解率的影响 Fig. 3 Effects of incubation temperature on degradation rate of difenoconazole |
从图 4可看出:培养基中的pH值对BMJHZ-01的降解效果影响较大。其中,pH值由5升到7时,降解率显著升高,并于pH=7时,降解率达到最大值,为90.4%。 可能是由于pH值为中性时最适宜BMJHZ-01菌株的生长,pH值过高或过低,降解率均下降,所以最佳降解pH 值为7。
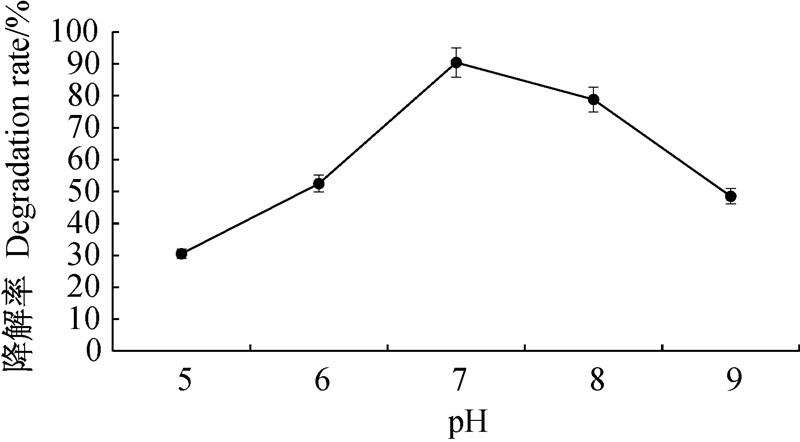 | 图 4 初始 pH 值对苯醚甲环唑降解率的影响 Fig. 4 Effect of initial pH on degradation rate of difenoconazole |
从图 5可以看出:苯醚甲环唑质量浓度在60 mg/L时,BMJHZ-01对其降解率最大,为98.4%;当其质量浓度从60 mg/L升高到180 mg/L时,降解率缓慢下降,但无显著性差异(P>0.05);当其质量浓度为300 mg/L时仅为42.9%。说明BMJHZ-01菌株对高浓度苯醚甲环唑的降解能力下降。综合考虑,以BMJHZ-01为降解菌时,苯醚甲环唑的质量浓度最高不宜超过180 mg/L。
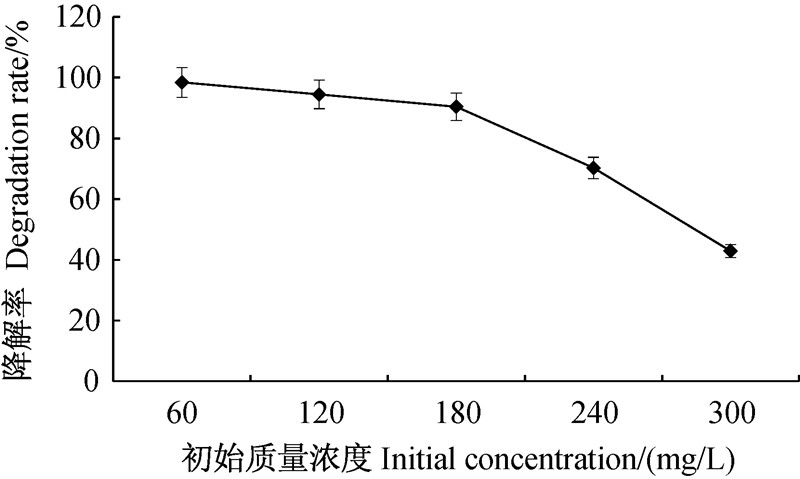 | 图 5 苯醚甲环唑初始质量浓度对其降解率的影响 Fig. 5 Effect of initial concentration of difenoconazole on its degradation rate |
从图 6可以看出:接种5 d内BMJHZ-01对苯醚甲环唑的降解率随接种时间的增加而显著增加,5 d时降解率达到90.4%;之后随着时间的增加各处理间无显著差异(P>0.05)。故选取5 d为BMJHZ-01的最佳降解时间。
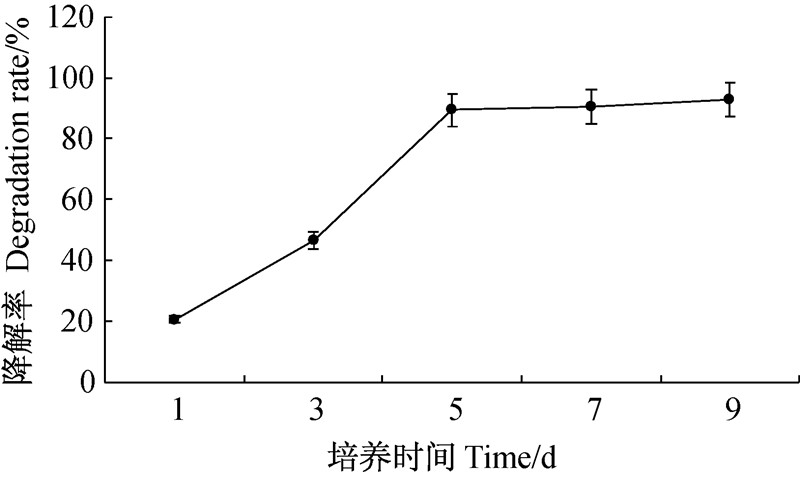 | 图 6 培养时间对苯醚甲环唑降解率的影响 Fig. 6 Effect of incubation time on the degradation rate of difenoconazole |
从生产苯醚甲环唑原药的江苏某农药厂污水区污泥中筛选出一株以苯醚甲环唑为惟一碳源的菌株BMJHZ-01,在固体基础培养基上于30 ℃下培养48 h,观察其形态,进行生理生化鉴定。结果显示:BMJHZ-01为革兰氏阴性、有鞭毛、无芽孢的杆菌,菌落较大为白色、隆起,边缘规则,表面光滑,严格好氧,化能异养。经16S rDNA序列同源性比对及系统发育树分析,初步鉴定为硝基还原假单胞菌Pseudomonas nitroreducens。
BMJHZ-01降解苯醚甲环唑的最适宜条件:培养箱转速200 r/min,培养温度30 ℃,初始pH值为7.0,在此条件下,菌株BMJHZ-01在5 d内对180 mg/L 的苯醚甲环唑降解率可达90%以上。
| [1] | Wang Zhihua, Yang Tong, Qin Dongmei, et al. Determination and dynamics of difenoconazole residues in Chinese cabbage and soil[J]. Chin Chem Lett, 2008, 19: 969-972. |
| [2] | 蔡智华, 郭正元. 三唑类杀菌剂的研究进展[J]. 农化新世纪, 2006(3): 17-18. Cai Zhihua, Guo Zhengyuan. Research progress of three triazole fungicide[J]. Convers New Cent, 2006(3): 17-18. (in Chinese) |
| [3] | Tomlin C. The Pesticide Manual [M]. Surrey: The British Crop Protection Countil, 1994: 323-324, 882-884. |
| [4] | 张月, 张学强, 王素茹. 苯醚甲环唑和丙环唑对罗非鱼的急性毒性研究[J]. 现代农药, 2011, 10(4): 30-31. Zhang Yue, Zhang Xueqiang, Wang Suru. Acute toxicity of difenoconazole and propiconazole for tilapia[J]. Mod Agrochem, 2011, 10(4): 30-31. (in Chinese) |
| [5] | 苍涛, 赵学平, 张志恒, 等. 草莓生产中常用农药对蜜蜂的毒性及安全评价[J]. 浙江农业科学, 2009(4): 785-787. Cang Tao, Zhao Xueping, Zhang Zhiheng, et al. Toxicity and safety evaluation of pesticides commonly used in strawberry production of bees[J]. Zhejiang Agric Sci, 2009(4): 785-787. (in Chinese) |
| [6] | 徐华强, 刘艳艳, 祝国栋, 等. 16种不同类型农药对两种寄生蜂的毒性比较和安全性评价[J]. 环境昆虫学报, 2014, 36(6): 959-964. Xu Huaqiang, Liu Yanyan, Zhu Guodong, et al. Comparison of toxicity and safety evaluation of 16 kinds of pesticides on Trichogramma ostriniae and Encarsia formosa[J]. J Environ Entomol, 2014, 36(6): 959-964. (in Chinese) |
| [7] | 俞瑞鲜, 王彦华, 吴声敢, 等. 21种杀菌剂对家蚕的急性毒性与风险评价[J]. 生态毒理学报, 2011, 6(6): 643-648. Yu Ruixian, Wang Yanhua, Wu Shenggan, et al. Acute toxicity and risk assessment of 21 fungicides to the larvae of Bombyx mori[J]. Asian J Ecotoxicol, 2011, 6(6): 643-648. |
| [8] | 吕铭潇, 张骞. 7种杀菌剂对家蚕的急性毒性评价[J]. 生物灾害科学, 2014, 37(2): 140-143. Lü Mingxiao, Zhang Qian. Toxicity and toxicity evaluation of seven fungicides to Bombyx mori and observation of toxicity symptoms[J]. Biol Dis Sci, 2014, 37(2): 140-143. (in Chinese) |
| [9] | Hinfray N, Porcher J M, Brion F, et al. Inhibition of rainbow trout (Oncorhynchus mykiss) P450 aromatase activities in brain and ovarian microsomes by various environmental substances[J]. Compar Biochem Physiol C: Toxicol Pharmacol, 2006, 144(3): 252-262. |
| [10] | Abd-Alrahman S H, Elhalwagy M E A, Kotb G A, et al. Exposure to difenoconazole, diclofop-methyl alone and combination alters oxidative stress and biochemical parameters in albino rats[J]. Int J Clin Exp Med, 2014, 7(10): 3637-3646. |
| [11] | Mukhopadhyay S, Das S, Bhattacharyya A, et al. Dissipation study of difenoconazole in/on Chili fruit and soil in India[J]. Bull Environ Contam Toxicol, 2011, 87(1): 54-57. |
| [12] | Guo Cong, Li Jianzhong, Guo Baoyuan, et al. Determination and safety evaluation of difenoconazole residues in apples and soils[J]. Bull Environ Contam Toxicol, 2010, 85(4): 427-431. |
| [13] | 初春. 苯醚甲环唑在菜豆、葡萄、芹菜及土壤中的残留测定和消解动态研究[D]. 北京:北京化工大学, 2010. Chu Chun. Study on determination and dynamics of difenoconazole residues in kidney bean, grape, celery and soil[D]. Beijing: Beijing University of Chemical Technology, 2010. (in Chinese) |
| [14] | Grant R J, Betts W B. Biodegradation of the synthetic pyrethroid cypermethrin in used sheep dip[J]. Lett Appl Microbiol, 2003, 36(3): 173-176. |
| [15] | 张松柏, 张德咏, 刘勇, 等. 一株菊酯类农药降解菌的分离鉴定及其降解酶基因的克隆[J]. 微生物学报, 2009, 49(11): 1520-1526. Zhang Songbai, Zhang Deyong, Liu Yong, et al. Isolation, identification and degrading gene cloning of a pyrethroids-degrading bacterium[J]. Acta Microbiol Sin, 2009, 49(11): 1520-1526. (in Chinese) |
| [16] | Mandal K, Singh B, Jariyal M, et al. Bioremediation of fipronil by a Bacillus firmus isolate from soil [J]. Chemosphere, 2014, 101: 55-60. |
| [17] | Antonious G F. On-farm bioremediation of dimethazone and trifluralin residues in runoff water from an agricultural field[J]. J Environ Sci Health B, 2012, 47: 608-621 |
| [18] | Garipova S R. Perspectives on using endophytic bacteria for the bioremediation of arable soils polluted by residual amounts of pesticides and xenobiotics[J]. Biol Bull Rev, 2014, 4(4): 300-310. |
| [19] | 郑金伟, 何健, 王哲, 等. 苯醚甲环唑降解菌B2的分离、鉴定及其降解特性[J]. 中国环境科学, 2009, 29(1): 42-46. Zheng Jinwei, He Jian, Wang Zhe, et al. Isolation, identification and characteristics of a difenoconazole-degrading bacterial strain B2[J]. China Environ Sci, 2009, 29(1): 42-46. (in Chinese) |
| [20] | 陈少华, 罗建军, 胡美英, 等. 一株拟除虫菊酯农药降解菌的分离鉴定及其降解特性与途径[J]. 环境科学学报, 2011, 31(8): 1616-1626. Chen Shaohua, Luo Jianjun, Hu Meiying, et al. Isolation, identification, degradation characteristics and pathway of a pyrethroid-degrading bacterial strain[J]. Acta Scientiae Circumstantiae, 31(8): 1616-1626. (in Chinese) |
| [21] | 周凌云, 王素芬. 高效液相色谱法测定废水中苯醚甲环唑的含量[J]. 光谱实验室, 2010. 27(6): 2211-2214. Zhou Lingyun, Wang Sufen. Determination of difenoconazole in waste water by HPLC[J]. Chin J Spect Lab, 2010, 27(6): 2211-2214. (in Chinese) |
| [22] | 谷晓明, 魏朝俊, 贾临芳, 等. 百菌清降解菌 BJQ2 的分离、鉴定及影响因素研究[J]. 农业环境科学学报, 2012, 31(2): 306-311. Gu Xiaoming, Wei Chaojun, Jia Linfang, et al. Isolation, identification and degradative characters of chlorothalonil-degrading bacteria BJQ2[J]. J Agro-Environ Sci, 2012, 31(2): 306-311. (in Chinese) |
| [23] | 宋蕾, 王慧, 姜健, 等. 降解1,2,4-三氯苯的硝基还原假单胞菌J5-1的分离鉴定和邻苯二酚1,2-双加氧酶基因的克隆[J]. 环境科学, 2007, 28(8): 1878-1881. Song Lei, Wang Hui, Jiang Jian, et al. Isolation, idetification of 1,2,4-trichlorobenzene-degrading strain Pseudomonas nitroreducens J5-1 and cloning of chlorocatechol 1,2-dioxygenase gene[J], Environ Sci, 2007, 28(8): 1878-1881. (in Chinese) |
| [24] | 严佳丽, 陈湖星, 杨杨, 等. 一株高效 DEHP 降解菌的分离、鉴定及其降解特性[J]. 微生物学通报, 2014, 41(8): 1532-1540. Yan Jiali, Chen Huxing, Yang Yang, et al. Isolation and characterization of a highly efficient DEHP-degrading bacterium[J]. Microbiol China, 2014, 41(8): 1532-1540. (in Chinese) |
| [25] | Yang Rui, Sun Baolin. Physiological characterization of a microbial consortium that reductively dechlorinates 1,1-dichloroethane to chloroethane [J]. J Univ Sci Technol China, 2009, 39(1): 83-89. |
 2015, Vol. 17
2015, Vol. 17


